Й уровень
121-125. Вычислите количество теплоты, выделившееся при сгорании углеродсодержащего топлива А массой m, в котором также содержится негорючий компонент с массовой долей Сm. Считать, что горючим компонентом в топливе является углерод С(т):
| Задачи | |||||
| А | Антрацит | Бурый уголь | Каменный уголь | Горючий сланец | Кокс |
| m, кг | |||||
| Cm, % ^т. /о |
126-130. Вычислите, какое количество теплоты выделится при восстановлении оксида А металлом Б, если было получено m, г, восстановленного металла:
| Задачи | |||||
| A | Fе2О3 | ТiO2 | Сr2О3 | СdО | РbО |
| Б | Аl | Са | Mg | Аl | Zn |
| m, г |
131-135. Оцените при стандартных условиях возможность самопроизвольного протекания реакции восстановления металла из его оксида с помощью восстановителей А и В:
| Задачи | |||||
| Оксид | Sb2O5 | Fе3О4 | Вi2О3 | WO3 | ZrO2 |
| А, В | С, Н2 | Са, Н2 | С, Н2 | С, Н2 | Са, Н2 |
136-140. Определите знаки при D Н° и D S° для реакции, протекающей при стандартных условиях в прямом направлении. Как будет изменяться DG° (возрастать или убывать), если температура будет изменяться так, как указано в условии?
| Задачи | Реакция | Температура | |
| 2АВ(т)+В2(г)=2АВ2(т) | возрастает | ||
| АВ5(т) =АВ3(т) +В2(г) | уменьшается | ||
| 2А(ж)+ВС(г)=А2ВС(ж) | уменьшается | ||
| АВ(т)+В(ж)=АВ2(т) | возрастает | ||
| А2В3(г)=2А2В(ж) + В2(г) | возрастает | ||
141-145. Для данной реакции оцените возможность самопроизвольного ее протекания при температуре 298 К.
| Задачи | Реакция |
| H2(г) + Cl2(г) + O2(г) = HСlO4(ж) | |
| Ca(т) + P(т) + O2(г) = Ca3(PO4)2(т) | |
| H2(г) + N2(г) + O2(г) = HNO3(ж) | |
| N2(г) +2 H2(г) = N2H4(г) | |
| Ca(т) + C(т) + O2(г) = CaCO3(т) |
146-150. Рассчитайте температуру, при которой возможно протекание данной реакции в прямом направлении:
| Задачи | Реакция | |
| СН4(г)= С(т) + 2Н2(г) | ||
| Са3(РO4)2(т) = СаО(т) + Р2O5(т) | ||
| Mg(NO3)2(т) = MgO(т) + N2O5(г) | ||
| 2Н2О(г) = 2 H2(г) + O2(г) | ||
| Nа2SО3(т) = Nа2О(т) + SО2(г) | ||
3-й уровень
151. Раствор ацетата натрия, содержащий фенолфталеин, при Т =298 К обесцвечивается, а при нагревании становится розовым. На основании этого определите знаки при 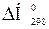 и
и  наблюдаемого процесса, напишите его уравнение.
наблюдаемого процесса, напишите его уравнение.
152. Почему при растворении в воде кристаллического хлорида калия энтропия увеличивается, а при растворении газообразного диоксида углерода – уменьшается?
153. Каков знак изменения энергии Гиббса процесса таяния льда при 273 К?
154. Стандартные энтальпии образования (кДж/моль) гидридов азота (III) и фосфора (III) равны соответственно -46,2 и 5,4. Сделайте вывод об относительной устойчивости этих веществ.
155. Предварительно подобрав коэффициенты в уравнении, рассчитайте энтальпию образования реагента Fe3O4 при стандартных условиях, если известны стандартные энтальпии остальных реагентов и продуктов реакции, а также стандартный тепловой эффект реакции ∆Н0х.р= 37 кДж:
СО(г) + Fe3O4(т) → FeO(т) + СO2(г)
156-160. По стандартному изменению энтропии в реакциях (I) и (II) рассчитайте стандартную энтропию образования указанного вещества из простых веществ. Напишите уравнение реакции образования этого вещества из простых веществ:
| Задачи | Реакции | ΔS°, Дж/(мольК) | Вещество | |||
| (I) 2С(т)+O2(г)=2СО(г) (II) СO(г)+F2(г)= СОF2(г) | + 179 -143 | СОF2 | ||||
| (I) 2Сr(т)+3F2(г)=2СrF3(т) (II) 2СrF2(т)=2СrF2(т)+F2(г) | -469 -40; | СгF2 | ||||
| (I) Zr(т)+ZrСl4(г)=2ZrСl2(г) (II) Zr(т)+2Сl2(г)=ZrСl4(г) | +208 -116; | ZrСl2 | ||||
| (I) 2Аs(Т)+3F2(г)=2АsF3(г) (II) АsF5(г)=АsF3(г)+F2(г) | -103 + 139; | АsF5 | ||||
| (I) 2СlF5(г)=Сl2F6(г)+2F2(г) (II) Сl2(г)+5F2(г)=2СlF5(г) | +346 -616 | Сl2F6 | ||||