ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ - раздел Химия, Основные понятия и законы химии
Окислительно-Восстановительными Называются Реакции, Которые С...
Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ. Степень окисления – это условный заряд атома в молекуле, возникающий вследствие разности электроотрицательностей и рассчитанный из предположения, что молекула состоит только из ионов. Окисление – это процесс отдачи электронов, который приводит к повышению степени окисления восстановителя. Восстановление – это процесс присоединения электронов, при котором понижается степень окисления у окислителя. При определении степени окисления атомов необходимо помнить:
- что степень окисления атома в молекуле простого вещества равна нулю;
- степень окисления атома водорода во всех соединениях, кроме гидридов щелочных и щелочноземельных металлов равна +1;
- степень окисления кислорода во всех соединениях, кроме пероксидных и ОF2, равна –2;
- сумма степеней окисления всех атомов в молекуле равна нулю.
Атом элемента в высшей степени окисления является только окислителем (например, сера в молекуле H2SO4 имеет высшую степень окисления 6+); атом элемента в низшей степени окисления является только восстановителем (например, сера в молекуле H2S имеет низшую степень окисления 2–); атом элемента, находящийся в промежуточной степени окисления, может быть и окислителем и восстановителем (например, сера в молекуле H2SO3 имеет промежуточную степень окисления 4–). Такие соединения проявляют окислительно-восстановительную двойственность и способны к реакциям диспропорционирования.
Пример 1.Могут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и HI; б) H2S и H2SО3; в) H2SО3 и HClО4?
Решение: а) степень окисления серы в H2S равна –2, йода в HI равна –1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) степень окисления серы в H2S равна –2, то есть низшая, в H2SО3 –равна +4 – промежуточная. Следовательно, взаимодействие этих веществ возможно, причем H2SО3 является окислителем;
в) степень окисления серы в H2SО3 равна +4 (промежуточная), хлора в HClО4 равна +7 (высшая). Соединения H2SО3 и HClО4 могут реагировать, причем H2SО3 будет проявлять восстановительные свойства.
Пример 2. Завершить уравнение реакции, дописав недостающие продукты. Составить уравнения полуреакций окисления и восстановления, на их основе написать уравнения реакций в ионной и молекулярной формах:
KNO2+KI+H2SO4®J2+NO + …`
Решение.В реакции йод меняет степень окисления от –1 в иодиде калия до нуля в I2. Йод теряет электроны, т.е. окисляется. Восстанавливаться в данной реакции будет азот, который меняет степень окисления от +3 до +2. Нитрит-ион восстанавливается до NO с приобретением одного электрона на каждый атом азота. Избыточный кислород нитрит-иона будет связываться водородными ионами кислой среды с образованием воды:
| NO-2+2H++e=NO+H2O
2I-–2e=I2
| | | 2NO-2+4H++2I-=2NO+2H2O+I2
| |  
|
Полученное уравнение является уравнением искомой реакции в ионной форме. Молекулярное уравнение реакции получится, если учесть, что ионы калия, освобождающиеся при разрушении молекул KNO2 и KJ, образуют соли с серной кислотой:
2KNO2+2KI+2H2SO4®J2+2NO +2 К2SO4+2 H2O
Пример 3. Установить, в каком направлении возможно самопроизвольное протекание реакции 2NaCl+Fe2(SO4)3=2FeSO4+Cl2+Na2SO4?
Решение. Уравнение реакции в ионно-молекулярной форме:
2Cl-+2Fe3+=2Fe2++Cl2
Запишем стандартные электродные потенциалы электрохимических систем, участвующих в реакции, используя данные прил. 6:
Cl2+2e-=2Cl- E1=1,36 B
Fe3++e-=Fe2+ E2=0,77 B
Поскольку Е1 >Е2, то окислителем будет служить хлор, а восстановителем – ион Fe2+; рассматриваемая реакция будет протекать справа налево.
Пример 4.Найти при 25°С константу равновесия реакции Hg2(NO3)2+2Fe(NO3)2=2Hg+2Fe(NO3)3.
Решение. Уравнение реакции в ионно-молекулярной форме:
Hg22++2e-=2Hg+2Fe3+
В реакции участвуют две электрохимические системы (прил. 6):
Hg22++2e-=2Hg - E1=0,79 В
Fe3++e-=Fe2+ E2=0,77 B
Находим значение стандартной ЭДС рассматриваемого элемента:
E0=E1-E2=0,79-0,77=0,02 В.
Теперь вычислим константу равновесия реакции:
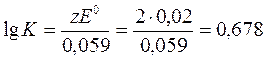 , К=4,76.
, К=4,76.
Ответ: К=4,76.
Все темы данного раздела:
Контрольных работ по общей химии
Введение
Химия – одна из фундаментальных наук естествознания, формирующих естественно-научное мировоззрение будущих специалистов. Наличие пр
Фактор эквивалентности химического элемента Х в его соединениях равен
fэ (Х) = 1:|с.о.| ,
где с.о. – степень окисления элемента Х в данном соединении.
Пример 1.Найти величины факторов экви
Фактор эквивалентности вещества Х, участвующего в окислительно-восстановительном процессе, равен
fэ (Х) = 1: Nе,
где Nе – количество электронов, которые теряет или присоединяет одна молекула вещества Х.
Фактор эквивалентности вещества Х, участвующего в ионообменном процессе, равен
fэ (Х) = 1: (Ni·|zi|),
где Ni и zi - соответственно число и заряд ионов, которыми обменивается молекула реагирующего
Й уровень
1-5. При взаимодействии m, г, n-валентного металла с серной кислотой выделилось V, мл, (н.у.) водорода. Рассчитайте эквивалентную и мольную массы металла, массу прореагирова
Й уровень
16-20. В нижеприведенной реакции определите факторы эквивалентности и эквивалентные массы исходных веществ. Для окислительно-восстановительных реакций найдите массу окислите
Й уровень
31-35. Какой объем (н.у.) вещества А образуется при взаимодействии N молекул вещества Б с кислородом:
Задачи
Состав атома
Атом – это мельчайшая, химически неделимая электронейтральная частица вещества. В центре атома находится ядро, состоящее из протонов р и нейтронов n. Вокруг ядра вращаются электроны
Строение электронных оболочек
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
Геометрические и энергетические характеристики атомов
Атомный радиус.Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности внешних электронных оболочек. С увеличением за
Химическая связь.
Под химической связью понимают результат взаимодействия двух и более атомов, приводящий к образованию устойчивой многоатомной системы.
Важнейшими видами химической связи являются: ковалент
Й уровень
41-45. Составьте электронную формулу атома элемента с порядковым номером Z. К какому электронному семейству принадлежит этот элемент? Составьте уравнение β--
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Для прогнозирования физико-химических процессов очень важно заранее знать, возможна ли реакция между теми или иными веществами, приведенными в химический контакт. В случае, если реакция в данных ус
Термохимия
Термохимия изучает тепловые эффекты химических процессов. Протекание химических реакций всегда связано с выделением или поглощением теплоты. Химические реакции, в результате которых выделяется тепл
Химическое сродство
Чтобы понимать химические процессы и управлять ими, необходимо знать ответ на вопрос: каковы движущие силы и критерии самопроизвольных химических процессов. Одной из движущих сил химической реакции
Й уровень
91-95. Рассчитайте стандартный тепловой эффект реакции, предварительно подобрав коэффициенты в уравнении, и установите, является ли реакция экзо- или эндотермической. Станда
Й уровень
121-125. Вычислите количество теплоты, выделившееся при сгорании углеродсодержащего топлива А массой m, в котором также содержится негорючий компонент с массовой долей Сm
Химическая кинетика
Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой. При определении скоростей учитывается, что реакции могут быть гомогенными, то есть
Химическое равновесие
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. ΔΗ = ΤΔS. В этом случае соблюдается усло
Решение.
1. Влияние концентраций (парциальных давлений) компонентов системы. Если, например, в систему добавить метан, т.е. увеличить его концентрацию, то равновесие системы нарушится. При этом ускор
Й уровень
161 – 165 Во сколько раз изменится скорость прямой гомогенной реакции, если концентрацию вещества А увеличить в X раз, а концентрацию вещества В умень
Й уровень
176-180. В гомогенной химической реакции установилось состояние равновесия с константой равновесия, равной k. Рассчитайте равновесные концентрации всех веществ
Й уровень
206-210.В какой массе воды нужно растворить 100 г вещества А, чтобы получить Х% по массе раствор? Какова молярность этого раствора, если его плотность равна ρ г/
Й уровень
221-225. Вычислите нормальность и титр раствора Н2С2О4·2Н2О, полученного растворением Х, г ее в Y, см3, воды. Плотность получ
Й уровень
236-240. При охлаждении 2,0 кг Х%-го по массе раствора соли А из него выкристаллизовалось m, г, соли. Вычислите массовую долю (%) соли в охлажденном растворе и его нормальную конце
Свойства растворов неэлектролитов
Разбавленные растворы неэлектролитов обладают рядом свойств, количественное выражение которых зависит от числа находящихся в растворе частиц растворенного вещества и от количества р
Й уровень
246-250. Для приготовления антифриза на V, л, воды было взято m, г, вещества А.Чему равна температура замерзания приготовленного антифриза?
Задачи
Й уровень
261-265. Какой объем вещества А плотностью r, кг/л, необходимо добавить на каждый литр воды , чтобы получить антифриз, замерзающий при температуре – 20°С?
Й уровень
276-280. При температуре 315 К давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт.ст.). На сколько понизится давление пара при указанной температуре, если в m, г,
Электролитическая диссоциация
Электролиты – вещества, расплавы или растворы в полярных растворителях которых проводят электрический ток. Причина этого явления состоит в том, что в данных условиях такие вещества
Произведение растворимости
Для практически нерастворимого продукта АВ, образующего твердую фазу, процесс его диссоциации характеризуется константой равновесия Кравн= =[А+]·[В-], в выражение к
Й уровень
286-290. найти изотонический коэффициент для раствора электролита с концентрацией растворенного вещества СМ, если известно, что в 1 дм3 этого раствора содержи
Й уровень
301. Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при температуре – 0,13 ºC. Вычислить кажущуюся степень диссоциации Na2СO3.
Й уровень
311. Нужно приготовить раствор, содержащий в 1 дм3 0,5 моля NaCl, 0,16 моля КCl и 0,24 моля К2SO4. Как это сделать, имея в своем распоряжении тольк
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
Вода является слабым электролитом и диссоциирует по уравнению
Н2О↔ Н+ + ОН-
Константа диссоциации воды весьма мала и составляет при 25º
Й уровень
321-325. Найти концентрацию ионов Н+ в растворах, в которых концентрация гидроксид-ионов составляет А:
Задачи
Й уровень
331. Рассчитать рН раствора, полученного смешением 25 см3 0,5М раствора НСl, 10 см3 0,5М раствора NaOΗ и 15 см3воды.
332
ИОНООБМЕННЫЕ РЕАКЦИИ. ГИДРОЛИЗ СОЛЕЙ
При взаимодействии растворов электролитов реакции происходят между ионами растворенных веществ. Химический процесс можно записать в молекулярной и ионно-молекулярной формах. Однако ионная форма отр
Й уровень
336-340. Записать в молекулярной и ионно-молекулярной формах уравнения реакций между веществами А и Б, приводящих к образованию малорастворимых осадков или газов:
Й уровень
356-360. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах и укажите, как изменится (уменьшится или увеличится) степень гидролиза этой сол
Й уровень
371-375. Записать в молекулярной и ионно-молекулярной формах уравнения реакций между водными растворами следующих веществ:
Задачи
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называются комплексными. Строение комплексных соединений объясняет координационная
Й уровень
386-390. Составить выражение для константы нестойкости комплексного иона А и определить в нем степень окисления иона – комплексообразователя:
Задачи
Й уровень
391-395. Составить координационную формулу комплексной соли с названием А и написать для нее уравнения первичной и вторичной диссоциации:
Задачи
Й уровень
396-400. Составить уравнения первичной и вторичной диссоциации комплексного соединения А. Написать в молекулярной и ионно-молекулярной формах уравнения обменных реакций, происходящ
Й уровень
401-405. Исходя из степени окисления элемента А в соединениях Б, В, Г, определите, какое из них может быть только окислителем, только восстановителем или может проявлять оки
Й уровень
416-420.Составьте электронные уравнения окисления или восстановления элемента
Й уровень
431-435. На основе сравнения стандартных окислительно-восстановительных потенциалов окислителей в левой и правой частях уравнения определить направление окислительно-восстан
ЭЛЕКТРОХИМИЧЕСКИЕ ЯВЛЕНИЯ
Самопроизвольно протекающие окислительно-восстановительные реакции при пространственном разделении процессов окисления и восстановления могут создавать электрическую энергию вследствие уменьшения с
Гальванический элемент
Гальванический элемент – это устройство, способное преобразовывать свободную энергию Гиббса окислительно-восстановительной реакции в электрическую.
Элемент состоит из двух
Электролиз
Электролизом называется процесс раздельного окисления и восстановления на электродах, опущенных в раствор электролита, осуществляемый за счет протекания тока от внешнего источника ЭДС. При этом на
Й уровень
441-445. Дана схема гальванического элемента. Напишите электронные уравнения электродных процессов и уравнение токообразующей реакции, протекающих в этом элементе:
Уровень
471-475. Дана схема гальванического элемента. Напишите электронные уравнения электродных процессов и уравнение токообразующей реакции, протекающих в этом элементе. Рассчитай
Й уровень
501-505. Дана схема гальванического элемента. Напишите электронные уравнения электродных процессов и уравнение токообразующей реакции, протекающих в этом элементе. Рассчитайте
Относительная электроотрицательность элементов
Н
2,1
&
Термодинамические свойства простых веществ и соединений
В таблице указаны жидкое (ж), газообразное (г) и твердое (т) состояния веществ.
Вещество
DН0,кДж/моль
DG 0, кДж/моль
Произведения растворимости труднорастворимых веществ
Вещество
Произведение растворимости (ПР)
Ag2Cr2О7
1·10-10
AlРО
Термодинамические свойства ионов в водных растворах
Ион
DН0, кДж/моль
DG°, кДж/моль
ΔS 0, Дж/(моль К)
Со2+
Стандартные электродные потенциалы в водных растворах
Электродная реакция
E°, В
Электродная реакция
E°, В
Li++е=Li
-3,024
Растворимость неорганических веществ в воде при комнатной температуре
Ионы
Вr -
СН3СОО -
СN -
СO32-
Названия некоторых кислот и их кислотных остатков
Кислота
Кислотный остаток
Формула
Название
Формула
&


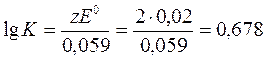 , К=4,76.
, К=4,76.






Новости и инфо для студентов