рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ОПРЕДЕЛЕНИЕ ДИХРОМАТНОЙ ОКИСЛЯЕМОСТИ ВОДНОЙ ПРОБЫ В ОТСУТСТВИЕ ХЛОРИДОВ (АРБИТРАЖНЫЙ МЕТОД).
Реферат Курсовая Конспект
ОПРЕДЕЛЕНИЕ ДИХРОМАТНОЙ ОКИСЛЯЕМОСТИ ВОДНОЙ ПРОБЫ В ОТСУТСТВИЕ ХЛОРИДОВ (АРБИТРАЖНЫЙ МЕТОД).
ОПРЕДЕЛЕНИЕ ДИХРОМАТНОЙ ОКИСЛЯЕМОСТИ ВОДНОЙ ПРОБЫ В ОТСУТСТВИЕ ХЛОРИДОВ (АРБИТРАЖНЫЙ МЕТОД). - раздел Химия, ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ Этот Метод Определения Хпк Применяется В Основном Для Анализа...
Этот метод определения ХПК применяется в основном для анализа сточных вод.
Реагенты:
1. Серная кислота, плотность 1,84 г/мл, ч.д.а.
2. Сульфат серебра, твердый, ч.д.а.
3. Индикатор. В качестве индикатора используют один из следующих растворов:
а) N- фенилантраниловая кислота - 0,25 г растворяют в 12 мл 0,1 н. раствора гидроксида натрия и разбавляют водой до 250 мл,
б) ферроин - 1,485 г 1,10-фенантролина и 0,695 г FеSO4·7Н2О растворяют в воде, и раствор разбавляют водой до 100 мл.
4. Дихромат калия, 0,25 н. раствор (12,2580 г дихромата калия, предварительно высушенного в течение 2 ч при 105oС, растворяют в дистиллированной воде и раствор разбавляют до 1 л).
5. Соль Мора, 0,25 н. раствор (растворяют 98 г соли Мора в дистиллированной воде, прибавляют 20 мл концентрированной серной кислоты и раствор разбавляют дистиллированной водой до 1 л). Раствор соли Мора предварительно стандартизируют по дихромату калия. Для этого отбирают 25 мл стандартного раствора дихромата калия, разбавляют его дистиллированной водой до 250 мл, приливают 20 мл концентрированной серной кислоты и дают остыть. Затем прибавляют 3-4 капли раствора ферроина или 5-10 капель раствора N-фенилантраниловой кислоты и титруют раствором соли Мора.
Методика определения. Отобрав такую порцию анализируемой сточной воды, чтобы на ее окисление расходовалось не более 20 мл титрованного раствора дихромата калия, разбавляют ее дистиллированной водой до 50 мл, переносят в круглодонную колбу вместимостью 300 мл, прибавляют 25 мл стандартного раствора дихромата калия и осторожно, малыми порциями вливают 75 мл концентрированной серной кислоты, тщательно перемешивая смесь после добавления каждой порции. Затем насыпают 0,3-0,4 г сульфата серебра, вводят в колбу несколько стеклянных бусинок или кусочков пемзы, закрывают пробкой, соединенной с обратным холодильником, и нагревают до слабого кипения, которое поддерживают в течение 2 ч. Затем охлаждают, обмывают стенки холодильника 25 мл дистиллированной воды и переносят содержимое этой колбы в коническую колбу вместимостью 500 мл, обмывая стенки первой колбы несколько раз дистиллированной водой. Добавив дистиллированную воду до объема 350 мл, вводят 3-4 капли раствора ферроина (10-15 капель раствора N-фенилантраниловой кислоты) и оттитровывают избыток дихромата титрованным раствором соли Мора.
Проводят холостой опыт; для этого берут 50 мл дистиллированной воды и проводят ее через все ступени анализа.
Химическое поглощение кислорода (ХПК), выраженное числом миллиграммов кислорода на 1 л сточной воды, вычисляют по формуле:
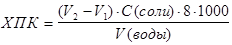
где V1 – объем раствора соли Мора, израсходованного на титрование в холостом опыте, мл;
V2 – объем того же раствора, израсходованного на титрование пробы, мл;
С (соли) – молярная концентрация эквивалента соли Мора, моль/л;
8 – молярная масса эквивалента кислорода, г/моль,
V(воды) – объем анализируемой сточной воды, мл.
Лабораторная работа №4. Колориметрическое определение содержания меди в воде (с диэтилдитиокарбаматом натрия)
Определение меди в питьевой воде в соответствии со стандартом проводится фотоколориметрически – при содержании меди в концентрации от 0,02 до 0,5 мг/л с реактивом диэтилдитиокарбаматом натрия:
|
При пониженном содержании меди (от 0,002 до 0,06 мг/л) используют диэтилдитиокарбамат свинца, и тогда прибегают к дополнительному концентрированию меди путем экстракции в органическую фазу.
Настоящий метод основан на взаимодействии катионов Сu2+ с диэтилдитиокарбаматом натрия (см. рисунок) в слабоаммиачном растворе с образованием диэтилдитиокарбамата меди, который окрашен в желто-коричневый цвет:
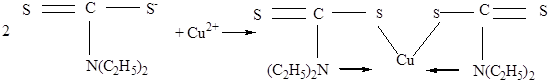

Диэтилдитиокарбамат меди нерастворим в воде, но в разбавленных растворах образует коллоидные системы, для большей устойчивости которых добавляют раствор крахмала. Для устранения мешающего влияния железа и жесткости воды добавляют раствор сегнетовой соли (KNaC4H4O6 5H2O). Для определения меди в концентрациях от 0,02 до 0,5 мг/л требуется объем пробы воды 50 мл.
Реагенты:
1. 1л исходного стандартного раствора сульфата меди (0,01г/л).
2. 1л 0,1%-ного раствора диэтилдитиокарбамата натрия.
3. 1л 5% раствора аммиака.
4. 200 мл 50%-ного раствора сегнетовой соли.
5. 100 мл 5%-ного раствора персульфата аммония.
6. 10 мл 0,5%-ного раствора крахмала.
Методика определения. Подготавливают фотоколориметр к работе (см. работу №1). Для приготовления серии стандартных растворов в мерные колбы на 50 мл отбирают по 1,0; 2,0; 3,0; 4,0; 5,0 мл исходного стандартного раствора. В каждую колбу последовательно добавляют (порядок прибавления реагентов важен!) по 1 мл раствора сегнетовой соли, 5 мл раствора аммиака, 1 мл крахмала, 5 мл раствора диэтилдитиокарбамата натрия, тщательно перемешивают и доводят объёмы растворов до метки дистиллированной водой. Оптическую плотность полученных растворов, А, измеряют фотометрически в кюветах длиной 5 см и при длине волны 440 нм. Заносят данные измерений в табл. 4. Строят градуировочный график в координатах А = f[C(Cu2+)].
– Конец работы –
Эта тема принадлежит разделу:
ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ
Факультет почвоведения агрохимии и экологии... Кафедра неорганической и аналитической химии... Г Д Клинский Д А Князев С Н Смарыгин...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОПРЕДЕЛЕНИЕ ДИХРОМАТНОЙ ОКИСЛЯЕМОСТИ ВОДНОЙ ПРОБЫ В ОТСУТСТВИЕ ХЛОРИДОВ (АРБИТРАЖНЫЙ МЕТОД).
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?








Новости и инфо для студентов