рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ
Реферат Курсовая Конспект
ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ
ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ - раздел Химия, Московская Сельскохозяйственная Академия Имени К. А. Тимирязева Факу...
Московская сельскохозяйственная академия имени К. А. Тимирязева
Факультет почвоведения, агрохимии и экологии
Кафедра неорганической и аналитической химии
Г.Д.Клинский, Д.А.Князев, С.Н.Смарыгин,
А.В.Бочкарев, И.В.Дайдакова
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ
Часть 1
Химия воды
МОСКВА ИЗДАТЕЛЬСТВО МСХА 2000
ВВЕДЕНИЕ.
Данное учебное пособие является первой частью лабораторного практикума по химии окружающей среды. В нем описаны лабораторные работы по анализу природных или сточных вод с применением химических и физико-химических методов, используемых в настоящее время в соответствии с государственными стандартами. Химический состав объектов окружающей среды определяется не только естественными, но и антропогенными факторами, прежде всего химическим загрязнением. Одной из важных особенностей анализа объектов окружающей среды является многокомпонентность проб. Поэтому часто актуален анализ проб на содержание не только основных компонентов, микрокомпонентов, но и на степень загрязнения токсичными веществами. При проведении лабораторных работ большое внимание отводится таким этапам анализа как отбор пробы, ее хранение, подготовка к анализу. На заключительном этапе выполнения лабораторной работы необходимо проводить математическую обработку результатов эксперимента, сравнивать полученные данные со значениями ПДК по определенным загрязнителям, делать выводы о качестве исследуемого объекта окружающей среды.
Природные и сточные воды являются сложными многокомпонентными системами. В них содержится большое количество разнообразных минеральных и органических веществ, которые могут присутствовать как в истинно растворенной форме, так и в виде коллоидных частиц, суспензий, эмульсий. Исследование качества воды заключается в сопоставлении результатов анализа воды по определенным параметрам с установленными стандартами. Разработаны стандарты качества воды для каждого из предполагаемых способов применения конкретного вида воды. Эти стандарты определяются также технологическими и экономическими возможностями водопользования в различных районах. Качество воды предварительно оценивается по общим характерным параметрам и суммарным показателям: органолептические свойства, цветность, мутность, кислотность, щелочность, химическое потребление кислорода (ХПК), биохимическое потребление кислорода (БПК), объем грубодисперсной фазы, общее содержание углерода, азота, серы и т.д. Общие параметры дополняются более детальными требованиями к качеству воды. При этом нормируются концентрации отдельных веществ (по величинам ПДК).
При отборе пробы воды из водоёма необходимо учитывать конкретную санитарную ситуацию и задачи аналитического контроля. В первую очередь надо правильно определить пункты и сроки отбора проб воды. При централизованном водоснабжении в населенном пункте пробы воды из водоема берутся в точке водозабора по глубине и ширине реки. В водохранилищах, озерах, прудах, где течение воды резко замедлено, качество воды может быть различным в нескольких точках, поэтому в этих водоёмах берут серию проб по створам и глубине. При контроле сточных вод режим отбора проб должен исходить из условий образования, отведения, очистки и выпуска сточных вод контролируемого предприятия.
В зависимости от определяемых компонентов в каждом особом случае оговариваются дополнительные меры по пробоподготовке. В лабораторных журналах обязательно указывают даты отбора и анализа воды.
О ПОРЯДКЕ ВЫПОЛНЕНИЯ ПРАКТИКУМА
1. Г.Фелленберг, Загрязнение природной среды. Введение в экологическую химию, М., Мир, 1997. 2. Основы аналитической химии, Ю.А.Золотов и др., М., Высшая школа, 1996. 3. А.Г.Муравьев, Руководство по определению показателей качества воды полевыми методами, Крисмас, Санкт-Петербург,…ЛАБОРАТОРНЫЕ РАБОТЫ
Лабораторная работа №1. Определение органолептических свойств природных вод.
Для фотоколориметрического определения цветности и мутности используют способ калибровочного графика. Для этого измеряют оптическую плотность серии… Проведение фотоколориметрического определения на фотоколориметре КФК-2… 1. Включают прибор в сеть и дают ему прогреться 15 мин. Во время прогрева прибора кюветное отделение должно быть…ЦВЕТНОСТЬ
Цветность воды определяют фотометрически. Пробу исследуемой воды сравнивают по окраске с растворами, имитирующими цвет природных вод (по так… Реагенты: 1. 1л основного стандартного раствора, соответствующего 500о по шкале цветности (0,09г дихромата калия, 2г сульфата…МУТНОСТЬ.
Реагент: 1 л основной стандартной суспензии аморфного диоксида кремния (0,1г/л). Методика определения. Подготавливают фотоколориметр к работе. Для приготовления эталонных суспензий берут 5 мерных…НАЛИЧИЕ ОСАДКА.
Осадок оценивают визуально и характеризуют по следующим параметрам: нет, незначительный, заметный, большой. При очень большом осадке указывают толщину слоя в мм. По качеству осадок определяют как хлопьевидный, илистый, песчаный и т.п. с указанием цвета – серый, бурый, черный и др.
ПРОЗРАЧНОСТЬ.
Шрифт Снеллена №1 для измерения прозрачности воды. 1,0 Научная санитарная оценка питьевой воды и источ- ников водоснабжения…ЗАПАХ
Запах воды обусловлен наличием в ней летучих пахнущих веществ, которые попадают в нее естественным путём или со сточными водами. Определение основано на органолептическом исследовании характера и интенсивности запаха воды при 20оС, часто дополнительно и при 50оС.
Методика определения.100 мл исследуемой воды при 20оС наливают в колбу вместимостью 150-200 мл с широким горлом, закрывают пробкой, встряхивают вращательным движением, открывают пробку и быстро определяют характер и интенсивность запаха. Интенсивность запаха определяют по пятибалльной шкале (см. таблицу 1).
Таблица 1. Определение интенсивности запаха питьевой воды.
| Интенсивность запаха | Характер проявления запаха | Оценка интенсивности запаха, балл |
| Нет | Запах не ощущается | |
| Очень слабая | Запах не ощущается потребителем, но обнаруживается при лабораторном исследовании | |
| Слабая | Запах замечается потребителем, если обратить на это внимание | |
| Заметная | Запах легко замечается и вызывает неодобрительный отзыв о воде | |
| Отчетливая | Запах обращает на себя внимание и заставляет воздержаться от питья | |
| Очень сильная | Запах настолько сильный, что делает воду непригодной к употреблению |
По характеру запахи делятся на две группы:
1. Запахи естественного происхождения (ароматический, болотный, древесный, гнилостный, землистый, плесневый, травянистый, сероводородный, неопределенный).
2. Запахи искусственного происхождения (хлорфенольный, камфорный, бензиновый, хлорный и т.д.).
ВКУС И ПРИВКУС.
Вкус и привкус определяют качественно и количественно по интенсивности в баллах (см. таблицу 2). Для питьевой воды вкус и привкус исследуют в сырой воде при комнатной температуре. В воде открытых водоёмов и источников, ненадёжных в санитарном состоянии, вкус воды устанавливают после её кипячения.
Таблица 2. Определение интенсивности вкуса питьевой воды (200С).
| Интенсивность вкуса и привкуса | Характер вкуса и привкуса | Оценка интенсивности вкуса и привкуса, балл |
| Нет | Вкус и привкус не ощущаются | |
| Очень слабая | Вкус и привкус не ощущаются потребителем, но обнаруживаются при лабораторном исследовании | |
| Слабая | Вкус и привкус замечаются потребителем, если обратить на это внимание | |
| Заметная | Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о воде | |
| Отчетливая | Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья | |
| Очень сильная | Вкус и привкус настолько сильный, что делает воду непригодной к употреблению |
При исследовании в рот набирают 10-15 мл воды, держат несколько секунд, не проглатывая, и определяют характер и интенсивность вкуса и привкуса. Различают четыре вида вкуса: горький, сладкий, солёный и кислый. Остальные вкусовые ощущения называют привкусами: хлорный, рыбный, металлический и т.п.
Лабораторная работа №2. Определение биохимического потребления кислорода (БПК)
Биохимическое потребление кислорода (БПК) – это количество кислорода, требуемое для окисления находящихся в 1л воды органических веществ в аэробных условиях при 20оС в результате протекающих в воде биохимических процессов за определенный период времени (БПК за 3, 5, 10 суток). Установлено, что при загрязнении водоёмов преимущественно хозяйственно-бытовыми сточными водами с относительно постоянным составом и свойствами пятисуточное БПК5 составляет около 70% полного БПК. Величина БПК определяется по разности содержания растворенного кислорода до и после инкубации пробы воды при стандартных условиях (инкубация проводится в темноте при определенной температуре без дополнительного доступа воздуха). БПК определяют в натуральной, тщательно перемешанной воде.
Величину БПК, Х, (мг О2 /л) рассчитывают по формуле:
БПК = С1 - С2,
где С1 и С2 – концентрации кислорода в пробе воды до начала инкубации (нулевой день) и после, мг/л.
Концентрацию растворенного в воде кислорода определяют иодометрическим титрованием по Винклеру. Метод Винклера основан на способности Mn2+ окисляться в щелочной среде до MnO2, количественно связывая при этом растворенный кислород:
 2Mn2+ + 4OH- + 2O2 → 2MnO2 + 2H2O.
2Mn2+ + 4OH- + 2O2 → 2MnO2 + 2H2O.
При последующем подкислении MnO2 восстанавливается до Mn2+, окисляя при этом эквивалентное связанному кислороду количество иодида калия:
MnO2 + 2I- + 4H+ →Mn2+ +I2 + 2H2O.
Выделившийся иод оттитровывают раствором тиосульфата натрия:
I2 +2S2O32- → 2I- + S4O62-.
Реагенты:
1. 1л 2М раствора сульфата или хлорида марганца (II).
2. Щелочной раствор иодида калия (15г иодида калия растворить в 10 мл воды и смешать с 50 мл концентрированного раствора гидроксида натрия, довести объём смеси водой до 100 мл).
3. 1л 15% раствора соляной кислоты.
4. 1л стандартизированного раствора тиосульфата натрия (0.01н.).
Для приготовления этого раствора взвесить на технохимических весах рассчитанную навеску кристаллического тиосульфата натрия Na2S2O3×5H2O, через воронку высыпать его в чистую бутыль из темного стекла вместимостью 1 л, залить дистиллированной водой, перемешать и оставить в темном месте не менее чем на 10 дней. По истечении этого срока провести стандартизацию этого раствора. Для этого в коническую колбу для титрования вместимостью 250 мл налить при помощи мерного цилиндра 10 мл 10%-ного раствора иодида калия и 10 мл 20%-ного раствора серной кислоты. Затем пипеткой перенести в эту колбу 10 мл стандартизированного раствора перманганата калия. Накрыть колбу часовым стеклом и поставить в темное место на 5 минут. После этого добавить в колбу 100 мл дистиллированной воды и титровать выделившийся иод раствором тиосульфата натрия до перехода окраски раствора от бурой до соломенно-желтой. Затем добавить 3 мл раствора крахмала и продолжать титрование до полного обесцвечивания раствора. Вычислить молярную концентрацию эквивалента тиосульфата натрия в этом растворе.
5. 10 мл 0.5 % крахмала.
Методика определения. Предварительно проводится калибровка специальной склянки с точностью до 0.1 мл. Вместимость склянки численно равна разности массы склянки, полностью заполненной дистиллированной водой и закрытой пробкой, и массы пустой сухой склянки, также закрытой пробкой, при одинаковой температуре.
В откалиброванную склянку вместимостью 100-200 мл, снабженную притертой пробкой, отбирают пробу воды. Склянка должна быть заполнена водой до краёв. В склянку вводят пипеткой
1 мл раствора хлорида или сульфата марганца (II) и 1 мл щелочного раствора иодида калия. После введения реактивов закрывают склянку пробкой, следя за тем, чтобы в ней не осталось пузырьков воздуха. При добавлении реагентов часть жидкости переливается через край: ее нужно собрать, и определить ее объем. Затем содержимое склянки тщательно перемешивают многократным резким перевертыванием склянки. После того, как раствор над образовавшимся осадком станет прозрачным, в склянку добавляют 5 мл раствора хлороводородной кислоты. Склянку закрывают пробкой и содержимое тщательно перемешивают. Осадок растворяется, выделившийся при окислении иодида калия иод окрашивает раствор в жёлтый цвет. После этого всю пробу переливают в колбу вместимостью 200-300 мл и быстро титруют стандартизированным раствором тиосульфата натрия при непрерывном перемешивании до слабо-желтого цвета. Далее прибавляют 1мл 0,5%-ного раствора крахмала и продолжают титровать по каплям до исчезновения синей окраски.
Содержание растворенного кислорода в воде, С(O2) (мг/л), рассчитывают по формуле:
кислорода в воде, С(O2) (мг/л), рассчитывают по формуле:

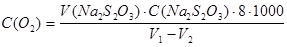 ,
,
где V(Na2S2O3) – объём тиосульфата натрия, пошедшего на титрование пробы, мл;
C(Na2S2O3) – молярная концентрация эквивалента (нормальность) раствора тиосульфата натрия, моль/л;
8 – молярная масса эквивалента кислорода; г/моль;
V1 – объём пробы воды в склянке, мл;
V2 – объём воды, вылившейся при введении реактивов для фиксации кислорода, мл.
Кроме концентрации растворенного в воде кислорода, вычисляют процент насыщения воды кислородом по отношению к нормальному содержанию кислорода при данной температуре и давлении. Для этого пользуются данными Таблицы 3, где представлено нормальное содержание кислорода при разной температуре и давлении 760 мм.рт.ст. (общая минерализация воды не должна превышать 1000мг/л, поскольку растворенные в воде соли влияют на растворимость в воде кислорода и других газов).
Процент насыщения воды кислородом рассчитывают по формуле:
 ,
,
где С(O2) – концентрация кислорода, полученная в результате анализа (мг/л),
760 – атмосферное давление (мм. рт. ст.),
Сn - нормальная концентрация кислорода, определенная при помощи таблицы 3 (с учетом температуры),
p – фактическое атмосферное давление, при котором проводится анализ воды (мм. рт. ст.).
Таблица 3. Зависимость равновесной концентрации растворенного в воде кислорода (мг/л) при атмосферном давлении 760 мм.рт.ст. (1013 гПа) от температуры воды, Т (0С).
| Т, 0С | Равновесная концентрация растворенного кислорода (мг/л) при изменении температуры на десятые доли градуса (0С) | |||||||||
| 0.0 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | |
| 12.79 | 12.76 | 12.72 | 12.69 | 12.66 | 12.52 | 12.59 | 12.56 | 12.53 | 12.49 | |
| 12.46 | 12.43 | 12.40 | 12.36 | 12.33 | 12.30 | 12.27 | 12.24 | 12.21 | 12.18 | |
| 12.14 | 12.11 | 12.08 | 12.05 | 12.02 | 11.99 | 11.96 | 11.93 | 11.90 | 11.87 | |
| 11.84 | 11.81 | 11.78 | 11.75 | 11.72 | 11.70 | 11.67 | 11.64 | 11.61 | 11.58 | |
| 11.55 | 11.52 | 11.49 | 11.47 | 11.44 | 11.41 | 11.38 | 11.35 | 11.33 | 11.30 | |
| 11.27 | 11.24 | 11.22 | 11.19 | 11.16 | 11.14 | 11.11 | 11.08 | 11.06 | 11.03 | |
| 11.00 | 10.98 | 10.95 | 10.93 | 10.90 | 10.87 | 10.85 | 10.82 | 10.80 | 10.77 | |
| 10.75 | 10.72 | 10.70 | 10.67 | 10.65 | 10.62 | 10.60 | 10.57 | 10.55 | 10.52 | |
| 10.50 | 10.48 | 10.45 | 10.43 | 10.40 | 10.38 | 10.36 | 10.33 | 10.31 | 10.28 | |
| 10.26 | 10.24 | 10.22 | 10.19 | 10.17 | 10.15 | 10.12 | 10.10 | 10.08 | 10.06 | |
| 10.03 | 10.01 | 9.99 | 9.97 | 9.95 | 9.92 | 9.90 | 9.88 | 9.86 | 9.84 | |
| 9.82 | 9.79 | 9.77 | 9.75 | 9.73 | 9.71 | 9.69 | 9.67 | 9.65 | 9.63 | |
| 9.61 | 9.58 | 9.56 | 9.54 | 9.52 | 9.50 | 9.48 | 9.46 | 9.44 | 9.42 | |
| 9.40 | 9.39 | 9.36 | 9.34 | 9.32 | 9.30 | 9.29 | 9..27 | 9.25 | 9.23 | |
| 9.21 | 9.19 | 9.17 | 9.15 | 9.13 | 9.12 | 9.10 | 9.08 | 9.06 | 9.04 | |
| 9.02 | 9.00 | 8.98 | 8.97 | 8.95 | 8.93 | 8.91 | 8.90 | 8.88 | 8.86 | |
| 8.84 | 8.82 | 8.81 | 8.79 | 8.7 | 8.75 | 8.74 | 8.72 | 8.70 | 8.68 | |
| 8.67 | 8.65 | 8.63 | 8.62 | 8.60 | 8.58 | 8.56 | 8.55 | 8.53 | 8.52 | |
| 8.50 | 8.48 | 8.46 | 8.45 | 8.43 | 8.42 | 8.40 | 8.38 | 8.37 | 8.35 | |
| 8.33 | 8.32 | 8.30 | 8.29 | 8.27 | 8.25 | 8.24 | 8.22 | 8.21 | 8.19 | |
| 8.18 | 8.16 | 8.14 | 8.13 | 8.11 | 8.11 | 8.08 | 8.07 | 8.05 | 8.04 |
ЛАБОРАТОРНАЯ РАБОТА № 3. Определение окисляемости водной пробы.
Окисляемость водной пробы (иначе называемая "химическое потребление кислорода", ХПК) отражает общее количество содержащихся в воде восстановителей (неорганических и органических), реагирующих с сильными окислителями, например, дихроматом калия, перманганатом калия и т.д. Результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно различаются из-за неодинаковой способности к окислению присутствующих в воде веществ. Величина окисляемости зависит от свойств окислителя, его концентрации, температуры, рН воды и т.п. Поэтому все методы определения окисляемости в определенной мере условны, а получаемые результаты сравнимы только в том случае, когда точно совпадают все условия проведения подобного анализа. Кроме того, при проведения анализа могут окисляться также растворенные в воде хлориды, что приводит к искажению результатов при анализе засоленных вод.
В связи с этим существует несколько методик определения окисляемости, которые по способу проведения анализа делятся на стационарные и полевые, а по области применения – на используемые в отсутствие или при наличии хлоридов. При применении любой методики результаты определения окисляемости воды выражают в мг кислорода на 1 л воды (мг О2/л).
ОПРЕДЕЛЕНИЕ ПЕРМАНГАНАТНОЙ ОКИСЛЯЕМОСТИ ВОДНОЙ ПРОБЫ
Наиболее проста методика определения перманганатной окисляемости. Она основана на окислении присутствующих в воде веществ (в основном легкоокисляющихся, например, гуминовых производных) избытком перманганата калия в сернокислой среде. Далее добавляют иодид калия, который реагирует с не вступившим в реакцию избытком перманганата калия:
2MnO4- + 16H+ +10I- ® 2Mn2+ +5I2 + 8H2O
Выделившийся иод (его количество эквивалентно количеству непрореагировавшего перманганата калия) оттитровывают тиосульфатом натрия.
Реагенты:
1. 1л раствора перманганата калия (0,01н.).
2. 1л раствора серной кислоты (1:3).
3. 1л раствора тиосульфата натрия (0,01н.).
4. 10г кристаллического иодида калия.
5 . 10 мл 0,5%-ного раствора крахмала.
Методика определения. Перед определением перманганатной окисляемости воды необходимо предварительно стандартизировать растворы перманганата калия и тиосульфата натрия (см. лабораторную работу №2).
В коническую колбу помещают 100 мл исследуемой воды, несколько стеклянных капилляров для равномерного кипения, 5мл разбавленной (1:3) серной кислоты, нагревают, и в самом начале кипения добавляют 10 мл раствора перманганата калия, кипятят 10 мин, закрыв колбу конической воронкой для уменьшения испарения жидкости. Далее раствор охлаждают, прибавляют 0,5г кристаллического иодида калия и выделившийся иод оттитровывают раствором тиосульфата натрия до слабо-желтого цвета. Затем прибавляют 1 мл 0,5% -ного раствора крахмала и продолжают титровать до исчезновения синей окраски. Аналогичный анализ проводят для определения окисляемости холостой пробы (дистиллированной воды).
Величину перманганатной окисляемости XПК, (мг О2/л) вычисляют по формуле:

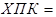
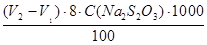
где V1 и V2 – объёмы раствора тиосульфата натрия, израсходованного на титрование холостой и исследуемой пробы, мл;
8 – молярная масса эквивалента кислорода, г/моль;
С(Na2S2O3) – молярная концентрация эквивалента тиосульфата натрия, моль/л;
100 – объём пробы воды, взятой для определения, мл.
ОПРЕДЕЛЕНИЕ ДИХРОМАТНОЙ ОКИСЛЯЕМОСТИ ВОДНОЙ ПРОБЫ В ОТСУТСТВИЕ ХЛОРИДОВ (АРБИТРАЖНЫЙ МЕТОД).
Этот метод определения ХПК применяется в основном для анализа сточных вод. Реагенты: 1. Серная кислота, плотность 1,84 г/мл, ч.д.а.Таблица 4. Данные для построения градуировочного графика
| № раствора | Анализируемая проба воды | |||||
| Концентрация меди, С (мг/л) | ||||||
| Оптическая плотность, А |
Аналогично проводят измерение оптической плотности для исследуемой пробы воды. В плоскодонную колбу отбирают 50 мл исследуемой воды. Если вода не была подкислена при отборе пробы, её подкисляют 2 каплями 20% НСl, затем последовательно добавляют все реактивы, как и в случае приготовления стандартных растворов меди. После добавления каждого реактива проводят перемешивание. При очень большом содержании меди в исследуемой пробе проводят её разбавление дистиллированной водой в несколько раз. При цветности воды больше 20о её обесцвечивают окислением персульфатом аммония: к 50 мл исследуемой воды прибавляют 2,5 мл раствора персульфата аммония и 20 мл дистиллированной воды. Пробу кипятят до получения объёма 50 мл и далее проводят определение содержания меди, как описано выше.
Содержание меди, Х, (мг/л) вычисляют по формуле:
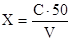 ,
,
где С – концентрация меди, найденная по градуировочному графику (мг/л),
V – объём пробы воды, взятый для определения (мл).
Лабораторная работа №5. Колориметрическое определение содержания железа в природной воде (с сульфосалициловой кислотой)
При рН от 9 до 11,5 катионы железа Fe2+ и Fe3+ образуют с сульфосалициловой кислотой (см. рис) желтоокрашенное комплексное соединение состава 1:3 (максимум поглощения в области 420-430 нм). Интенсивность окраски раствора пропорциональна концентрации катионов железа. Определению мешает присутствие фторид-ионов и других соединений, образующих прочные комплексы с ионами железа.
|
Реагенты:
1. 1л стандартного раствора Fe3+ (0,1 г/л),
2. 1л 10%-ного раствора сульфосалициловой кислоты,
3. 1л 10%-ного раствора аммиака.
Методика определения. Подготавливают фотоколориметр к работе (см. лаб. работу №1). Для приготовления эталонных растворов в пять мерных колб вместимостью 50 мл вводят по 10 мл воды, а также по 1, 2, 3, 4 и 5 мл стандартного раствора железа из бюретки. Во все растворы добавляют по 5 мл раствора аммиака и по 5 мл раствора сульфосалициловой кислоты. Объём раствора доводят до метки, колбы закрывают, тщательно перемешивают и оставляют стоять на 10 мин. Измеряют оптическую плотность полученных растворов (используют кюветы длиной 0,5 см), занося данные измерений в табл. 5, и строят градуировочный график.
Таблица 5. Данные для построения градуировочного графика
| № раствора | Анализируемая проба воды | |||||
| Концентрация катионов Fe3+, С (мг/л) | ||||||
| Оптическая плотность, А |
Для определения железа в исследуемой водной пробе в плоскодонную колбу вводят 50 мл исследуемой воды и все те же компоненты, за исключением, разумеется, стандартного раствора соли железа, и в той же последовательности, что и при приготовлении градуировочных растворов. Далее фотометрируют раствор в кюветах длиной 0,5 см и определяют содержание железа аналогично предыдущим определениям.
Лабораторная работа №6. Колориметрическое определение содержания фосфора в виде фосфорномолибденового комплекса (синяя форма)
Метод основан на определении растворенных в воде ортофосфатов колориметрическим методом в виде фосфорномолибденового комплекса, окрашенного в синий цвет. Определению мешают железо при концентрации, превышающей 1 мг/л, растворимые силикаты с концентрацией более 25 мг/л, нитриты. Влияние железа и силикатов устраняется соответствующим разбавлением исследуемой пробы воды. При наличии нитритов с концентрацией не более 25 мг/л их влияние устраняется добавлением к пробе 0,1 г сульфаминовой кислоты, которая вносится до добавления к пробе молибдата аммония.
Реагенты:
1. 1л 0,001М исходного стандартного раствора дигидрофосфата калия,
2. 1л молибденового реактива [10г (NH4)6Mo7O24 4H2O растворяют в 400 мл воды и добавляют 7 мл концентрированной серной кислоты].
3. 500 мл 9%-ного раствора аскорбиновой кислоты.
Методика определения. Подготавливают фотоколориметр к работе. Для приготовления градуировочных растворов в пять мерных колб вместимостью 50 мл вводят по 20 мл дистиллированной воды. Далее добавляют в каждую колбу соответственно 2, 4, 6, 8 и 10 мл исходного стандартного раствора. В каждый раствор приливают по 5 мл молибденового реактива, перемешивают и через пять минут добавляют 5 мл раствора аскорбиновой кислоты, доводят объём раствора до метки дистиллированной водой и снова перемешивают. Через 15 мин растворы фотометрируют (длина кюветы 2 см) в области поглощения 670 нм, занося данные измерений в табл. 6, и строят градуировочный график.
Таблица 6. Данные для построения градуировочного графика
| № раствора | Анализируемая проба воды | |||||
| Концентрация ортофосфат-ионов, С (мг/л) | ||||||
| Оптическая плотность, А |
Для определения содержания ортофосфат-ионов в исследуемой воде берут 50 мл этой воды, добавляют все реагенты за исключением, разумеется, исходного стандартного раствора дигидрофосфата калия, в той же последовательности, что и при приготовлении градуировочных растворов и фотометрируют при тех же условиях, что и градуировочные растворы. По построенному ранее градуировочному графику определяют содержание фосфора аналогично предыдущим определениям.
Лабораторная работа №7. Калибровка рН-метра и определение
РН природной воды
Включают прибор (рН-метр: милливольтметр рН-121, или иономер: иономер универсальный ЭВ-74) и прогревают его не менее 20 мин. С помощью термометра… Приготавливают по крайней мере два буферных раствора, имеющих значения рН… Наливают в стаканчик дистиллированную воду и погружением в нее электродов промывают их. Убирают стаканчик и…Лабораторная работа №8. Ионометрическое определение содержания нитратов
Метод прямой потенциометрии (ионометрии) широко применяемый для определения нитратов в объектах окружающей среды, позволяет быстро, достаточно точно… Для определения содержания в воде нитратов используют ионоселективный… Реагент:Лабораторная работа №9. Кондуктометрическое определение удельной электропроводности природной воды
Удельная электропроводность воды является одним из показателей общей концентрации солей и позволяет судить о величине солености воды, а также… Для проведения анализа применяют кондуктометр с диапазоном измерений 0,01 –… Реагент:Таблица 7. Значения коэффициента поправки при разных температурах кондуктометрического анализа.
| Т, оС | k | Т, оС | k |
| 1.254 1.224 1.196 1.168 1.142 1.118 1.092 1.067 | 1.044 1.021 1.000 0.979 0.960 0.941 0.923 0.906 |
Лабораторная работа № 10. Определение содержания калия и
Натрия в природных водах методом пламенной фотометрии
Фотометрическое определение калия и натрия проводят способом добавок. Используя способ добавок, иногда можно устранить влияние состава пробы на… Реагенты: 1. Стандартный раствор хлорида калия, содержащий 50 мкг/мл калия.Таблица 8. Состав растворов для определения содержания калия и натрия в природной воде способом добавок.
| Стандартный раствор | Объем добавляемого стандартного раствора, мл | ||
| Раствор 1 (С0) | Раствор 2 (С1) | Раствор 3(С2) | |
| Хлорида натрия | – | 5.0 | 10.0 |
| Хлорида калия | – | 2.5 | 5.0 |
Строят графики зависимости показаний прибора (интенсивности излучения пламени) от концентраций добавок натрия и калия в растворах 1, 2 и 3. При этом условный ноль координат будет соответствовать раствору 1, так как в него не вводились добавки. Через три точки, одна из которых лежит на оси ординат, проводят прямую до пересечения с осью абсцисс (см. рисунок). Длина отрезка от условного нуля координат до точки пересечения прямой с осью абсцисс соответствует концентрации Сх катионов натрия или калия в растворе 1. Для определения концентраций катионов этих металлов в анализируемой воде Сх нужно умножить на два, так как при приготовлении раствора 1 анализируемую воду разбавили дистиллированной водой в два раза.

Лабораторная работа №11. Определение содержания кальция, магния, меди, цинка, свинца в природных водах методом атомно-абсорбционной спектроскопии
Определение содержания ионов металлов проводят на спектрофотометре ААS-1 в режиме адсорбции. Реагенты: 1. Стандартный раствор соли кальция (100 мкг/мл).ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ ПО
Химия атмосферы. Спектр излучения Солнца и спектр поглощения атмосферы.… Экзосфера и ионосфера. Их переменный химический состав. Реакции фотохимической диссоциации молекул кислорода и азота.…ТЕМЫ РЕФЕРАТОВ ПО КУРСУ
"ХИМИЯ ОКРУЖАЮЩЕЙ СРЕДЫ"
Химия атмосферы
2. Основные циклы реакций образования и разложения молекул озона в стратосфере. 3. Озоновый шит планеты и возможность его истощения. 4. Каталитическое разложение озона оксидами азота и атомным хлором фреонов.Химия гидросферы
2. Условия образования и выпадения, химический состав природных атмосферных осадков. 3. Генезис природных пресных вод. 4. Растворение углекислого газа в атмосферных осадках.– Конец работы –
Используемые теги: химии, окружающей, среды0.059
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ПО ХИМИИ ОКРУЖАЮЩЕЙ СРЕДЫ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?








Новости и инфо для студентов