Пептиды
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –CO–NH–.
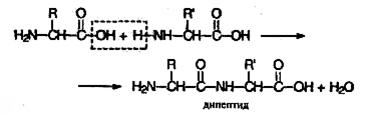
Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
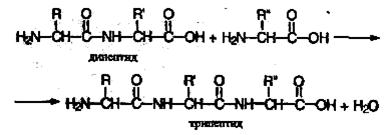
Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться, в принципе, неограниченно и приводить к веществам с очень высокой молекулярной массой (белкам).
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих п остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т.д. При п = 62 число возможных пептидов превосходит число атомов во Вселенной (1080).
Формулы пептидов обычно записывают так, что свободная аминогруппа находится слева (на N-конце цепи), а свободная карбоксильная группа – справа (на С-конце). Основная часть пептидной цепи построена из повторяющихся участков -CH-CO-NH- и боковых групп R, R' и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений. Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить в сокращенном виде следующим образом:
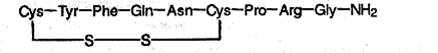
Обратите внимание на то, что в этом пептиде остатки цистеина связаны дисульфидным мостиком. С-конец цепи содержит амидную группу –CO–NH2 вместо карбоксильной.
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи, и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи. Интересно, что селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Биологическое значение. Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты. Известны гормоны, содержащие 9 аминокислотных остатков, – вазопрессин и окситоцин. Вазопрессин повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.