ХИМИЯ
ХИМИЯ - раздел Химия, Поволжский Государственный Университет Сервиса Кафедра "совреме...
ПОВОЛЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ СЕРВИСА
кафедра "Современное естествознание"
В. М. Васюков, О.В. Савенко, А. В. Иванова
ХИМИЯ
КОНСПЕКТ ЛЕКЦИЙ
для студентов всех специальностей и направлений подготовки
высшего профессионального образования
Тольятти 2012
Границ научному познанию и предсказанию предвидеть невозможно.
Д. И. Менделеев
Часть I. ТЕОРЕТИЧЕСКАЯ ХИМИЯ
Глава 2. Строение атома и периодический закон............................................................................ 6 Глава 3. Химическая… Глава 4. Комплексные…Часть II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Глава 11. Важнейшие классы неорганических соединений...................................................... 55 Глава 12. Элементы I группы (водород, литий, натрий, подгруппа калия,… Глава 13. Элементы II группы (бериллий, магний, подгруппа кальция, подгруппа цинка) 68Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Глава 20. Общая характеристика органических соединений..................................................... 124 Глава 21.… Глава 22.…Часть I. ТЕОРЕТИЧЕСКАЯ ХИМИЯ
Глава 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Математика, физика, химия и биология относятся к основным естественным точным наукам. Различие между ними состоит, главным образом, в уровне (масштабе) изучаемых явлений. Основной предмет современной химии – это явления, происходящие на атомно-молекулярном уровне.
Химия – наука о веществах, их строении, свойствах и превращениях.
На сегодняшний день известно около 20 млн. органических и около миллиона неорганических веществ, причем каждое из этих веществ может вступать в десятки реакций, и каждое из них имеет внутреннее строение. Эти два аспекта взаимосвязаны. Внутреннее строение определяет химические свойства; в свою очередь, по химическим свойствам мы часто можем судить о строении вещества.
Современная химия разнообразна как по объектам, так и по методам их исследования и многие ее разделы представляют собой самостоятельные науки: неорганическая и органическая химия, биохимия, физическая химия, математическая химия и др.
Таким образом, современная химия самым тесным образом взаимодействует со всеми другими областями естествознания.
Основу химии составляют атомно-молекулярная теория, теория строения атомов и молекул, закон сохранения массы и энергии и периодический закон.
Основные понятия химии
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Частица, состоящая из ядра и электронов и имеющая заряд, называется атомным ионом.
Химический элемент – это вид атомов, характеризующихся одним и тем же зарядом ядра. Например, элемент «кислород» включает атомы О, входящие в состав любых соединений (CuSO4, CO2, O3 и т.д.). В настоящее время достоверно известны 112 элементов. Атомы химических элементов взаимодействуют друг с другом и образуют молекулы.
Mолекула – это наименьшая электронейтральная замкнутая совокупность атомов, образующих определенную структуру с помощью химических связей.Система взаимодействующих атомов, имеющая заряд, называется молекулярным ионом. Индивидуальные молекулы существуют только в газовой фазе.
Вещество – это любая совокупность атомов и молекул, находящаяся в определенном агрегатном состоянии. Вещества бывают простые и сложные. В состав простых веществ входят атомы только одного элемента. Сложные вещества, или химические соединения, содержат атомы нескольких элементов.
Многие элементы образуют несколько простых веществ, различающихся составом или строением. Это явление называется аллотропией, а соответствующие простые вещества – аллотропными модификациями. В качестве примера можно привести элемент кислород, который имеет две аллотропные модификации – кислород О2 и озон О3, и элемент углерод, который образует 4 простых вещества – алмаз, графит, карбин и фуллерен.
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее.
Основоположник атомной теории Дальтон составил таблицу атомных масс, приняв массу атома водорода за единицу. В настоящее время в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12С.
А.е.м. =1/12 m(12С) = 1.66057∙10–27 кг
Относительная атомная масса элемента (Аr) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа: 35Сl (75,5%) и 37Сl (24,5%). Относительная атомная масса хлора равна:
[0,755 ∙ т(35Сl) + 0,245 ∙ m(37Сl)] : 1/12 m(12С) =35,5
Относительная молекулярная масса вещества (Mr) – это безразмерная величина, равная отношению массы молекулы вещества к 1/12 массы атома 12С. Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы, например:
Mr (N2O) = 2∙Ar(N) + Ar(O) = 2∙14 + 16 = 44
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12С.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12∙1,66057∙10–24 г = 6,0221∙1023
Таким образом, моль любого вещества содержит 6,0221∙1023 частиц этого вещества.
Физическая величина NA– постоянная Авогадро, она имеет размерность [NA] = моль–1. Число 6,0221∙1023 называют числом Авогадро.
Молярная масса (М) – это масса 1 моль вещества. Численные значения молярной массы М и относительной молекулярной массы Мr равны, однако первая величина имеет размерность [М] = г/моль, а вторая безразмерна.
Число молей (ν)вычисляется по формулам:
ν = m / M ν = V / Vm ν = N / NA
где ν – количество вещества, m – масса вещества, M – молярная масса, V – объем газообразного вещества, Vm – молярный объем газа (22,4 л/моль при н.у.), N – число частиц, NA – постоянная Авогадро.
Основные положения атомно-молекулярной теории
1. Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. 2. Молекулы состоят из атомов. Атом – наименьшая частица элемента в химических… 3. Молекулы и атомы находятся в непрерывном движении.Закон эквивалентов – для молекулярных соединений количество составляющих элементов пропорционально их химическим эквивалентам.
Э = 1 / z (моль) где z – степень окисления или число электронов, перешедших от восстановителя к… Так, в Н2О и NН3 с 1 моль атомов водорода соединяется соответственно ½ моль атомов кислорода и ⅓ моль…Газовые законы
Изучение свойств газообразных веществ и химических реакций с участием газов сыграло настолько важную роль в становлении атомно-молекулярной теории,… Экспериментальные исследования, по изучению химических реакций между… Эти пропорции нашли объяснение в законе Авогадро: в равных объемах разных газов при одинаковых условиях (температуре и…Моль любого газа при нормальных условиях (Р0 = 1 атм или 101,325 кПа или 760 мм.рт.ст. и температура Т0 = 273,15 К или 0°С) занимает объем 22,4 л.
Газообразное состояние вещества заданной массы характеризуется тремя параметрами: давлением Р, объемом V и температурой Т. Между этими величинами были экспериментально установлены следующие соотношения.
Закон Бойля-Мариотта: при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа.
Р2 / Р1 = V1 / V2, или РV = const.
Закон Гей-Люссака: при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре.
V1 / Т1 = V2 / Т2, или V/Т = const.
Закон Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
Эти три закона можно объединить в один универсальный газовый закон: Р1V1 / Т1 = Р2V2 / Т2, или РV /Т = const. Это уравнение было установлено Б. Клапейроном (1834 г.). Значение постоянной в уравнении зависит только от количества…Закон парциальных давлений: общее давление смеси газов, не вступающих в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.
Глава 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
Модели строения атома
Планетарная модель Резерфорда.Сутьпланетарной модели строения атома можно свести к следующим утверждениям: 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную… 2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.Квантовые числа электронов
Главное квантовое число п определяет общую энергию электрона на данной орбитали (п = 1, 2, 3, ...). Главное квантовое число для атомов известных… Побочное (орбитальное) квантовое число l(l = 0, 1, ..., п - 1) определяет… Форма и направленность в пространстве электронных облаков s- и р-орбиталей:Электронные конфигурации атомов
Так как при химических реакциях ядра реагирующих атомов остаются без изменения (за исключением радиоактивных превращений), то химические свойства… Выше показано, что состояние электронов можно описать набором четырех…Принцип Паули или запрет Паули (1925 г.): в атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Максимальное число электронов с одинаковым квантовым числом п выражается формулой: N = 2n2. Отсюда ясно, почему на первом энергетическом уровне… Состояние электрона в атоме водорода 1Н можно представить как 1s1 Строение электронной оболочки атома гелия 2Не можно представить как 1s2Правило Гунда: при данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Если, например, в трех р-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных р-орбиталях:

В этом случае суммарный спин равен 3/2, поскольку его проекция равна тl = +1/2 + 1/2 + 1/2 = 3/2. Эти же три электрона не могут быть расположены таким образом:
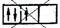
потому что тогда проекция суммарного спина тl = +1/2–1/2+1/2 = 1/2. По этой же причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода.
Первые 18 электронов заполняют следующие орбитали: 1s22s22p63s23p6. Казалось бы, что девятнадцатый электрон атома калия должен попасть на подуровень 3d, которому соответствуют п = 3 и l = 2. Однако на самом деле валентный электрон атома калия располагается на орбитали 4s. Дальнейшее заполнение оболочек после 18-го элемента происходит не в такой последовательности, как в двух первых периодах. Электроны в атомах располагаются в соответствии с принципом Паули и правилом Гунда, но так, чтобы их энергия была наименьшей.
Принцип наименьшей энергии: в атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом п и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел п и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае п+ l = 4+0 =4, а во втором п+ l = 3+2 = 5 и т.д.
В.М. Клечковский (1961 г.) сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением п, а с наименьшим значением суммы п + l.
S<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d<7p
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Ядро атома и радиоактивные превращения
Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются… В состав ядра входят протоны и нейтроны. В настоящее время известно, что… Эта форма записи распространяется и на элементарные частицы:Периодический закон
Д.И. Менделеев считал, что основной характеристикой элементов являются их атомные веса, и впервые сформулировалпериодический закон: свойства… На основе современных представлений о строении ядра и о распределении… Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением числа…Глава 3. ХИМИЧЕСКАЯ СВЯЗЬ
Валентность и степень окисления
Валентность выражается целым положительным числом, лежащим в интервале от I до VIII. Валентности, равно 0 или больше VIII нет. Постоянную… Валентность равна числу химических связей, которыми атом химического элемента… Степень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный…Химическая связь – взаимодействие атомов, обусловленное перекрытием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Согласно теории химической связи, при образовании молекулы атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки.
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводить к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи – ионная, ковалентная, металлическая, водородная и ван-дер-ваальсова связи.
Важной характеристикой химической связи является длина связи, под которой понимают расстояние между центрами ядер атомов в молекуле или кристалле, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Длина связи в рядах однотипных соединений увеличиваются с возрастанием атомарного номера элемента.
Химическая связь характеризуется определенной пространственной направленностью. Если двухатомные молекулы всегда линейны, то формы многоатомных молекул различны.
Между взаимодействующими атомами, которые различаются по электроотрицательности, возникают полярные связи. В результате смещения электронной плотности в сторону более электроотрицательного атома происходит образование положительных и отрицательных зарядов, и возникает диполь, представляющий собой систему из двух равных и противоположных по знаку зарядов s+ и s–, находящихся на определенном расстоянии друг от друга.
Lis+®Fs– l = 0,21 нм
Диполь выражается через электрический момент диполя m, представляющий собой произведение заряда s на длину диполя l:
M = l ∙s
При наличии нескольких связей в молекуле, их электрические моменты складываются по правилу параллелограмма.
В 1916 г. Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам – эта идея послужила основой для разработки современной теории ковалентной связи. В том же году В. Коссель предположил, что химическая связь возникает при взаимодействии двух атомов, один из них отдает электроны, превращаясь в положительно заряженный ион (катион), а второй атом принимает электрон, превращаясь в отрицательно заряженный ион (анион). Дальнейшее развитие идей Косселя привело к созданию представлений об ионной связи.
Ковалентная связь
Ковалентная связь – связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам.
Н·+ ·Н® Н : Н или Н – НСвязью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Связью можно назвать ковалентную связь, образованную при перекрывании атомных орбиталей вне линии, соединяющей атомы.
Еще один вид гибридизации s- и р-орбиталей осуществляется в соединениях бора, алюминия или углерода (этилен, бензол). Возбужденный атом бора имеет… Посредством образования sp2-гибридных орбиталей объясняются структуры непредельных углеводородов с двойными связями.…Ионная связь
Ионная связь – электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов. Na+ Cl–, NH4+ OH– Ионная связь – предельный случай полярной ковалентной связи (разность ЭО атомов >1,7 по шкале Полинга). Даже такая…Металлическая связь
Металлы объединяют свойства, имеющие общий характер и отличающиеся от свойств других веществ. Такими свойствами являются сравнительно высокие… Металлическая связь – связь между положительными ионами в кристаллах металлов,… Именно этим и объясняется, например, пластичность металлов, т.е. возможность смещения ионов и атомов в любом…Межмолекулярные взаимодействия
Электрически нейтральные атомы и молекулы способны к дополнительному взаимодействию друг с другом. Водородная связь – связь между положительно заряженным атомом водорода одной…Глава 4. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Соединения типа ВF3, СН4, NН3, Н2О, СО2 и др., в которых элемент проявляет свою обычную максимальную валентность, называются валентно-насыщенными соединениями или соединениями первого порядка. При взаимодействии соединений первого порядка друг с другом образуются соединения высшего порядка. К соединениям высшего порядка относятся гидраты, аммиакаты, продукты присоединения кислот, органических молекул, двойные соли и многие др. Примеры образования комплексных соединений:
PtCl4 + 2KCl = PtCl4∙2KCl или K2[PtCl6]
CoCl3 + 6NH3 = CoCl3∙6NH3 или [Co(NH3)6]Cl3.
А. Вернер ввел в химию представления о соединениях высшего порядка и дал первое определение понятию комплексного соединения. Элементы после насыщения обычных валентностей способны проявлять еще и дополнительную валентность – координационную. Именно за счет координационной валентности и происходит образование соединений высшего порядка.
Комплексные соединения –сложные вещества, в которых можно выделить центральный атом (комплексообразователь) и связанные с ним молекулы и ионы – лиганды.
Центральный атом и лиганды образуют комплекс (внутреннюю сферу), который при записи формулы комплексного соединения заключают в квадратные скобки. Число лигандов во внутренней сфере называется координационным числом. Молекулы и ионы, окружающие комплекс, образуют внешнюю сферу. Пример комплексной соли гексацианоферрат (III) калия К3[Fe(CN)6] (так называемая красная кровяная соль).
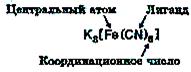
Центральными атомами могут быть ионы переходных металлов или атомы некоторых неметаллов (Р, Si). Лигандами могут служить анионы галогенов (F–, Cl–, Br–, I–), ОН–, СN–, СNS–, NO2– и др., нейтральные молекулы Н2О, NH3, СО, NO, F2, Cl2, Br2, I2, гидразин N2H4, этилендиамин NH2–CH2–CH2–NH2 и др.
Координационная валентность (КВ) или координационное число – число мест во внутренней сфере комплекса, которые могут быть заняты лигандами. Координационное число обычно больше степени окисления комплексообразователя, зависит от природы комплексообразователя и лигандов. Чаще встречаются комплексные соединения с координационной валентностью 4, 6 и 2.
Координационная емкость лиганда – число мест во внутренней сфере комплекса, занимаемых каждым лигандом. Для большинства лигандов координационная емкость равна единице, реже 2 (гидразин, этилендиамин) и более (ЭДТА - этилендиамминтетраацетат).
Заряд комплекса должен быть численно равен суммарному заряду внешней сферы и противоположным ему по знаку, но существуют и нейтральные комплексы. Степень окисления комплексообразователя равна и противоположна по знаку алгебраической сумме зарядов всех остальных ионов.
Систематические названия комплексных соединений формируются следующим образом: вначале называется в именительном падеже анион, затем раздельно в родительном падеже – катион. Лиганды в комплексе перечисляются слитно в следующем порядке: а) анионные; б) нейтральные; в) катионные. Анионы перечисляются в порядке H–, О2–, ОН–, простые анионы, полиатомные анионы, органически анионы – в алфавитном порядке. Нейтральные лиганды называются так же, как молекулы, за исключением Н2О (аква) и NH3 (аммин); к отрицательно заряженным ионам прибавляют соединительную гласную «о». Число лигандов указывают приставками: ди-, три, тетра-, пента-, гекса- и т.д. Окончанием для анионных комплексов является «-ат» или «‑овая», если называется кислота; для катионных и нейтральных комплексов типичных окончаний нет.
H[AuCl4] – тетрахлороаурат (III) водорода
[Cu(NH3)4](ОН)2 – гидроксид тетраамминмеди (II)
[Pt(NH3)6]Cl4 – хлорид гексаамминплатина (IV)
[Ni(CO)4] – тетракарбонилникель
[Co(NH3)6][Fe(CN)6] – гексацианоферрат (III) гексаамминкобальта (III)
Классификация комплексных соединений основана на различных принципах:
По принадлежности к определенному классу соединений:
- комплексные кислоты – H2[SiF6], H2[Mn(IO3)6];
- комплексные основания – [Cu(NH3)4](ОН)2;
- комплексные соли – Li3[AlH6], [Co(NH3)2(NO2)]Cl2.
По природе лигандов:
- аквакомплексы (лигандами выступает вода) – [Cu(H2O)4]SO4∙H2O, [Со(Н2О)6]Сl2;
- аммиакаты (комплексы, лигандами в которых служат молекулы аммиака) – [Сu(NH3)4]SO4, [Ag(NH3)2]Cl;
- ацидокомплексы (оксалатные, карбонатные, цианидные, галогенидные комплексы, содержащие в качестве лигандов анионы различных кислот) – K2[PtCl4], K4[Fe(CN)6];
- гидроксокомплексы (соединения с ОН-группами в виде лигандов) – К3[Аl(ОН)6];
- хелатные или циклические комплексы (би- или полидентатный лиганд и центральный атом образуют цикл) – комплексы с аминоуксусной кислотой, ЭДТА; к хелатам относят хлорофилл (комплексообразователь – магний) и гемоглобин (комплексообразователь – железо).
По знаку заряда комплекса: катионные, анионные, нейтральные комплексы.
Особую группу составляют сверхкомплексные соединения. В них число лигандов превышает координационную валентность комплексообразователя. Так, в соединении CuSO4∙5Н2О у меди координационная валентность равна четырем и во внутренней сфере координированы четыре молекулы воды, пятая молекула присоединяется к комплексу при помощи водородных связей: [Cu(Н2О)4]SO4∙Н2О.
Лиганды связаны с центральным атомом донорно-акцепторной связью. В водном растворе комплексные соединения могут диссоциировать с образованием комплексных ионов:
[Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl–
В незначительной степени, происходит диссоциация и внутренней сферы комплекса:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
Мерой прочности комплекса есть константа нестойкости комплекса:
Кнест[Ag(NH3)2]+ = CAg+∙C2NH3 / CAg(NH3)2]+
Вместо константы неустойчивости иногда пользуются обратной величиной, называемой константой устойчивости:
Куст = 1 / Кнест
В умеренно разбавленных растворах многих комплексных солей существуют как комплексные, так и простые ионы. Дальнейшее разбавление может приводить к полному распаду комплексных ионов.
По простой электростатической модели В.Косселя и А.Магнуса, взаимодействие между комплексообразователем и ионными (или полярными) лигандами подчиняется закону Кулона. Устойчивый комплекс получается когда силы притяжения к ядру комплекса уравновешивают силы отталкивания между лигандами. Прочность комплекса увеличивается с ростом заряда ядра и уменьшением радиуса комплексообразователя и лигандов. Электростатическая модель очень наглядна, однако не в состоянии объяснить существование комплексов с неполярными лигандами и комплексообразователем в нулевой степени окисления; чем обусловлены магнитные и оптические свойства соединений.
Наглядным способом описания комплексных соединений является метод валентных связей (МВС), предложенный Полингом. В основе метода лежит ряд положений:
- Связь между комплексообразователем и лигандами донорно-акцепторная. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали. Мерой прочности связи служит степень перекрывания орбиталей.
- Орбитали центрального атома, участвующие в образовании связей, подвергаются гибридизации. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса.
- Дополнительное упрочнение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи.
- Магнитные свойства, проявляемые комплексом, объясняются исходя из заселенности орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
МВС пригоден для описания только ограниченного круга веществ и не объясняет оптические свойства комплексных соединений, т.к. не учитывает возбужденные состояния.
Дальнейшим развитием электростатической теории на квантово-механической основе является теория кристаллического поля (ТКП). Согласно ТКП, связь между ядром комплекса и лигандами ионная или ион-дипольная. Основное внимание ТКП уделяет рассмотрению тех изменений, которые происходят в комплексообразователе под влиянием поля лигандов (расщепление энергетических уровней). Представление об энергетическом расщеплении комплексообразователя может быть использовано для объяснения магнитных свойств и окраски комплексных соединений.
ТКП приложима лишь к комплексным соединениям, в которых комплексообразователь (d-элемент) имеет свободные электроны, и не учитывает частично ковалентный характер связи комплексообразователь-лиганд.
Метод молекулярных орбиталей (ММО) учитывает детальную электронную структуру не только комплексообразователя, но и лигандов. Комплекс рассматривается как единая квантово-механическая система. Валентные электроны системы располагаются на многоцентровых молекулярных орбиталях, охватывающих ядра комплексообразователя и всех лигандов. Согласно ММО, рост энергии расщепления обусловлен дополнительным упрочнением ковалентной связи за счет π-связывания.
Глава 5. СОСТОЯНИЕ ВЕЩЕСТВА
В зависимости от характера взаимодействия частиц, образующих вещество, различают четыре агрегатных состояния: твердое, жидкое, газообразное и плазменное. Жидкости имеют промежуточную природу между твердыми веществами и газами.

В жидком состоянии могут находиться соединения с металлическими, ионными и ковалентными связями; в качестве соответствующих примеров назовем ртуть, расплав хлорида натрия и бензол. Сжимаемость жидкостей очень мала и поэтому требуются очень высокие давления для того, чтобы заметно сжать жидкость.
В твердом состоянии при обычных условиях находятся почти все вещества с металлическими или ионными связями; вещества с ковалентными связями могут быть в любом агрегатном состоянии. Большинство твердых тел, в свою очередь, подразделяют на кристаллические (их подавляющее большинство) и аморфные. Кристаллическое состояние характеризуется строго упорядоченной структурой; аморфные вещества не образуют правильной геометрической структуры, представляя собой структуры неупорядоченно расположенных молекул. В отличие от кристаллических веществ, имеющих вполне определенную температуру плавления, аморфные вещества плавятся в широком интервале температур. При нагревании они постепенно размягчаются, затем начинают растекаться и, наконец, становятся жидкими (стекла, смолы, большинство полимеров).
Большинство газов – вещества с ковалентными связями. Наиболее характерным свойством газов является их сжимаемость и способность расширяться; газы не имеют собственного объема.
Плазма – динамическая система беспрерывно перемещающихся атомов, электронов, положительных ионов, атомных ядер с протеканием процессов ионизации и рекомбинации атомов и ионов. Плазма возникает при нагревании вещества до очень высоких температур.
Единицы измерения температуры Т, давления р и объема V.
В СИ единицей давления является паскаль (Па), который определяется как давление, создаваемое силой в один ньютон, действующей перпендикулярно… Взаимосвязь всех трех единиц измерения давления следующая: 760 мм. рт. ст. = 1 атм = 101325 Па ≈ 101,3 кПа.Глава 6. ФИЗИКО-ХИМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Химическая термодинамика
Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде…Энергия (Е) – мера взаимодействия и движения материальных систем.
Система – тело или группа тел, отделенных от окружающей среды реальной или воображаемой поверхностью раздела.
| Тип системы | Обмен энергией | Обмен веществом |
| изолированная | нет | нет |
| закрытая | есть | нет |
| открытая | есть | есть |
Система, состоящая из нескольких фаз, называется гетерогенной, однофазная система – гомогенной.
Реакции, протекающие в гомогенной системе, развиваются во всем ее объеме и называются гомогенными. Реакции, происходящие на границе раздела фаз, называются гетерогенными.
Состояние химической системы определяется свойствами, подразделяющимися на интенсивные (температура, давление, концентрация и др.) и экстенсивные (объем, энергия).
Термодинамическое состояние системы можно представить в виде так называемого уравнения состояния:
f (p, V, T) = 0,
связывающего все параметры системы. Конкретный вид уравнения состояния известен лишь для ограниченного числа наиболее простых объектов. Так, уравнение Менделеева-Клапейрона является уравнением состояния идеального газа: pV=(m/M)RT.
Для большинства систем уравнение состояния неизвестно, то для термодинамического описания системы пользуются так называемыми функциями состояния системы – это любая физическую величину, значения которой однозначно определяются термодинамическими свойствами системы.
К важнейшим функциям состояния системы относятся полная энергия системы (Е) внутренняя энергия системы (U), энтальпия (или теплосодержание, Н), энтропия (или мера неупорядоченности системы, S), энергия Гиббса (или мера устойчивости системы при постоянном давлении, G), энергия Гельмгольца (или мера устойчивости системы при постоянном объеме, F).
Полная энергия системы (Е) представляет собой сумму трех составляющих: кинетической энергии Екин движущейся системы, потенциальной энергии Епот, обусловленной воздействием на систему внешних силовых полей, и внутренней энергии системы (U):
Е = Екин + Епот + U
При термодинамическом описании предполагают, что система находится в состоянии относительного покоя (Екин = 0) и воздействие внешних полей пренебрежимо мало (Епот = 0). Тогда полная энергия системы определяется только запасом внутренней энергии: Е = U. Общий запас внутренней энергии остается постоянным, если отсутствует тепловой обмен с окружающей средой.
Внутренняя энергия U – это общий запас энергии системы, слагающийся из кинетической энергии движения составляющих ее частиц (молекул, атомов, ионов, электронов и др.) и потенциальной энергии их взаимодействия.
Переход системы из одного состояния в другое называется процессом. Различают следующие виды процессов: изотермические (Т = const), изобарные (Р = const) и изохорные (V = const). Химические реакции обычно протекают при постоянном давлении или при постоянном объеме, т.е. являются соответственно изобарными или изохорными процессами.
Известны две формы передачи энергии от одной системы к другой. Упорядоченную форму передачи энергии называют работой, неупорядоченную форму – теплотой.
Теплота, поглощенная системой, расходуется на изменение внутренней энергии системы ΔU и на совершение работы против внешних сил А:
Q = ΔU + A
Данное уравнение выражает закон сохранения энергии – первый закон термодинамики – энергия не исчезает и не возникает вновь из ничего при протекании процесса, она лишь может переходить из одной формы в другую в строго эквивалентных отношениях.
Для химических реакций под работой против внешних сил обычно подразумевается работа против внешнего давления. Для изобарных процессов она равна произведению давления р на изменение объема системы ΔV при переходе ее из состояния 1 в состояние 2:
А = pΔV
Исходя из вышеприведенных выражений тепловой эффект Qp для изобарного процесса имеет вид:
Qp = ΔU + pΔV
Общепринято обозначение ΔU + pΔV = Н, где величину Н называют энтальпией (теплосодержание) – мера энергии, накапливаемая веществом при его образовании.
При изохорном процессе изменение объема не происходит и работа расширения А = 0. Тогда из первого закона термодинамики следует:
Qv = ΔU
Энергетический эффект химической реакции возникает за счет изменения в системе или внутренней энергии V или энтальпии Н.
Подавляющее большинство химических реакций происходит при постоянном давлении. Поэтому энергетический эффект реакции оценивают именно изменением энтальпии или тепловым эффектом реакции.
Уравнение реакции, для которой указываютсясоответствующиеэтой реакции изменение энтальпии ΔН или тепловой эффект Qp, называется термохимическим.
Химические реакции, при протекании которых происходит уменьшение энтальпии системы (ΔН < 0) и во внешнюю среду выделяется теплота (Qp > 0), называются экзотермическими.
Реакции, в результате которых энтальпия возрастает (ΔН > 0) и система поглощает теплоту извне (Qp < 0) называются эндотермическими.
С6Н12О6 + 6О2 = 6СО2 + 6Н2О, ΔН = –2800 кДж При сравнении энергетических эффектов различных процессов, термохимические… В термохимических уравнениях указывают также фазовое состояние и аллотропную модификацию реагентов и образующихся…G = ∆H – T∙∆S
Свободная энергия Гиббса является мерой устойчивости системы при постоянном давлении. При условии постоянства объема состояние системы может быть описано аналогичной характеристической функцией, которая называется свободной энергией Гельмгольца (F):
F = ∆U – T∙∆S
Соотношение между ∆G и ∆F такое же, как между ∆H и ∆U, т.е. они различаются на величину работы расширения:
G – ∆F = p∙∆V
Судить о возможности самопроизвольного протекания процесса можно по знаку изменения функции свободной энергии Гиббса: если ∆G < 0, т.е. в процессе взаимодействия происходит уменьшение свободной энергии, то процесс термодинамически возможен. Если ∆G > 0, то протекание процесса невозможно.
Таким образом, все процессы могут самопроизвольно протекать в сторону уменьшения свободной энергии. Это справедливо как для изолированных, так и для открытых систем. Самопроизвольное осуществление реакции (∆G < 0) возможно при следующих условиях:
1) ∆H < 0 (экзотермический процесс) и в то же время |∆H| > |T∆S|, т.е. при экзотермических процессах знаки ∆H и ∆G в выражении ∆G = ∆H – T∆S совпадают, что означает возможность протекания реакции независимо от знака ∆S;
2) ∆H > 0 (эндотермический процесс) и |∆H| < |T∆S|, тогда возрастания энтальпии компенсируется значительно большим ростом энтропии, что осуществимо при высоких температурах или при реакциях с участием газовой фазы, когда наблюдаются значительные изменения энтропии (этим и объясняется возможность протекания эндотермических реакций, что не согласуется с принципом Бертло).
Самопроизвольное протекание процесса невозможно, если ∆H > 0 и |∆H| > |T∙∆S|, тогда ∆G = ∆H – T∙∆S > 0. Положительное значение ∆G определяет принципиальную невозможность самопроизвольного осуществления процесса. В то же время отрицательный знак ∆G свидетельствует лишь о возможности протекания данного процесса, зависящее от конкретных условий и кинетических факторов.
Химическая кинетика и катализ
Химическая кинетика – раздел химии, задача которого – объяснение качественных и количественных изменений химических процессов, происходящих во времени.
Основным понятием в химической кинетике является понятие о скорости реакции.
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшими из них являются: концентрация,… Количественно зависимость между скоростью реакции и молярными концентрациями… Для реакции, записанной в общем виде аА + bB → сС + dD, в соответствии с законом действующих масс зависимость…Обратимые и необратимые реакции. Состояние химического равновесия
Химическая реакция не всегда «доходит до конца», т.е. исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому,… Химические реакции, которые при одних и тех же условиях могут идти в… При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки.Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
Так для обратимой химической реакции: aА + bВ cС + dD, зависимость скоростей прямой (v→) и обратной (v←) реакций от концентраций… v→ = k1[A]a·[B]b v← = k2[C]c·[D]d В состоянии химического равновесия v→ = v← т.е. k1[A]a·[B]b = k2[C]c·[D]d, отсюда:Глава 7. ФИЗИКО-ХИМИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ
Механизм образования растворов и их классификация
Растворами называются гомогенные системы, содержащие не менее двух веществ. Как правило, вещество взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке – растворенным веществом.
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, а также стекла.
Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четыреххлористый углерод и др.
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие – в ограниченных (хлорид натрия и вода).
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества – ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества и раствор становится насыщенным. Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы – растворы с небольшим содержанием растворенного вещества; концентрированные растворы – растворы с большим содержанием растворенного вещества.
В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
Идеальные и реальные растворы. Растворение как физико-химический процесс
Известны две основные теории растворов: физическая и химическая. Физическая теория растворов предложена Вант-Гоффом и Аррениусом. Согласно… Например, по закону Дальтона общее давление газовой смеси равно сумме парциальных давлений ее компонентов:Зависимость растворимости различных веществ от природы растворителя, температуры и давления
Растворимость веществ в различных растворителях, например в воде, колеблется в широких пределах. Если в 100 г воды при комнатной температуре… На растворимость веществ в общем случае оказывает влияние природа… Влияние природы растворителя и растворяемого вещества.Опытным путем установлено правило, согласно которому подобное…Законы разбавленных растворов
При растворении в растворителе нелетучего вещества давление пара растворителя над раствором уменьшается, что вызывает повышение температуры кипения… Согласно закону Рауля: относительное понижение давления насыщенного пара… (p0 – p) / p0 = χAПрисутствие растворенного вещества, наряду с понижением давления насыщенного пара над раствором, повышает температуру кипения и понижает температуру замерзания.
В соответствии с законом Рауля, и повышение температуры кипения, и понижения температуры замерзания растворов по сравнению с чистым растворителем (Δt), пропорциональны моляльной концентрации растворенного вещества:
Δt = К∙Сm,
где К – коэффициент пропорциональности; Ст – моляльность раствора.
В общем виде зависимость понижения температуры замерзания ΔТам и повышения температуры кипения ΔТкип разбавленных растворов от концентрации растворенного вещества можно записать так:
ΔТзам = КзамС и ΔТкип = КкипС,
где Кзам и Ккип – коэффициенты пропорциональности, зависящие от природы растворителя; С – молярная концентрация растворенного вещества. Коэффициент пропорциональности (К) в случае повышения температуры кипения называется эбулиоскопическим (КЭ), а при понижении температуры замерзания – криоскопическим (КК).
Методы криоскопии и эбулиоскопии позволяют определить молярную массу недиссоциирующих при растворении веществ по понижению температуры замерзания и повышению температуры кипения растворов известной концентрации:
Δt = К∙Сm; M = K∙1000∙m/Δt∙m1
где т – масса вещества (г), М – молярная масса.
К общим свойствам растворов относится осмос – явление селективной диффузии частиц в растворе через полупроницаемую мембрану. Сила, обуславливающая осмос, отнесенная к поверхности полупроницаемой мембраны называется осмотическим давлением.
Вант-Гофф сформулировал закон осмотического давления: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, который занимает раствор при той же температуре.
Вант-Гофф показал, что осмотическое давление в растворе неэлектролита пропорционально молярной концентрации растворенного вещества:
Р = CRT
Способы выражения концентрации (состава) растворов
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», т.е. содержание растворенного вещества в единице массы или… 1. Массовая доля (ω) – это отношение массы растворенного вещества к…S = (mв-ва / mр-ля) · 100
Растворимость числено равна концентрации (моль/л) того иона, содержание которого в данном веществе равно концентрации насыщенного раствора. Так, если концентрация OH– в Mg(OH)2 равна 4,12∙10–4, следовательно, концентрация Mg2+ равна 2,6∙10–4.
Солевой эффект – повышение растворимости малорастворимых солей при добавлении к ним сильных электролитов.
Пересчет одного количественного выражения состава раствора в другое можно производить, пользуясь формулами связи этих физических величин. Так,
СМ = 10 ∙ ρ ∙ ω / М
СН = 10 ∙ ρ ∙ ω / mЭ
Т = СН ∙ Э / 1000
Сравнение формул для определения молярной и нормальной концентраций
СМ = ν /V = m / (M ∙ V)
СН = m / (М ∙ Э ∙ V)
показывает, что если эквивалент растворенного вещества Э = 1 моль, СМ = СН. Эквивалент, равный единице, имеют растворы одноосновных кислот (HCl, HNO3 и т.д.), однокислотных оснований (NaOH, KOH и т.д.), солей катион и анион которых однозарядные (KCl, NaNO3 и т.д.). Если же эквивалент растворенного вещества не равен 1 моль, то формула соотношения молярной и нормальной концентраций имеет вид: СМ = СН· Э.
Электролиты и электролитическая диссоциация
Оказалось, что растворы электролитов обладают более низкими значениями температуры плавления и более высокими температурами кипения по сравнению с… Под электролитической диссоциацией понимается распад молекул электролита в… СН3СООН СН3СОО– + Н+Гидролиз солей
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей.
Правило направления протекания ионных реакций: реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Гидролизу подвергаются соли образованные:
- слабым основанием и сильной кислотой (например, MgCl2, CuSO4), и гидролиз идет по катиону, т.к. молекулы слабого электролита образуются за счет катионов;
- слабой кислотой и сильным основанием (например, Na2CO3, K2S, CH3COONa), и гидролиз идет по аниону, т.к. молекулы слабого электролита образуются за счет анионов;
- слабым основанием и слабой кислотой (например, NH4CN, CH3COONH4), и гидролиз идет по аниону и катиону, т.к. молекулы слабого электролита образуются за счет анионов и катионов.
Соли, образованные сильным основанием и сильной кислотой (например, NaCl, Na2SO4, KNO3) гидролизу не подвергаются, т.к. в этом случае не образуются молекулы слабого электролита.
Уравнения реакций гидролиза пишутся аналогично другим ионным уравнениям: малодиссициированные (в том числе вода) и малорастворимые, а также газообразные продукты гидролиз и исходные вещества пишутся в виде молекул, сильные электролиты записываются в ионной форме. Краткое ионное уравнение показывает какие ионы (Н+ или ОН–) накапливаются в растворе данной соли при растворении, что позволяет определить реакционную среду рассматриваемой соли. Так, если в кратком ионном уравнении имеются ионы Н+, то реакция среды раствора этой соли кислая, а гидролиз будет идти по катиону. Если в кратком ионном уравнении имеются ОН–, то реакция среды раствора этой соли щелочная, а гидролиз будет идти по аниону. Если же краткое ионное уравнение показывает, что в растворе присутствуют и ионы Н+ и ОН–, то реакция среды нейтральная, а гидролиз будет идти и по и аниону и по катиону.
Пример. Составить уравнение гидролиза ацетата натрия СН3СООNа (соль сильного основания и слабой кислоты) и определить реакцию среды в растворе этой соли.
– запишем уравнение реакции гидролиза в молекулярной форме:
СН3СООNа + Н2О 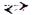 СН3СООН + NаОН
СН3СООН + NаОН
(образовался слабый электролит – уксусная кислота)
– составим полное ионное уравнение данной реакции:
СН3СОО– + Nа+ + Н2О 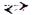 СН3СООН + Nа+ + ОН–
СН3СООН + Nа+ + ОН–
– составим краткое ионное уравнение данной реакции:
СН3СОО– + Н2О 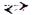 СН3СООН + ОН–
СН3СООН + ОН–
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы ОН– и реакция среды будет щелочной (рН > 7).
Пример. Составить уравнение гидролиза хлорида железа (II) – соли слабого основания и сильной кислоты, определить реакцию среды в растворе этой соли.
FеСl2 + Н2O 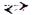 Fе(ОН)Сl + НСl
Fе(ОН)Сl + НСl
Fе2+ + 2Сl– + Н2O 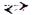 Fе(ОН)– + Сl– + Н+ + Сl–
Fе(ОН)– + Сl– + Н+ + Сl–
Fе2+ + Н2O 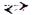 Fе(ОН)– + Н+
Fе(ОН)– + Н+
По второй ступени гидролиз протекает следующим образом:
Fе(ОН)Сl + Н2O  Fе(ОН)2↓ + НСl
Fе(ОН)2↓ + НСl
Fе(ОН)– + Сl– + Н2O  Fе(ОН)2↓ + Н+ + Сl–
Fе(ОН)2↓ + Н+ + Сl–
Fе(ОН)– + Н2O  Fе(ОН)2↓ + Н+
Fе(ОН)2↓ + Н+
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы Н+ и реакция среды будет кислой (рН < 7).
В общем случае:
- если соль образована сильным основанием и слабой кислотой, то рН > 7;
- если соль образована слабым основанием и сильной кислотой, то рН < 7;
- если соль образована слабым основанием и слабой кислотой, то рН ≈ 7;
- если соль образована сильным основанием и сильной кислотой, то рН = 7.
Гидролиз солей, образованных слабым многоосновным основанием или слабой многоосновной кислотой, протекает ступенчато, число ступеней гидролиза равно заряду катиона слабой кислоты или слабого основания (если гидролиз идет и по катиону и по аниону, то число ступеней равно наибольшему из зарядов):
- при гидролизе солей, образованных слабым многокислотным основанием и сильной кислотой, образуются основные соли (содержащие катион металла, анионы ОН– и кислотного остатка, например, FеОНСl2 – гидроксохлорид железа III);
- при гидролизе солей, образованных слабой многоосновной кислотой и сильным основанием, образуются кислые соли (содержащие анионы кислотного остатка, катионы металла и Н+, например, КНСО3 – гидрокарбонат калия).
Гидролиз по второй и, особенно, по третьей ступени выражен незначительно
Пример. Составить уравнения гидролиза и определить реакцию среды в растворе хлорида железа (III).
Реакция гидролиза FеСl3 проходит в три стадии, так как заряд иона железа равен 3+:
1) составим молекулярное, полное и краткое ионное уравнение первой ступени гидролиза:
молекулярное уравнение: FеСl3 + НОН ↔ FеОНСl2 + НСl
полное ионное уравнение: Fе3+ + 3Cl– + НОН ↔ (FеОН)2+ + 2Сl– + H+ + Сl–
краткое ионное уравнение: Fе3+ + НОН ↔ (FеОН)2+ + H+
2) составим молекулярное, полное и краткое ионное уравнение второй ступени гидролиза:
FеОНСl2 +НОН ↔ Fе(ОН)2Сl + НСl
FеОН2+ + 2Сl– + НОН ↔ (Fе(ОН)2)+ + Сl– + H+ + Сl–
FеОН2+ + НОН ↔ (Fе(ОН)2)+ + H+
3) составим молекулярное, полное и краткое ионное уравнение третьей ступени гидролиза:
Fе(ОН)2Сl + НОН ↔ Fе(ОН)3↓ + НСl
Fе(ОН)2+ + Сl– + НОН ↔ Fе(ОН)3↓ + H+ + Сl–
Fе(ОН)2+ + НОН ↔ Fе(ОН)3↓ + H+
4) общее уравнение реакции гидролиза в молекулярной полной и краткой ионной форме имеет вид:
FеСl3 + НОН ↔ Fе(ОН)3↓ + 3НСl
Fе3+ + 3Сl– + 3НОН ↔ Fе(ОН)3↓ + 3H+ + 3Сl–
Fе3+ + 3НОН ↔ Fе(ОН)3↓ + 3H+
Таким образом, гидролиз соли, образованной слабым трехкислотным основанием и сильной кислотой идет по катиону в три стадии, а накопление ионов H+ приводит к тому, что рН < 7.
Степень гидролиза (h) – соотношение числа молекул, подвергшихся гидролизу к общему числу молекул.
В разбавленных растворах гидролиз можно охарактеризовать константой гидролиза (КГ). Так, для соли образованной сильным основанием и слабой кислотой:
KCN + HOH → KOH + HCN
CN– + HOH → OH– + HCN
КГ = [OH–][HCN] / [CN–]∙[HOH]
Концентрация недиссоциированных молекул воды постоянна, тогда
КГ = [OH–]∙[HCN] / [CN–]
Так как [H+][ОН–] = Кводы, то [ОН–] = Кводы / [H+], и преобразуя константу гидролиза получим:
КГ = Кводы [ HCN] / [CN–]∙[H+], т.е. КГ = Кводы / Ккислоты
Аналогично, константа гидролиза соли слабого основания и сильной кислоты выражается соотношением ионного произведения воды и константы диссоциации соответствующего основания: КГ = Кводы / Коснования
Глава 8. ДИСПЕРСНЫЕ СИСТЕМЫ
Наука, изучающая свойства веществ в дисперсном состоянии и явления на поверхности раздела фаз – коллоидная химия.
Дисперсные системы – гетерогенные двух- или многофазовые системы, состоящие из частиц дисперсной фазы и окружающей их дисперсионной среды.
Классификации дисперсных систем
I. По размеру частиц дисперсной фазы дисперсные системы делят на коллоидно-дисперсные (коллоидные) системы (размеры частиц 10–7–10–9 м) и грубо-дисперсные системы (размеры частиц порядка 10–7 м и более). Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности – величина, обратная размеру дисперсных частиц.
II. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды (Т, Ж, Г – соответственно твердое, жидкое и газообразное состояние) выделяют следующие основные типы:
| Дисперсная фаза | Непрерывная фаза (дисперсионная среда) | Обозна-чение | Примеры |
| Системы с жидкой дисперсионной средой | |||
| Твердая | Жидкая | Т/Ж | высокодисперсные золи(краски), связанодисперсные системы или гели (желе, агар-агар) и суспензии или взвеси |
| Жидкая | Жидкая | Ж1/Ж2 | эмульсии (нефть, молоко, майонез, водоэмульсионные краски) |
| Газообразная | Жидкая | Г/Ж | пены (мыльная пена, взбитые сливки) |
| Системы с газообразной дисперсионной средой или аэрозоли | |||
| Твердая | Газообразная | Т/Г | дым, пыль |
| Жидкая | Газообразная | Ж/Г | туман, облака |
| Системы с твердой дисперсионной средой | |||
| Твердая | Твердая | Т1/Т2 | горные породы, сплавы, цветные стекла |
| Газообразная | Твердая | Г/Т | твердые пены (пенопласты, пенобетон, пемза, шлак, хлебобулочные изделия) |
| Жидкая | Твердая | Ж/Т | масло, жемчуг, клетки живых организмов |
III. По природе устойчивости и интенсивности межмолекулярных взаимодействий на границе раздела фаз выделяют лиофильные (термодинамически устойчивые) и лиофобные (кинетически устойчивые)системы. В лиофильных системах частицы прочно связывают значительное количество молекул дисперсионной среды и при выделении удерживают их образуя гели; в лиофобных – подобного взаимодействия не наблюдается. И обычно они выпадают в виде порошкообразных продуктов.
IV. В зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы дисперсные системы могут быть свободнодисперсными (аэрозоли, золи, разбавленные суспензии и эмульсии; они текучи) и связанодисперсными (гели; они тредрообразны).
Оптические и молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства – диффузия, броуновское движение, седиментация связанны с хаотическим тепловым движением частиц. Броуновское движение – беспорядочное движение частиц. А.Эйнштейн и независимо… Диффузия – самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации. Скорость…Поверхностные и адсорбционные явления
Работу обратимого изотермического образования единицы поверхности называют удельной свободной поверхностной энергией (σ). В случае границы двух… Различают два вида устойчивости коллоидно-дисперсных систем: седиментационную… Нарушение агрегативной устойчивости, при которой происходит объединение частиц в агрегаты, называют коагуляцией.…Коллоидные (коллоидно-дисперсные) системы
Коллоидные частицы обычно имеют сложную структуру, которая зависит от условий получения золей, стабилизатора и других факторов. Рассмотрим строение… Если к раствору хлорида натрия прибавлять постепенно раствор нитрата серебра,… При обратном порядке смешения растворов, т. е. при медленном прибавлении хлорида натрия к раствору нитрата серебра, в…Глава 9. ТЕОРИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции –реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ.
Вещество, в состав которого входит элемент, атомы которого отдают электроны, является восстановителем. Вещество, в состав которого входит элемент, атомы которого принимают…Химические источники электрической энергии. Электродные потенциалы
Электрод, от которого движутся электроны (восстановитель), называется анодом (–), а электрод, к которому переходят электроны (окислитель),… Степень электроотрицательности элементов пары оценивается по электродному… Рассмотрим металлический стержень, погруженный в воду (рис.). Поскольку совершенно нерастворимых веществ не…H, Cu, Ag, Pd, Hg, Pt, Au
В ряду слева направо возрастают значения электродных потенциалов (так, Cs=‑3.08, Н=0, Au=+1,68) и уменьшаются восстановительные свойства металлов.
На основании стандартных электродных потенциалов можно сделать два практически важных заключения:
1) металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
Металлы, выступающие в качестве отрицательного электрода по отношению к водородному (в ряду левее Н), вытесняют водород из кислот, а металлы с более положительным электродным потенциалом (в ряду правее Н) не обладают этим свойством.
Пример простейшего электрохимического элемента – гальванический элемент Даниэля-Якоби, состоит из медного и цинкового электродов в растворах их солей (рис.).
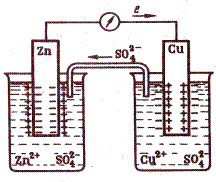
При работе элемента, т.е. при замкнутой внешней цепи, наблюдается направленное перемещение электронов от анода к катоду, а в растворе (по внутренней цепи) осуществляется движение анионов от катода к аноду.
Так, цинк окисляется – на поверхности его соприкосновения с растровом атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор; высвобожденные при этом электроны движутся по внешней цепи к медному электроду:
Анодный процесс: Zn0 = Zn2+ + 2ē, Е° (Zn0/Zn2+)= +0,76 В
На медном электроде протекает восстановление ионов меди – электроны, приходящие от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди и образуются атомы меды, выделяющиеся в виде металла:
катодный процесс: Cu2+ + 2ē = Cu0, Е° (Cu2+/Cu0) = +0,34 В
Во внутренней цепи ионы SO42–, оказавшиеся в избытке в катодном пространстве в результате восстановления ионов Cu2+, переходят в анодное пространство, где уравновешивают образовавшиеся при окислении анода ионы цинка Zn2+.
Суммируя полуреакции получим:
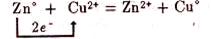
Э.д.с. (электродвижущая сила) элемента равна сумме +0,76 + 0,34 = 1,10 В.Положительный знак э.д.с. определяет направление самопроизвольного протекания реакции слева направо.
Максимальное напряжение электрохимического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э.д.с.) этого элемента.
Э.д.с. электрохимического элемента возникает за счет протекания окислительно-восстановительной реакции. Движущей силой химической реакции является убыль свободной энергии Гиббса (∆G). С другой стороны, ее убыль определяет максимальную работу химической реакции. Для реакции, осуществляемой в гальваническом элементе, работа (А), производимая системой, равна A = IUt = QU, где I – сила тока в цепи, U – падение напряжения, t – время, Q – количество электричества.
Для одного моль вещества, вступившего в реакцию, Q = Amax = nFE, где n – число электронов, принимаемых или отдаваемых веществом (заряд иона), F = 96485 Кл/моль – постоянная Фарадея, т.е. количество электричества, необходимое для выделения одного эквивалента вещества. Тогда максимальная работа химической реакции равна убыли энергии Гиббса: –∆G = Amax = n∙F∙E
При стандартных условиях: –∆G = n∙F∙E°,
где E° – э.д.с. гальванического элемента при стандартных условиях.
Взаимосвязь между э.д.с. гальванического элемента и изменением свободной энергии Гиббса дает возможность непосредственного определения величины ∆G.
Э.д.с. гальванических элементов в процессе работы уменьшается вследствие электродной поляризации. Поляризация – изменение потенциала электрода при прохождении электрического тока по сравнению с состоянием равновесия.
Электродный потенциал металла, как отмечалось выше, зависит не только от его природы, но и от концентрации ионов данного металла в растворе и температуры. Эта зависимость выражается уравнением Нернста:
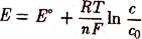
Из данного уравнения следует, что при с = с0 (= 1 моль/л) электродный потенциал Е = Е°. При росте концентрации по сравнению со стандартной (с > с0) электродный потенциал увеличивается (становиться более положительным). Так же действует и увеличение температуры. Соответственно при с < с0 электродный потенциал становиться меньше стандартного значения.
Коррозия металлов
По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают… Химическая коррозия – разрушение металлов, находящихся вне электролита,… По условиям протекания коррозионного процесса различают: а) газовую коррозию – в сухих газах и парах без конденсации…Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через раствор или… Катод (–) – отрицательный электрод, на котором при электролизе происходит… Анод (+) – положительный электрод, на котором при электролизе происходит окисление.Электролиз расплавов электролитов
KtAn ↔ Ktn+ + Anm– Катод– | Ktn+ + bē → B0 | b | c Анод+ | Anm– – cē → C0 | c | bЭлектролиз водных растворов электролитов
Катод– | Н2О + 2ē → Н20 + 2ОН– Анод+ | 2Н2О – 4ē → О20 + 4Н+ В виду одновременного присутствия в растворах около электродов ионов электролита и молекул воды, они будут…Cs______________Al Mn_______________________________Pb H Cu_________________Au
Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
Анодный процесс: 1. На нерастворимых анодах при конкуренции аниона бескислородных кислот (Cl–,… 2. На нерастворимых анодах при конкуренции аниона кислородсодержащих кислот (SO42–, NO3–, CO32– и др.) с молекулами…Глава 10. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ВЕЩЕСТВ
Аналитическая химия – наука о методах определения химического состава и структуры веществ.
Химический анализ лежит в основе современного химико-технологического контроля и установления государственных стандартов на выпускаемую продукцию.
Качественный анализ
Качественный анализ проводят химическими, физическими и физико-химическими методами. Физические и физико-химические методы анализа основаны на… Химические методы качественного анализа основаны на превращении анализируемого… Качественные аналитические реакции по способу их выполнения делятся на реакции «мокрым» и «сухим» путем. Наибольшее…Классификация катионов на аналитические группы
Применение групповых реактивов позволило разработать ряд аналитических классификаций катионов. Наибольшее применение получили сульфидная, кислотно-основная и аммиачно-фосфорная классификации.
Ниже приведена кислотно-основная система анализа катионов, основанная на отношении их к соляной и серной кислотам, к растворам едких щелочей и аммиака.
| Аналитические группы | Групповой реагент | Характеристика групп | |
| I | K+, Na+, NH4+ | Группового реагента нет | Хлориды, сульфиды и гидроксиды растворимы в воде |
| II | Ag+, Pb2+, Hg22+ | 2 н раствор HCl | Хлориды нерастворимы в воде и в разб. кислотах |
| III | Ba2+, Ca2+, Sr2+ (Pb2+) | 2 н раствор H2SO4 | Сульфаты нерастворимы в оде и кислотах |
| IV | Al3+, Cr3+, Zn2+, Sn2+, Sn+4, As+3, As+5, (Sb+3) | Избыток 4 н раствора NaOH или КОН | Гидроксиды амфотерны; растворимы в избытке щелочи |
| V | Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb+5, | Избыток 25%-ного раствора NН4ОН | Гидроксиды нерастворимы в избытке щелочи |
| VI | Cu2+, Hg2+, Cd2+, Co2+, Ni2+ | Избыток 25%-ного раствора NН4ОН | Гидроксиды образуют растворимые аммиакаты |
Классификация анионов на аналитические группы
Ниже принята классификация анионов, основанная на различной растворимости бариевых и серебряных солей.
| Аналитические группы | Групповой реагент | Характеристика групп | |
| I | SO42–, SO32–, CO32–, PO43–, SiO32– | BaCl2 в нейтральном или слабощелочном растворе | Соли бария практически нерастворимы в воде |
| II | Cl–, Br–, I–, S2–, | AgNO3 в присутствии НNO3 | Соли серебра практически нерастворимы в воде и разб. НNO3 |
| III | NO3–, NO2–, CH3COO– | Группового реагента нет | Соли бария и серебра растворимы в воде |
Количественный анализ
Задача количественного анализа– определение количественного содержания химических элементов (или их групп) в соединениях. Методы количественного анализа разделяются на химические, физические и…Часть II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Неорганическая химия – это химия элементов Периодической системы Д. И. Менделеева и образованных ими простых или сложных веществ.
Глава 11. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (около 400) и очень многочисленную группу сложных веществ.
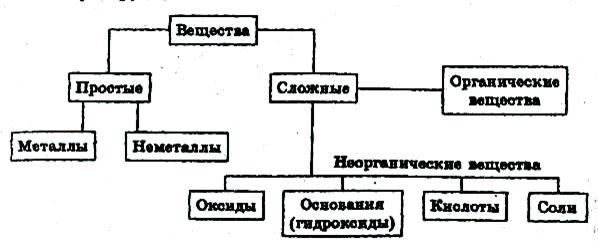
Приведенная первичная классификация несовершенна. Так, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Все вещества делятся на простые и сложные. Простое вещество представляет собой гомоатомное химическое соединение. Сложные вещества состоят из двух или более элементов и по составу разделяются на бинарные (двухатомные) и многоэлементные соединения.
Все простые вещества подразделяются на металлы и неметаллы. Эта классификация основана на существенно различном характере физических и химических свойств веществ. Причины различий между металлами и неметаллами кроется в разном типе межатомного взаимодействия при образовании простых веществ. Преобладание вклада металлической связи приводит к металлическим свойствам простого вещества, а неметаллические свойства обусловлены преимущественно ковалентными взаимодействиями. Для образования ковалентной связи, свободно взаимодействующие атомы должны обладать достаточным числом валентных электронов. При дефиците валентных электронов осуществляется коллективное электронно-атомное взаимодействие, приводящее к возникновению металлических свойств.
Металлы и неметаллы различаются по физическим свойствам, которые проявляются у соответствующих простых веществ. Так, для металлов характерны высокая тепло- и электрическая проводимость, специфический металлический блеск, ковкость, пластичность и т. п. Физические свойства неметаллов существенно отличаются: они хрупкие, обладают низкой тепло- и электрической проводимостью и т. п. Различия между металлами и неметаллами проявляются в их химических свойствах: для металлов характерны оснóвные свойства оксидов и гидроксидов, восстановительное действие; для неметаллов – кислотный характер оксидов и гидроксидов, окислительная активность. Но деление химических элементов на металлы и неметаллы относительно, т. к. существуют амфотерные элементы.
К важнейшим бинарным соединениям относятся соединения элементов с кислородом (оксиды), галогенами (галогениды или галиды), азотом (нитриды), углеродом (карбиды), а также соединения металлов с водородом (гидриды), кремнием (силициды), бором (бориды). Названия бинарных соединений образуются из латинского корня более электроотрицательного элемента с окончанием -ид и русского названия менее отрицательного элемента в родительном падеже.
Многоэлементные соединения традиционно подразделяют на три класса: основания, кислоты и соли. В эту же классификацию обычно включают и комплексные соединения.
Ниже рассмотрим важнейшие классы неорганических соединений – оксиды, гидроксиды и соли.
Оксиды
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород. Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SO2 – оксид серы (IV), SO3 – оксид серы (VI), CrO – оксид хрома (II), Cr2O3 – оксид хрома (III), CrO3 – оксид хрома (VI).
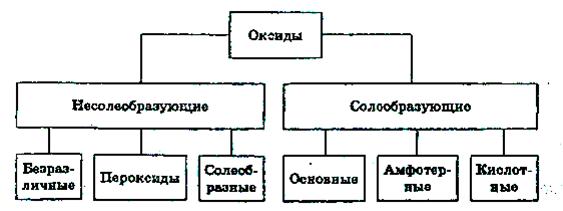
Наиболее важные несолеобразующие оксиды – СО, NO, H2O2, Na2O2.
Оснóвные оксиды – оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение оснóвных оксидов.
2Mg + O2 → 2MgO
Cu(OH)2 → CuO + H2O
BaCO3 → BaO + СO2
2Pb(NO3)2 → 2PbO + 4NO2 + O2
Химические свойства основных оксидов.
Большинство оснóвных оксидов представляет собой твердые кристаллические вещества ионного характера, они обладают высокими температурами плавления и кипения.
Оснóвные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами:
BaO + SiO2 → Ba2SiO3
MgO + Al2O3 → Mg(AlO2)2
ZnO + H2SO4 → ZnSO4 + H2O
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
K2O + H2O→ 2KOH
СаО + Н2О → Са(ОН)2
Кислотные оксиды – оксиды неметаллов или переходных металлов в высоких степенях окисления
Получение кислотных оксидов.
4Р+5O2 → 2Р2O5
2ZnO + 3O2 → 2ZnO + 2SO2
Na2SiO3 + 2HCl → 2NaCl + SiO2↓ + H2O
Химические свойства кислотных оксидов.
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
SO3 + H2O → H2SO4 CO2 + H2O → H2CO3
P2O5 + 3H2O → 2H3PO4
Наиболее типичными для кислотных оксидов являются их реакции с оснóвными и амфотерными оксидами, с щелочами:
P2O5 + Al2O3 → 2AlPO4
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Амфотерные оксидыобладают двойственной природой: они одновременно способны к реакциям, в которые вступают как оснóвные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
К числу амфотерных оксидов относятся оксид алюминия Al2O3, оксид хрома (III) Cr2O3, оксид бериллия ВеО, оксид цинка ZnO, оксид железа (III) Fe2O3 и ряд других. Идеально амфотерным оксидом является вода H2O.
Основания (гидроксиды металлов)
Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН–.
Гидроксиды металлов принято делить на две группы: растворимые в воде – щелочи [образованные щелочными LiOH, NaOH, KOH, RbOH, CsOHи щелочноземельными металлами Ca(OH)2, Sr(OH)2, Ba(OH)2] и нерастворимые в воде (все остальные гидроксиды металлов).
Получение оснований. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
Щелочи в технике обычно получают электролизом водных растворов хлоридов:
2NaCl + 2Н2O → 2NаОН + Н2 + Сl2
Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2Na + H2O → 2NaOH + H2↑ 2LiO + H2O → 2LiOH
Гидроксиды серебра, ртути настолько легко распадаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды:
2AgNО3 + 2КОН = Ag2O↓ + Н2О + 2KNO3
Химические свойства оснований. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:
2Fe(OH)3 → Fe2O3 + H2O Ca(OH)2 → CaO + H2O
Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
NаОН + НNО3 → NаNО3 + Н2O
Cu(ОН)2 + Н2SO4 → СuSO4 + 2H2O
Растворы щелочей способны реагировать с некоторыми неметаллами (галогенами, серой, белым фосфором, кремнием):
2NаОН + Сl2 → NaCl + NaClO + Н2O (на холоде)
6КОН + 3Сl2 → 5КСl + КClO3 + 3Н2О (при нагревании),
6КОН + 3S → К2SO3 + 2К2S + 3Н2О
Нерастворимые основания не реагируют с металлами.
Концентрированные растворы щелочей при нагревании взаимодействуют с некоторыми металлами (соединения которых обладают амфотерными свойствами):
2Аl + 2NаОН + 6Н2О = 2Nа[Аl(ОН)4] + 3Н2↑
Zn + 2КОН + 2Н2О = К2[Zn(ОН)4] + Н2↑
Амфолиты – это гидроксиды, которые проявляют как основные, так и кислотные свойства – Сr(ОН)3, Zn(OH)2, Be(OH)2, Аl(OН)3 и др. Амфотерные гидроксиды способны реагировать как с кислотами, так и со щелочами. С кислотами они реагируют как основания, а со щелочами – как кислоты.
Кислоты
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+(по теории… Любая реакция отщепления протона выражается уравнением: кислота →… Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В…Соли
Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода Н+ и гидроксид-ионы ОН–.
Соли принято делить на три группы: средние, кислые и основные:
- в средних солях все атомы водорода соответствующей кислоты замещены на атомы металла: хлорид натрия NaCl, сульфид железа (II) FeS, карбонат кальция СаСО3, сульфат железа (III) Fe2(SO)3, перманганат калия КМnO4, дихромат калия К2Cr2O7.
По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро-, а группа ОН – приставкой гидрокси-.
- в кислых солях атомы водорода соответствующей кислоты замещены только частично: NaHS – гидросульфид натрия, NaHSO3 – гидросульфит натрия.
- в основных солях группы ОН– соответствующего основания частично замещены на кислотные остатки: Мg(ОН)Сl – гидроксихлорид магния, Аl(ОН)2Сl – дигидроксихлорид алюминия.
Существуют также некоторые другие типы солей, например: двойные соли – СаСО3∙МgСО3 (доломит), КСl∙МаСl (сильвинит), КАl(SO4)2 (алюмокалиевые квасцы); смешанные соли – СаОСl2 или Са(ОСl)Сl; комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами – K3[Fe(СN)6] (красная кровяная соль или гексацианоферрат (III) калия), [Ag(NH3)2]Сl хлорид диамминсеребра (I); гидратные соли, в которых содержатся молекулы кристаллизационной воды – CuSO4∙5H2O (пентагидрат сульфата меди (II) или медный купорос), Na2SO4∙10Н2O глауберова соль.
Способы получения. Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов.
Химические свойства.Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются:
NH4Cl → NH3 + HCl NH4NO3 → N2O + 2H2O
CaCO3 → CaO + CO2 2KNO3 → 2KNO2 + O2
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O 2KClO3 → 2KCl + 3O2
Соли могут реагировать с кислотами, солями или основаниями, а также проявлять окислительные и восстановительные свойства.
AgNO3 + KBr → AgBr + KNO3
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Zn + CuSO4 → ZnSO4 + Cu
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Растворимость важнейших солей в воде:
- все соли HNO3 и СН3СООН растворимы;
- большинство солей HCl растворимы (кроме AgCl, CuCl, PbCl2, Hg2Cl2);
- большинство солей H2SO4 растворимы (кроме BaSO4, SrSO4, PbSO4; CaSO4 малораствор-м);
- средние соли слабых и средних кислот (H3PO4, H2SiO3, HNO2, H2S, H2CO3 и др.) не растворимы, кроме солей NH4+ и щелочных металлов (без Li);
- большинство кислых солей растворимы (кроме CaHPO4; Ca(H2PO4)2 малорастворим).
Глава 12. ЭЛЕМЕНТЫ I ГРУППЫ
IA-группа (щелочные металлы): литий Li 2s1, натрий Na 3s1 и элементы подгруппы калия – калий К 4s1, рубидий Rb 5s1, цезий Cs 6s1, франций Fr 7s1. По сравнению с элементами других подгрупп у них наиболее низкие первые энергии ионизации, а размеры атомов и ионов наибольшие. Они проявляют степень окисления +1. Для некоторых из них получены соединения, в которых элементы проявляют степень окисления –1, что определяется сродством атомов к электрону. Водород Н по электронной формуле 1s1 формально относится к s-элементам и является аналогом типичных элементов I группы.
IB-группа (подгруппа меди): медь Сu 3d104s1, серебро Ag 4d105s1, золото Au 5d106s1.
Водород
С другой стороны, как у водорода, так и у галогенов не хватает одного электрона до завершения внешнего электронного слоя. Подобно галогенам, водород… Водород – самый распространенный элемент Вселенной, составляет основную массу… Природный водород представляет собой смесь стабильных изотопов протия 1Н (99,985%) и дейтерия 2H (2D), радиоактивного…Литий
Литий достаточно широко распространен в земной коре. Он входит в состав многих минералов, содержится в каменном угле, почвах, морской воде, а также в живых организмах. Наиболее ценны минералы – сподумен LiAl(SiО3)2, амблигонит LiAl(PО4)F и лепидолит Li2Al2(SiО3)3(F,OH)2.
Простое вещество. Li (литий) – серебристо-белый, мягкий, низкоплавкий щелочной металл самый легкий из металлов. Реакционноспособный; на воздухе покрывается оксидно-нитридной пленкой (Li2О, Li3N). Воспламенятся при умеренном нагревании (выше 200°С); окрашивает пламя газовой горелки в темно-красный цвет. Сильный восстановитель. По сравнению с натрием и собственно щелочными металлами (подгруппа калия) литий является химически менее активным металлом. В обычных условиях бурно реагирует со всеми галогенами. При нагревании непосредственно соединяется с серой, углем, водородом и другими неметаллами. Будучи накален, горит в СО2. С металлами литий образует интерметаллические соединения. Кроме того, образует твердые растворы с Na, Al, Zn и с некоторыми другими металлами. Литий энергично разлагает воду, выделяя из нее водород, еще легче взаимодействует с кислотами.
2Li + Н2О = 2LiОН + Н2↑
2Li + 2НCl = 2LiСl + Н2↑
3Li + 4НNO3(разб.) = 2LiNO3 + NO↑ + 2Н2O
Литий хранят под слоем вазелина или парафина в запаянных сосудах.
Получение и применение.Литий получают при вакуум-термическом восстановлении сподумена или оксида лития в качестве восстановителя применяют кремний или алюминий.
2Li2О + Si = 4Li + SiО2
3Li2О + 2Al = 6Li + A12О3
При электролитическом восстановлении используют расплав эвтектической смеси LiCl-KCl.
Литий придает сплавам ряд ценных физико-химических свойств. Так, у сплавов алюминия с содержанием до 1% Li повышается механическая прочность и коррозионная стойкость, введение 2% Li в техническую медь значительно увеличивает ее электрическую проводимость и т. д. Важнейшей областью применения лития является атомная энергетика (в качестве теплоносителя в атомных реакторах). Его используют как источник получения трития (3Н).
Соединения лития (I). Бинарные соединения лития – бесцветные кристаллические вещества; являются солями или солеподобными соединениями. По химической природе, растворимости и характеру гидролиза они напоминают производные кальция и магния. Плохо растворимы LiF, Li2CО3, Li3PО4 и др.
Пероксидные соединения для лития малохарактерны. Однако для него известны пероксид Li2О2, персульфид Li2S2 и перкарбид Li2C2.
Оксид лития Li2О – оснóвный оксид, получается взаимодействием простых веществ. Активно реагирует с водой, кислотами, кислотными и амфотерными оксидами.
Li2О + Н2О = 2LiOH
Li2О + 2НCl(разб.) = 2LiCl + H2О
Li2О + CО2 = Li2CО3
Гидроксид лития LiOH – сильное основание, но по растворимости и силе уступает гидроксидам остальных щелочных металлов, и в отличие от них, при накаливании LiOH разлагается:
2LiOH ↔ Li2О + Н2О (800-1000°С, в атмосфере Н2)
LiOH получают электролизом водных растворов LiCl. Применяется как электролит в аккумуляторах.
При совместной кристаллизации или сплавлении солей лития с однотипными соединениями других щелочных металлов образуются эвтектические смеси (LiNО3–KNО3 и др.); реже образуются двойные соединения, например M+1LiSО4, Na3Li(SО4)2∙6H2О и твердые растворы.
Расплавы солей лития и их смесей являются неводными растворителями; в них растворяется большинство металлов. Эти растворы имеют интенсивную окраску и являются очень сильными восстановителями. Растворение металлов в расплавленных солях важно для многих электрометаллургических и металлотермических процессов, для рафинирования металлов, проведения различных синтезов.
Натрий
Натрий – один из наиболее распространенных элементов на Земле. Важнейшие минералы натрия: каменная соль или галит NaCl, мирабилит или глауберова соль Na2SO4∙10H2О, криолит Na3AlF6, бура Na2B4O7∙10H2О и др.; входит в состав многих природных силикатов и алюмосиликатов. Соединения натрия содержатся в гидросфере (около 1,5∙10 т), в живых организмах (так, в крови человека ионы Na+ составляют 0,32%, в мышечной ткани – до 1,5%).
Простое вещество. Na (натрий) – серебристо-белый, легкий, очень мягкий, низкоплавкий щелочной металл. Весьма реакционноспособный; на воздухе покрывается оксидной пленкой (тускнеет), воспламеняется при умеренном нагревании. Устойчив в атмосфере аргона и азота (с азотом реагирует только при нагревании). Сильный восстановитель; энергично реагирует с водой, кислотами, неметаллами. С ртутью образует амальгаму (в отличие от чистого натрия, реакция с водой протекает спокойно). Окрашивает пламя газовой горелки в желтый цвет.
2Na + Н2О = 2NaOH + Н2↑
2Na + 2НCl(разб.) = 2NaCl + Н2↑
2Na + 2NaOH(ж) = 2Na2О + H2↑
2Na + H2 = 2NaH
2Na + Hal2 = 2NaHal (комн., Hal = F, Cl; 150-200° C, Hal = Br, I)
2Na + NH3(г) = 2NaNH2 + H2
Co многими металлами натрий образует интерметаллические соединения. Так, с оловом дает ряд соединений: NaSn6, NaSn4, NaSn3, NaSn2, NaSn, Na2Sn, Na3Sn и др.; с некоторыми металлами дает твердые растворы.
Натрий хранят в запаянных сосудах или под слоем керосина.
Получение и применение натрия.Натрий получают электролизом расплавленного NaCl и реже NaOH. При электролитическом восстановлении NaCl используют эвтектическую смесь, например, NaCl-KCl (температура плавления почти на 300°С ниже, чем температура плавления NaCl).
2NaCl(ж) = 2Na + Cl2↑ (эл. ток)
Натрий используется в металлотермии, органическом синтезе, ядерных энергетических установках (в качестве теплоносителя), клапанах авиационных двигателей, химических производствах, где требуется равномерный обогрев в пределах 450-650° С.
Соединения натрия (I).Наиболее характерны ионные соединения кристаллического строения, отличающиеся тугоплавкостью, хорошо растворяются в воде. Труднорастворимы некоторые производные со сложными анионами, как гексагидроксостибат (V) Na[Sb(OH)6]; мало растворим NaHCO3 (в отличие от карбоната).
При взаимодействии с кислородом натрий (в отличие от лития) образует не оксид, а пероксид: 2Na + O2 = Na2O2
Оксид натрия Na2O получают восстановлением Na2O2 металлическим натрием. Известны также малостойкие озонид NaO3 и надпероксид натрия NaO2.
Из соединений натрия важное значение имеют его хлорид, гидроксид, карбонаты и многочисленные другие производные.
Хлорид натрия NaCl является основой для целого ряда важнейших производств, таких, как производство натрия, едкого натра, соды, хлора и др.
Гидроксид натрия (едкий натр, каустическая сода) NaOH – очень сильное основание. Применяется в разнообразных отраслях промышленности, главные из которых – производство мыл, красок, целлюлозы и др. Получают NaOH электролизом водных растворов NaCl и химическими методами. Так, распространен известковый способ – взаимодействие раствора карбоната натрия (соды) с гидроксидом кальция (гашеной известью):
Na2CO3 + Са(ОН)2 = 2NaOH + СаСO3
Карбонаты натрия Na2CO3 (кальцинированная сода), Na2СО3∙10Н2О (кристаллическая сода), NaHCO3 (питьевая сода) используются в химической, мыловаренной, бумажной, текстильной, пищевой промышленности.
Подгруппа калия (калий, рубидий, цезий, франций)
Элементы подгруппы калия – наиболее типичные металлы. Для них наиболее характерны соединения с преимущественно ионным типом связи. Комплексообразование с неорганическими лигандами для К+, Rb+, Cs+ нехарактерно.
Наиболее важными минералами калия являются: сильвин КCl, сильвинит NaCl∙KCl, карналлит KCl∙MgCl2∙6H2О, каинит KCl∙MgSО4∙3H2О. Калий (вместе с натрием) входит в состав живых организмов и всех силикатных пород. Рубидий и цезий содержатся в минералах калия. Франций радиоактивен, стабильных изотопов не имеет (наиболее долгоживущий изотоп Fr с периодом полураспада 22 мин.).
Простые вещества. К (калий) – серебристо-белый, мягкий, низкоплавкий щелочной металл. Чрезвычайно реакционноспособный, сильнейший восстановитель; реагирует с О2 воздуха, водой (идет воспламенение выделяющегося Н2), разбавленными кислотами, неметаллами, аммиаком, сероводородом, расплавом гидроксида калия. Практически не реагирует с азотом (в отличие от лития и натрия). Образует интерметаллиды с Na, Tl, Sn, Pb и Bi. Окрашивает пламя газовой горелки в фиолетовый цвет.
Rb (рубидий) – белый, мягкий, весьма низкоплавкий щелочной металл. Чрезвычайно реакционноспособный; сильнейший восстановитель; энергично реагирует с О2 воздуха, водой (идет воспламенение металла и выделяющегося Н2), разбавленными кислотами, неметаллами, аммиаком, сероводородом. Не реагирует с азотом. Окрашивает пламя газовой горелки в фиолетовый цвет.
Cs (цезий) – белый (на срезе светло-желтый), мягкий, весьма низкоплавкий щелочной металл. Чрезвычайно реакционноспособный, сильнейший восстановитель; реагирует с О2 воздуха, водой (идет воспламенение металла и выделяющегося Н2), разбавленными кислотами, неметаллами, аммиаком, сероводородом. He реагирует с азотом. Окрашивает пламя газовой горелки в синий цвет.
Fr (франций) – белый, весьма легкоплавкий щелочной металл. Радиоактивен. Самый реакционноспособный из всех металлов, по химическому поведению подобен цезию. На воздухе покрывается оксидной пленкой. Сильный восстановитель; энергично реагирует с водой и кислотами, выделяя Н2. Выделены соединения франция FrClО4 и Fr2[PtCl6] методом осаждения с соответствующими малорастворимыми солями Rb и Cs.
Калий и его аналоги хранят в запаянных сосудах, а также под слоем парафинового или вазелинового масла. Калий, кроме того, хорошо сохраняется под слоем керосина или бензина.
Получение и применение. Калий получают электролизом расплава КCl и натрийтермическим методом из расплавленного гидроксида или хлорида калия. Рубидий и цезий чаще получают вакуум-термическим восстановлением их хлоридов металлическим кальцием. Все щелочные металлы хорошо очищаются возгонкой в вакууме.
Металлы подгруппы калия при нагревании и освещении сравнительно легко теряют электроны, и эта способность делает их ценным материалом для изготовления фотоэлементов.
Соединения калия (I), рубидия (I), цезия (I). Производные калия и его аналогов являются преимущественно солями и солеподобными соединениями. По составу, кристаллическому строению, растворимости и характеру сольволиза их соединения проявляют большое сходство с однотипными соединениями натрия.
В соответствии с усилением химической активности в ряду K–Rb–Cs возрастает тенденция к образованию пероксидных соединений. Так, при сгорании они образуют надпероксиды ЭО2. Косвенным путем можно получить также пероксиды Э2О2 и озониды ЭО3. Пероксиды, надпероксиды и озониды – сильные окислители, легко разлагаются водой и разбавленными кислотами:
2КО2 + 2Н2О = 2КОН + Н2О2 + О2↑
2КО2 + 2НCl = 2КCl + Н2О2 + О2↑
4КО3 + 2Н2О = 4КОН + 5О2↑
Гидроксиды ЭОН – самые сильные основания (щелочи); при накаливании, подобно NaOH, возгоняются без разложения. При растворении в воде выделяется значительное количество теплоты. Наибольшее значение в технике имеет КОН (едкое кали), получаемый электролизом водного раствора КCl.
В противоположность аналогичным соединениям Li+ и Na+ их оксохлораты (VII) ЭОCl4, хлороплатинаты (IV) Э2РlCl6, нитритокобальтаты (III) Э3[Со(NO2)6] и некоторые другие труднорастворимы.
Из производных подгруппы наибольшее значение имеют соединения калия. Около 90% солей калия потребляется в качестве удобрении. Его соединения применяются также в производстве стекла, мыла.
Подгруппа меди (медь, серебро, золото)
Для меди наиболее характерны соединения со степенями окисления +1 и +2, для золота +1 и +3, а для серебра +1. Все они обладают ярко выраженной склонностью к комплексообразованию.
Все элементы IB-группы относятся к сравнительно малораспространенным. Наибольшее значение из природных соединений меди имеют минералы: медный колчедан (халькопирит) CuFeS2, медный блеск Cu2S, а также куприт Cu2О, малахит CuСО3∙Cu(ОН)2 и др. Серебро входит в состав сульфидных минералов других металлов (Pd, Zn, Cd и др.). Для Cu, Ag и Au довольно обычны также арсенидные, стибидные и сульфидарсенидные минералы. Медь, серебро и особенно золото встречаются в природе в самородном состоянии.
Все растворимые соединения меди, серебра и золота ядовиты.
Простые вещества. Си (медь) – красный, мягкий, ковкий металл. Не изменяется на воздухе в отсутствии влаги и СO2, при нагревании тускнеет (образование оксидной пленки). Слабый восстановитель (благородный металл); не реагирует с водой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии O2, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами металлов. Реагирует при нагревании с галогеноводородами.
Cu + H2SO4(конц., гор.) = CuSО4 + SO2↑ + H2O
Cu + 4НNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
ЗCu + 8НNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4Н2O
2Cu + 4НCl(разб.) + O2 = 2CuCl2 + 2Н2O
Cu + Cl2(влаж., комн.) = CuCl2
2Cu + O2(нагр.) = 2CuО
Cu + 4KCN(конц.) + Н2O = 2K[Cu(CN)2] + 2KOH + H2↑
4Cu + 2O2 + 8NH3 + 2Н2O = 4[Cu(NH3)2]OH
2Cu + СO2 + O2 + Н2O = Cu2СO3(ОН)2↓
Ag (серебро) – белый, тяжелый, пластичный металл. Малоактивный (благородный металл); не реагирует с кислородом, водой, разбавленными хлороводородной и серной кислотами. Слабый восстановитель; реагирует с кислотами-окислителями. Чернеет в присутствии влажного H2S.
Ag + 2H2SO4(конц., гор.) = Ag2SO4↓ + SO2↑ + Н2O
3Ag + 4HNO3(paзб.) = 3AgNO3 + NO↑ + 2H2O
4Ag + H2S + О2(воздух) = 2Ag2S + 2H2O
2Ag + Наl2(нагр.) = 2AgHal
4Ag + 8KCN + 2H2O + O2 = 4K[Ag(CN)2] + 4KOH
Аи (золото) – желтый, ковкий, тяжелый, высокоплавкий металл. Устойчив в сухом и влажном воздухе. Благородный металл; не реагирует с водой, кислотами-неокислителями, концентрированной серной и азотной кислотами, щелочами, гидратом аммиака, кислородом, азотом, углеродом, серой. В растворе простых катионов не образует. Переводится в раствор «царской водкой», смесями галогенов и галогеноводородных кислот, кислородом в присутствии цианидов щелочных металлов. Окисляется нитратом натрия при сплавлении, дифторидом криптона.
Au + HNO3(конц.) + 4НCl(конц.) = Н[AuCl4] + NO↑ + 2Н2O
2Au + 6H2SeO4(конц., гор.) = Au2(SeO4)3 + 3SeO2 + 6Н2O
2Au + 3Cl2(до 150°C) = 2AuCl3
2Au + Cl2(150-250°С) = 2AuCl
Au + 3Наl + 2ННаl(конц.) = Н[AuНаl4] + NO↑ + 2Н2О (Hal = Cl, Br, I)
4Au + 8NaCN + 2Н2О + О2 = 4Na[Au(CN)2] + 4KOH
Au + NaN03 = NaAuО2 + NO↑
Получение и применение.Медь получают пирометаллургическим восстановлением окисленных сульфидных концентратов. Выделяющийся при обжиге сульфидов диоксид серы SO2 идет на производство серной кислоты, а шлак используется для производства шлакобетона, каменного литья, шлаковаты и пр. Восстановленную черновую медь очищают электрохимическим рафинированием. Из анодного шлама извлекают благородные металл, селен, теллур и др. Серебро получают при переработке полиметаллических (серебряно-свинцово-цинковых) сульфидных руд. После окислительного обжига, цинк отгоняют, медь окисляют, а черновое серебро подвергают электрохимическому рафинированию. При цианидном способе добычи золота сначала золотоносную породу отмывают водой, затем обрабатывают раствором NaCN на воздухе; при этом золото образует комплекс Na[Au(CN)2], из которого его осаждают цинком:
Na[Au(CN)2] + Zn = Na2[Zn(CN)2] + 2Au↓
Этим способом можно выделять и серебро из бедных руд. При ртутном способе золотоносную породу обрабатывают ртутью с целью получения амальгамы золота, затем ртуть отгоняется.
Си, Ag и Au друг с другом и со многими другими металлами образуют сплавы. Из сплавов меди наибольшее значение имеют бронзы (90% Cu, 10% Sn), томпак (90% Cu, 10% Zn), мельхиор (68% Cu, 30% Ni, 1% Mn, 1% Fe), нейзильбер (65% Cu, 20% Zn, 15% Ni), латунь (60% Cu, 40% Zn), а также монетные сплавы.
Ввиду высокой тепло- и электропроводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности, электротехнике, машиностроении. Из меди изготавливают электрические провода и кабели, различную промышленную аппаратуру (котлы, перегонные кубы и т.п.)
Серебро и золото вследствие мягкости обычно сплавляют с другими металлами, чаще с медью. Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, радиодеталей, серебряно-цинковых аккумуляторов, в медицине. Сплавы золота применяются для электрических контактов, для зубопротезирования, в ювелирном деле.
Соединения меди (I), серебра (I) и золота (I).Степень окисления +1 наиболее характерна для серебра; у меди и, в особенности, у золота эта степень окисления проявляется реже.
Бинарные соединения Cu (I), Ag (I) и Au (I) – твердые кристаллические солеподобные вещества, в большинстве нерастворимые в воде. Производные Ag (I) образуются при непосредственном взаимодействии простых веществ, а Cu (I) и Au (I) – при восстановлении соответствующих соединений Cu (II) и Au (III).
Для Cu (I) и Ag (I) устойчивы амминокомплексы типа [Э(NH3)2]+, и поэтому большинство соединений Cu (I) и Ag (I) довольно легко растворяется в присутствии аммиака, так:
CuCl + 2NH3 = [Cu(NH3)2]Cl
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2](OH)
Гидроксиды типа [Э(NH3)2](OH) значительно устойчивее, чем ЭОН, и по силе приближаются к щелочам. Гидроксиды ЭОН неустойчивы, и при попытке их получения по обменным реакциям выделяются оксиды CuО (красный), Ag2O (темно-коричневый), так:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + Н2O
Оксиды Э2O проявляют кислотные свойства при взаимодействии с соответствующими основными соединениями образуются купраты (I), аргентаты (I) и аураты (I).
Cu2O + 2NаОН(конц.) + Н2O = 2Na[Cu(OH)2]
Нерастворимые в воде и кислотах галогениды ЭНаl довольно значительно растворяются в растворах галогеноводородных кислот или основных галогенидов:
CuCl + HC1 = H[CuCl2] AgI + KI = K[AgI2]
Аналогично ведут себя нерастворимые в воде цианиды ЭCN, сульфиды Э2S и пр.
Большинство соединений Cu (I) и Au (I) легко окисляется (даже кислородом воздуха), переходя в устойчивые производные Cu (II) и Au (III).
4CuCl + O2 + 4НCl = 4CuCl2 + 2Н2О
Для соединений. Cu (I) и Au (I) характерно диспропорционирование:
2CuC1 = СuCl2 + Cu
3AuCl + КCl = K[AuCl4] + 2Au
Большинство соединений Э (I) при небольшом нагревании и при действии света легко распадаются, поэтому их обычно хранят в банках из темного стекла. Светочувствительность галогенидов серебра используется для приготовления светочувствительных эмульсий. Оксид меди (I) применяют для окрашивания стекла, эмалей, а также в полупроводниковой технике.
Соединения меди (II). Степень окисления +2 характерна только для меди. При растворении солей Cu (II) в воде или при взаимодействии CuО (черного цвета) и Cu(ОН)2 (голубого цвета) с кислотами образуются голубые аквакомплексы [Cu(H2O)2]2+. Такую же окраску имеет большинство кристаллогидратов, например, Cu(NO3)2∙6H2O; встречаются также кристаллогидраты Cu (II), имеющие зеленую и темно-коричневую окраску.
При действии аммиака на растворы солей меди (II) образуются аммиакаты:
Cu(OH)2↓ + 4NH3 + 2H2 = [Cu(NH3)4(H2O)2](OH)2
Для меди (II) характерны также анионные комплексы – купраты (II). Так, Сu(ОН)2 при нагревании в концентрированных растворах щелочей частично растворяется, образуя синие гидроксокупраты (II) типа M2+1[Cu(OH)4]. В водных растворах гидроксокупраты (II) легко разлагаются.
В избытке основных галогенидов CuHal2 образуют галогенокупраты (II) типа M+1[CuHal3] и М2+1[СuНаl4]. Известны также анионные комплексы Cu (II) с цианид-, карбонат-, сульфат- и другими анионами.
Из соединений меди (II) технически наиболее важен кристаллогидрат CuSO4∙5H2O (медный купорос) применяется для получения красок, для борьбы с вредителями и болезнями растений, служит исходными продуктом для получения меди и ее соединений и т. д.
Соединения меди (III), серебра (III), золота (III). Степень окисления +3 наиболее характерна для золота. Соединения меди (III) и серебра (III) неустойчивы и являются сильными окислителями.
Исходным продуктом для получения многих соединений золота является АuCl3, который получают взаимодействием порошка Аu с избытком Cl2 при 200°С.
Галогениды, оксид и гидроксид Au (III) – амфотерные соединения с преобладанием кислотных свойств.
NaOH + Au(OH)3 = Na[Au(OH)4]
Au(OH)3 + 4HN03 = H[Au(NO3)4] + 3H2O
AuHal3 + M+1Hal = M[Au(Hal)4]
Нитрато- и цианоаураты (III) водорода выделены в свободном состоянии. В присутствии солей щелочных металлов образуются аураты, например: М+1[Au(NO3)4], M+1[Au(CN)4] и др.
Соединения золота (V) и (VII). Взаимодействием золота и фторида криптона (II) получен пентафторид золота AuF5:
2Au + 5KrF2 = 2AuF5 + 5Кr
Пентафторид AuF5 проявляет кислотные свойства, с оснóвными фторидами образует фтороаураты (V).
NaF + AuF5 = Na[AuF6]
Соединения Au (V) – очень сильные окислители. Так, AuF5 окисляет даже XeF2:
AuF5 + XeF2 = XeF4 + AuF3
Известны также соединения типа XeFAuF6, XeF5AuF6 и некоторые другие.
Известен крайне неустойчивый фторид AuF7.
Глава 13. ЭЛЕМЕНТЫ II ГРУППЫ
IIА-группа: бериллий Be 2s2, магний Mg 3s2 и элементы подгруппы кальция (щелочно-земельные металлы) – кальций Са 4s2, стронций Sr 5s2, барий Ва 6s2, радий Ra 7s2. Элементы проявляют степень окисления +2. Как и в других главных подгруппах, с увеличением атомного номера энергия ионизации атомов уменьшается, радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются.
IIВ-группа (подгруппа цинка): цинк Zn 3d104s2, кадмий Cd 4d105s2, ртуть Hg 5d106s2.
Бериллий
Во всех устойчивых соединениях степень окисления бериллия +2. Содержание бериллия в земной коре невелико. Важнейшие минералы: берилл… Соединения бериллия ядовиты.Магний
Магний – один из наиболее распространенных элементов на Земле, входит в состав силикатных минералов (среди них преобладает оливит Mg2SiО4), карбонатных минералов – доломита CaMg(CО3)2, цезита MgCО3. Важное техническое значение имеет минерал карналлит KCl∙MgCl2∙6H2O. Большое количество магния содержится в морской воде и в воде некоторых озер, придавая ей горький вкус. Магний выступает комплексообразователем в хлорофилле.
Простое вещество. Mg (магний) – серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Пассивируется в холодной воде, концентрированных серной и фтороводородной кислотах. Не реагирует со щелочами. Сильный восстановитель; реагирует с горячей водой, разбавленными кислотами, неметаллами. Переводится в раствор солями аммония.
Mg + 2H2O(гор.) = Mg(OH)2↓ + H2↑
Mg + 2HCl(разб.) = MgCl2 + H2↑
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O↑ + 5H2O
Mg + H2(нагр., кат.) = MgH2
2Mg + O2 = MgO; 3Mg + N2 = Mg3N2 (сгорание на воздухе)
Получение и применение.Основную массу производимого магния получают электролизом расплавленного карналлита или MgCl2 (c добавлением NaCl или других хлоридов для понижения температуры плавления), а также металлотермическим и углетермическим методами:
2(CaO∙MgO) + Si = Ca2SiО4 + 2Mg
MgO + С(кокс) = Mg + СО
Магний в основном используется для производства «сверхлегких» сплавов, в металлотермии (для производства Ti, Zr, V, U и др.). Смеси порошка магния с окислителями применяются для осветительных и зажигательных ракет, снарядов, в фото- и осветительной технике.
Соединения магния (II). Бинарные соединения Mg в зависимости от электроотрицательного элемента могут быть соединениями от металлических до ионных. Так, Mg3Al2 – типично металлическое соединение, a MgCl2 – ионное.
По химической природе соединения Mg( II) преимущественно оснóвные. Некоторые из них, например, MgCl2, MgSО4, Mg(NО3)2, в обычных условиях гидролизу не подвергаются, другие создают слабощелочную среду.
Анионные комплексы для Mg (II) не характерны, но весьма разнообразны двойные соединения типа смешанных карбоната СаСО3∙MgCО3 (доломит), нитрида Li3N∙Mg3N2 (LiMgN) и др.
Оксид MgO (жженая магнезия) – оснóвное соединение, взаимодействует с водой, поглощает СО2, легко растворяется в кислотах, но сильно прокаленный MgO теряет химическую активность. Жженую магнезию применяют в производстве магния, в качестве наполнителя в производстве резины, для очистки нефтепродуктов, в производстве огнеупоров, строительных материалов и др.
MgO + Н2О = Mg(OH)2↓
Важное промышленное значение имеет MgCl2, получаемый хлорированием MgO, в присутствии угля: MgO + Сl2 + С = MgCl2 + СО или обезвоживанием MgCl2∙6Н2О, добываемого из морской воды. Дихлорид магния в основном применяется для получения магния и в производстве магнезиального цемента. Последний получают смешиванием предварительно прокаленного MgO с 30%-ным водным раствором MgCl2.
Подгруппа кальция(кальций, стронций, барий, радий)
Кальций – один из наиболее распространенных элементов на Земле. Большая его часть содержится в виде силикатов и алюмосиликатов в изверженных горных породах (граниты, гнейсы и др.). Из других пород наиболее распространены известняк и мел, состоящие в основном из минерала кальцита СаСО3; значительно реже встречается кристаллизованная форма кальцита – мрамор. Широко распространены ангидрит CaSО4 и гипс CaSО4∙2H2О. Важны для промышленности минералы флюрорит CaF2, апатит Са5(РО4)3 (F, Cl, ОН) и др. В качестве продуктов выветривания минералов соединения кальция содержатся в большинстве природных вод и в основном обусловливают их жесткость. Важнейшие минералы стронция и бария – стронцианит SrCО3, витерит ВаСО3, целестин SrSО4, барит (тяжелый шпат) BaSО4. Радий обычно содержится в урановых рудах.
Простые вещества. Са (кальций) – серебристо-белый, пластичный, достаточно твердый, щелочноземельный металл. Во влажном воздухе покрывается оксидно-гидроксидной пленкой. Окрашивает пламя газовой горелки в коричнево-красный цвет. Реакционноспособный, реагирует с кислородом, азотом, водородом, галогенами и другими неметаллами при нагревании. Сильный восстановитель; реагирует с водой, разбавленными кислотами, аммиаком.
Ca + 2H2O = Ca(OH)2 + H2↑
Ca + 2HCl(разб.) = CaCl2 + H2↑
4Ca + 10HNO3(разб.) = 4Ca(NO3)2↓ + N2O↑ + 5H2O
Ca + H2 = CaH2
Ca + Hal2 = CaHal2
Ca + 2C = CaC2
Sr (стронций) – светло-желтый, ковкий щелочноземельный металл. На воздухе покрывается оксидно-нитридной пленкой. Окрашивает пламя газовой горелки в ярко-красный цвет. Реакционноспособный; реагирует с кислородом, азотом, водородом, галогенами и другими неметаллами при нагревании. Сильный восстановитель; окисляется водой, разбавленными кислотами, аммиаком.
Ba (барий) – серебристо-белый, ковкий, пластичный щелочноземельный металл. На воздухе покрывается темной оксидно-нитридной пленкой. Окрашивает пламя газовой горелки в желто-зеленый цвет. Реакционноспособный; реагирует с кислородом, азотом, водородом, галогенами и другими неметаллами. Сильный восстановитель; реагирует с водой, кислотами, сероводородом, аммиаком.
Ra (радий) – белый, блестящий, мягкий щелочноземельный металл. Радиоактивен. Реакционноспособный; на воздухе покрывается темной оксидно-нитридной пленкой. Окрашивает пламя газовой горелки в темно-красный цвет. Сильный восстановитель; реагирует с водой, кислотами, хлором, серой.
Щелочно-земельные металлы (кроме радия) хранят под керосином в запаянных сосудах (кальций – в плотно закрывающихся металлических банках).
Получение и применение.Общий способ получения кальция, стронция, бария и радия – электролиз их расплавленных хлоридов и алюмотермия в вакууме.
Кальций применяют для восстановления из соединений ряда металлов (U, Cr, Zr, Cs, Rb), для удаления из стали кислорода и серы. Кроме того, кальций служит легирующим компонентом некоторых свинцовых сталей. Практически важен карбид кальция CaC2, получаемый карботермически из оксида кальция.
Природные соединения кальция широко применяются в производстве вяжущих материалов. Последние представляют собой порошкообразные вещества, образующие при смешении с водой пластичную массу, затвердевающую в твердое прочное тело. Вяжущие материалы для изготовления бетона, строительных деталей и конструкций. К вяжущим веществам относятся цементы, гипсовые материалы, известь и др. По химическому составу цементы представляют собой главным образом силикаты и алюминаты кальция. Силикатные цементы получают обжигом до спекания тонкоизмельченной смеси известняка и богатой SiО2 глины. Гипсовые материалы – прежде всего жженый гипс (алебастр) 2CaSО4∙H2О получают обжигом гипса CaSО4∙2H2О; при взаимодействии с водой происходит закристаллизовывание, сопровождающееся отвердеванием всей массы:
2[CaSO4∙0,5H2O] + 3Н2О = 2[CaSО4∙2H2О]
Кальций, стронций и барий применяют как газопоглотители в вакуумной технике. Кроме того, стронций и барий используют в сплавах, их соли – в производстве красок, эмалей, в медицине. Радиоактивные свойства радия нашли практическое применение в медицине и технике.
Соединения кальция (II), стронция (II), бария (II). Неорганические соединения кальция и его аналогов представляют собой кристаллические вещества, в большинстве с высокими температурами плавления.
Оксиды получают термическим разложением соответствующих карбонатов или нитратов:
СаСО3 = СаО + СО2
2Ba(NО3)2 = 2ВаО + 4NО2 + О2
Оксиды энергично взаимодействуют с водой, образуя более или менее растворимые основания Э(ОН)2.
Гидроксиды Э(ОН)2 – сильные основания, по силе уступающие лишь гидроксидам элементов IА-группы.
Из солей и солеподобных соединений в воде хорошо растворимы лишь ЭСl2, ЭBr2, ЭI2, Э(NO3)2; более или менее растворимы ЭS, Э(ОН)2, а также большинство кислых солей.
Высокая активность кальция и его аналогов проявляется также в их способности образовывать многочисленные перекисные соединения, например, пероксиды ЭО2, надпероксиды Э(О2)2, персульфиды ЭSn (n = 2–5), перкарбиды ЭС2.
Жесткость воды.Наличие в природной воде солей кальция и магния обусловливает ее жесткость. Различают временную и постоянную жесткость воды. Временную жесткость придают воде гидрокарбонаты, постоянную – сульфаты и хлориды Са (II) и Mg (II).
Жесткость воды устраняют физическими и химическими методами. Временная жесткость устраняется кипячением воды. При этом гидрокарбонаты переходят в нерастворимые карбонаты:
Са(НСО3)2 = СаСО3↓ + СО2 + Н2О
При химическом умягчении природную воду обрабатывают гашеной известью или содой:
CaSО4 + Na2(CО3) = СаСО3↓ + Na2SО4
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
MgSО4 + Са(ОН)2 = Mg(ОH)2↓ + CaSО4
Для удаления ионов Са2+ и Mg2+ можно применять также фосфаты натрия, буру, поташ и др. В методе устранения жесткости воды путем ионообмена используются высокомолекулярные соединения – иониты (катиониты и аниониты). Катиониты представляют собой алюмосиликаты типа цеолитов, например Na2[Al2Si2О8]∙nH2О.
Подгруппа цинка(цинк, кадмий, ртуть)
Для элементов подгруппы цинка характерна степень окисления +2, в производных Hg22+ степень окисления ртути равна +1.
Содержание элементов в земной коре невелико. Важнейшие цинковые руды: цинковая обманка ZnS и галмей ZnCO3. Кадмий сопутствует цинку в полиметаллических сульфидных рудах и редко образует самостоятельное месторождение CdS (гринокит). Киноварь Hg2S является главной рудой в производстве ртути; изредка встречается самородная ртуть.
Простое вещество и производные ртути чрезвычайно ядовиты.
Простые вещества. Zn (цинк) – белый с голубоватым оттенком, мягкий, хрупкий (из-за примесей) металл. Во влажном воздухе покрывается устойчивой гидроксидно-карбонатной пленкой. В воде пассивируется. Проявляет амфотерные свойства; реагирует с кислотами, щелочами. Сильный восстановитель; реагирует с кислородом, галогенами, халькогенами, нитратами металлов в щелочной среде.
Zn + 2HCl(разб.) = ZnCl2 + H2↑
Zn + 2H2SO4(разб.) = ZnSO4 + H2↑
Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S↑ + 4H2O
Zn + 4HNO3(конц., гор.) = Zn(NO3)2 + 2NO2↑ + 2H2O
4Zn + 10HNO3(разб., гор.) = 4Zn(NO3)2 + N2O↑ + 5H2O
4Zn + 10HNO3(оч. разб., гор.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
2Zn + О2 (свыше 225° C) = 2ZnО
Zn + Hal2 (60° C) = ZnHal2
4Zn + 7NaOH(конц.) + NaNO3 + 6H2O = 4Na2[Zn(OH)4] + NH3↑
Cd (кадмий) – серебристо-белый, тяжелый, низкоплавкий, мягкий, ковкий металл. Во влажном воздухе покрывается устойчивой оксидной пленкой. Не реагирует со щелочами. Восстановитель; реагирует с водяным паром, сильными кислотами, кислородом, галогенами, халькогенами и другими неметаллами, сероводородом, нитратом аммония. Вытесняет благородные металлы из их солей в растворе.
Hg (ртуть) – серебристо-белый, жидкий при комнатной температуре металл. Не окисляется в сухом воздухе, покрывается серой оксидной пленкой во влажном воздухе. Благородный металл; не реагирует с водой, кислотами-неокислителями, щелочами, гидратом аммония. Переводится в раствор иодоводородной кислотой за счет комплексообразования. Слабый восстановитель; реагирует с концентрированными серной и азотной кислотами, «царской водкой», галогенами, халькогенами. Со многими металлами (Na, K, Ca, Ba, Cu, Ag, Au, Zn, Cd, Pb и др.) образует амальгамы (жидкие и твердые) – интерметаллические соединения или сплавы.
Получение и применение.Для получения цинка и кадмия их сульфидные концентраты подвергают обжигу, затем проводят карботермическое восстановление.
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + C = Zn = CO
Наряду с пирометаллургическим методом, цинк и кадмий получают и гидрометаллургическим способом; руду в виде оксидов растворяют в разбавленной серной кислоте и подвергают электролизу. Кроме того, кадмий из сульфатных растворов обычно вытесняют металлическим цинком.
Большая часть добываемого цинка используется для оцинкования железа (предохранения от ржавления), а также для получения различных сплавов – латунь (60% Cu, 40% Zn), томпак (90% Cu, 10% Zn), нейзильбер (65% Cu, 20% Zn, 15% Ni). Из кадмия изготовляют регулирующие стержни атомных реакторов; его применяют для получения легкоплавких сплавов, гальванических покрытий, электродов щелочных аккумуляторов, механически прочных медно-кадмиевых сплавов для электропроводов и т. д. Ртуть широко используется как катод при электрохимическом получении гидроксида натрия и хлора, как катализатор в органическом синтезе (например, в производстве уксусной кислоты), для изготовления выпрямителей, ламп дневного света, ртутных манометров.
Применение соединений цинка и его аналогов весьма разнообразно. Так, их сульфиды используются в производстве минеральных красок; HgCl2 (сулема), Hg2Cl2 (каломель) и др. препараты ртути, а также цинка – в медицине. Концентрированный раствор ZnCl2, растворяющий клетчатку, используется в производстве пергамента.
Соединения цинка (II), меди (II), ртути (II). В подгруппе цинка с увеличением атомного номера элемента устойчивость однотипных бинарных соединений уменьшается. Так, Zn(ОН)2 и Cd(ОН)2 устойчивы, а гидроксид Hg (II) неизвестен, так как уже при получении разлагается на ртуть и воду:
Hg(NO3)2 + 2КОН = HgO + 2КNO3 + Н2O
Малоустойчивы также Hg3N2 и HgC2, распадающиеся со взрывом.
Из соединений цинка и его аналогов в воде растворяются галогениды (кроме ZnF2, HgBr2, HgI2), сульфаты, нитраты и некоторые другие.
При растворении соединений Э (II) в воде, а также при взаимодействии ЭО или Э(ОН)2 с кислотами образуются устойчивые аквакомплексы типа [Э(H2O)4]2+, [Э(H2O)6]2+. Поэтому для Zn (II), Cu (II), Hg (II) характерны кристаллогидраты. Из других катионных комплексов наиболее устойчивы амминокомплексы [Э(NН3)4]2+ и [Э(NН3)6]2+, легко образующиеся действием аммиака на растворы солей и Э(ОН)2:
ZnSO4 + 4NH3 = [Zn(NH3)4]SO4
Cd(ОН)2 + 6NH3 = [Cd(NH3)6](ОН)2
Цинк и в меньшей степени кадмий образуют различного рода цинкаты и кадматы. Так, амфотерный Zn(ОН)2 легко растворяется в щелочах за счет образования растворимых гидроксоцинкатов:
Zn(ОН)2 + 2КОН = К2[Zn(ОН)4]
Наиболее прочны комплексы с лигандами CN– типа [Э(СN)4]2–, которые легко образуются при действии на растворы солей Э (II) оснóвного цианида (образующиеся вначале осадки Э(CN)2 растворяются в избытке оснóвного цианида):
2KCN + Э(CN)2 = K2[Э(CN)4]
Комплексные галогениды Zn (II) по устойчивости относятся к двойным солям, а комплексы Hg (II) очень устойчивы и легко образуются в растворах. Так, нерастворимый в воде HgI2 легко растворяется при избытке оснóвного иодида:
2КI + Hg(NO3)2 = HgI2↓+ 2КNO3
2КI + HgI2 = К2[HgI 4]
Производные ртути (II) проявляют окислительные свойства, так:
Hg+2(NO3)2 + Hg0 = Hg2+1(NO3)2
HgCl2 + SO2 + 2H2O = Hg + H2SO4 + 2HCl
Соединения ртути (I). Известны оксид Hg2О, галогениды Hg2Наl2, некоторые соли. Наиболее устойчивы Hg2Сl2 и Hg2SO4 (распадаются при небольшом нагревании и интенсивном освещении). В зависимости от условий соединения Hg22+ проявляют восстановительные и окислительные свойства:
Hg2Сl2 + Сl2 = 2HgСl2
Hg2Сl2 + SnСl2 = 2Hg + SnСl4
Соединения Hg22+ склонны к диспропорционированию с выделением свободной ртути и образованием соответствующих соединений ртути (II):
Hg2+1Сl2 = Hg0 + Hg+2Сl2
Глава 14. ЭЛЕМЕНТЫ III ГРУППЫ
IIIА-группа: бор B 2s22p1, алюминий Al 3s23p1 22p1и элементы подгруппы галлия – галлий Ga 4s24p1, индий In 5s25p1, таллий Tl 6s26p1.
IIIB-группа (подгруппа скандия): скандий Sc 3d14s2, иттрий Y 4d15s2, лантан La 5d16s2, актиний Ac 6d17s2. В подгруппу скандия помещают f-элементы Периодической системы: лантаноиды и актиноиды.
Бор
Для бора наиболее характерны соединения, в которых его степень окисления равна +3; отрицательные степени окисления бора проявляются редко; с металлами бор обычно образует нестехиометрические соединения.
В природе относительно невысокое содержание бора в виде кислородных соединений: борной кислоты Н3ВО3, буры Na2B4O7∙10H2O и минерала ашарита MgНBO3.
Простые вещества. В (бор) – серо-черный (кристаллический) или коричневый (аморфный) тугоплавкий, очень твердый, хрупкий неметалл. Химически пассивный; не реагирует с водородом, водой, разбавленными кислотами, щелочами в разбавленном растворе. Реагирует с водяным паром, горячими концентрированными азотной и серной кислотами, «царской водкой», галогенами, азотом, фторо- и сероводородом, концентрированными щелочами и аммиаком при нагревании.
2B + 3H2O(пар, 700°С) = B2O3 + 3H2
B + 3HNO3(конц., гор.) = H3BO3↓ + 3NO2↑
2B + 2NaOH(конц.) + 2H2O = 2NaBO2 + 3H2↑
4B + 3O2(700°С) = 2B2O3
2B + 3Hal2(нагр.) = 2BHal3
2B + 6HCl(нагр.) = BCl3 + 3H2
Получение и применение.Для получения из природных соединений бор переводят в оксид В2О3, в галогениды или бороводороды. Чаще других пользуются методами металлотермии:
В2О3 + 3Mg = 3MgО + 2В
2BCl3 + Zn = 3ZnCl2 + 2B
Более чистый бор получают восстановлением его хлорида или осаждением кристаллического бора на раскаленной проволоке из тантала или вольфрама. Наиболее перспективны методы, основанные на пиролизе боранов:
В2Н6 = 2В + 3Н2
Бор и его соединения применяются в ядерной энергетике в качестве замедлителей ядерных процессов (способен поглощать нейтроны) и в биологической защите. В металлургии бор используют как добавку к стали и некоторым цветным сплавам.
Ортоборная кислота Н3ВО3 и бура Na2B4O7∙10H2O применяется при приготовлении эмалей и глазури, в производстве термически и химически стойких стекол, в качестве дезинфицирующего средства. Буру также используют при сварке, паянии металлов и в качестве удобрения.
Металлические соединения бора. С металлами бор образует бориды среднего состава: М4В, М2В, МВ, М3В4, МВ2, МВ6, МВ12, например, Cr4B, Cr2B, CrB, Cr3B4, CrB2.
Большинство боридов d- и f-элементов очень тверды, жаростойки (2000–3000° С) и химически устойчивы. Бориды Cr, Zr, Ti, Nb, Ta применяют для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр.
Соединения бора (III). Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными, чем он сам, элементами, т.е. в галогенидах, оксиде, сульфиде, нитриде, гидридах и в соответствующих анионных борат-комплексах, например [BF3OH]–, [B(OH)4]–.
Бинарные соединения бора (III) проявляют кислотные свойства, так, при гидролизе и взаимодействии с оснóвными соединениями:
ВНаl3 + 3Н2О = Н3ВО3 + 3ННаl
BCl3 + 6NH3(ж) = B(NH2)3 + 3NH4Cl
В2О3 + 3Н2О = 2Н3ВО3
В2О3 + 2КОН = 2КВО2 + Н2О
Гидриды бора (бораны) по способу получения и по свойствам подобны силанам. Обычно смесь боранов с водородом получается действием кислот на некоторые химически активные бориды:
6MgВ2 + 12НСl = Н2 + В4Н10 + 6MgCl2 + 8В
Из выделенных в свободном состоянии гидридов бора простейшими представителями являются: диборан В2Н6, тетраборан В4Н10 – газы; В5Н9, В6Н10 – жидкости; В10Н14 – твердое вещество. Их получают косвенным путем.
Бороводороды химически весьма активны. Так, большинство боранов на воздухе самовоспламеняется и сгорает с выделением очень большого количества теплоты (их используют в качестве ракетного топлива); они разлагаются водой, спиртами и щелочами с выделением водорода.
В2Н6 + 6Н2О = 2Н3ВО3 + 6Н2↑
Большинство боранов имеет отвратительный запах и очень ядовиты.
Кислотные свойства слабой ортоборной кислоты Н3ВО3 обязаны не отщеплению протона, а присоединению ОН–-ионов:
В(ОН)3 + НОН ↔ [В(ОН)4]– + Н+
Ортоборную кислоту получают гидролизом галогенидов, боранов и др. При нагревании ортоборат водорода теряет воду, переходя в полимерные метабораты водорода НВО2, а затем в В2О3.
Полибораты водорода в растворе легко гидратируются, поэтому при действии на них кислот обычно образуется ортоборная кислота; наоборот, при нейтрализации Н3ВО3 избытком щелочи (т. е. при выделении воды) образуются полибораты, выделяющиеся из растворов в виде кристаллогидратов.
Na2B4O7 + 2H2SO4(конц.) + 5H2O = 4H3BO3↓ + 2NaHSO4
4H3BO3 + 2NaОН + 3Н2O = Na2B4O7∙10H2O
Водные растворы буры Na2B4O7∙10H2O вследствие гидролиза обладают сильнощелочной средой.
Борорганические соединения содержат цепи B–O–B, B–N–B, B–P–B, B–S–B. Особый интерес представляют производные боразола B3N3H6 – по структуре и ряду свойств он близок к бензолу и его образно называют «неорганический бензол». Соединения бора с азотом во многом напоминают органические соединения углерода. Например: H3N–ВH3 (боразан), H2N=ВH2 (боразен), HN≡ВH (боразин).
Алюминий
Алюминий – типичный амфотерный элемент, для него наиболее типична степень окисления +3. В отличие от бора для него характерны не только анионные, но… По распространенности на Земле алюминий занимает третье место (после О, Si), и… Простое вещество. Al (алюминий) – серебристо-белый, легкий, пластичный металл. Пассивируется в воде, концентрированной…Лантаноиды
Поскольку у лантаноидов валентными в основном являются 5d16s2-электроны, их устойчивая степень окисления равна +3. Однако элементы, примыкающие к… Благодаря близости свойств часто лантаноиды совместно с лантаном, иттрием, а… По содержанию в земной коре лантаноиды не уступают таким элементам, как иод, сурьма, медь, но они очень рассеяны в…Актиноиды
В семейство актиноидов входят торий Th 5f06s26p66d27s2, протактиний Pr 5f2 6d17s2, уран U 5f3 6d17s2, нептуний Np 5f4 6d17s2, плутоний Pu 5f6… Уран, торий и протактиний содержатся в земной коре. Торий и уран относятся к… Простые вещества. В виде простых веществ торий Th, протактиний Pr, уран U, нептуний Np, плутоний Pu, америций Am,…Глава 15. ЭЛЕМЕНТЫ IV ГРУППЫ
IVА-группа: углерод С 2s22p2, кремний Si 3s23p2 и элементыподгруппы германия – германий Ge 4s24p2, олово Sn 5s25p2, свинец Pb 6s26p2.
IVВ-группа (подгруппа титана) – титан Ti 3d24s2, цирконий Zr 4d25s2, гафний Hf 5d26s2, резерфордий Rf 6d27s2.
Углерод
В большинстве неорганических соединений углерод проявляет степени окисления –4, +4, +2. В природе содержание углерода составляет 0,15% (мол. доли) и находится в… Простые вещества. Простые вещества элемента углерода имеют полимерное строение, и в соответствии с характерными…Кремний
Кремний в соединениях имеет степени окисления +4 и –4. Для него наиболее характерны связи Si–F и Si–О. По распространенности на Земле 20% (мол. долей) кремний уступает только… Простое вещество. Si (кремний) – темно-серый (кристаллический) или белый (аморфный), с металлическим блеском, весьма…Глава 16. ЭЛЕМЕНТЫ V ГРУППЫ
VA-группа: азот N 2s22p3, фосфор Р 3s23p3 и элементы подгруппы мышьяка – мышьяк As 4s24p3, сурьма Sb 5s25p3, висмут Bi 6s26p3.
VB-группа: ванадий V 3d34s2, ниобий Nb 4d45s1, тантал Та 5d36s2, дубний Db 6d37s2.
Азот
Азот по электроотрицательности (3,0) уступает лишь фтору и кислороду. Степени окисления азота в соединениях –3, –1, +1, +3, +5, а также –2, +2 и +4.
Содержание азота (изотоп 14N с примесью 15N) на Земле составляет 0,03 % (мол. доли). Основная масса его входит в состав атмосферы 78% (об.) в виде простого вещества. Из минералов промышленное значение имеют чилийская NаNО3 и индийская КNО3 селитры. Азот входит в состав белков живых организмов, обнаружен в газовых туманностях и солнечной атмосфере, на Уране и Нептуне и др.
Простое вещество. N2 (диазот) – бесцветный газообразный неметалл, кипит при более низкой температуре, чем кислород (в жидком состоянии бесцветный, в твердом – белый). Плохо растворяется в воде (хуже, чем кислород), хорошо растворяется в жидком SO2. В обычных условиях химически пассивный (молекула N≡N исключительно прочна); не реагирует с кислотами, щелочами, гидратом аммиака, галогенами, серой. В незначительной степени реагирует с Н2 и О2 при действии электрического разряда. В присутствии влаги реагирует с литием при комнатной температуре. При нагревании взаимодействует с Mg, Ca, Al и другими металлами. В особых условиях образуется атомарный азот, обладающий высокой химической активностью.
Получение и применение.В промышленности азот получают фракционированной дистилляцией жидкого воздуха, в лаборатории – термическим разложением соединений, чаще всего нитрита аммония NH4NO2:
N–3H4N+3O2 = N20 + 2H2O
Основная масса получаемого азота используется для синтеза аммиака, а также для создания инертной атмосферы в химических и других производствах.
Соединения азота (–III). При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды:
3Mg + N2 = Mg3N2; 2B + N2 = 2BN; 3H2 + N2 = 2H3N
Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Так, в малых периодах наблюдается переход от оснóвных нитридов к кислотным: Na3N, Mg3N2 – оснóвные, AlN – амфотерный, Si3N4, P3N4, S4N4, Cl3N – кислотные.
Из нитридов наибольшее практическое значение имеет нитрид водорода NH3 – аммиак – в обычных условиях бесцветный газ с резким удушающим запахом. Молекула NН3 – резко выраженный донор электронной пары и обладает высокой полярностью. Аммиак характеризуется значительной энтальпией испарения и легко сжижается; на этом основано его применение в холодильных машинах. Жидкий аммиак хранят в стальных баллонах.
Аммиак хорошо растворяется в воде, что объясняется образованием водородной связи между молекулами NН3 и Н2О; в растворе имеет место ионизация:
NН3 + Н2О = NН4+ + ОН– (щелочная среда раствора)
При взаимодействии ионов NН4+ + ОН–вновь образуются молекулы NН3 + Н2О, между которыми имеет место водородная связь. Следовательно, ионное соединение NН4ОН (гидроксид аммония) не существует. Из водных растворов аммиака выделяются два кристаллогидрата NH3∙H2O и NH3∙2H2O, устойчивые лишь при низкой температуре. Почти все соли аммония NН4+ хорошо растворимы и полностью диссоциируют в воде.
При нагревании аммиак проявляет восстановительные свойства, окисляясь обычно до свободного азота:
4NH3 + 3O2 = 2N2 + 6Н2O
На восстановительной способности аммиака основано применение NH4Cl (нашатыря) для очистки от оксидов поверхности металлов при пайке:
3CuO + 2NH4Cl = 3Cu + 2HCl + N2 + 3H2O
В промышленности аммиак получают синтезом из простых веществ при 450–500°С, высоком давлении (107–108 Па) и применением катализатора (простые вещества элементов подгруппы железа). В технике обычно используют железный катализатор (с добавлением активаторов). В лаборатории его получают действием щелочей на аммонийные соли. Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений.
Производные NН2– называются амидами, а производные NН2–– имидами.
Соединения азота (–II). Азот, как и кислород, образует соединения перекисного типа – пернитриды. Простейший представитель – пернитрид водорода N2H4, называемый гидразином или диамидом.
Растворы гидразина получают осторожным окислением аммиака гипохлоритом:
2NH3 + NаClO = N2H4 + NаCl +Н2О
Гидразин – сильный восстановитель:
4KMnO4 + 5N2H4 + 6H2SO4(разб.) = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
N2H4 + O2 = N2 + H2O
Соединения азота (–I). Промежуточное положение между пероксидом и пернитридом водорода по составу и структуре занимает гидроксиламин NH2OH.
Гидроксиламин образуется при восстановлении раствора HNO3 атомным водородом в процессе электролиза:
HNO3 + 6Н = NH2OH + 2Н2O
Как слабое основание с кислотами дает соли гидроксиламмония [NH3ОН]–, так:
NН2OН + НCl = [NH3ОН]Cl
В щелочной среде NН2OН является сильным восстановителем, а в кислой среде отчетливо проявляет окислительные свойства:
2N–1Н2OН + I2 + 2КОН = N20 + 2КI + 4Н2O (восстановитель)
2N–1Н2OН + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (N–3H4)2SO4 + 2Н2О (окислитель)
Как и пероксид водорода, NН2OН легко разлагается (в особенности при нагревании) по механизму диспропорционирования:
3N–1Н2OН = 3 Н3N–3 + N20 + 3Н2O
Соединения азота (III). Для азота в степени окисления +3 известны фторид NF3, оксид N2O3, оксогалогениды NOHal, а также производные аниона NO2–.
Трифторид азота NF3 – весьма устойчив к нагреванию и различным химическим воздействиям (вступает в реакции только выше 100°С); его получают при окислении аммиака фтором:
4NH3 + 3F2 = NF3 + 3NH4F
Оксид азота (III) N2O3 (триоксид диазота) существует только в твердом состоянии при низких температурах. В виде жидкости и пара в значительной степени диссоциирован: N2O3 ↔ NО2 + NО. Его получают охлаждением смеси NО2 с NО.
N2O3 – кислотный оксид, легко поглощается щелочами, образуя нитриты:
N2O3 + 2NаОН = 2NаNО2 + Н2О
Диоксонитрат (III) водорода НNО2 известен лишь в водном растворе, который является кислотой, называемой азотистой.
Производные азота (III) проявляют и восстановительные, и окислительные свойства:
2NаNO2 + 2КI + 2Н2SO4 = I2 + 2NО + К2SO4 + Na2SO4 + 2Н2О (окислитель)
2КМnO4 + 5NаNO2 + 3Н2SO4 = 2МnSO4 + 5NаNО3+ К2SO4 + 3Н2О (восст-ль)
Кроме того, они склонны к реакциям диспропорционирования:
3HNO2 ↔ HNO3 + 2NO + H2O
Соединения азота (V). Степень окисления +5 азот проявляет в оксиде N2O5, оксонитриде NОN, диоксофториде NO2F, а также в триоксонитрат(V)-ионе NO3– и динитридонитрат(V)-ионе NN2–.
Оксид азота (V) N2O5 представляет ионное соединение нитрат нитроила [NO2+][NO3–]. Его получают осторожным обезвоживанием НNО3 (например, с помощью Р2O5) или окислением NO2 озоном. В обычных условиях N2O5 постепенно разлагается на NO2 и О2, при нагревании взрывается.
Оксонитрид азота (V) N+5ОN–3 (N2O – «веселящий газ») получается разложением аммонийной селитры (при 250°С):
NН4NО3 = N2O + 2Н2О
Оксонитрат (V) водорода HNO3 при обычных условиях бесцветная жидкость; с водой смешивается в любых, отношениях. Растворы HNO3 – сильная азотная кислота. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитрат натрия. Промышленное производство HNO3 осуществляется по стадиям: окисление NH3 в NO кислородом воздуха на платиновом катализаторе, окисление NО в NО2 и взаимодействие последнего с водой:
4NH3 + 5O2 = 4NO + 6H2O
2NО + O2 = 2NО2
2NО2 + H2O = НNO3 + НNO2
3НNО2 = НNО3 + 2NО + Н2О
Азотная кислота обладает сильно выраженными окислительными свойствами; разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. Образование тех или иных продуктов взаимодействия зависит от концентрации НNО3, активности простого вещества и температуры. Достаточно разбавленная кислота в основном восстанавливается до NН4NО3; с повышением ее концентрации становиться более характерным образование NO; концентрированная НNО3 восстанавливается до NO2.
Смесь одного объема НNО3 и трех объемов НCl называют «царской водкой». Ее сильное окислительное действие обусловлено образующимся хлором:
3НCl + НNО3 = NOCl + Cl2 + 2Н2О
Она растворяет платину, золото и другие неактивные металлы, переводя их в комплексные хлориды.
Нитрат-ион NO3– в нейтральной среде окислительные свойства практически не проявляет, но является окислителем при сплавлении:
Сr2О3 + 3NаNО3 + 4КОН = 2К2СrO4 + 3NаNO2 + 2Н2O
Нитраты металлов растворимы в воде. Большое значение имеют нитраты как удобрения (особенно калийная и аммонийная селитры). Азотная кислота применяется для получения минеральных удобрений, взрывчатых веществ, органических красителей, пластических масс и в других многочисленных производствах.
Соединения азота (I), (II) и (IV).Для азота характерны достаточно устойчивые оксиды NО и NО2.
В лаборатории N+2О получают действием разбавленной HNO3 на медь, а в промышленности – окислением аммиака на платиновом катализаторе. В отличие от всех остальных оксидов азота NО образуется прямым взаимодействием простых веществ:
N2 + O2(2000°С, kat. Pt/MnO2) = 2NO
Оксид азота (II) – бесцветный газ, химически активное соединение; с водородом образует гремучую смесь, легко окисляется кислородом, галогенами:
2NO + O2 = 2NO2
2NO + Cl2 = 2NOCl
Диоксид азота N+4O2 – бурый газ, токсичен. Химически активен; в его атмосфере горят уголь, сера, фосфор. Жидкий и твердый диоксид азота бесцветен, состоит из молекул N2О4 (тетраоксид диазота). В лаборатории NО2 получают взаимодействием меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
и термическим разложением, ряда оксонитратов (V), так:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
Диоксид азота применяют как нитрующий агент, в частности, для получения безводных нитратов; N2О4 – окислитель ракетного топлива.
Фосфор
Фосфор в соединениях проявляет степени окисления от –3, +1, +3, +5. Наиболее характерна степень окисления +5. Для фосфора наиболее прочны связи с фтором и кислородом.
В земной коре фосфор содержится в основном в виде фосфатов (V). Наиболее распространены минералы гидроксилапатит Са5(РO4)3(ОН), фторапатит Са5(РO4)3F. Фосфор входит в состав живых организмов. Гидроксилапатит составляет минеральную часть костей, фторапатит – зубов, а сложные органические производные фосфора входят в состав нейронов.
Простые вещества. Р (фосфор) существует в нескольких аллотропных формах.
Белый фосфор состоит из молекул Р4, метастабильный, при комнатной температуре мягкий как воск, на холоде хрупкий. Плавится и кипит без разложения. Медленно окисляется на воздухе, при слабом нагревании воспламеняется в присутствии кислорода. Хорошо растворяется в сероуглероде, жидких PCl3, PBr3, NH3, S2Cl2 и SO2. Не растворяется в воде, хорошо сохраняется под слоем воды. Чрезвычайно химически активен. Энергично окисляется серной и азотной кислотами, пероксидом водорода, перманганатом калия, галогенами, халькогенами. В растворах щелочей подвергается дисмутации. Восстанавливает благородные металлы из растворов их солей. Не реагирует с азотом, углеродом. Белый фосфор чрезвычайно ядовит.
Красный фосфор состоит из полимерных молекул Рn различной длины, метастабильный. При нагревании возгоняется. Окисляется на воздухе (значительно медленнее, чем белый фосфор). Не растворяется в воде и в CS2. Химическая активность красного фосфора значительно меньше, чем белого и черного фосфора. Растворяется в расплаве свинца, из которого кристаллизуется фиолетовый фосфор состава Р8.
Черный фосфор состоит из непрерывных цепей Рn, имеет слоистую структуру, по внешнему виду похож на графит. Термодинамически устойчивый, высокоплавкий. Химически пассивный по сравнению с белым фосфором, устойчив на воздухе.
2P(красный) + 8H2O(700-900°С, kat. Pt, Cu, Ti, Zr) = 2H3PO4 + 5H2
P4 + 6H2SO4(конц.) = 4H3PO3 + 6SO2
P(красн.) + 5HNO3(конц.) = H3PO4 + 5NO2 + H2O
P4 + 6NaOH(конц.) + 4H2O = 4Na2HPO3 + 6H2
P4 + 6H2 = 4PH3
P4 + 5O2 = P4O10
4P(красн.) + 5O2 = P4O10
P4 + Cl2(комн., в жидком CS2) = PCl3 [PCl3 + Cl2(кип., в жидком CS2) = PCl5]
P4 + 6HCl = 2PH3 + 2PCl3
P4 + 10CuSO4 + 16H2O = 4H3PO4 + 10Cu + 10H2SO4
P4(белый) = 4Р(красный) [250°С, kat. I2, Na]
P4(белый) = 4Р(черный) [от комн. до 200° С, р]
4Р(красный) = P4(белый) [416°С]
4Р(черный) = P4(белый) [453°С]
Р(черный) = Р(красный) [550-560°С]
Получение и применение.В технике фосфор получают прокаливанием фосфата кальция с углем и песком в электропечах при 1500°С:
2Са3(РО4)2 + 10С + 6SiO2 = 6СаSiO3 + 10СО + P4
Основная масса красного фосфора используется в спичечном производстве.
Соединения фосфора (–III). При нагревании фосфор окисляет почти все металлы, образуя фосфиды. Фосфиды s-элементов II группы состава Э3Р2 солеподобны, легко разлагаются водой:
Мg3Р2 + 6Н2O = 3Мg(ОН)2 + 2РН3↑
Фосфиды d-элементов (обычно типа МР, МР2, М3Р) химически малоактивны; они серые или черные с металлическим блеском и электрической проводимостью.
Ковалентным фосфидом является фосфид водорода Р–3Н3 (фосфин). С водородом фосфор практически не взаимодействует. Образуется РН3 при гидролизе некоторых фосфидов, а также при диспропорционировании фосфора в щелочной среде при нагревании:
2Р40 + 3Ва(ОН)2 + 6Н2О = 3Ва(Р+1О2Н2)2 + 2РН3↑
Соединения фосфора (I). Фосфиновая кислота H[PO2H2] в водном растворе сильная одноосновная кислота. Ее соли – фосфинаты – хорошо растворимы в воде. Как кислота, так и ее соли – сильные восстановители, окисляются до оксофосфатов (V).
Фосфинаты применяют в качестве восстановителей, например, при химическом никелировании:
NiCl2 + NaPO2H2 + 2Н2О = Ni + Na3PO4 + 4НCl + Н2↑
Соединения фосфора (I) практически не проявляют окислительных свойств, но при нагревании они диспропорционируют:
H[P+1O2H2] = Р–3H3 + 2Н2[Р+3О3Н]
Соединения фосфора (III). Характеристические соединения – тригалогениды фосфора РНаl3, оксид фосфора (III) Р2О3. По химической природе бинарные соединения фосфора (III) являются кислотными, о чем свидетельствует их гидролиз:
Р2О3 + 3Н2О = 2Н2[РО3Н]
РCl3 + ЗН2О = Н2[РО3Н] + 3НCl
и характер взаимодействия с основными соединениями:
4NаОН + Р2О3 = 2Nа2[РО3Н] + Н2О
3Nа2S + Р2S3 = 2Nа3[РS3]
При гидролизе образуется фосфоновая (фосфористая) кислота Н2[РО3Н], производные иона [РО3Н]2– называются фосфонатами. Большинство из них, кроме солей s-элементов I группы, в воде растворяется плохо.
Соединения фосфора (III) – довольно сильные восстановители. Так, они восстанавливают малоактивные металлы из растворов их соединений:
HgCl2 + Н2[РО3Н] + Н2О = Н3РO4 + Нg + 2НCl
Фосфоновая кислота окисляется до фосфорной галогенами, диоксидом азота и другими окислителями. Тригалогениды окисляются фтором и хлором до РНаl5, кислородом до РОНаl3 и т. д.
Соединения фосфора (V). Фосфор проявляет степень окисления +5 в соединениях с галогенами РНаl5, кислородом Р2O5, серой Р2S5 и азотом Р3N5, в соответствующих им анионных комплексах и соединениях смешанного типа РОНаl3, РОN и др.
Пентагалогениды фосфора (V) – типично кислотные соединения. Так, они более или менее легко гидролизуются, образуя кислоты:
РCl5 + 4Н2О = Н3РO4 + 5НCl
Бинарные соединения фосфора (V) с кислородом, серой, азотом полимерны и построены из структурных единиц типа РХ4 (РО4, РS4, РN4).
Оксид фосфора (V) Р2O5 активно взаимодействует с водой. Он может отнимать воду у различных веществ; например, превращает НNО3 в N2O5 и даже H2SO4 в SO3. В качестве хорошего дегидратирующего средства оксид фосфора (V) широко используется в химическом синтезе.
Производные Р2O5 – оксофосфаты – весьма разнообразны. Так, с открытой цепью (из 2–10 атомов Р) они называются полифосфатами, циклического строения – метафосфатами, фосфаты с бесконечной открытой цепью называются полиметафосфатами.
Простейшие по составу оксофосфаты имеют формулы М3+1РО4 и М3+2(РО4)2, М4+1Р2О7 и М2+2Р2О7, М+1РО3 и М+2(РО3)2. Так, при взаимодействии СаО с Р2O5 образуются Са3(РO4)2, Са2Р2О7, Са(РО3)2.
Простейшим представителем оксофосфатов (V) водорода является Н3РO4. Все оксофосфаты водорода – твердые вещества, хорошо растворимые в воде. Их растворы являются кислотами средней силы. Ортофосфорную кислоту Н3РO4 получают взаимодействием фосфатных минералов с серной кислотой:
Са3(РO4)2 + 3Н2SO4 = 3СаSO4 + 2Н3РO4
или гидратацией оксида фосфора (V): Р2O5 + 3Н2O = 2Н3РO4
Ортофосфорная кислота – конечный продукт гидролиза всех соединений фосфора (V):
РОНаl3 + 3Н2О = Н3РO4 + 3ННаl
P2S3 + 8Н2О = 2Н3РO4 + 5Н2S
Полифосфорные кислоты образуются при взаимодействии Р2O5 с ортофосфорной кислотой.
Из оксофосфатов (V) наибольшее практическое значение имеют производные анионов РO43– (фосфаты), НРО42– (гидрофосфаты) и Н2РО4– (дигидрофосфаты). Из фосфатов растворимы лишь немногие, в частности, производные Nа+, K+, NH4+.
Основная масса фосфатов применяется в качестве удобрений. Так, Са(Н2РO4)2∙2Н2O составляет основу суперфосфата, СаНРO4∙2Н2О – преципитата. Смешанными азотнофосфорными удобрениями являются так называемые аммофос – смесь (NН4)Н2РO4 и (NН4)2НРO4 и азофоска – смесь аммофоса с KNO3.
Фосфаты в отличие от нитратов окислительные свойства не проявляют.
Соединения фосфора широко применяют в качестве удобрений, для борьбы с вредителями сельскохозяйственных культур и сорняками, в медицине, производстве пластмасс, моющих средств и др.
Подгруппа мышьяка(мышьяк, сурьма, висмут)
Степени окисления мышьяка, сурьмы и висмута равны –3, +3 и +5; для висмута наиболее характерна степень окисления +3.
Содержание в земной коре мышьяка, сурьмы и висмута сравнительно невелико. Они обычно встречаются в виде сульфидных минералов: аурипигмент As2S3, реальгар As4S4, сурьмяный блеск (антимонит) Sb2S3, висмутовый блеск (висмутин) Bi2S3, а также мышьяковый колчедан (арсенопирит) FeAsS.
Все соединения сурьмы, висмута и в особенности мышьяка ядовиты.
Простые вещества. As (мышьяк) – неметалл. Существует в трех формах: серый мышьяк (α-As) – устойчивая форма, относительно твердый, хрупкий; черный мышьяк (β-As) – аморфный, хрупкий; желтый мышьяк (γ-As) – метастабильный, мягкий (как воск) и по свойствам напоминает белый фосфор. Химическая активность γ-As выше, чем у α-As и β-As. При нагревании возгоняется, плавится под избыточным давлением. Не реагирует с водой, разбавленными кислотами. Переводится в раствор действием концентрированной азотной кислоты, «царской водки», щелочей, типичных окислителей. Реагирует с кислородом, галогенами, серой, металлами.
2As + 3H2SO4(конц., гор.) = As2O3↓ + 3SO2↑ + 3H2O
As + 5HNO3(конц.) = H3AsO4 + 5NO2 + H2O
As + 3HCl(конц.) + HNO3(конц.) = AsCl3 + NO↑ + 2H2O
2As + 2NaOH(разб., кип.) = 2NaAsO2 + 3H2↑
2As + 2KOH(разб., хол.) = 2K3AsO3 + 3H2↑
2As + 6NaOH(разб.) + 5H2O2(конц.) = 2Na3AsO4 + 8H2O
4As + 3O2 = 2As2O3
2As + 5F2 = 2AsF5
2As + 3Cl2 = 2AsCl3
As + 3M(нагр.) = M3As (M = Li, Na, K)
2As + 3M(нагр.) = M3As2 (M = Mg, Ca, Cu)
2As + M(нагр.) = MAs2 (M = Ca, Zn, Fe)
β-As(100-200°C) → α-As
γ -As(358° C или медленно на свету) → α-As
Sb (сурьма) – белый с голубым оттенком, умеренно твердый, хрупкий металл. В особых условиях выделены аллотропные модификации – желтая сурьма, черная сурьма, взрывчатая сурьма. Не реагирует с водой (при н. у.), хлоро- и фтороводородными кислотами, разбавленной серной кислотой, щелочами, гидратом аммиака, азотом, углеродом. Простых аквакатионов не образует. Реагирует с кислотами-окислителями, «царской водкой», типичными окислителями в расплаве, галогенами, халькогенами.
2Sb + 3H2O(пар, 600°C) = Sb2O3 + 3H2
2Sb + 6H2SO4(конц., хол.) = Sb2(SO4)3↓ + 3SO2↑ + 6H2O
2Sb + 10HNO3(конц.) = Sb2O5 + 10NO2↑ + 5H2O
2Sb + 18HCl(конц.) + 5HNO3(конц.) = 3H[SbCl6] + 5NO↑ + 10H2O
6Sb + 6KOH + 5KClO3(400-550°C) = 2KSbO3 +5KCl + 3H2O
4Sb + 3O2 = 2Sb2O3
2Sb + 3Cl2 = 2SbCl3 (примесь SbCl5)
2Sb + 3Э(нагр.) = Э3Sb2 (Э = S, Se, Te)
Sb + 3M(сплавление) = M3Sb (M = Li, Na, K)
2Sb + 3Mg(650°C) = Mg3Sb2
Bi (висмут) – серовато-белый (с красным оттенком), тяжелый, хрупкий металл (в виде порошка – черный). Устойчив в сухом воздухе, чувствителен к влаге (покрывается оксидной пленкой). Малореакционноспособный; не реагирует с водой, хлороводородной кислотой, щелочами, гидратом аммиака, водородом. Простых аквакатионов в растворе не образует. Пассивируется в сильноконцентрированных кислотах-окислителях. Реагирует с умеренно разбавленными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами. Сплавляется со смогими металлами.
2Bi + 6H2SO4(40%, медленно) = Bi2(SO4)3 + 3SO2 + 6H2O
Bi + HNO3(разб.) = Bi(NO3)3 + NO↑ + 2H2O
4Bi + 3O2 = 2Bi2O3
2Bi + 5F2(600° C) = 2BiF5
2Bi + 3Hal2(200° C) = 2BiHal3 (Hal = Cl, Br, I)
2Bi + 3Э(300° C) = Э3Bi2 (Э = S, Se, Te)
2Bi + 3Mg(650° C) = Mg3Bi2
Получение и применение.Для получения мышьяка, сурьмы и висмута их природные сульфиды обжигают; образующиеся при этом оксиды восстанавливают углем:
2Э2S3 + 9O2 = 6SO2 + 2Э2О3
Э2О3 + 3С = 2Э + 3СО
Мышьяк и сурьма используются главным образом в качестве добавки к свинцу для придания ему повышенной твердости. Важное значение имеет типографский сплав, содержащий 25% Sb, 60% Pb и 15% Sn.
Сплавы висмута эвтектического состава применяются в автоматических огнетушителях, в качестве припоев. Так, широко применяемый сплав Вуда (50% Вi, 25% Pb, 12,5% Sn и 12,5% Cd) плавится при 65–70°С, т. е. ниже температуры кипения воды.
Применение соединений мышьяка, сурьмы и висмута весьма разнообразно. Так, производные мышьяка в сельском хозяйстве служат одним из основных средств борьбы с вредителями культурных растений. Важное применение соединения мышьяка (As2O3, КAsO2, органические производные) находят в медицине.
Соединения мышьяка, сурьмы и висмута (–III). Солеподобные соединения – арсениды, стибиды (антимониды) и висмутиды s-элементов I и II групп (К3Э, Са3Э2, Мg3Э2 и др.). В большинстве же других случаев при взаимодействии металлов с мышьяком, сурьмой и висмутом образуются соединения металлического типа (Zn3Э2, AlAs, AlSb и др.). Большинство арсенидов, стибидов и висмутидов довольно легко разлагается кислотами.
Mg3Sb2 + 6HCl(разб.) = 2SbH3↑ + 3MgCl2
Mg3Bi2 + 6HCl(конц.) = 2BiH3↑ + 3MgCl2
В обычных условиях арсин AsH3, стибин SbH3 и висмутин BiH3 – газообразные вещества с резким запахом. При нагревании они довольно легко распадаются с образованием простых веществ. Все они – сильные восстановители.
Арсин (в меньшей степени стибин и висмутин) очень токсичен. Поскольку цинк почти всегда содержит небольшие количества мышьяка, опасно вдыхать водород, выделяющийся при действии кислот на цинк:
As2O3 + 6Zn + 12HCl = 2AsH3↑ + 6ZnCl2 + 3H2O
Соединения мышьяка (III), сурьмы (III) и висмута (III). Степень окисления +3 у мышьяка и его аналогов проявляется в галогенидах ЭНаl3, оксидах Э2О3, сульфидах Э2S3. Бинарные соединения и гидроксиды Э (III) амфотерны. Отвечающие кислотным признакам соединений Э (III) анионные комплексы имеют состав ЭНаl4–, ЭО2–, Э(ОH)4–.
В ряду однотипных соединений As (III) – Sb (III) – Bi (III) кислотные признаки ослабевают и нарастают основные.
Э2О3 получают прямым взаимодействием простых веществ, Sb2O3 – также окислением сурьмы разбавленной HNO3, а Bi2O3 – термическим разложением Bi(NO3)2.
As2O3 – преимущественно кислотный оксид; растворяется в воде и щелочах, взаимодействует также с галогеноводородными кислотами:
As2O3 + 3Н2О = 2Н3AsО3
As2O3 + 8НCl = 2НАsCl4 + 3Н2О
Оксид сурьмы (III) Sb2O3 в воде практически не растворяется, но взаимодействует со щелочами, а также с хлороводородной кислотой.
Взаимодействие As2O3 и Sb2O3 с растворами щелочей приводит к образованию соответственно гидроксоарсенитов и гидроксоантимонитов:
Э2O3 + 2КОН + 3Н2О = 2К[Э(ОН)4]
Наоборот, Bi2O3 легко взаимодействует с кислотами, образуя разнообразные соли Bi (III), в воде не растворяется, со щелочами практически не реагирует.
Аналогично изменяются свойства и в ряду гидроксидов. В водном растворе As(OH)3 ведет себя как слабая кислота Н3AsО3, называемая мышьяковистой.
Гидроксиды Sb (III) и Bi (III) в воде практически не растворяются и получаются при действии щелочей на катионные производные Э (III):
Bi(NO3)з + 3КОН = Bi(ОН)3↓ + 3КNO3
или кислот на анионные производные Э (III):
Nа[Sb(ОН)4] + НCl = NаCl + Sb(ОН)3 + Н2О
При сплавлении Э2O3 или Э(ОН)3 со щелочами обычно образуются полимерные метаарсениты и метаантимониты состава МЭО2. Метависмутиты неустойчивы.
Подобно Э2O3, сульфиды Э2S3 и галогениды As (III) – кислотные соединения, галогениды Sb (III) и Bi (III) проявляют свойства солей. При гидролизе AsHal3 образуются кислоты.
Соединения мышьяка (V), сурьмы (V) и висмута (V). Степень окисления +5 наиболее характерна для сурьмы, менее характерна для мышьяка и неустойчива у висмута. Для Bi (V) получен лишь фторид BiF5, для As (V) и Sb (V), кроме фторидов, известны оксиды Э2O5, сульфиды Э2S5, а для сурьмы (V) – еще и хлорид SbCl5.
По химической природе бинарные соединения мышьяка (V) и его аналогов кислотные. Им соответствуют анионные комплексы, простейшие из которых ЭНаl6–, ЭO43–, Э(ОН)6–.
As2O5 напоминает P2O5, довольно хорошо растворяется в воде, а Sb2O5 в воде растворим мало, лучше – в щелочных растворах:
As2O5 + 3H2O = 2H3AsO4
Sb2O5 + 2KOH + 5H2O = 2K[Sb(OH)6]
Из растворов обычно выделяются тетраоксоарсенаты типа М3+1AsO4 и гексагидроксостибаты типа М+1[Sb(OH)6]. Они, как правило, трудно растворимы в воде.
В свободном состоянии получен оксоарсенат (V) водорода H3AsO4 (мышьяковая кислота) – твердое, растворимое в воде вещество. Ее получают окислением As или As2O3 азотной кислотой. При получении сурьмяных кислот образуется осадок неопределенного состава Sb2O3∙nH2O. Не выделены в свободном состоянии и висмутовые кислоты.
Пентагалогениды – типичные кислотные соединения. При взаимодействии с водой ЭНаl5 дают кислоты, с основными галогенидами образуют галогеноарсенаты (V) и галогеностибаты (V): КF + ЭF5 = К[ЭF6]
Соединения висмута (V) – сильные окислители. Так, переводят Мn (II) в Мn (VII):
10NaBiO3 + 16H2SO4 + 4MnSO4 = 5Bi2(SO4)3 + 4HMnO4 + 5Na2SO4 + 14H2O
Производные сурьмы (V) окислительные свойства проявляют в меньшей степени, однако Sb2O5 может окислять концентрированную хлороводородную кислоту по обратимой реакции: Sb2O5 + 10НCl ↔ 2SbCl3 + 2Cl2 + 5Н2О
Подгруппа ванадия(ванадий, ниобий, тантал, дубний)
Ванадий в соединениях имеет степень окисления +2, +3, +4 и +5. Для ниобия и тантала наиболее устойчива высшая степень окисления, т. е. +5. Высшая степень окисления ванадия стабилизируется в фторо- и оксопроизводных.
Ванадий в земной коре более распространен, чем медь, цинк и свинец, но его соединения редко встречаются в виде крупных месторождений. Ванадий относится к рассеянным элементам; содержится в железных рудах, высокосернистых нефтях. Наиболее важные его минералы – патронит VS2, ванадинит Pb5(VО4)3Cl. Ниобий и тантал почти всегда встречаются совместно, чаще всего в составе ниобат-танталатовых минералов типа М+2Э2О6 (М = Fe, Mn). При преобладании тантала минерал М(ТаО3)2 называется танталатом, а ниобия – колумбитом M(NbO3)2.
Простые вещества. V (ванадий) – светло-серый, ковкий металл (в присутствии VN и VC – очень твердый и хрупкий). Не тускнеет во влажном воздухе. В виде тонкодисперсного порошка пирофорен. Не реагирует с водой, разбавленными кислотами и щелочами, гидратом аммиака. В растворе V2+ имеет фиолетовую окраску, V3+ – сине-зеленую, VО2+ – синюю и VО2+ – красную. Реагирует с концентрированной серной и азотной кислотами, «царской водкой», фтороводородной кислотой, водородом, кислородом, галогенами, серой, азотом, фосфором, углеродом, аммиаком.
V + 3H2SO4(конц., гор.) = (VO)SO4 + 2SO2 + 3H2O
V + 6HNO3(конц., гор.) = (VO2)NO3 + 5NO2 + 3H2O
3V + 12HCl(конц.) + 4HNO3(конц.) = 3VCl4↓ + 4NO↑ + 8H2O
4V + 4NaOH(к) + 5O2(500-650°C) = 4NaVO3 + 2H2O
2V + 5F2(300°C) = 2VF2
V(порошок) + 2Cl2(200-350°C) = VCl4
V + P(красный; 500°C) = VP, VP2, V2P, V3P
V + C(графит; 1300°C) = VС, С2P
Nb (ниобий) – светло-серый, мягкий, пластичный, тугоплавкий, коррозионно-стойкий металл (хрупкий в присутствии NbN). При нагревании на воздухе покрывается защитной оксидной пленкой. Не реагирует с водой, разбавленными кислотами и щелочами, гидратом аммиака. Пассивируется в концентрированной серной и азотной кислотах. Реагирует с концентрированной фтороводородной кислотой, щелочами при кипячении, кислородом, галогенами, водородом.
2Nb + 12HF(конц.) = 2H[NbF6] + 5H2↑
4Nb + 4NaOH + 5O2(500-700°C) = 4Na3NbO4 + 6H2O
Nb + H2 = NbH2
2Nb + 5O2 = 2Nb2O5
2Nb + 5Hal2(нагр.) = 2NbHal5 (Hal = F, Cl)
Та (тантал) – серый, мягкий, пластичный, тугоплавкий, коррозионно-стойкий металл (хрупкий в присутствии ТаН). При нагревании на воздухе покрывается защитной оксидной пленкой. Не реагирует с водой, разбавленными кислотами и щелочами, гидратом аммиака. Медленно реагирует с концентрированной фтороводородной кислотой, концентрированными щелочами при кипячении. Реагирует с кислородом, галогенами, водородом.
2Ta + 16HF(конц.) = 2H3[TaF8] + 5H2↑
2Ta + 2NaOH(конц., кип.) + 4H2O = 2(NaTa)O3↓ + 5H2↑
4Ta + 5O2(выше 600°C) = 2Ta2O5
2Ta + 5Hal2(нагр.) = 2TaHal5 (Hal = F, Cl)
Db (дубний) – радиоактивный металл; наиболее долгоживущий изотоп 262Db (Т½ = 34 сек.). Химический аналог тантала, характерная степень окисления +5. Химические свойства мало изучены. До 1997 г. имел название и символ нильсборий Ns.
Получение и применение.Для получения ванадия, ниобия и тантала их природные соединения переводят в оксиды либо в простые или комплексные галогениды, которые далее восстанавливают металлотермическим методом:
V2О3 + 3Са = 3СаО + 2V
K2[NbF7] + 5Na = 2KF + 5NaF + Nb
Ниобий и тантал получают также электролизом Э2О5 в расплавленных комплексных фторидах, например, K2[TaF7], K2[NbF7]. Первые ядра дубния были синтезированы бомбардировкой америция-243 ядрами неона-22.
Для технических целей (в основном в черной металлургии) обычно выплавляют феррованадий, феррониобий и ферротантал. V, Nb и Та используют при создании атомных реакторов и как конструкционные материалы для особо агрессивных сред в химической промышленности.
Металлические и металлоподобные соединения. Порошкообразные V, Nb и Та абсорбируют значительные количества H2, O2, N2, образуя твердые растворы внедрения.
С металлами подгрупп железа, титана и хрома они образуют металлические твердые растворы. Интерметаллические соединения ванадия и его аналогов придают сплавам ценные физико-химические свойства. Так, ванадий резко повышает прочность, вязкость и износоустойчивость стали. Ниобий придает сталям повышенную коррозионную стойкость и жаропрочность.
Соединения ванадия (II). Из производных элементов подгруппы ванадия со степенью окисления +2 относительно более устойчивы соединения ванадия.
Оксид ванадия (II) VO получают восстановлением V2O5 в токе водорода. С водой VO не взаимодействует, но как оснóвное соединение легко реагирует с разбавленными кислотами:
VO + 2HCl + 5Н2O = [V(H2O)6]Cl2
Соединения V(II) – сильные восстановители. В отсутствие окислителей (например, кислорода воздуха) растворы соединений V(II) постепенно разлагают даже воду с выделением водорода.
Соединения ванадия (III).По структуре соединения V (III) аналогичны однотипным производным Аl(III). Так, V2O3, V(OH)3 – амфотерны, но с преобладанием оснóвных свойств.
V2O3 + 6HCl + 3Н2O = [V(H2O)6]Cl3
Производные ванадия (III) – сильные восстановители; в растворах они довольно легко окисляются кислородом воздуха до производных V (IV). Тригалогениды при нагревании диспропорционируют: 2VCl3 = VCl2 + VCl4↑
Соединения ванадия (IV).При обычных условиях степень окисления +4 для ванадия наиболее характерна. Соединения V (III)довольно легко окисляются до производных V (IV) кислородом, а соединения V (V) восстанавливаются до производных V (IV).
Из производных V(IV) известны VO2, (VO1,8-2,17), VF4 и VCl4, а также оксогалогениды типа VOHal2. Диоксид VO2 образуется при восстановлении V2O5 водородом, a VCl4 – при окислении ванадия (или феррованадия) хлором.
Бинарные соединения V (IV) проявляют амфотерные свойства. Так, нерастворимый в воде VО2 относительно легко взаимодействует при нагревании со щелочами с образованием оксованадатов (IV) бурого цвета, чаще всего состава М2+1[V4О9]:
4VO2 + 2KOH = K2[V4O9] + Н2O
Еще легче VО2 растворяется в кислотах. При этом образуются аквапроизводные оксованадила VО2–:
VО2 + 2НCl + 4Н2О = [VO(H2O)5]Cl2
Тетрагалогениды ванадия легко гидролизуются. Так, в воде VCl4 мгновенно переходит в VOCl2 (дихлорид ванадила):
VCl4 + Н2O = VOCl2 + 2HCl
Для ниобия и тантала известны диоксиды ЭO2, тетрагалогениды ЭНаl4.
Соединения ванадия (V), ниобия (V), тантала (V).Для ванадия (V) известны лишь оксид V2O5 и фторид VF5, тогда как дляниобия (V) и тантала (V) известны и все другие галогениды ЭHal5, а также анионные комплексы [ЭF6]–, [ЭO4]3–, [ЭO3]–. Эти соединения типично кислотные. Для Э (V), кроме того, характерны оксогалогениды типа ЭOНаl3.
Производные ванадия (V) в кислой среде проявляют окислительные свойства, например окисляют концентрированную хлороводородную кислоту:
V2О5 + 6НС1 = 2VОC12 + Cl2 + 3Н2О
Для перевода же ниобия (V) и в особенности тантала (V) в более низкие степени окисления требуются энергичные восстановители и нагревание.
Соединения ванадия используются в химической промышленности в качестве катализаторов (в производстве серной кислоты), а также применяются в стекольной и других отраслях промышленности.
Глава 17. ЭЛЕМЕНТЫ VI ГРУППЫ
VIА-группа (халькогены): кислород О 2s22p4, сера S 3s23p4 и элементы подгруппы селена – селен Se 4s24p4, теллур Те 5s25p4, полоний Ро 6s26p4.
VIВ-группа (подгруппа хрома): хром Cr 3d54s1, молибден Мо 4d55s1, вольфрам W 5d46s2.
Кислород
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Степень окисления кислорода в подавляющем… Кислород – самый распространенный элемент на Земле, неметалл. Природный… Простые вещества. О2 (дикислород) – бесцветный газ, в жидком состоянии светло-голубой, в твердом – синий. Плохо…Сера
Сера по электроотрицательности уступает только галогенам, кислороду и азоту. Наиболее устойчивы степени окисления серы –2, +2, +4, +6.
Сера весьма распространенный на Земле элемент, она содержится в нефти, углях, природных газах. Сера – биогенный элемент, входит в состав белков.
Известны соединения серы почти со всеми элементами. В природе сера встречается в виде сульфидных (ZnS, HgS, PbS, Cu2S, FeS2, CuFeS2 и др.) и сульфатных (Na2SO4∙10H2O, СаSO4∙2Н2О и др.) минералов, а также в самородном состоянии.
Простые вещества. S (сера) – типичный неметалл, существует в двух аллотропических модификациях (ромбическая α-сера, моноклинальная β-сера) и в аморфной форме (пластическая сера). В кристаллическом состоянии построена из неплоских циклических молекул S8. Не реагирует с жидкой водой, иодом. В воде сера практически нерастворима. Окисляется концентрированной серной и азотной кислотами, подвергается дисмутации в растворах щелочей и гидрата аммиака. Реагирует с металлами, водородом, кислородом, галогенами.
S + 2H2SO4(конц., кип.) = 3SO2↑ + 2H2O
S + 6HNO3(конц., кип.) = H2SO4 + 6NO2↑ + 2H2O
4S + 6NaOH(конц., кип.) = Na2SO3S + 2Na2S + 3H2O
S + Cl2 = SCl2
3S + 2Al = Al2S3
Получение и применение серы.Основной способ получения серы – выплавка их самородных руд. Сера применяется в производстве серной кислоты, для вулканизации каучука, как инсектицид в сельском хозяйстве и т. д.
Соединения серы (–II). Важнейшим характеристическим соединением серы –2 является сероводород H2S (сульфид водорода) – бесцветный газ с неприятным запахом, очень токсичен. Его водный раствор – слабая сероводородной кислота. Для ее получения обычно используют реакция вытеснения H2S из сульфида железа хлороводородной кислотой:
FeS + 2HCl = FeCl2 + H2S
Соли сероводородной кислоты – сульфиды, как производные низшей степени окисления серы, они проявляют восстановительные свойства. В зависимости от условий продуктами окисления сульфидов могут быть S, SO2 и Н2SO4:
2КMn+7O4 + 5Н2S–2 + 3Н2SO4 = 2Mn+2SO4 + 5S0 + К2SO4 +8Н2О
Н2S–2 + 4Br20 + 4Н2О = Н2S+6O4 + 8HBr–1
Сульфиды металлов разнообразны, многие из них являются соединениями переменного состава.
Персульфиды. В персульфидах (полисульфидах) типа Me2+1Sn–2 сера образует гомоцепи, так например: Na–S–S–S–Na.
Получены многочисленные персульфиды водорода типа Н2Sn (где п = 2–23), называемые многосернистыми водородами или сульфанами.
Широко распространенный минерал пирит FeS2 представляет собой персульфид железа (II).
Соединения серы (IV).Степень окисления +4 у серы проявляется в тетрагалогенидах SHal4, оксодигалогенидах SOHal2, диоксиде SO2, также в отвечающих им анионах. Химический характер бинарных соединений серы (IV) кислотный.
В промышленности диоксид серы SO2 (сернистый газ) получают сжиганием серы и обжигом пирита:
4FeS2 + 11O2 = 8SO2↑ + 2Fe2O3
Диоксид серы хорошо растворяется в воде. Водный раствор SO2 называют сернистой кислотой H2SO3. Соли сернистой кислоты – сульфиты и гидросульфиты, получают взаимодействием SO2 с щелочами или растворимыми карбонатами металлов:
NaOH + SO2 = NaHSO3; 2NaOH + SO2 = Na2SO3
В силу нестабильности степени окисления +4 SO2, H2SO3 и сульфиты функционируют как восстановители. Даже твердые сульфиты при хранении медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
При повышенной температуре и в присутствии катализатора SO2 окисляется до оксида серы (VI):
2SO2 + О2 = 2SO3
При взаимодействии же с более сильными восстановителями производные серы (IV) проявляют окислительные свойства:
SO2 + 2H2S = 3S + 2H2O
При нагревании сульфиты диспропорционируют:
4Na2SO3 = 3Na2SO4 + Na2S
Соединения серы (VI). Степень окисления серы +6 проявляется в соединениях с наиболее электроотрицательными элементами: в гексафториде SF6, триоксиде SO3, оксо- и диоксодигалогенидах SOF4, SO2Hal2, а также в анионных комплексах SO3Hal–, SO42–.
Большинство оксогалогенидов и SO3 легко гидролизуется, образуя кислоты:
SO3 + Н2О = Н2SO4
SO2Cl2 + 2Н2О = Н2SO4 + 2НCl
Водный раствор тетраоксосульфата (VI) водорода Н2SO4 – сильная серная кислота. Взаимодействие Н2SO4 с водой сопровождается выделением большого количества теплоты за счет образования гидратов, поэтому смешивать концентрированную серную кислоту с водой следует очень осторожно, вливая серную кислоту тонкой струйкой в воду, а не наоборот.
Концентрированная серная кислота – сильный окислитель, в зависимости от силы восстановителя она может быть восстановлена до SO2, S и H2S.
Серная кислота используется в производстве кислот, щелочей, солей, минеральных удобрений, органическом синтезе, травления металлов, очистки нефтяных масел и продуктов коксохимической промышленности и т. д.
Большинство сульфатов хорошо растворимы в воде (кроме BaSO4, SrSO4, PbSO4), из водных растворов выделяются в виде кристаллогидратов. Соединения типа CuSO4∙5H2O, FeSO4∙7Н2O называются купоросами.
Сульфаты щелочных и щелочно-земельных металлов термически стойки; сульфаты менее активных металлов при нагревании разлагаются, так:
ZnSO4 = ZnO +SO3↑
Ag2SO4 = 2 Ag + SO2↑ + O2↑
При кипячении раствора сульфита натрия с порошком серы образуется сульфидотриоксосульфат (VI) натрия:
Na2S+4O3 + S0 = Na2S+6O3S–2
Свойства сульфидотриоксосульфатов (тиосульфатов) обусловливаются присутствием атомов серы в двух разных степенях окисления (+6 и –2). Наличие атома серы со степенью окисления –2 определяет восстановительные свойства SO3S2–-иона:
Na2SO3S–2 + Cl20 + Н2О = Na2SO4 + S0↓ + 2HCl–1
При растворении SO3 в концентрированной серной кислоте образуется целая серия полисерных кислот: H2S2O7 (дисерная кислота), H2S3O10 (трисерная кислота) и др. Смесь серной и полисерных кислот – олеум.
Взаимодействием хлорсульфоновой кислоты с пероксидом водорода получают пероксосерные кислоты:
2HSO3Cl + H2O2(безводн.) = H2S2O6(O2) + 2HCl
Подгруппа селена(селен, теллур, полоний)
Степень окисления в соединениях у селена и его аналогов –2, +2, +4, +6.
Селен и теллур – рассеянные неметаллы, а полоний – редкий металл. Собственные минералы селена и теллура встречаются редко. Чаще всего Se и Те сопутствуют самородной сере и в виде селенидов и теллуридов присутствуют в сульфидных минералах меди, цинка и свинца. Полоний содержится в урановых и ториевых минералах как продукт распада радиоактивного ряда урана.
Многие соединения селена и теллура токсичны. Полоний еще опаснее ввиду его радиоактивности.
Простые вещества. Se (селен) – типичный неметалл. Существует в виде модификаций: устойчивая – серый (металлический) α-Se и неустойчивая – красный β-Se, а также известен аморфный Se (окраска серая или красная), в особых условиях получен темно-желтый коллоидный селен. Не реагирует с жидкой водой, хлороводородом, иодом. Реагирует с концентрированными серной (кроме β-Se) и азотной кислотами, щелочами, водородом, галогенами, металлами.
Se + 2H2SO4(конц., кип.) = SeO2↓ + 2SO2↑ + 2H2O
Se + 2Cl2 = SeCl4
Se + О2 = SeО2
Se + Н2 = Н2Se
3Se + 2Al = Al2Se3
Те (теллур) – серый металл с металлическим блеском. Не реагирует с водой, хлороводородом, серой, азотом. Реагирует с концентрированными кислотами-окислителями и щелочами, атомным водородом, кислородом, галогенами, металлами.
Ро (полоний) – мягкий серебристо-белый металл. Радиоактивен. Не реагирует с водой, гидратом аммиака, азотом. Не образует катионов в растворе. Проявляет окислительно-восстановительные свойства; реагирует с кислотами, щелочами при спекании, кислородом, атомным водородом, галогенами, металлами. Полоний, в отличие от Se и Те, реагирует с соляной кислотой как типичный металл:
Ро + 2НCl = РоCl2 + Н2↑
Получение и применение.Селен и теллур получают из отходов цветной металлургии (при электролитическом рафинировании меди с медного анода осаждается шлам, который наряду с благородными металлами содержит селен и теллур) и из отходов производства серной кислоты (пыль каналов и пылевых камер содержит селен и теллур). При извлечении селена и теллура из этих источников их окисляют и образующиеся при этом SeO2 и ТеO2 разделяют и восстанавливают диоксидом серы:
SeO2 + 2SO2 + 2H2O = Se + 2H2SO4 или SeO2 + 2SO2 = Se + 2SO3
Полоний получают в атомных реакторах бомбардировкой висмута нейтронами.
Как полупроводники селен и теллур используются для изготовления фотоэлементов оптических и сигнальных приборов. Кроме того, селен используют для получения стекол рубинового цвета и др. Соединения селена и теллура используются в химическом синтезе, в частности, для получения разнообразных селен- и теллурорганических соединений. Изотоп 210Ро применяют как источник α-частиц. Селениды и теллуриды – полупроводники.
Соединения селена, теллура и полония (–II). У селена, теллура и полония степень окисления –2 проявляется соответственно в селенидах, теллуридах и полонидах – соединениях с менее электроотрицательными, чем они сами, элементами (проявляется аналогия элементов селена и теллура с кислородом и серой).
Селенид и теллурид водорода можно получить действием воды или кислот на селениды и теллуриды некоторых металлов:
Al2Те3 + 6Н2О = 2Al(ОН)3 + 3Н2Те↑
Растворы в воде Н2Sе и Н2Те – слабые кислоты (селеноводородная и теллуроводородная).
Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО2, тетрагалогенидах ЭНаl4, оксодигалогенидах ЭОНаl, а также в соответствующих им анионных комплексах, например типа ЭО32–, ЭНаl62–. Для полония (IV), кроме того, характерны солеподобные соединения типа Ро(SO4)2, Ро(NO3)4.
Диоксиды селена и его аналогов ЭО2 – полимерные соединения (в отличие от серы). В ряду SеO2–ТеO2–РоO2 наблюдается ослабление кислотных свойств. Так, SеO2 легко растворяется в воде, образуя селенистую кислоту Н2SеО3:
SеO2 + Н2О = Н2SеО3
ТеО2 в воде не растворяется, но взаимодействует с растворами щелочей. РоО2 с щелочами реагирует только при сплавлении, а с кислотами взаимодействует как оснóвный оксид:
РоО2 + 2Н2SО4 = Ро(SО4)2 + 2Н2O
Тетрагалогениды образуются при взаимодействии простых веществ. Будучи кислотными соединениями, ЭНаl4 довольно легко гидролизуются и взаимодействуют с оснóвными галогенидами:
SеCl4 + 3Н2О = Н2SеО3 + 4НCl
2КI + ТеI4 = К2[ТеI6]
2КCl + РоCl4 = К[PoCl6]
Соединения селена (VI), теллура (VI) и полония (VI). Для селена (VI) и теллура (VI) известны бинарные соединения с кислородом и фтором, а также соответствующие им анионы. Соединения полония (VI) неустойчивы.
SeO3 получают действием на селенаты (VI) триоксидом серы, а ТеО3 – обезвоживанием гексаоксотеллурата (VI) водорода:
К2SеО4 + SO3 = К2SО4 + SеO3; Н6ТеО6 = ТеО3 + 3Н2О
SeO3 энергично взаимодействует с водой, образуя сильную селеновую кислоту Н2SеО4:
SeO3 + Н2О = Н2SеО4
Н2SеО4 – более сильный окислитель, чем Н2SО4, так, она окисляет концентрированную хлороводородную кислоту и за счет выделения атомного хлора – смесь Н2SеО4 и HCl – сильнейший окислитель, которая растворяет золото и платину:
Н2Sе+6О4 + 2НCl ↔ Н2Sе+4О3 + Cl2↑ + Н2О
Слабая теллуровая кислота Н6ТеО6 образуется при гидролизе гексафторида теллура TeF6:
TeF6 + 6H2O = Н6ТеО6 + 6HF
Окислительные свойства у Н6ТеО6 выражены слабее, чем у Н2SеО4.
Подгруппа хрома (хром, молибден, вольфрам)
Характерные степени окисления хрома +3 и в меньшей мере +6; для молибдена и вольфрама наиболее характерна высшая степень окисления +6. Возможны также соединения, где хром и его аналоги проявляют степени окисления 0, +1, +2, +4, +5.
В природе хром и вольфрам находятся в виде соединений с кислородом, а молибден – с серой. Наиболее распространенными минералами являются FeО∙Cr2О3 – хромистый железняк, PbCrO4 – крокоит, MoS2 – молибденит, CaWО4 – шеелит, (Fe, Mn)WО4 – вольфрамит.
Наличие в почве следов молибдена необходимо для каталитической фиксации атмосферного азота растений, особенно у видов семейства бобовых.
Простые вещества. Cr (хром) – серый, очень твердый, тугоплавкий металл. На воздухе покрыт тонкой оксидной пленкой. Не реагирует с холодной водой, щелочами, гидратом аммиака. Пассивируется в концентрированной и разбавленной азотной кислоте, «царской водке». Реагирует с серой, азотом, разбавленными хлороводородной и серной кислотами, расплавами KClO3, KNO3. Медленно окисляется кислородом воздуха при нагревании, быстро – галогенами.
Мо (молибден) – светло-серый, достаточно твердый, пластичный металл. Устойчив на воздухе. Не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака, водородом, иодом. Пассивируется дымящей азотной кислотой. Реагирует с водяным паром, концентрированными серной и азотной кислотами, при сплавлении – со щелочами на воздухе, кислородом, галогенами, серой, моно- и диоксидом углерода, сероводородом.
W (вольфрам) – светло-серый, очень твердый и наиболее тугоплавкий из всех металлов. Устойчив на воздухе. Мало реакционноспособный; не реагирует с водой, разбавленными и концентрированными кислотами (кроме смеси азотной и фтороводородной кислот), щелочами, гидратом аммиака, водородом, иодом. Реагирует с кислородом, галогенами, серой, углеродом, сероводородом, моно- и диоксидом углерода.
Получение и применение. В чистом виде хром получают с помощью алюмотермии; молибден и вольфрам методом водородного восстановления из оксидов.
Cr2O3 + 2Al = 2Cr + Al2O3
MoO3 + 3H2 = Mo + 3H2O
WO3 + 3H2 = W + 3H2O
В металлургии при карботермическом восстановлении совместно с железными рудами получают обычно феррометаллы (феррохром, ферромолибден, ферровольфрам), которые используются для получения высококачественных специальных сталей.
Хром легко пассивируется и используется в качестве гальванических защитных покрытий и для получения коррозионно стойких сталей. Молибден применяют для изготовления химической аппаратуры, вольфрам – в электротехнической промышленности (в частности, для ламп накаливания). Молибден и вольфрам используют в качестве катализаторов.
Из производных хрома и его аналогов применяются главным образом соединения самого хрома. Так, Cr2O3 используется для приготовления красок и как катализатор, CrО3 – для электролитического получения хрома и хромированных изделий.
Соединения хрома (0), молибдена (0), вольфрама (0).Для хрома и его аналогов известны гексакарбонилы Э(СО)6 – бесцветные легко возгоняющиеся твердые вещества, хорошо растворимые в органических растворителях. Термическим разложением карбонилов получают чистейшие металлы. Кроме того, их используют в химическом синтезе. Они очень токсичны.
Соединения хрома (II). Известно лишь небольшое число соединений, в частности, дигалогениды CrНаl2, CrO, Cr(ОН)2, которые проявляют практически лишь оснóвные свойства, взаимодействуя с кислотами:
Cr(OH)2 + 2HCl + 4Н2O = [Cr(Н2О)6]2+Cl2
Дигалогениды довольно легко поглощают газообразный аммиак, образуя аммиакаты, так: Cr(OH)2 + 6NH3 = [Cr(NH3)6]Cl2
Соединения Cr (II) получают восстановлением соединений Cr (III), например водородом в растворе в момент выделения, или нагреванием в атмосфере Н2. Дигалогениды можно получить также взаимодействием металла с газообразными галогеноводородами (при 600–700 °С).
Кластерные соединения. Для d-элементов характерны соединения, в которых содержатся группировки из двух и большего числа непосредственно связанных друг с другом атомов d-элементов, такие группировки называют кластерами. Известные в настоящее время кластерные соединения делят на два больших класса: 1) низшие галогениды и оксиды и 2) многоядерные карбонилы.
Так, молекуле МоСl2 отвечает формула [Мо6Cl8]Cl4 с ковалентными связями Мо–Мо. Аналогичное шестиядерное строение кластеров имеют МоBr2, WCl2, WBr2. К двухъядерным кластерам относится ион [Мо2Сl8]4+.
Соединения кластерного типа также весьма характерны для Nb, Ta, Tc и Re.
Соединения хрома (III).Степень окисления хрома +3 является наиболее устойчивой и проявляется в галогенидах CrHal3, солях ряда кислородсодержащих кислот, оксидах Cr2О3, FeCr2O4, гидроксиде Cr(OH)3, катионных и анионных комплексах.
Оксид хрома (III) Cr2О3 – порошок темно-зеленого цвета, нерастворимый в воде, кислотах и растворах щелочей.
(NH4)2Cr2O7 = Cr2O3 + N2↑ + H2O
При высокой температуре проявляет амфотерные свойства. При сплавлении Cr2О3 со щелочами и соответствующими основными оксидами образуются оксохроматы (III), называемые хромитами:
2КОН + Cr2О3 = 2КCrО2 + Н2О
Осаждаемый из растворов серо-голубой гидроксид Cr(ОН)3 имеет переменный состав Cr2О3∙nН2О.
Cr2(SO4)3 + 6NaOH(разб.) = Cr(OH)3↓ + 3Na2SO4
Гидроксид хрома (III) обладает амфотерными свойствами:
Cr(ОН)3 + 3HCl + 3H2O = [Cr(Н2О)6] Cl3 (оснóвные свойства)
Cr(ОН)3 + 3NaОН = Na3[Cr(ОН)6] (кислотные свойства)
Соединения хрома (VI), молибдена (VI), вольфрама (VI). Степень окисления +6 у хрома и его аналогов проявляется в галогенидах, оксогалогенидах,оксидах и отвечающих им анионных комплексах.
Триоксид хрома CrО3 в отличие от МоО3 и WO3 легко растворяется в воде, образуя сильную хромовую кислоту Н2CrO4:
Н2О + CrО3 = Н2CrO4
Кислотная природа МoО3 и WO3 проявляется при растворении в щелочах:
2КОН + ЭО3 = К2ЭО4 + Н2О
Для Mo (VI) и W (VI) известны многочисленные производные полимерных оксоанионов весьма сложного состава и строения. Способность к полимеризации иона CrО2– менее выражена, тем не менее известны, например, К2Cr2О7 – дихромат, К2Cr3О10 – трихромат, CrCr4О13 – тетрахромат. Полихроматы образуются при действии кислот на хроматы, так:
2К2CrО4 + 2Н2SO4(разб.) = К2Cr2О7 + K2SO4 + Н2O
3К2Cr2О7 + 2Н2SO4(разб.) = 2К2Cr3О10 + K2SO4 + Н2O и т. д.
При действии раствора концентрированной серной кислотой выделяются темно-красные кристаллы триоксида:
К2CrО4 + H2SО4 = CrО3 + K2SО4 + Н2О
Если же действовать на растворы полихроматов щелочью, процесс идет в обратном направлении и получается снова хромат. Равновесие очень подвижно.
Из оксохроматов (VI) наибольшее значение имеют соли Na+ и К+, получаемые сплавлением Cr2О3 или хромистого железняка с соответствующими карбонатами на воздухе.
Соединения хрома (VI) – сильные окислители, переходят в окислительно-восстановительных процессах в производные Cr (III) в зависимости от среды, так:
в нейтральной – Na2Cr2О7 + 3(NH4)2S + Н2О = 2Cr(ОН)3↓ + 3S + 6NH3 + 2NaОH
в кислой – Na2Cr2О7 + 3Na2SO3 + 4Н2SO4 = Cr2(SO4)3 + 4Na2SO4 + 4Н2O
в щелочной – Na2Cr2О7 + 3(NH4)2S + 4NaОН + Н2О = 2Na3[Cr(OH)6] + 3S + 6NH3
Окислительная способность соединений хрома (VI) используется в химическом анализе и синтезе. Окислительные свойства производных Мо (VI) и W (VI) проявляются лишь при взаимодействии с наиболее сильными восстановителями, например, с водородом в момент выделения.
Глава 18. ЭЛЕМЕНТЫ VII ГРУППЫ
VIIА-группа (галогены): фтор F 2s22p5, хлор Cl 3s23p5 и элементы подгруппы брома – бром Br 3d104s24p5, иод I 4d105s25p5, астат At 5d106s26p5.
VIIВ-группа (подгруппа марганца): марганец Mn 3d54s2, технеций Tc 4d55s2, рений Re 4f145d56s2.
Фтор
Фтор – самый электроотрицательный элемент системы (4,0), неметалл. В химии фтора представлено только две степени окисления: 0 и –1. Поэтому он только окислитель, восстановителем быть не может.
Довольно распространен в природе. Наиболее важными минералами фтора являются плавиковый шпат (флюорит) CaF2, криолит Na3AlF6 и фторапатит 3Ca3(PO4)2∙CaF2. Фтористые соединения содержатся в организме человека (в основном в зубах и костях).
Простое вещество. F2 (дифтор) – светло-желтый газ с резким специфическим запахом. Растворяется в жидком HF.
Фтор – сильнейший окислитель, химически взаимодействует почти со всеми веществами, в том числе и тяжелыми благородными газами.
X2 + F2 = XeF2
С кислородом фтор реагирует при низких температурах в электрических разрядах с образованием фторидов кислорода. Углерод, кремний, фосфор, сера и другие неметаллы, а также большинство металлов воспламеняются в атмосфере фтора при 20–300°С с образованием соответствующих фторидов. Фтор при обычных условиях энергично реагирует с водой, кислотами, щелочами, аммиаком.
Н2О + F2 = 2НF + О0
Получение и применение фтора. Свободный фтор получают электролизом его расплавленных соединений. Контейнеры и изделия для работы с фтором изготавливают из нержавеющей стали, никеля, меди или алюминия (образуются защитные пленки из фторидов соответствующих металлов, предохраняющие от коррозии).
Фтор применяют для разделения изотопов урана диффузионным методом, для синтеза различных хладагентов и полимерных материалов (фторопластов), отличающихся высокой химической стойкостью. Жидкий фтор и ряд его соединений применяют в качестве окислителей ракетного топлива.
Соединения фтора (–I). Многие фториды металлов в низких степенях окисления получают действием раствора НF на оксиды, гидроксиды, карбонаты и пр., например:
3НF + Al(ОН)3 = AlF3 + 3H2O
Большинство кристаллических фторидов нерастворимо в воде. Хорошо растворяются лишь фториды s-элементов I группы (кроме Li), а также AgF, HgF2, SnF2 и некоторые другие. По химической природе ионные фториды являются оснóвными соединениями, а ковалентные фториды – кислотными.
2NaF + SiF4 = Nа2[SiF6]
Амфотерные фториды взаимодействуют как с оснóвными, так и с кислотными фторидами:
2КF + ВеF2= К2[ВеF4]
ВеF2 + SiF4 = Ве[SiF6]
Комплексные фториды весьма разнообразны.
Оснóвные фториды при гидролизе создают щелочную среду, а кислотные фториды – кислотную:
SiF4 + 3H2O = H2SiO3 + 4НF
Водный раствор HF – фтороводородная (плавиковая) кислота, представляет собой кислоту средней силы в отличие от остальных сильнейших галогеноводородных кислот (из-за склонности молекул к ассоциации за счет водородных связей). В промышленности фтороводород HF получают реакцией вытеснения из CaF2 концентрированной серной кислотой.
CaF2 + H2SO4(конц.) = CaSO4 + 2HF
Фтороводородную кислоту хранят не в стеклянной посуде (т. к. она взаимодействует с SiO2), а в сосудах из свинца, каучука, полиэтилена или парафина. Она токсична, при попадании на кожу вызывает плохо заживающие болезненные язвы.
Хлор
Хлор характеризуется меньшей неметаллической активностью по сравнению с фтором. При взаимодействии атомов хлора между собой и с другими элементами хлор проявляет степени окисления –1, 0, +1, +3, +5, +6 и +7.
Хлор относится к довольно распространенным на Земле элементам; основные минералы: каменная соль NаCl, сильвинит NаCl∙КCl, карналлит КСl∙MgSO4∙3H2O. Кроме того, в огромном количестве хлориды содержатся в морской воде, входят составной частью во все живые организмы и пр.
Простое вещество. Cl2 (дихлор) – желто-зеленый ядовитый газ с резким раздражающим запахом, термически устойчив. При насыщении хлором охлажденной воды образуется твердый клатрат (Cl2∙8H2O). Хорошо растворяется в воде, в большей степени подвергается дисмутации («хлорная вода»). Растворяется в CCl4, SiCl4 и TiCl4. Реагирует со щелочами. Сильный окислитель; энергично реагирует с металлами и неметаллами (за исключением О2, N2 и благородных газов), легко окисляет многие сложные соединения. Восстановительные свойства хлор проявляет лишь при взаимодействии с фтором. Хлор хранят и транспортируют в стальных баллонах, т. к. при обычных условиях хлор не реагирует с железом.
Получение и применение хлора. В лаборатории хлор получают химическим окислением концентрированной хлороводородной кислоты; в технике – электролизом водного раствора NаCl и как побочный продукт при получении натрия электролизом расплава NаCl. Хлор применяют для стерилизации питьевой воды, используют в качестве окислителя в разнообразных отраслях химической промышленности. Важна его роль в металлургии цветных металлов.
Хлороводородная кислота HCl широко применяется в технике, медицине, лабораторной практике; она входит в состав желудочного сока.
Бертолетову соль КСlO3 используют в производстве спичек и смеси для фейерверков; в смеси с восстановителями образуют легко взрывающиеся составы.
Соединения хлора (–I). Хлориды получают хлорированием простых веществ и оксидов хлором или сухим хлоридом водорода:
2Fе + 3Cl2 = 2FеCl3
Fе + 2НCl(г) = FеCl2 + Н2↑
TiO2 + 2Cl2 + С = TiCl4 + СО2↑
Оснóвные хлориды (хлориды металлов или ионные хлориды) гидролизу практически не подвергаются, а кислотные (хлориды неметаллов или ковалентные хлориды) гидролизуются полностью и необратимо с образованием кислот:
SiCl4 + 3Н2О = Н2SiO3 + 4НCl
Большинство хлоридов металлов хорошо растворимо в воде (за исключением AgCl, CuCl, AuCl, TlCl и PbCl2).
В промышленности хлорид водорода HCl получают синтезом из простых веществ: Н2 + Cl2 = 2НCl, в лаборатории: NaCl(т) + Н2SO4(конц.) = Na2SO4 + 2НCl↑
При растворении НCl в воде образуется хлороводородная (соляная) кислота.
При действии сильных окислителей или при электролизе хлориды проявляют восстановительные свойства.
МnО2 + 4НCl = МnCl2 + Cl2↑ + 2Н2О
Соединения хлора (I). Степень окисления хлора +1 проявляется во фториде ClF, оксиде Cl2O и нитриде Cl3N, а также в соответствующих им анионах [СF2]–, [СlO]– и [ClN]2–. Бинарные соединения хлора +1 имеют кислотный характер, например:
Cl2O + НОН = 2НClО
Производные оксохлорат(I)-аниона СlO–, называемые гипохлоритами, неустойчивы и получают растворением хлор в охлажденных растворах щелочей:
KOH(хол.) + Сl2 ↔ КCl + КClO + Н2О
Оксохлорат (I) водорода НСlO – слабая хлорноватистая кислота, существующая только в разбавленных растворах.
Сl2 + НOH ↔ НCl + НClO
Производные хлора (I) – сильные окислители. Наибольшее практическое применение (как отбеливающее средство, средство для дегазации) имеет гипохлорит кальция Са(ClО)2 и хлорная известь (гипохлорит и хлорид кальция).
Соединения хлора (III). Степень окисления хлора +3 проявляется в три-фториде ClF3 и тетрафторохлорат(III)-анионе [ClF4]–, а также в диоксохлорат(III)-анионе [ClO2]–.
Производные диоксохлорат(III)-аниона ClO2– называются хлоритами. Диоксохлорат(III) водорода НClO2 – хлористая кислота средней силы, в свободном состоянии не получена, в водном растворе быстро разлагается. При нагревании хлориты диспропорционируют или разлагаются:
3NaCl+3O2 = NaCl–1 + 2NaCl+5O3
NaClO2 = NaCl + O2↑
Соединения хлора (IV). Степень окисления хлора +4 проявляется в его оксидах СlO3 и Cl2O6.
2КClО3(насыщ.) + Н2SO4(конц.) + SO2 = КНSO4 + 2ClO2
Соединения хлора (V). Степень окисления хлора +5 проявляется в соединениях пентафторид ClF5, оксотрифторид СlOF3, диоксофторид СlO2F, производные триоксохлорат(V)-аниона [СlO3]– и др.
Производные СlO3– называют хлоратами. Наибольшее практическое значение имеет хлорат калия КСlO3 (бертолетова соль).
6КОН(гор.) + 3Cl2 = 5КCl + КСlO3 + 3Н2О
Триоксохлорат (V) водорода НСlO3 – сильная кислота, называемая хлорноватой, существует в растворе (до 40%). По свойствам напоминает азотную кислоту.
При нагревании хлораты (V) – сильные окислители, диспропорционируют или разлагаются (в присутствии катализатора):
4КСlO3 = 3КClО4 + КCl
2КСlO3 = 2КCl + 3О2↑
Соединения хлора (VII). Высшая степень окисления хлора +7 проявляется в его оксиде, ряде оксофторидов (ClO3F, ClO2F3, ClOF5) и отвечающих им анионных комплексах.
Тетраоксохлораты (VII) (перхлораты) довольно многочисленны. Тетраоксохлорат (VII) водорода НСlO4 – бесцветная жидкость, разлагающаяся при нагревании или при стоянии. Водный раствор является хлорной кислотой – одна из наиболее сильных кислот. Ее получают действием концентрированной серной кислоты на КClО4:
КClО4 + Н2SO4 = НClO4 + КНSO4
Перхлораты в основном применяются в производстве взрывчатых веществ, в реактивной технике.
Подгруппа брома(бром, иод, астат)
Элементы подгруппы брома проявляют степени окисления –1, +1, +3, +5 и +7, из них наиболее устойчивы –1 и +5. Неметаллы, но с увеличением числа заполняемых электронных слоев атомов неметаллические признаки в ряду Br–I–At ослабевают.
Бром и иод – довольно распространенные на Земле элементы, содержатся в морской воде, в водах буровых скважин нефтяных месторождений. Собственные минералы обоих элементов редки и практического значения не имеют. Бром обычно сопутствует хлору в его калийных минералах. Некоторые морские водоросли содержат значительные количества иода. Астат в природе практически не встречается; ничтожные количества его обнаружены в продуктах естественного радиоактивного распада урана и тория.
Простые вещества. Br2 (дибром) – красно-коричневая жидкость, а ее пар – желто-бурого цвета с резким раздражающим запахом. Умеренно растворяется в воде и в небольшой степени подвергается дисмутации («бромная вода»), в присутствии бромидов и хлоридов щелочных металлов растворимость повышается. Сильный окислитель. Реагирует при обычных условиях со щелочами, многими металлами и неметаллами. Непосредственно не реагирует с кислородом, азотом, углеродом благородными газами. Образует соединения с другими галогенами.
I2 (дииод) – фиолетово-черное твердое вещество с металлическим блеском, легко возгоняется, образуя фиолетовые пары. Плохо растворим в воде, в ничтожно малых количествах подвергается дисмутации. Хорошо растворяется в органических растворителях, в водных растворах иодидов металлов (за счет комплексообразования, «иодная вода»). Слабый восстановитель и окислитель. Реагирует с концентрированной серной и азотной кислотой, «царской водкой», металлами, неметаллами, щелочами, сероводородной кислотой. Со многими элементами иод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы). Образует соединения с другими галогенами.
At (астат) – твердое серое вещество с металлическим блеском. Радиоактивен. Не растворяется в воде и не реагирует с ней. Растворяется в CCl4. Реагирует с кислотами-окислителями, типичными восстановителями и окислителями.
Получение и применение. Бром и иод получают, окисляя бромиды и иодиды:
2NаЭ + МnО2 + 2Н2SO4 = Э2 + МnSO4 + Nа2SO4 + 2Н2О
При получении брома в качестве окислителя часто используют хлор:
2KBr + Cl2 = 2KCl + Br2
Астат получают бомбардировкой висмута α-частицами или тория протонами на ядерном ускорителе.
Соединения брома и иода в основном применяются в производстве лекарств, для синтезов и в химическом анализе.
Соединения брома (I), иода (I), астата (I). Бром, иод и астат с менее электроотрицательными, чем они сами, элементами образуют бромиды, иодиды, астатиды. В отличие от фторидов бромиды и иодиды известны главным образом для элементов низких степеней окисления. Бромиды и иодиды щелочных и щелочно-земельных металлов преимущественно являются ионными соединениями; а неметаллических элементов – преимущественно ковалентными. Большинство бромидов и иодидов хорошо растворяется в воде (кроме AgЭ и РbЭ2).
Бромид водорода HBr и иодид водорода HI при обычных условиях – газы, хорошо растворимы в воде. Их растворы – сильные кислоты, называемые соответственно бромоводородной и иодоводородной. В ряду НF–НCl–НBr–НI сила кислот увеличивается, что в основном определяется уменьшением прочности связи Н–Наl, и в этом же ряду возрастает восстановительная активность.
Так, НF и НCl с концентрированной H2SO4 не взаимодействуют; НBr восстанавливает H2SO4 при нагревании до SO2, а НI – до SO2, S и даже H2S:
8НI(г) + H2SO4(ж) = 4I2(к) + Н2S(г) + 4Н2О(ж)
НBr и НI получают гидролитическим разложением бромидов и иодидов фосфора (III), а не действием серной кислоты на их соли (в отличие от фторида и хлорида водорода).
Соединения брома (I), иода (I) и астата (I). Степень окисления +1 у брома и его аналогов проявляется в соединениях с более электроотрицательными галогенами и кислородом (BrF, BrCl, Br2O, IF, ICl, IBr и др.). Бинарные соединения брома (I) и иода (I) являются кислотными соединениями.
Br2O + НОН = 2НВrО
ICl + НОН = HIO + НCl
KCl + ICl = K[ICl2]
Производные BrО– и IO– (гипобромиты, гипоиодиты) по свойствам и способам получения подобны гипохлоритам.
Оксобромат (I) водорода НВrО и оксоиодат (I) водорода HIО известны только в разбавленных водных растворах. Их растворы – слабые бромноватистая HBrO и иодноватистая HIO кислоты. Как и HClO, при нагревании и на свету разлагаются:
HЭO = НЭ + ½О2↑
Производные брома (I) и иода (I) – сильные окислители.
Соединения брома (III) и иода (III). Степень окисления +3 брома и иода проявляется в тригалогенидах (BrF3, IF3, ICl3) и соответствующих им анионах. Сильные окислители. Гидролиз соединений сопровождается диспропорционированием:
3BF3 + 6HOH = 2HBrO3 + HBr + 9HF
Соединения брома (V) и иода (V). Бром и иод проявляют степень окисления +5 в следующих соединениях: BrF5, BrO2F, IF5, IO2F, I2O5 и отвечающих им анионах. Проявляют кислотные свойства. Более или менее энергично взаимодействуют с водой, образуя кислоты:
I2O5 + НОН = 2HIO3
BrF5 + 3НОН = HBrO3 + 5HF
При взаимодействии с оснóвными соединениями они образуют соли:
6КОН + IF5 = К[IO3] + 5КF + 3Н2О
Производные ЭО3– называются броматами и иодатами. Анионы ЭО3– весьма устойчивы и поэтому их производные обычно образуются в водных растворах при действии на соединения брома, иода и астата сильных окислителей:
Br2 + 5Cl2+ 6Н2О = 2НBrO3 + 10НCl
Водные растворы НBrO3 – бромноватая и НIO3 – йодноватая кислоты. В ряду НСlO3–НBrO3–НIO3 кислотные свойства ослабевают, но повышается устойчивость.
При сильном нагревании броматы и иодаты разлагаются, выделяя кислород:
2НBrO3 = 2НBr + 3O2↑; 2НIO3 = 2НI + 3O2↑
Соединения брома (VII) и иода (VII). В высшей степени окисления для иода и брома известны BrF7, IF7, IO3F, а также анионы BrO4– и IO65–.
Водные растворы гексаоксоиодата (VII) водорода H5IO6 и тетраоксобромата (VII) водорода НBrO4 – йодная и бромная кислота (последнее соединение существует только в водном растворе).
Подгруппа марганца (марганец, технеций, рений)
Для марганца характерны степени окисления +2, +4, +7 и существуют производные, отвечающие степеням окисления 0, +3, +5 и +6. Для рения наиболее устойчивы производные в высшей степени окисления +7. Для технеция типичными являются степени окисления +4, +6 и +7.
Марганец относится к числу наиболее распространенных элементов. Основным природным минералом марганца является пиролюзит MnО2∙nН2О; часто марганец встречается совместно с железом в оксидных, карбонатных и сульфидных рудах. Рений самостоятельные минералы образует редко и содержится в качестве примеси в молибденовых, вольфрамовых и платиновых рудах. Незначительные количества технеция встречаются в урановых рудах.
Простые вещества. Mn (марганец) – серебристо-белый или светло-серый металл, более твердый и хрупкий по сравнению с железом. В виде порошка пирофорен. В холодной воде пассивируется. Реагирует с водяным паром, кислотами, галогенами, кислородом, серой. Поглощает водород, но не реагирует с ним.
Tc (технеций) – серебристо-белый с серым оттенком, тугоплавкий, высококипящий металл. Радиоактивен. Химическая активность значительно ниже, чем у марганца. Не реагирует с водой, хлороводородной кислотой, щелочами, пероксидом водорода. Реагирует с азотной кислотой, «царской водкой», кислородом, галогенами.
Re (рений) – светло-серый, весьма твердый, тяжелый, тугоплавкий, высококипящий металл. Устойчив на воздухе. Не реагирует с водой, гидратом аммиака, водородом, иодом, азотом, углеродом, хлороводородной и фтороводородной кислотами. Реагирует с концентрированными кислотами-окислителями и пероксидом водорода, галогенами, серой.
Получение и применение. Основную массу металлического марганца получают путем методом алюмино- и силикотермии:
MnО2 + Si = Mn + SiО2
3Mn3О4 + 8Al = 9Mn + 4Al2O3
Рений обычно выделяют нагреванием NH4ReO4, KReО4 в токе водорода:
2NH4ReО4 + 4Н2 = 2Re + N2 + 8Н2О
Источником для получения технеция являются отходы атомной промышленности (продукты деления урана).
Около 90% марганца применяется в металлургии для легирования сталей (придает сплавам железа коррозионную стойкость, вязкость и твердость). Рений в основном используется в электротехнической промышленности и как катализатор.
Из соединений элементов подгруппы марганца наибольшее применение имеет MnO2 для получения всех производных марганца, а также в качестве катализатора, окислителя, деполяризатора в гальванических элементах, в том числе батарей карманных фонариков и т. д. Оксоманганат (VII) калия KMnO4 используется в медицине. Ряд соединений используют в качестве микроудобрений. Соединения рения, как и сам металл, применяют в качестве катализаторов.
Соединения марганца (0), технеция (0), рения (0). Для марганца и его аналогов известны карбонилы состава Э2(СО)10. Диамагнетизм карбонилов подтверждает образование связи Э–Э по обменному механизму и возникновение биядерного кластера типа (CO)5–Mn–Mn–(CO)5. Карбонилы металлов способны к реакциям замещения и окисления – восстановления.
Соединения марганца (II). По химическим свойствам бинарные соединения Mn(II) слабо амфотерны (преобладают признаки оснóвных соединений).
MnО + 2HCl(разб.) = MnCl2 + H2O
Большинство солей Mn (II) хорошо растворимы в воде; малорастворимы MnS, Mn(ОН)2, MnСО3 и Mn3(РО4)2.
Придействии окислителей производные Mn (II) проявляют восстановительные свойства. Так, в щелочной среде Mn(ОН)2 легко окисляется даже молекулярным кислородом воздуха. Поэтому Mn(ОН)2, получаемый по обменной реакции, быстро темнеет с образованием MnО2∙Н2О.
Сильные окислители, такие как PbO2 (в кислой среде), переводят соединения Mn (II) в оксоманганаты (VII):
2MnSО4 + 5PbO2 + 6HNО3 = 2НMnО4 + 3Pb(NО3)2 + 2PbSО4 + 2Н2О
Соединения Тс (II) и Re (II) не характерны.
Соединения марганца (IV). Устойчивые бинарные соединения марганца (IV) – диоксид MnО2, тетрафторид MnF4 и относительно устойчивые производные гексагалогеноманганаты (IV)-комплексов типа MnF62– и MnС162–.
MnО2 – наиболее устойчивое соединение марганца, при обычных условиях не растворяется в воде и без нагревания устойчив к действию большинства кислот. По химической природе амфотерен. При нагревании с кислотами MnО2 проявляет окислительные свойства:
MnО2 + 4HCl = MnС12 + С12↑ + 2Н2O
2MnО2 + 2H2SO4(конц., кип.) = 2MnSO4 + О2↑ + 2H2O
Соединения марганца (VI), технеция (VI), рения (VI). Соединения, в которых степень окисления марганца и его аналогов +6, немногочисленны. Из них более устойчивы соединения рения и технеция, для которых известны фториды и хлориды, ряд оксогалогенидов и оксиды.
Степень окисления +6 марганца несколько стабилизируется в манганат-ионе MnО42–. Производные MnО42–, ТсО42,- и ReO42 в водных растворах существуют лишь при большом избытке щелочи.
Гидролиз галогенидов и оксогалогенидов Тс (VI) и Re (VI) сопровождается диспропорционированием с образованием НЭО4, ЭО2 и HHal.
3TcF6 + 10H2O = TcO2 + 2HTcO4 + 18HF
Соединения Mn (VII), Тс (VII), Re (VII).Для Mn (VII) известны лишь оксид Mn2О7 и оксофторид MnО3F, а для Re (VII) получены соединения ReF7, Re2О7, что объясняется повышением устойчивости соединений. Это типичные кислотные соединения, они взаимодействуют с водой с образованием кислот:
Э2О7 + Н2О = 2НЭО4
Mn2О7 – неустойчивая маслянистая жидкость, получаемая действием концентрированной серной кислоты на оксоманганаты (VII):
2КMnО4 + H2SO4(конц.) = Mn2О7 + K2SO4 + H2O
2Mn2О7 = 4MnО2 + 3О2↑
Тетраоксоманганат (VII) водорода НMnО4 неустойчив. В водных растворах является сильной кислотой, называемой марганцевой. В ряду HMnО4–HTcО4–HReО4 сила кислот несколько уменьшается. Большинство производных MnО4–, ТсО4– и ReO4– (перманганаты, пертехнаты и перренаты) хорошо растворимо в воде.
Соединения марганца (VII) – сильные окислители. Тетраоксоманганаты (VII) или перманганаты в качестве сильных окислителей широко используются в лабораторной практике. В зависимости от среды возможны следующие направления восстановления иона MnО4–:
Кислая среда: MnО4– + 8Н+ + 5ē = Mn2+ + 4H2O
Нейтральная и щелочная среда: MnО4– + 2Н2O + 3ē = MnО2 + 4OН–
Сильнощелочная среда: MnО4– + ē = MnО42–
При нагревании оксоманганаты (VII) распадаются:
2КMnO4 = К2MnO4 + MnO2 + O2↑
Глава 19. ЭЛЕМЕНТЫ VIII ГРУППЫ
VIIIА-группа (благородные газы): гелий Не 1s2, неон Ne 2s22p6, аргон Ar 3s23p6 и элементы подгруппы криптона – криптон Kr 4s24p6, ксенон Хе 5s25p6, радон Rn 6s26p6. Их атомы имеют завершенную конфигурацию внешнего электронного слоя, характеризуются наименьшими значениями атомных радиусов и наивысшими потенциалами ионизации. Неметаллы. В природе встречаются только в свободном состоянии. При обычных условиях все элементы VIIIА-группы представляют собой моноатомные газы, которые лишь при значительном охлаждении могут быть переведены в жидкое или твердое состояние.
VIIIВ-группа включает 9 элементов: подгруппа железа – железо Fe 3d64s2, рутений Ru 4d75s1, осмий Os 5d66s2; подгруппа кобальта – кобальт Co 3d74s2, родий Rh 4d85s1, иридий Ir 5d76s2; подгруппа никеля – никель Ni 3d84s2, палладий Pd 4d105s0, платина Pt 5d96s1. По мере заполнения d-орбиталей вторым электроном усиливается сходство соседних элементов по периоду. Так, Ni проявляет большое сходство как с Со и Fe, так и с Сu. Кроме того, вследствие лантаноидного сжатия особая близость свойств наблюдается у диад Ru–Os, Rh–Ir и Pd–Pt. Поэтому эти элементы 5-го и 6-го периодов часто объединяют в семейство так называемых платиновых металлов, а Fe, Со и Ni объединяют в семейство железа.
Гелий
Не (гелий) – бесцветный, трудносжимаемый газ. Наиболее распространенный после водорода элемент космоса, он состоит из изотопа 4Не с примесью 3Не. Накапливание ядер 4Не во Вселенной обусловлено термоядерной реакцией, служащей источником солнечной и звездной энергии:
41Н = 4Не + 2β+ + 2ν
На Земле гелий накапливается за счет α-распада радиоактивных элементов, содержится растворенным в минералах, в самородных металлах. Содержание Не в воздухе 5∙10–4% (об.).
В промышленности гелий в основном выделяют из природных газов методом фракционной дистилляции при глубоком охлаждении. Газообразный гелий применяется для создания инертной атмосферы при сварке металлов, при консервации пищевых продуктов и др.
По сравнению с другими благородными газами обладает наибольшей энергией ионизации атома. Особая устойчивость электронной структуры атома отличает гелий от всех остальных химических элементов периодической системы.
Плохо растворяется в воде, лучше – в бензоле, этаноле, толуоле. Обладает сильной способностью проникать через стекло и металлическую фольгу. Не реагирует со всеми веществами (простыми и сложными), не образует (в отличие от других благородных газов) клатратов с водой и органическими растворителями. Но при сильном возбуждении атомов гелий может образовывать неустойчивые молекулярные ионы Не2+, захватывающие недостающий электрон и распадающиеся на два нейтральных атома. Возможно также образование ионизированных молекул НеН+.
Неон
Ne (неон) – бесцветный, трудносжимаемый газ. Содержание Ne в воздухе 0,0015% (об.). В природе представлен двумя стабильными изотопами 21Ne и 23Ne.
Получают фракционной дистилляцией жидкого воздуха при глубоком охлаждении. Применяется в электровакуумной технике для наполнения стабилизаторов напряжения, фотоэлементов и других приборов. Различные типы неоновых ламп с характерным красным свечением используют в светотехнике и т. п.
Неон обладает очень высоким ионизационным потенциалом, и поэтому не образует соединений валентного типа. При сильном возбуждении атомов образует молекулярные ионы типа Ne2+. Практически не растворяется в воде, плохо растворяется в этаноле. Образует клатрат 8Nе∙46Н2О. Не реагирует со всеми другими веществами.
Аргон
Ar (аргон) – бесцветный газ. Самый распространенный в природе элемент VIIIА-группы, содержание в воздухе 0,932% (об.). В природе преобладает наиболее тяжелый изотоп 40Ar (с примесями 36Ar, 38Ar). Образуется при захвате электрона ядром нуклида 40К в литосфере Земли.
Получают фракционной дистилляцией жидкого воздуха при глубоком охлаждении. Применяют для создания инертной атмосферы (аргоно-дуговая сварка алюминиевых и алюмо-магниевых сплавов), в ядерной энергетике (ионизационные счетчики). Различные типы аргоновых ламп с характерным синим свечением используют в светотехнике.
Вследствие высокой энергии ионизации (и большой устойчивости электронной структуры атома) не образует соединения валентного типа. Плохо растворяется в воде, лучше – в органических растворителях. Образует молекулярные соединения включения – клатрат 8Ar∙46Н2О и сольваты Ar∙4C6Н5ОН, Ar∙2L (L = HCl, HBr, H2S, CO2, SO2). Не реагирует со всеми другими веществами (простыми и сложными).
Подгруппа криптона(криптон, ксенон, радон)
Элементы подгруппы криптона характеризуются меньшей энергией ионизации атомов, чем типические элементы VIIIА-группы, поэтому они образуют соединения обычного типа. Так, ксенон проявляет степени окисления +2, +4, +6 и +8 (по характеру соединений напоминает иод).
В ряду Не–Ne–Ar–Kr–Хе–Rn увеличивается поляризуемость молекул, усиливается растворимость в воде и других растворителях, возрастает склонность к адсорбции и устойчивость соединений включения.
Kr (криптон) – бесцветный газ. Содержание в воздухе 1,1∙10–4% (об.). Очень плохо растворяется в воде, этаноле. Образует клатрат 8Кr∙46Н2О и сольват 2Кr∙12C6Н5ОН. Не реагирует с кислотами и щелочами. Реагирует с атомным фтором (образуется KrF2) и образует неустойчивые KrF4, KrO3∙Н2О и BaKrO4.
Хе (ксенон) – бесцветный газ. Содержание в воздухе 8∙10–6% (об.). Плохо растворяется в воде, лучше – в органических растворителях. Образует сольват 4Хе∙3C6Н5ОН. Не реагирует с кислотами и щелочами. Реакционная способность выше, чем у криптона, реагирует с сильными окислителями.
Rn (радон) – бесцветный газ, радиоактивен. Плохо растворяется в воде, хорошо – в органических растворителях. Образует клатрат 8Rn∙46Н2О. Реакционная способность выше, чем у ксенона. Химические свойства изучены мало из-за высокой радиоактивности. Окисляется при действии окислителей; реагирует со фтором (продукт – твердая смесь фторидов RnFn), жидкими BrF3 и BrF5 (предполагаемый продукт – RnF2), твердым (O2)[SbF6] при 25°С (продукт – RnF[SbF6]).
Криптон и ксенон получают фракционной дистилляцией жидкого воздуха при глубоком охлаждении. Радон образуется в природе при радиоактивном распаде нуклидов 232Th, 235U, 238U, 218At, 226Ra.
Криптон применяется в электровакуумной технике, смеси его с ксеноном используются в качестве наполнителей различного рода осветительных ламп и трубок. Радиоактивный радон находит применение в медицине (например, «радоновые ванны»).
Соединения ксенона. Все многообразие соединений ксенона (и ряда других благородных газов) получают, исходя из фторидов – реакционноспособные вещества, функционирующие главным образом в роли энергичных окислителей.
Фториды получают прямым синтезом:
Хе(г) + F2(г) = XeF2(к)
Хе(г) + 2F2(г) = XeF4(к)
Хе(г) + 3F2(г) = XeF6(к)
Кроме того, фториды ксенона склонны к диспропорционированию и окислительно-восстановительному гидролизу:
2ХеF2 = Хе + XeF4
3XeF4 = Хе + 2XeF6
6XeF4 + 12Н2О = 2ХеО3 + 4Хе + 3О2 + 24HF
XeF6 + Н2О = XeОF4 + НF
XeОF4 + 2Н2О = ХеО3 + 4НF
Оксид ХеО3 обладает кислотными свойствами (чрезвычайно взрывчатое соединение), со щелочами образует оксоксенаты (VI):
ХеО3 + NaOH = Na2XeO4 + H2O
При диспропорционировании соединений ксенона (VI) или при их окислении энергичными окислителями получают производные – перксенаты или оксоксенаты (VIII):
4XeF6 + 18Ba(OH)2 = 3Ba2XeO6 + Xe + 12BaF2 + 18H2O
ХеО3 + 4NaOH + O3 = Na4XeO6 + О2 + 2H2O
При взаимодействии перксенатов с безводной серной кислотой получается ХеО4, медленно отщепляющий кислород уже при обычных условиях.
Ва2ХеО6 + 2H2SО4 = 2BaSО4 + ХеО4 + 2Н2О
Фториды ксенона склонны к реакциям присоединения, образуя комплексные соединения:
XeF2 + SbF5 = [XeF][SbF6]
XeF6 + 2CsF = Cs2[XeF8]
Подгруппа железа(железо, рутений, осмий)
Для железа наиболее характерны степени окисления +2 и +3, известны также производные железа, в которых его степень окисления равна –2, 0, +4, +6 и +8. Наиболее устойчивы соединения Ru (IV) и Os (VIII).
Железо по распространенности в природе находится на четвертом месте после кислорода, кремния и алюминия. Основными формами рудоносных минералов железа являются оксидные и сульфидные соединения: магнетит Fe3O4, гематит Fe2O3, лимонит Fe2O3∙nH2O), пирротин FeS, пирит FeS2. Изредка встречается самородное железо космического (метеорного) или земного происхождения. Железо содержится в природных водах и гемоглобине. Рутений и осмий сопутствуют платине и палладию в полиметаллических рудах, а также встречаются в виде самородных сплавов с иридием и платиной.
Простые вещества. Fe (железо) – серебристо-белый, мягкий, ковкий металл. При различных температурах существует в трех полиморфных модификациях (α, γ, δ). Медленно окисляется во влажном воздухе (процесс ржавления). Не реагирует с гидратом аммиака; пассивируется в концентрированных серной и азотной кислоте, разбавленных щелочах. Реагирует с разбавленными кислотами, концентрированными щелочами, неметаллами, монооксидом углерода. Вытесняет благородные металлы из их солей в растворе.
Ru (рутений) – белый с серым оттенком металл, очень твердый, хрупкий, тугоплавкий. Благородный металл; не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака, «царской водкой». Простых катионов не образует. Реагирует с концентрированными кислотами (в присутствии кислорода), сильными окислителями (при спекании), кислородом, галогенами, серой. Поглощает значительное количество Н2.
Os (осмий) – светло-голубой с серым оттенком металл, очень твердый, хрупкий, тугоплавкий; самый тяжелый из металлов. Благородный металл; не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака. На воздухе легко окисляется до высшей степени окисления (+8). Простых катионов в растворе не образует. Реагирует с концентрированными серной и азотной кислотами, сильными окислителями, кислородом, галогенами, серой. Поглощает заметное количество Н2.
Получение и применение. Железоуглеродистые сплавы, содержащие до 2% углерода (частично в виде Fe3C), называются сталями, содержащие 2–4% углерода – чугунами, менее 0,3% углерода – мягкой сталью (мягким железом). На свойства сталей большое влияние оказывает их термическая обработка, вызывающая изменения в соотношении соединений и структуре сплавов. Так, при медленном охлаждении (отпуске) сталь становится мягкой. При быстром же охлаждении (закалка) сталь приобретает большую твердость и некоторую хрупкость. Физико-химические свойства железоуглеродистых сплавов изменяются еще сильнее при добавлении легирующих компонентов (Cr, Mn, Ni, Co, Ti, W, Мо, Сu, Si, В, V, Zr и др.). При этом легирующие элементы вступают во взаимодействие с железом и углеродом и их соединениями с образованием новых металлических и металлоподобных соединений. В результате этого происходит изменение всего комплекса механических и физико-химических свойств стали. Чугун получают при восстановлении руд железа в доменных печах. Восстановление руды суммарно выражается уравнением: Fe2О3 + 3СО = 2Fe + 3СО2. Последующей переработкой чугуна (мартеновским способом, электроплавкой в вакууме и др.) получают сталь и техническое железо. Железо в чистом виде получают электролизом растворов его солей, термическим разложением ряда соединений.
Рутений и осмий (и их сплавы) благодаря высокой твердости и коррозионной устойчивости применяются для изготовления деталей точных измерительных приборов. Они эффективные катализаторы процессов гидрогенизации, синтеза углеводородов с длинными цепями, синтеза аммиака.
Соединения железа (0), рутения (0), осмия (0). Железо и его аналоги способны образовывать комплексные соединения за счет донорно-акцепторного взаимодействия. Наиболее типичным соединением является пентакарбонил железа Fe(CO)5; его получают в виде жидкости при нагреванием порошка железа в струе СО (при 180–220°С) и повышенном давлении: Fe + 5CO = Fe(CO)5.
Получены и другие карбонилы железа и его аналогов: Ru(CO)5, Os(CO)5, Fe2(CO)9, Fe3(CO)12, Ru3(CO)12, Os3(CO)12.
При нагревании карбонилы разрушаются, что используется для получения чистейших металлов: Fe(CO)5 = Fe + 5CO.
Карбонилы металлов могут окисляться и восстанавливаться частично или полностью, сохраняя координированные молекулы СО.
Fe0(CO)5 (в жидком аммиаке) + 2Na = Na2[Fe–2(CO)4] + СО↑
Fe0(CO)5 + I2 = [Fe+2(CO)4]I2 + СО↑
Для Fe(0), Ru(0) и Os(0) известны также нитрозилы Э(NO)4, нитрозилкарбонилы Э(СО)2(NO)2 и др.
Соединения железа (II). Степень окисления +2 железо проявляет в FeO, Fe(OH)2, многочисленных солях (образует соли почти со всеми анионами) и комплексных ионах [Fe(CN)6]4–, [FeF6]4–, [FeCl]42– , [Fe(NH3)6]2– и др.
Ион Fe2+ может окисляться до Fe3+ молекулярным кислородом, особенно легко в щелочной среде:
2Fe2+ + ½O2 + 2H+ = 2Fe3+ + H2О
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3
В присутствии влаги постепенно окисляются О2 воздуха твердые FeCО3 и FeS.
4FeS + О2 + 10Н2О = 4Fe(ОH)3 + 4H2S
Из производных железа (II), рутения (II) и осмия (II) наиболее устойчивы комплексные цианиды типа М4[Э(CN)6]. В аналитической практике широко используется желтая кровяная соль K4[Fe(CN)6] для обнаружения ионов Fe3+:
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ (синий осадок) + 3KCl
Соединения железа (III). Степень окисления +3 железо проявляет в Fe2O3, Fe(OH)3, многочисленных солях и комплексных ионах [Fe(OH2)6]3+, [Fe(OH)6]3–, [FeCl]4– и др.
Fe2О3 или Fe(OH)3 проявляют как оснóвные свойства (с кислотами образуются соответствующие соли), так и кислотные, реагируя с горячими концентрированными растворами щелочей с образованием гидроксокопмлексов, например, Na3[Fe(OH)6]. Причем, анионные комплексы Fe (III) устойчивее и легче образуются, чем таковые для Fe (II). Производные железистой кислоты HFeO2 – ферриты – получают при сплавлении щелочей или карбонатов с Fe2О3 или Fe(OH)3:
Na2CО3 + Fe2О3 = 2NaFeО2 + CО2↑
Из анионных комплексов железа (III) особо устойчив гексацианоферрат (III)-ион [Fe(CN)6]3–. Наибольшее значение имеет красная кровяная соль K3[Fe(CN)6], в частности, является реактивом на ионы Fe2+:
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2КСl
Соединения Fe (III) проявляют окислительные свойства. По этой причине неустойчивы иодид и цианид железа (III):
FeCl3 + 6KI = 2FeI2 + I2 + 6КСl
Для рутения (III) и осмия (III) известны соединения типа M3[Э(CN)6] и М3[ЭСl6].
Соединения железа (IV), рутения (IV), осмия (IV). Степень окисления +4 обычно проявляют рутений и осмий. Для них известны оксиды, галогениды и многочисленные производные анионных комплексов, например, M2+1[ЭСl6], M2+1[ЭBr6], М2+1[ЭBr3Сl3].
Оксиды и гидроксиды рутения (IV) и осмия (IV) – преимущественно кислотные соединения. Диоксиды ЭО2 в воде не растворяются, но взаимодействуют с галогеноводородными кислотами:
ЭО2 + 6НСl = Н2[ЭСl6] + 2Н2О
Для железа степень окисления +4 стабилизируется в оксоферратах (IV) типа M2+2FeО4.
Соединения железа (VI), рутения (VI), осмия (VI). Степень окисления +6 железа и рутения проявляется в анионах типа ЭО42–, а осмия – [OsO2(OH)4]2–. Производные этих анионов образуются при окислении металлов или соответствующих соединений в сильнощелочной среде, при нагревании:
Fe2О3 + 3KNО3 + 4КОН = 2K2FeО4 + 3KNО2 + 2Н2О
Оксоферраты (VI) сильные окислители:
4K2FeО4 + 6Н2О = 4FeО(ОН)↓ + 8КОН + О2↑
4K2FeО4 + 3Cr(OH)2 = 4FeО(ОН)↓ + 3K2CrO4 + 2KOH
Окислительные свойства оксорутенатов (VI) менее выражены, а гидроксооксоосматы (VI) довольно легко окисляются до OsО4:
2K2[OsО2(OH)4] + О2 = 2ОsО4 + 4КОН + 2Н2О
Соединения типа Н2ЭО4 (железная, рутениевая, осмиевая кислоты) не получены: при действии кислот оксоферраты (VI), оксорутенаты (VI) и гидроксооксоосматы (VI) разлагаются, например:
2Na2RuО4 + 2H2SО4 = 2Na2SО4 + 2RuО2 + О2 + 2H2О
Соединения железа (VIII), рутения (VIII), осмия (VIII). Для рутения и осмия известны тетраоксиды: RuО4 и OsО4 – летучие, легкоплавкие вещества; ядовиты. Имеются сведения о получении FeО4 – очень неустойчивое летучее соединение.
Na2RuО4 + Сl2 = RuО4 + 2NaCl; Os + 2О2 = OsО4
OsО4 проявляет кислотные свойства при взаимодействии с концентрированными щелочами, фторидами щелочных металлов:
2КОН + OsО4 = K2[OsО4(OH)2], 2KF + OsО4 = K2[OsО4F2]
RuО4 – неустойчив, сильный окислитель; в щелочах растворяется, выделяя О2.
4NaOH + 2RuО4 = 2Na2RuО4 + О2 + 2Н2О
Подгруппа кобальта(кобальт, родий, иридий)
Для кобальта наиболее типичны степени окисления +2, +3, а для иридия +3 и +4. Получены также производные родия (IV) и иридия (VI).
Кобальтовые руды встречаются редко, наиболее распространен минерал кобальтин CoAsS. Кобальт содержится в некоторых медных, никелевых, серебряных, железных, марганцевых и полиметаллических рудах, в животных и растительных организмах. Иридий чаще всего встречается в виде сплава с осмием, как и родий, в самородной платине и в медно-никелевых полиметаллических рудах.
Простые вещества. Со (кобальт) – темно-серый или желтовато-серый, твердый, ковкий, пластичный, высокоплавкий металл. При нагревании на воздухе покрывается оксидной пленкой. Пассивируется в концентрированных серной и азотной кислотах. Не реагирует с водой, фтороводородной кислотой, щелочами в растворе, гидратом аммиака, азотом. Реагирует с разбавленными кислотами, щелочами при сплавлении, неметаллами, аммиаком, монооксидом углерода. Заметно поглощает Н2 при комнатной температуре.
Rh (родий) – серебристо-белый металл, твердый, тугоплавкий, высококипящий, трудно поддается обработке. Благородный металл; в компактном виде не реагирует с водой, кислотами, «царской водкой», щелочами, гидратом аммиака. Родиевая чернь (тонкодисперсный родий) реагирует с концентрированной серной кислотой, «царской водкой», хлором в щелочной среде, хлороводородной кислотой (в присутствии кислорода). Реагирует с кислородом, галогенами.
Ir (иридий) – серебристо-белый, очень твердый, хрупкий, весьма тугоплавкий, высококипящий металл. Благородный металл; не реагирует с водой, кислотами, «царской водкой», щелочами, гидратом аммиака. Реагирует с сильными окислителями (при сплавлении), хлороводородной кислотой (в присутствии кислорода), кислородом, галогенами, серой.
Получение и применение. Кобальт применяется главным образом в сплавах, которые используются в качестве жаропрочных и жаростойких материалов, для изготовления постоянных магнитов, режущих инструментов, как легирующая добавка к сталям и для электролитического покрытия металлических деталей. Кроме того, соединения кобальта применяют для изготовления цветных эмалей и красок, в качестве микроудобрений и для подкормки животных. Кобальт получают переработкой полиметаллических руд (восстанавливают углем или водородом Со3О4), электролитическим рафинированием и термическим разложением некоторых его соединений.
Родий и иридий обладают большой коррозионной стойкостью и высокой твердостью; из них изготовляют детали контрольно-измерительных приборов. Родий, обладающий высокой отражательной способностью, используется как покрытие в зеркалах и рефлекторах. Платиново-родиевыесплавы применяются в качестве катализаторов окисления аммиака впроизводстве азотной кислоты.
Соединения кобальта (0), родия (0), иридия (0). Характерными комплексными соединениями кобальта являются карбонилы типа Со2(СО)8, Co4(CO)12, получены также карбонилы родия и иридия состава Э2(СО)8, Э4(CO)12, Э6(СО)16.
При нагревании Со2(СО)8 под давлением водорода образуется гидрокарбонил (карбонилгидрид), это производное кобальта в степени окисления –1.
Со20(СО)8 + Н2 = 2Н[Со–1(СО)4].
Известны также соли типа К[Со(СО)4], NH4[Co(CO)4].
Соединения кобальта (II). Степень окисления +2 характерна для кобальта.
Оксид кобальта (II) СоО (серо-зеленые кристаллы) образуется при взаимодействии простых веществ или термическим разложением Со(ОН)2, СоСО3. Галогениды СоНаl2 также образуются при взаимодействии простых веществ или обезвоживанием соответствующих кристаллогидратов. Дигалогениды (кроме CoF2) растворимы в воде.
По химической природе Со(ОН)2, как и СоО, – амфотерное соединение, преимущественно проявляющее оснóвные свойства.
Из катионных комплексов для Со (II) наиболее характерны аквакомплексы [Со(ОН2)6]2+, придающие растворам ярко-розовую окраску. Эти катионы образуются при взаимодействии с кислотами кобальта, СоО, Со(ОН)2.
Анионные комплексы Со (II) состава [CoX]2– (где X = Cl–, Br–, I–, NCS–, OH–) окрашены в синий и фиолетовый цвета. Они образуются при взаимодействии соответствующих соединений Со (II) с однотипными оснóвными соединениями.
2NaOH + Со(ОН)2 = Na2[Co(OH)4]
Соединения кобальта (III), родия (III), иридия (III). В степени окисления +3 для кобальта, родия и иридия характерны многочисленные катионные, анионные и нейтральные комплексы типа [Э(NH3)6]3+,[Co(NH3)3(NO2)3], [Э(CN)6]3–, [Э(NO2)6]3–, [ЭCl6]3–. Бинарные соединения и соли для Со (III) нехарактерны; относительно устойчив коричневый Со3О4, представляющий собой смешанный оксид Со+2Со2+3О4.
Для родия (III) и иридия (III) известны оксиды Э2О3, гидроксиды Э(ОН)3 (точнее Э2О3∙nН2О), галогениды ЭНаl3 и ряд других соединений, в частности, соли типа Э2(SО4)3, Rh(NО3)3. Соединения Ir (III) более или менее легко окисляются, переходя в производные Ir (IV).
Соединения родия (IV) и иридия (IV). Для иридия (IV) известны оксид IrO2 и гидроксид Ir(ОН)4 (точнее, IrO2∙nH20), галогениды IrНаl4, комплексные хлориды типа Na2[IrСl6]. Из соединений Rh (IV) известен гексахлорородиат (IV) цезия Cs2[RhCl6].
Соединения родия (VI) и иридия (VI). Неустойчивые гексафториды RhF6 и IrF6 – сильные окислители, энергично окисляют воду:
3IrF6 + 15Н2О = 3Ir(OH)4 + 18HF + О3
В отсутствие воды окисляют свободный хлор и NO:
2RhF6 + 3С12 = 2RhF3 + 6ClF
Подгруппа никеля(никель, палладий, платина)
Для никеля и палладия наиболее характерна степень окисления +2, а для платины +4. Известны также соединения Pd (VI) и Pt (VI).
Никель чаще образует сульфидные медно-никелевые минералы, являющиеся ценным полиметаллическим сырьем. Платина встречается обычно вместе с платиновыми металлами и, как правило, в самородном состоянии, а также в виде примеси в железных, хромовых, никелевых и медных рудах.
Простые вещества. Ni (никель) – белый, относительно твердый, тягучий, поддающийся ковке металл. Менее реакционноспособен, чем железо и никель; во влажном воздухе устойчив. Не реагирует с водой, щелочами, гидратом аммиака, азотом; пассивируется в концентрированной азотной кислоте. Реагирует с разбавленными кислотами, кислородом, галогенами, халькогенами, аммиаком, монооксидом углерода. Переводится в раствор карбонатом аммония. Поглощает заметное количество Н2. При обработке фтором компактный металл покрывается очень устойчивой пленкой NiF2. В электрохимическом ряду напряжений никель расположен до водорода, а палладий и платина – после водорода.
Pd (палладий) – светло-серый, относительно мягкий, ковкий металл. Наименее плотный, самый низкоплавкий и наиболее реакционноспособный из всех платиновых металлов. Благородный металл; не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака. Реагирует с концентрированными серной и азотной кислотами, «царской водкой», галогенами, серой; окисляется при сплавлении с гидросульфатом калия. Поглощает максимальное (среди металлов) количество Н2, причем окклюдированный водород находится в атомарном состоянии; насыщаемый водородом металл легко загорается на воздухе.
Pt (платина) – серовато-белый, относительно мягкий, ковкий, тугоплавкий металл. Занимает последнее место в электрохимическом ряду напряжений (самый электроположительный). Благородный металл; не реагирует с водой, кислотами (за исключением «царской водки»), щелочами, гидратом аммиака, монооксидом углерода. Переводится в водный раствор хлороводородной кислотой, насыщенной Сl2. При нагревании окисляется кислородом, галогенами, серой, при комнатной температуре – тетрафторидом ксенона. Губчатая платина и платиновая чернь активно поглощают значительное количество H2, He, O2.
Получение и применение.Никель получают главным образом из медно-никелевых сульфидных руд. В результате пирометаллургических операций получаемый NiO восстанавливают (чаще углем) до свободного металла и проводят электролитическое рафинирование. Попутно образуется анодный шлам, из которого выделяют присутствующие в нем в качестве примеси платиновые металлы, серебро и золото.
Основная масса выплавляемого никеля (около 80%) используется для получения никелевых сплавов и легированных сталей (нержавеющих, бронебойных, жаростойких и др.). Из никеля изготавливают специальную аппаратуру химических производств и защитные покрытия других металлов.
Палладий и платина используются для изготовления коррозионно-стойких аппаратов и приборов химических производств, для термометров сопротивления; применяются в ювелирном деле. Из платины изготавливают нерастворимые аноды. Палладий и никель – хорошие катализаторы гидрирования, восстановления водородом; платина – катализатор окисления кислородом аммиака (в производстве HNO3), водорода и других процессах каталитического окисления.
Соединения никеля (0), палладия (0), платины (0). Нулевая (а также отрицательная) степень окисления у никеля и его аналогов проявляется в соединениях с лигандами: СО, PF3, CN–, типа Ni(CO)4, K4[Ni(CN)4], K4[Pd(CN)4].
Соединения никеля (II), палладия (II), платины (II).Оксиды NiO, PdO, PtO, гидроксиды Ni(OH)2, Pd(OH)2, Pt(OH)2, сульфиды NiS, PdS, PtS в воде не растворяются. В противоположность Pd (II), и в особенности Pt (II), для Ni (II) характерны соли оксокислот.
Разнообразны катионные, анионные и нейтральные комплексы типа [Э(NН3)4]2+, [Э(СN)4]2–, [ЭHal4]2–, [Э(NH3)4X2] (где Х = Cl–, Br–, NO2–) и др.
Соединения никеля (IV), палладия (IV), платины (IV).Степень окисления +4 характерна для платины. Производные Pd (IV) малочисленны, являются окислителями. Еще менее устойчивы и очень редки соединения Ni (IV).
Для платины (IV) известны оксид PtO2, Pt(OH)4, (правильнее PtO2∙nН2О), галогениды PtHal4, сульфид PtS2 и многочисленные производные его катионных, нейтральных и анионных комплексов. В бинарных соединениях Pt (IV) кислотные свойства преобладают над оснóвными.
Pt(OH)4 + 2NаОН = Nа2[Pt(ОН)6]
Pt(OH)4 + 2НСl = Н2[PtСl6] + 4Н2О
Для тетрагалогенидов PtHal4 очень характерно взаимодействие с галогеноводородными кислотами и оснóвными галогенидами с образованием комплексов:
PtCl4 + 2НСl = Н2[PtCl6], PtCl4 + 2NаСl = Na2[PtCl6]
Соединения палладия (VI), платины (VI).Получены неустойчивые гексафториды PtF6 (сжиганием платины во фторе) и PdF6; последний легко разлагается.
PtF6 относится к числу наиболее сильных окислителей, является фторирующим агентом. Так, он легко фторирует BrF3 до BrF5, бурно реагирует с металлическим ураном, образуя UF6, разлагает воду с выделением кислорода, реагирует со стеклом, окисляет молекулярный кислород до O2+[PtF6]–.
Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Глава 20. ОБЩАЯ ХАРАКТЕРИСТИКА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органическая химия – это химия соединений углерода (А.М. Бутлеров). Помимо атомов углерода в состав органических соединений входят Н, О, N, S, Р, F, Сl, Вr, I и другие химические элементы.
Число известных в настоящее время органических соединений (природных и синтетических) около 20 млн. Ежегодно в лабораториях мира синтезируется 200–250 тыс. новых соединений.
На базе достижений теоретической и синтетической органической химии была создана промышленность органического синтеза, которая дает национальному хозяйству новые материалы, превосходящие по свойствам природные: пластмассы, синтетические каучуки, искусственные и синтетические волокна и др. Эти материалы позволили создать новые технологии и решить принципиально важные задачи в машиностроении, атомной технике, строительстве, медицине. Промышленность органического синтеза включает производство лекарственных препаратов, красителей, моющих средств, моторных топлив, взрывчатых веществ, пестицидов и т.д. Органические реакции лежат в основе нефтехимической и коксохимической промышленности. Методы органической химии используются для решения научных проблем молекулярной биологии, биохимии, медицины. Основным сырьем для производства органических соединений служат в большинстве случаев нефть и природный газ.
Теория строения органических соединений
А.М. Бутлеров (1861 г.) создал теорию строения органических веществ, ее основные идеи в современной формулировке можно представить следующим образом:
Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
Строение молекул может быть установлено на основе изучения их химических свойств.
Теория Бутлерова явилась фундаментом для развития органической химии, позволила систематизировать и объяснить известные факты и предсказать существование новых веществ и их свойств.
Формулы органических соединений
Молекулярная формула отражает качественный и количественный элементный состав вещества. В молекулярной формуле сначала пишут атомы углерода, затем… Структурная формула показывает порядок связи атомов в молекуле и составляется…Классификация органических соединений
Для классификации органических соединений по типам и построения их названий в молекуле органического соединения принято выделять углеродный скелет и функциональные группы.
Углеродный скелет представляет собой последовательность химически связанных между собой атомов углерода. Функциональные группы представляют собой атомы других элементов (кроме водорода) или группы атомов, связанные с атомами углерода.
В зависимости от строения углеродного скелета органические соединения разделяют на ациклические и циклические.
Ациклические соединения – соединения с открытой (незамкнутой) углеродной цепью; они могут быть насыщенными (алканы и их производные) и ненасыщенными (алкены, алкадиены, алкины и их производные).
Ациклические скелеты бывают неразветвленными (например, в н-пентане) и разветвленными (например, в 2,3-диметилбутане):
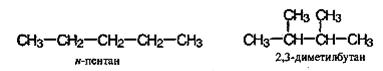
Циклические соединения – соединения с замкнутой цепью. В зависимости от природы атомов, составляющих цикл, различают карбоциклические и гетероциклические соединения.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две существенно различающиеся по химическим свойствам группы: алифатические циклические (сокращенно алициклические) и ароматические соединения.
Простейшим представителем насыщенных алициклических углеводородов (циклоалканов) служит циклопропан, содержащий трехчленный цикл. Число атомов углерода в циклах может быть различным. Известны большие циклы (макроциклы), состоящие из 30 и более атомов углерода.
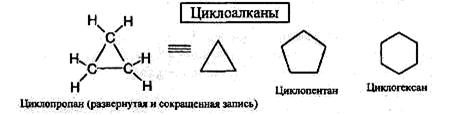
Родоначальником ароматических углеводородов (аренов) является бензол. Нафталин и фенантрен относятся к полициклическим аренам; они содержат бензольные кольца, имеющие общие связи (другое название этих соединений – конденсированные арены.
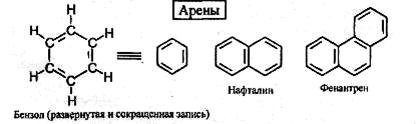
 Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов (от греч. heteros – другой, иной) – кислород, азот, серу и др.
Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов (от греч. heteros – другой, иной) – кислород, азот, серу и др.
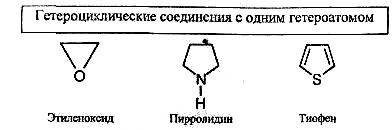
В самих углеродных скелетах полезно классифицировать отдельные атомы углерода по числу химически связанных с ними атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя – вторичным, тремя – третичным и четырьмя – четвертичным.
Поскольку атомы углерода могут образовывать между собой не только одинарные, но и кратные (двойные и тройные) связи, то соединения, содержащие только одинарные связи углерод-углерод, называют насыщенными, соединения с кратными углерод-углеродными связями называют ненасыщенными. Соединения, в которых атомы углерода связаны только с атомами водорода, называют углеводородами.
Углеводороды признаны в органической химии родоначалъными структурами. Разнообразные соединения рассматриваются как производные углеводородов, полученные введением в них функциональных групп.
Функциональные группы – атомы или их группировки, во многом определяющие химические и физические свойства органических соединений. Соединения, которые содержат несколько функциональных групп, называют полифункциональными.

Соединения, имеющие одинаковые функциональные группы, но различающиеся числом атомов углерода, обладают весьма похожими физическими и химическими свойствами. Гомологи – это соединения, принадлежащие к одному классу, но отличающиеся друг от друга по составу на целое число групп СН2. Совокупность всех гомологов образует гомологический ряд.
Номенклатура органических соединений
По правилам ИЮПАК название органического соединения строится из названия главной цепи, образующего корень слова, и названий функций, используемых в… Для правильного построения названия необходимо провести выбор главной цепи и… В заместительной номенклатуре название соединения представляет собой составное слово, корень которого включает…Изомерия органических соединений
Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов). Стереоизомерами называют соединения, имеющие одинаковый состав и одинаковый… Структурные изомеры.В соответствии с приведенной выше классификацией органических соединений по типам среди…Взаимное влияние атомов в молекуле
И реакционная способность органических соединений
Взаимное влияние, передающееся по цепи σ-связей, называетсяиндуктивным эффектом (I) атома или группы, а передающееся по цепи π-связей… Заместители проявляют отрицательный индуктивный эффект (-I), если они смещают…Общая характеристика органических реакций
I. Классификация химических реакций по результату химического превращения: 1. Реакции замещения (символ S): СН3–СН3 + Сl2 → СН3СН2Сl + НСlПромышленное производство органических соединений
Первое сырье для производства органических материалов было получено сухой перегонкой (карбонизацией, пиролизом) каменного угля, т.е. нагреванием… Лабораторные и промышленные способы получения. Между лабораторным и… Другая проблема – работа с ядовитыми веществами. В лабораторном синтезе обычно можно использовать ядовитые…Глава 21. АЛКАНЫ
Номенклатура и изомерия
По систематической номенклатуре ИЮПАК первым четырем членам гомологического ряда алканов присвоены их исторически сложившиеся названия – метан,… Алканы с разветвленной цепью рассматриваются как производные нормального…Физические свойства
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в…Способы получения
Из синтетических методов получения алканов можно выделить следующие: 1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов…Химические свойства
Химическая устойчивость алканов объясняется высокой прочностью σ-связей С–С и С–Н, а также их неполярностью. Неполярные связи С–С и С–Н в… 1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом)…Применение
Промышленное использование алканов подробно рассмотрено выше. Метан, этан, бутан, и другие алканы широко применяются как сырье для промышленных синтезов.
Глава 22. ЦИКЛОАЛКАНЫ
Номенклатура и изомерия
Общая формула гомологического ряда циклоалканов СnН2n. Точно такой же формулой… Каждый атом углерода в циклоалканах находится в состоянии sр3-гибридизации и образует четыре σ-связи С-С и С-Н.…Физические свойства
При обычных условиях первые два члена ряда (С3 - С4) – газы, (C5 – C16) – жидкости, начиная с С17 – твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Получение
1. Основной способ получения циклоалканов - отщепление двух атомов галогена от дигалогеналканов:
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
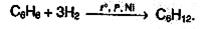
Химические свойства
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и вдет труднее, чем с прощеном или бутеном): 2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы.…Номенклатура и изомерия
Простейший алкен с разветвленным углеродным скелетом:Физические свойства
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 – 30 °С. При обычных условиях алкены С2 – С4– газы, С5 – С15 – жидкости, начиная с C16 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти: Крекинг протекает по свободнорадикальному механизму при 400-700°С.Химические свойства
На первой стадии электрофильная частица (чаще всего это бывает протон Н+) взаимодействует с π-электронами двойной связи и образует… На второй стадии карбокатион реагирует с анионом X , образуя вторую σ-связь за счет электронной пары аниона:Применение
Глава 24. АЛКАДИЕНЫ (ДИЕНОВЫЕ УГЛЕВОДОРОДЫ)Номенклатура и изомерия
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются… Если двойные связи разделены в цепи только одной σ-связью, то их называют…Физические свойства
Аллен СН2=С=СН2 – бесцветный газ tкип = –34,5 °С. Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. Изопрен – жидкость с tкип = 34 °С.
Получение
Изопрен (2-метилбутадиен-1,3) получают из 2-метилбутаца:Химические свойства
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений.Применение
Основная область применения алкадиенов – синтез каучуков.
Глава 25. АЛКИНЫ (АЦЕТИЛЕНЫ)
Номенклатура и изомерия
Первый представитель этого класса – ацетилен НС≡СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи… В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная…Физические свойства
Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных…Получение
2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли…Химические свойства
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена,… суммарно:Применение
Глава 26. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)Номенклатура и изомерия
Рассмотрим строение молекулы бензола. Молекулярная формула бензола – СбН6. Первая структура бензола была предложена в 1865 г. немецким ученым А.… Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола.…Физические свойства
Вдыхание паров бензола вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары…Способы получения
Из гексана при этом получается бензол, а из гептана – толуол. 2. Дегидрирование циклоалканов также приводит к ароматическим углеводородам. Реакция происходит при пропускании паров…Химические свойства
Для аренов наиболее характерны реакции, протекающие по механизму электрофилъного замещения, обозначаемого символом SE (от англ. substitution… Механизм реакции SE можно представить следующим образом:Правила ориентации (замещения) в бензольном кольце
В молекулах, имеющих только σ-связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой… Влияние заместителей, передающееся по сопряженной системе π-связей,… В молекуле бензола π-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если…Применение
Глава 27. ГИДРОКСИЛЬНЫЕ СОЕДИНЕНИЯ (СПИРТЫ) Производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу –ОН, называют…Номенклатура и изомерия
Простейшие спирты: Изомерияодноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и2-метилпропанол-2) и с…Физические свойства
Низшие спирты (до C15) – жидкости, высшие – твердые вещества. Метанол, этанол и пропанол-2 смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей.
Получение
CH2=CH2 + H2O → CH3–CH2–OH Из этилена получается этиловый спирт, из пропена – изопропиловый.… 2. Другой общий способ получения спиртов – гидролиз алкилгалогенидов под действием водных растворов щелочей:Химические свойства
Связи С–О и О–Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН: 1) Реакции с разрывом связи О–Н: а) взаимодействие спиртов с щелочными и… 2) Реакции, сопровождающиеся разрывом связи С–О: а) каталитическая дегидратация с образованием алкенов…Реакции с разрывом связи О–Н.
но не реагируют со щелочами. С увеличением длины углеводородного радикала… В присутствии следов влаги соли спиртов (алкоголяты) гидролизуются до исходных спиртов:Реакции с разрывом связи С–О.
При более слабом нагревании происходит межмолекулярная дегидратация с…Применение
Метиловый спиртСН3ОН – ядовитая жидкость температурой кипения 65°С, легко смешивается с водой. Главное промышленное применение метанола – получение… Этиловый спирт С2Н5ОН – бесцветная жидкость температурой кипения 78°С,… Высшие жирные спирты (ВЖС)содержат более десяти углеродных атомов. Сырье для их получения поставляет нефтехимическая…Многоатомные спирты
Важнейшие из многоатомных спиртов – этиленгликоль и глицерин:
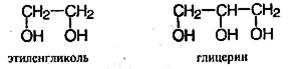
Это – вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение
1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):

2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия:
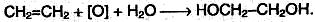
3. Глицерин образуется при гидролизе жиров.
Химические свойства
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко-синее окрашивание при действии… Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой…Применение
Глицерин находит широкое применение в косметике, пищевой промышленности,…Фенолы
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
 Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Простейший представитель этого класса – собственно фенол, С6Н5ОН.
Одна из двух неподеленных электронных пар атома кислорода втягивается в π-электронную систему бензольного кольца (+М-эффект группы ОН). Это приводит к двум эффектам: а) увеличивается электронная плотность в бензольном кольце, причем максимумы электронной плотности находятся в орто- и пара-положениях по отношению к группе ОН; б) электронная плотность на атоме кислорода, напротив, уменьшается, что приводит к ослаблению связи О-Н. Первый эффект проявляется в высокой активности фенола в реакциях электрофильного замещения, а второй – в повышенной кислотности фенола по сравнению с предельными спиртами.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров: орто-, мета- и пара-крезолов:
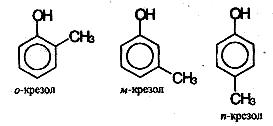
Физические свойства
Способы получения
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха…Химические свойства
1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как со щелочными металлами: так и с их гидроксидами (отсюда старинное название «карболовая кислота»):Применение
Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон, красителей, лекарственных средств и многих других ценных веществ. Пикриновую кислоту применяют в промышленности в качестве взрывчатого вещества. Крезолы используют как вещества с сильным дезинфицирующим действием.
Глава 28. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ (ОКСОСОЕДИНЕНИЯ)
Номенклатура и изомерия
В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом: метаналь этанальФизические свойства
Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомов водорода с положительным зарядом. По этой причине температуры кипения альдегидов и кетонов значительно ниже, чем соответствующих спиртов. Низшие альдегиды и кетоны – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде.
Получение
Из-за своей относительной дороговизны, а также из-за того, что: получаемые… 2. Общий способ получения карбонильных соединений – окисление спиртов. В качестве окислителя можно использовать не…Химические свойства
Альдегиды и кетоны – химически активные соединения, которые склонны к реакциям присоединения по связи С=О. Эти реакции протекают по механизму… Важнейшие реакции присоединения: 1. Присоединение водорода (восстановление). При взаимодействии альдегидов с водородом получаются первичные спирты: …Применение
6СН2О + 4 NН3 → (СН2)6N4 + 6Н2О Уротропин применяется в медицине как противовоспалительное средство,… Формальдегид обладает бактерицидным действием и применяется в качестве дезинфицирующего средства для обработки зерно-…Глава 29. КАРБОНОВЫЕ КИСЛОТЫ
Номенклатура и изомерия
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или… В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы…Физические свойства
Кислоты, содержащие 1-3 атома углерода, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость… В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот… При одной и той же длине углеводородного радикала температуры плавления (и кипения) зависят от наличия кратных связей…Получение
2. Другой общий способ – гидролиз галогензамещенных углеводородов, содержащих…Химические свойства
Тем не менее, из-за ковалентного характера молекул карбоновых кислот указанное… Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими…Применение
Уксусная кислота СН3СООН. Известна с глубокой древности, ее 5-10% растворы («столовый уксус») используют как вкусовую приправу и консервант.… Основную часть производимой уксусной кислоты используют для производства искусственных волокон на основе целлюлозы. …Мыла и моющие средства. Натриевые и калиевые соли высших жирных кислот называют мылами, т.к. они обладают хорошими моющими свойствами. Натриевые соли составляют основу твердых мыл, в то время как калиевые соли – жидких. Их получают кипячением животного сала либо растительного масла с гидроксидом натрия или калия – отсюда старинное название щелочного гидролиза жиров – «омыление». Очищающие (моющие) свойства мыла объясняются смачивающей способностью растворимых солей высших жирных кислот, т.е. анионы мыла обладают сродством, как к жирным загрязнениям, так и к воде. Анионная карбоксигруппа обладает сродством к воде: она гидрофильна. Углеводородная же цепь жирной кислоты обладает сродством к жирным загрязнениям. Она представляет собой гидрофобный конец молекулы мыла. Этот конец растворяется в капле грязи, в результате чего происходит ее трансформация и превращение в мицеллу. Удаление «пенообразных» мицелл с загрязненной поверхности достигается ее промыванием водой.
В так называемой жесткой воде, содержащей ионы Са2+ и Мg2+ происходит уменьшение моющей способности мыла, поскольку, взаимодействуя с ионами кальция и магния, мыла образуют нерастворимые кальциевые и магниевые соли, например:
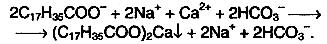
В результате этого мыло образует вместо пены хлопья на поверхности воды и расходуется бесполезно. Этого недостатка лишены синтетические моющие средства (детергенты), представляющие собой натриевые соли различных сулъфокислот общей формулы:
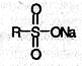
Распространенными синтетическими моющими средствами (детергентами) являются алкилбензолсульфонаты:
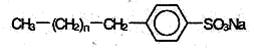
Правда, повсеместное использование синтетических детергентов (стиральные порошки) создает свои проблемы. Типичный стиральный порошок содержит приблизительно 70% синтетического моющего средства и приблизительно 30% неорганических фосфатов. Фосфаты удаляют растворимые соли кальция. К сожалению, эти фосфаты попадают в сточные воды, которые сбрасываются в ручьи, реки, озера или океаны. Фосфаты являются питательной средой для определенных водорослей. Это приводит к сильному разрастанию цианобактерий, особенно в замкнутых водоемах, например, в озерах.
Глава 30. СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ
Номенклатура и изомерия
Молекула сложного эфира состоит из остатка кислоты (1) и остатка спирта… Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо…Физические свойства
Сложные эфиры имеют, как правило, более низкую температуру кипения, чем соответствующие им кислоты. Например, стеариновая кислота кипит при 232 °С,… Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества, не…Химические свойства
Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результате… Реакция гидролиза ускоряется под действием щелочей; в этом случае гидролиз необратим:Жиры и масла
Среди сложных эфиров особое место занимают природные эфиры – жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными… где R', R'', R''' - углеводородные радикалы.Моносахариды
Номенклатура и изомерия
Остальные моносахариды по числу атомов углерода подразделяют на тетрозы…Физические и химические свойства глюкозы
Данное равновесие существует в водном растворе. Буква α в названии… Процесс образования циклических форм (кольчато-цепная таутомерия) глюкозы из линейной можно представить следующим…Дисахариды
Молекула сахарозы состоит из двух циклов: шестичленного (остатка α-глюкозы в пиранозной форме) и пятичленного (остатка β-фруктозы в… Молекула мальтозы состоит из двух остатков глюкозы (левый – α-глюкоза) в пиранозной форме, соединенных через 1-й…Полисахариды
Крахмал образуется в растениях при фотосинтезе и откладывается в корнях и семенах. Он представляет собой белый порошок, нерастворимый в холодной… Крахмал – это природный полимер, образованный остатками α-глюкозы. Он…Глава 32. АМИНЫ
Амины – органические соединения, которые рассматривают как производные аммиака, в котором атомы водорода (один, два или три) замещены на углеводородные радикалы.
Амины подразделяют на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал:
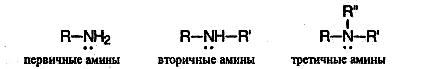
Существуют также органические аналоги солей аммония – это четвертичные соли типа [R4N]+Cl-.
В зависимости от природы радикалов, амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими или смешанными.
Предельные алифатические амины
Номенклатура и изомерия
Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и добавляя окончание -амин, например: По другой системе названия первичных аминов строят, исходя из названия родоначального углеводорода и добавляя…Физические свойства
Амины также образуют слабые водородные связи с водой, поэтому низшие амины хорошо растворимы в воде, по мере роста углеродного скелета…Получение
При избытке алкилгалогенида полученный первичный амин также может вступать в…Химические свойства
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя…Применение
Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс.
Ароматические амины
Неподеленная электронная пара атома азота взаимодействует с π-электронной системой бензольного кольца. Данное взаимодействие можно описать… Молекула анилина представляет собой среднее между изображенными четырьмя структурами.Физические свойства
Основной способ получения анилина – восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350°С на… В лаборатории для этой цели используют цинк в кислой среде:Химические свойства
Анилин реагирует с сильными кислотами, образуя соли фениламмония С6Н5NН3+, которые растворимы в воде, но нерастворимы в неполярных органических… 2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными…Применение
Основная область применения анилина – синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора):
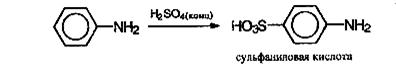
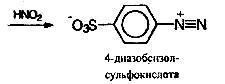
Глава 33. АМИНОКИСЛОТЫ, ПЕПТИДЫ И БЕЛКИ
Многие биологически активные молекулы включают несколько химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров – моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений – аминокислоты.
Аминокислоты
Номенклатура и изомерия
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной… В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные…Физические свойства
Аминокислоты представляют собой кристаллические вещества, растворимые в воде, плавятся при высокой температуре с разложением. Эти свойства указывают на солеобразное ионное строение аминокислот. Многие аминокислоты имеют сладкий вкус.
Получение
Основной способ получения аминокислот – замещение атома галогена на аминогруппу в галогензамещенных кислотах. Этот способ аналогичен получению аминов из алкилгалогенидов и аммиака. Выделяющийся при замещении галогеноводород связывают избытком аммиака:
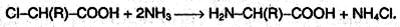
Химические свойства
В твердом состоянии и в водных растворах аминокислоты существуют в виде…Пептиды
Полученное соединение называют дипептидом. Молекула дипептида, подобно…Белки
Белки – это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка – это конкретная последовательность аминокислот в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Вторичная структура – это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и СО. Существует два основных способа укладки цепи – α-спираль и β-структура.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NH3+ и COO- и гидрофобные взаимодействия, т.е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры.
Третичная структура – высшая форма пространственной организации белков. Однако, некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями:
Ключевой этап определения структуры белка – расшифровка последовательности аминокислот в первичной структуре. Для этого белок сначала разделяют на полипептидные цепи (если их несколько), а затем анализируют аминокислотный состав цепей путем последовательного отщепления аминокислот. Это – чрезвычайно трудоемкая процедура, поэтому первичная структура надежно установлена только для достаточно простых белков.
Первый белок, у которого была расшифрована первичная структура, – гормон инсулин (1955г.). Это – простой белок, состоящий из двух полипептидных цепей (одна цепь содержит 21 аминокислотный остаток, другая – 30 остатков), соединенных двумя дисульфидными мостиками. На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет.
Пространственную структуру белков анализируют, изучая данные рассеяния рентгеновского излучения (рентгеноструктурный анализ) или нейтронов (нейтронография). Часто применяют спектроскопические методы, особенно для исследования структуры белков в водных растворах.
Принципиальная возможность синтеза белков была доказана на примере двух гормонов – вазопрессина и окситоцина. Впоследствии были синтезированы более сложные белки – инсулин и рибонуклеаза (124 аминокислотных остатка).
Для синтеза белков широко используют твердофазный метод, разработанный в начале 1960-х гг. американским химиком Б. Меррифилдом. В этом методе первая аминокислота закрепляется на полимерном носителе, и к ней последовательно подшиваются новые аминокислоты. По окончании синтеза готовая полипептидная цепь отрывается от носителя. В настоящее время искусственное получение белков осуществляется не с помощью химического, а с помощью микробиологического синтеза, путем использования микроорганизмов.
В живой природе синтез белков происходит чрезвычайно быстро, всего за несколько секунд. Живые клетки – это хорошо организованные «фабрики», в которых четко налажена система поставки сырья (аминокислот) и технология сборки. Информация о первичной структуре всех белков организма содержится в дезоксирибонуклеиновой кислоте (ДНК).
Физические свойства
Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы.
Химические свойства
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов – свинца или ртути. 2. Гидролиз белков – это необратимое разрушение первичной структуры в кислом… 3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое…Биологическое значение белков
1.Абсолютно все химические реакции в организме протекают в присутствии катализаторов – ферментов. Даже такая простая реакция как гидратация… 2. Некоторые белки выполняют транспортные функции и пере носят молекулы или… 3. Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.Глава 34. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклические соединения – органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие неуглеродные атомы (гетероатомы). Гетероциклические соединения классифицируют по числу атомов в цикле и по типу гетероатома. В данной главе мы рассмотрим только некоторые азотсодержащие гетероциклы, производные которых имеют важное биохимическое значение.
Шестичленные гетероциклы
По электронному строению пиридин напоминает бензол. Все атомы углерода и атом… Пиридин – бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых…Пиримидиновые основания – производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
Каждое из этих оснований может существовать в двух формах (это явление называют лактим-лактамной таутомерией). В свободном состоянии основания существуют в ароматической форме, а в состав нуклеиновых кислот они входят в NH-форме.
Пятичленные гетероциклы
Атомы углерода и атом азота находятся в состоянии sp2-гибридизации. 4… В отличие от пиридина, электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол…Пуриновые основания– производные пурина, остатки которых входят в состав нуклеиновых кислот: аденин, гуанин.
Нуклеиновые кислоты
Строение нуклеиновых кислот
Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза. При полном гидролизе нуклеиновых кислот образуется смесь… При частичном гидролизе нуклеиновых кислот образуется смесь нуклеотидов.Биологическая роль нуклеиновых кислот
ДНК содержит всю генетическую информацию, но непосредственно в синтезе белков не участвует. Роль посредника между ДНК и местом синтеза белка… Клетки содержат три типа РНК, которые выполняют различные функции.ДНК мРНК
Аденин урацил
Тимин аденин
Гуанин цитозин
Цитозин гуанин
2. Транспортная РНК (тРНК) переносит аминокислоты к рибосомам, где они соединяются пептидными связями в определенной последовательности, которую… 3. Рибосомная РНК (рРНК) непосредственно участвует в синтезе белков в… Все виды РНК синтезируются на двойной спирали ДНК.Глава 35.СИНТЕТИЧЕСКИЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ
Полимеры – соединения с большой молекулярной массой, молекулы которых состоят из большого числа повторяющихся фрагментов. В предыдущих главах рассмотрено строение и свойства природных полимеров – полисахаридов, белков (полипептидов) и нуклеиновых кислот (полинуклеотидов). Данная глава посвящена главным образом синтетическим полимерам, которые играют огромную роль в современной промышленности.
Общая характеристика полимеров
В зависимости от строения углеродной цепи, различают линейные (неразветвленные), разветвленные и сетчатые (сшитые) полимеры. Линейные и… Полимеры могут иметь регулярное и нерегулярное строение. Если все элементарные… Полимеры получают с помощью реакций двух основных типов – полимеризации и поликонденсации.Пластмассы
Пластмассы бывают двух основных типов: термопластичные и термореактивные. Термопластичные пластмассы могут многократно изменять свою форму при… Термореактивные пластмассы при нагревании также изменяют свою форму, но при… Рассмотрим некоторые основные типы пластмасс.Волокна
Рассмотрим два важнейших синтетических волокна – лавсан и найлон. Лавсан получают поликонденсацией этиленгликоля и терефталевой (бензол-1,4-дикарбоновой) кислоты:Каучуки
Натуральный каучук получают из латекса – сока некоторых тропических растений. Его строение можно установить по химическим свойствам: каучук… Молекулярная масса каучука изменяется от 100 тыс. до 3 млн. Каждое элементарное звено в полиизопрене может…ЛИТЕРАТУРА
1. Артеменко А. И. Органическая химия. М.: Высшая школа, 2005.
2. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 2002.
3. Балезин С. А., Ерофеев Е. Е., Подобаев Н. И. Основы физической и коллоидной химии. М.: Просвещение, 1975.
4. Васильев В. П. Аналитическая химия. Ч. 1, 2. М.: Высшая школа, 1989.
5. Глинка Н. Л. Задачи и упражнения по общей химии. Л.: Химия, 1983.
6. Глинка Н. Л. Общая химия. М.: Интеграл-Пресс, 2006.
7. Добычин Д. П. Физическая и коллоидная химия. М.: Просвещение, 1986.
8. Иванов В. Г., Горленко В. А., Гева О. Н. Органическая химия. М.: Академия, 2005.
9. Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. М.: КолосС, 2006.
10. Логинов Н. Я., Воскресенский А. Г., Солодкин И. С. Аналитическая химия. М.: Просвещение, 1979.
11. Некрасов Б. В. Основы общей химии. Т. 1, 2. М.: Химия, 1973.
12. Перекалин В. В., Зонис С. А. Органическая химия. М.: Просвещение, 1982.
13. Угай Я. А. Общая и неорганическая химия. М.: Высшая школа, 2004.
14. Филиппович Ю. Б. Основы биохимии. М.: Агар, 1999.
ПРИЛОЖЕНИЯ
Растворимость неорганических веществ в воде при 25°C
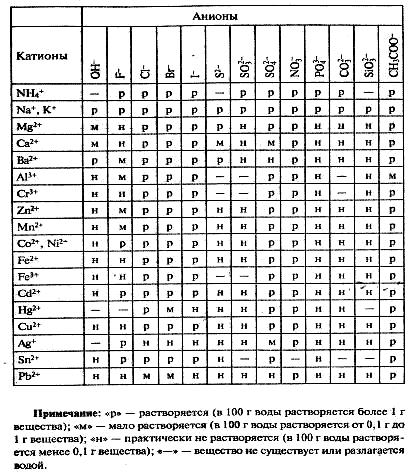
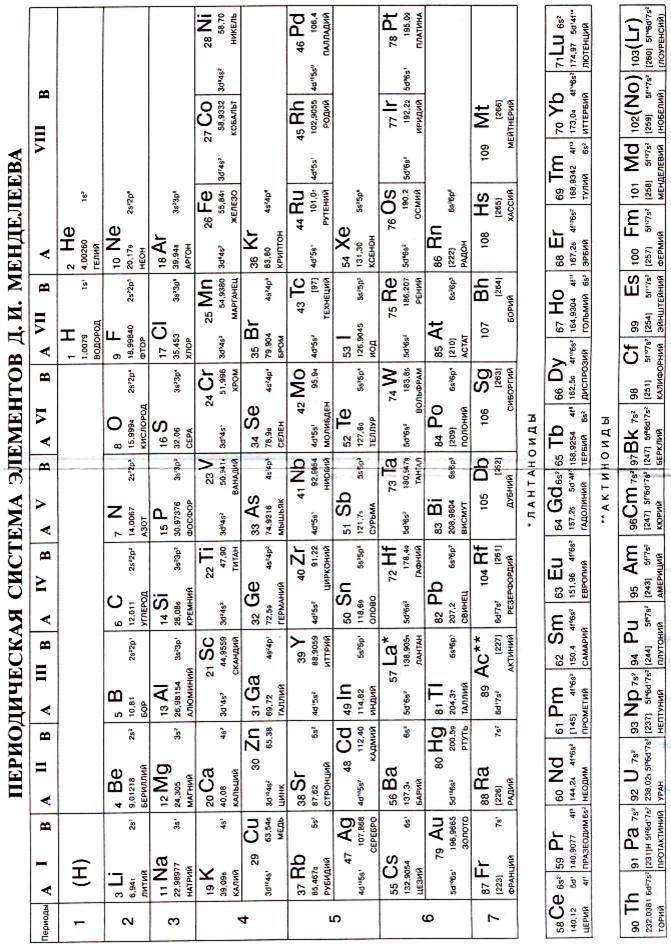
– Конец работы –
Используемые теги: Химия0.045
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ХИМИЯ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов