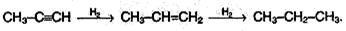Химические свойства
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии – присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Этой объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
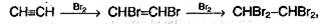
суммарно:
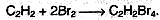
Алкины, так же как и алкены, обесцвечивают бромную воду.
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 – сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используют для получения важного полимера – поливинилхлорида.

В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:

3. Гидратация (реакции Кучерова). Присоединение воды к алкинам катализируется солями ртути (II):
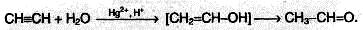
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом π-связь между атомами углерода разрывается, и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С.
В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:
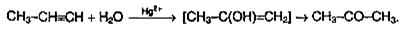
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией σ-связи: ≡С←Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами:
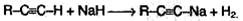
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эти реакции служат для обнаружения алкинов с тройной связью на конце цепи.
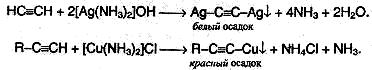
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
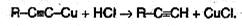
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4CI ацетилен димерзуется, давая винилакдетилен:
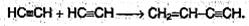
Винилацетелен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
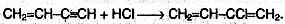
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризацш ацетилена с образованием бензола:
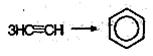
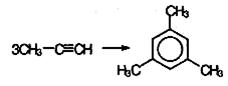
В аналогичные реакции тримергоации могут вступать также и ближайшие гомологи ацетилена, например:
6. Реакции окисления и восстановления. Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:
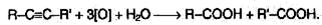
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы: