Запитання до семінару
1. Які сполуки кальцію: а) найбільше розповсюджені в природі; б) мають найбільше застосування.
2. Які елементи належать до металів? Що характерне для їх електронних конфігурацій? Метали у періодичній системі.
3. Які у металів спільні характерні ознаки (фізичні властивості) та чим вони зумовлені? Металічний зв'язок.
4. Що таке сплави? Як вони утворюються та як їх вивчають?
5. Як визначають та чим характеризують хімічну активність металів? Які загальні хімічні властивості у металів?
6. Чому активні метали схильні до корозії? Як протікає та від чого залежить цей процес? Які є способи захисту металів від корозії?
7. Які загальні промислові способи добування металів? В чому їх суть?
8. Які метали належать до лужних? Чим зумовлена така назва? Якими спільними ознаками вони характеризуються?
9. Які сполуки натрію і калію: а) найбільше розповсюдженні в природі; б) мають найбільше застосування.
10. Що таке твердість води? Комплекс яких властивостей охоплює цей термін? Як зм’якшують воду?
11. Як охарактеризувати властивості алюмінію та його сполук, виходячи з положення елемента у періодичній системі?
12. Як довести амфотерність сполук алюмінію?
13. Що бажано знати про сполуки алюмінію в природі та його роль у техніці?
14. Який хімічний характер мають оксиди та гідроксиди феруму? Чи залежать їх властивості від ступеня окиснення Феруму?
15. Що треба знати про сполуки Феруму в природі та роль заліза і його сплавів у техніці?
16. Яку масу солі можна одержати з сульфатної кислоти масою 30 г і ферум(ІІІ) гідроксиду, якщо якщо вихід реакції становить 90 % ?
17. Із Сульфур(VI) оксиду масою 40 г було здобуто сульфатну кислоту масою 82,32 г. Обчисліть вихід реакції.
18. Яку масу Сульфур(VI) оксиду необхідно взяти для одержання сульфатної кислоти масою 73,5 г, якщо вихід реакції становить 75 % ?
19. Яку масу сульфатної кислоти можна одержати із Сульфур(VI) оксиду масою 40 г, якщо вихід реакції – 80 % (0,8) ?
20. Яку масу цинк хлориду буде здобуто, якщо для реакції взято цинк масою 13,65 г і хлор масою 14,2 г? При обчисленнях врахуйте, що масова частка виходу продукту реакції становить 85 %.
21. Який об’єм Сульфур(IV) оксиду необхідно взяти для реакції окиснення киснем, щоб одержати сульфур(VІ) оксид масою 20 г, якщо вихід продукту продукту реакції дорівнює 80 % ? Об’єм обчисліть за нормальних умов.
22. При взаємодії магній оксиду масою 10 г із сульфатною кислотою здобуто магній сульфат масою 26,4 г. Обчисліть масову частку виходу продукту реакції.
23. Із гідраргірум(ІІ) оксиду масою 86,8 г було здобуто кисень масою 6 г. Обчисліть масову частку виходу кисню.
24. Для одержання амоній гідрогенкарбонату крізь надлишок розчину вугільної кислоти пропустили амоніак об’ємом 5,6 л (н.у.). Знайдіть масу одержаного продукту, якщо вихід його продукту реакції дорівнює 96 %.
25. При взаємодії магнію з киснем було здобуто магній оксид масою 18,4 г, причому масова частка виходу продукту реакції склала 92 %. Визначте, яку масу магнію було взято для реакції.
Семінар № 4
Тема: Теорія хімічної будови. Насичені вуглеводні, їх властивості, добування, застосування.
Мета: Розширити та поглибити знання про властивості та взаємозв’язок будови речовин. Сформувати поняття про хімічну будову органічних сполук. Знати властивості, добування, застосування насичених вуглеводнів.
Література: 1. М.В. Горский “Обученые основам общей химии” М. Просвещение 1991.
2. І.Г. Хомченко “Загальна хімія” Київ “Вища школа” 1993 р.
Методичні вказівки.
Хімія сполук вуглецю називаєтьcя органічною хімією. Так визначив предмет органічної хімії великий російський хімік О.М.Бутлеров.
Органічна хімія має велике наукове і практичне значення. Вона сприяє розвитку суміжних галузей науки - біології, медицини, біохімії, агрохімії тощо.Велике значення має органічна хімія для сільського господарства. Органічні добрива, засоби боротьби з шкідниками рослин, засоби, що прискорюють або сповільнюють ріст рослин і розвиток плодів, - все це органічні речовини.
Велику роль у розвитку органічної хімії відіграла теорія хімічної будови органічних сполук, засновником якої був великий російський хімік - органік О.М.Бутлеров. Розглянемо основні положення цієї теорії.
До робіт О.М.Бутлерова не приділялося достатньо уваги уявленням про розміщення атомів у молекулах, хоча атомно-молекулярне вчення вже утвердилося в хімії. О.М.Бутлеров ввів поняття про хімічну будову - чітко визначений порядок розміщення атомів у молекулі. В основу теорії будови було покладено валентністьелементів - важливу властивість атомів, яка характеризує їхню здатність до утворення хімічних зв'язків. Згідно з теорією Бутлерова в молекулах речовин атоми сполучені один з одним у певній послідовності відповідно до їхньої валентності, тобто молекули мають точну хімічну будову.
Хімічну будову молекул органічних речовин записують за допомогою структурних формул, у яких зазначають усі їх і хімічні зв'язки між атомами, зв'язок зображають рискою. Згідно з електронною теорією одна риска в структурних формулах означає електронну пару, що сполучає атоми.
Структурні формули сполук можна зображувати у спрощеній формі, вказуючи тільки зв'язки між атомами вуглецю. Наприклад, формули етану, етилену і пропану можна записати так: СН3 - СН3 ; СН2 = СН2 ; СН3 - СН2 - СН3.
Основні положення теорії хімічної будови:
1) атоми в молекулах сполучені у певній послідовності, тобто молекули мають певну хімічну будову;
2) будова молекул зумовлена електронною будовою атомів, що входять до складу молекул;
3) властивості речовини визначаються хімічною будовою молекул та їхнім складом;
4) атоми в молекулах чинять взаємний вплив один на одного, тобто реакційна здатність атомів залежить від того, з якими атомами вони сполучені в молекулі.
Вуглеводні - це сполуки, які складаються із вуглецю і водню. Загальна формула 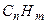 .
.
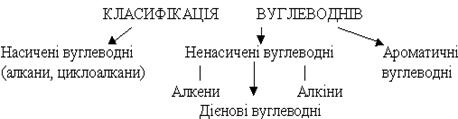
Алкани є найпростішими вуглеводнями. Всі атоми вуглецю в молекулах алканів сполучені один з одним простими, одинарними зв'язками. Алкани називають також парафінами, насиченими вуглеводнями.
Найпростіший алкан - метан СН4, молекула якого складається з одного атома вуглецю і чотирьох атомів водню.
Склад молекул усіх алканів відповідає загальній формулі СnН2n+2, де п = 1, 2, 3, 4…. Отже, алкани - це вуглеводні, склад молекул яких відповідає загальній формулі СnН2n+2.
Для алканів характерна структурна ізомерія, яка зумовлена можливістю розгалуження вуглецевого ланцюга молекули. Вуглеводень з прямим, нерозгалуженим ланцюгом називається нормальним ізомером. У алканах з розгалуженим ланцюгом замісники (бічні ланцюги) можуть займати різне положення відносно головного ланцюга. Речовини, що мають однаковий склад, але різняться будовою вуглецевого ланцюга, називаються структурними ізомерами.