Обработка результатов эксперимента
1. Водород находится в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляют по формуле:
P = Pатм − P1 − P2,
где Р1 – давление столба воды в бюретке, Па, Р1 = 9,8hdaq, 9,8 – переводной коэффициент из мм вод.ст. в Па; daq – плотность воды, равная 1 г/см3; Р2 – давление насыщенного водяного пара, которое находят по таблице 1.
Таблица 1
Зависимость давления насыщенного водяного пара от температуры
| Т, К | ||||||
| Р2, Па | 1226,4 | 1706,2 | 2332,7 | 3172,5 | 4238,9 | 5625,3 |
2. Массу выделившегося водорода mH вычисляют по уравнению Менделеева–Клапейрона:
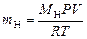 ,
,
где МН – молярная масса водорода, г/моль; V – объем водорода, м3; R – универсальная газовая постоянная, равная 8,314 Дж/моль·К.
3. Вычислить эквивалент металла по закону эквивалентов:
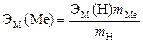 ,
,
где ЭМ(Н) – эквивалентная масса водорода, равная 1 г/экв
4. По степени окисления металла, указанной преподавателем, определить молярную массу металла. Установить, что это за металл.
5. Вычислить точное значение эквивалентной массы металла и найти относительную погрешность эксперимента:
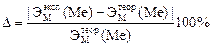 .
.