рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ОБЩая ХИМИя
Реферат Курсовая Конспект
ОБЩая ХИМИя
ОБЩая ХИМИя - раздел Химия, Государственный Комитет Рф По Высшему Образованию Санкт-Петербургски...
Государственный комитет РФ по высшему образованию
Санкт-Петербургский государственный горный институт
имени Г.В.Плеханова (технический университет)
Кафедра общей и физической химии
ОБЩая ХИМИя
Лабораторный практикумВведение
Лабораторные работы по общей и неорганической химии проводятся с целью закрепления теоретического материала, который излагается на лекциях и самостоятельно прорабатывается студентами по учебникам и учебным пособиям. В ходе лабораторного практикума студенту ставится задача освоить приемы и методы ведения химического эксперимента, приобрести навыки работы с аппаратурой и реактивами, научится основным способам обработки экспериментальных данных и оценки погрешностей полученных результатов.
Методические указания в сжатой форме знакомят студентов с основными теоретическими положениями, относящимися к данной лабораторной работе или группе лабораторных работ со схожей тематикой, основным оборудованием и приемами работы на нем, правилами оформления лабораторных протоколов, обработкой результатов эксперимента.
Рекомендуется следующий порядок выполнения работ. В начале семестра студенты получают у преподавателя график выполнения лабораторных работ (или могут ознакомиться с ним на доске объявлений кафедры общей и физической химии). Студенты должны приходить на лабораторную работу заранее подготовленными: иметь при себе методические указания к лабораторной работе и бланк протокола лабораторной работы. Протокол заполняется студентом в ходе выполнения лабораторного практикума. Содержание протокола имеется в методических указаниях к лабораторной работе.
Перед выполнением лабораторной работы студенты должны получить к ней допуск. Для допуска требуется знание теоретических основ выполняемой работы в пределах данных методических указаний, хода ее выполнения, порядка записи и обработки результатов измерений и вычисления погрешностей, наличие протокола ведения эксперимента, содержащего необходимые исходные данные и таблицы для записи экспериментальных данных (образец протокола см. приложение 1).
Для выполнения экспериментов после получения допуска студент получает от преподавателя индивидуальное задание. Полученные результаты эксперимента должны быть сразу занесены в протокол. Он должен быть выполнен по возможности аккуратно, в протокол необходимо занести используемое оборудование, реактивы, все экспериментальные данные, концентрации использованных растворов и др. В конце работы экспериментальные данные предъявляются преподавателю. Протокол является неотъемлемой частью отчета и должен быть подписан преподавателем с указанием даты выполнения работы. Исправления, подтирки, корректор в протоколе не допускаются. Новые измерения должны заноситься ниже прежних и опять подписываться преподавателем. Отчет без подписанного протокола на проверку не принимается, а лабораторная работа выполняется вновь.
Отчет по лабораторной работе вместе с черновиком сдается преподавателю не позднее начала следующей лабораторной работы. Отчет должен быть оформлен в соответствии с индивидуальным заданием согласно методическим указаниям к конкретной работе.
Преподаватель проверяет отчет и может возвратить его для исправления ошибок либо для переделки лабораторной работы. Возврат отчета на исправление допускается не более двух раз и только в течение месяца со дня выполнения работы. По истечении этого срока, если отчет не принят, работа подлежит переделке с новым персональным заданием. Принятый отчет подлежит защите. На защите требуется знание теоретического материала по данной работе и хода эксперимента.
Правила работы в лаборатории
Никакие вещества в химической лаборатории нельзя пробовать на вкус, а нюхать следует с большой осторожностью, направляя к себе пары или газ… При нагревании раствор в пробирке может бурно вскипеть, поэтому не следует… Концентрированные кислоты и щелочи, сильно пахнущие и ядовитые жидкости хранят в вытяжном шкафу в склянках из толстого…Определение эквивалентной массы
Сущность работы. Один из основных законов химии – закон эквивалентов – гласит: «массы веществ, вступивших в реакцию, пропорциональны их химическим…Общие сведения
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой ЭМ называется масса одного эквивалента вещества, т.е. масса вещества и количество эквивалентов связаны уравнением:
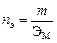 .
.
Для газов эквивалентным объемом называется объем, занимаемый при данных условиях одним эквивалентом вещества. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известны пользуясь законом эквивалентов: вещества взаимодействуют друг с другом в эквивалентных количествах.Например, для реакции:
aA + bB = cC + dD
nэ(А) = nэ(B) = nэ(C) = nэ(D) или
 .
.
Отсюда следует другая формулировка закона эквивалентов: массы взаимодействующих веществ пропорциональны их эквивалентным массам, например,
 .
.
На основе закона эквивалентов можно вывести общую формулу для вычисления эквивалентных масс веществ:

где М – молярная масса элемента, оксида, кислоты, основания или соли, г/моль; Z – степень окисления элемента в продукте реакции, произведение числа атомов элемента и степени окисления элемента в оксидах, основность кислоты, кислотность основания, произведение числа атомов металла и степени окисления металла в соли.
Контрольные вопросы
1. Что называется эквивалентом элемента?
2. Что такое эквивалентная масса вещества?
3. Как связаны между собой эквивалент и эквивалентная масса?
4. Как вычислить эквивалентную массу кислоты, зная ее молярную массу?
5. Как вычислить эквивалентную массу основания, зная его молярную массу?
6. Как вычислить эквивалентную массу соли, зная ее молярную массу?
7. Как определить эквивалентную массу химического элемента, если известна его степень окисления (валентность)?
8. Как формулируется закон эквивалентов?
9. Как при помощи закона эквивалентов определить эквивалентную массу вещества?
10. Как вычислить эквивалентную массу сложного вещества, если известны эквивалентные массы составляющих его элементов?
Лабораторная работа № 1. Определение эквивалентной массы металла
Оборудование и реактивы
Выполнение работы
2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не… 3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше… 4. В колбу Вюрца (круглодонная колба с боковым отводом) при помощи мерного цилиндра отобрать 15−20 мл соляной…Содержание протокола лабораторной работы
Масса навески металла, mМе = ……….г.
Объем соляной кислоты, VHCl = …………….мл.
Объем воды в бюретке в начале эксперимента V1 = ……..мл.
Объем воды в бюретке в конце эксперимента V2 = ……..мл.
Объем выделившегося водорода Vизм = V1 − V2 = ……….мл.
Высота столба воды в бюретке, h = …………..мм.
Атмосферное давление в лаборатории Pатм = ……..мм.рт.ст.
Температура в лаборатории, Т = ……°С.
Обработка результатов эксперимента
P = Pатм − P1 − P2, где Р1 – давление столба воды в бюретке, Па, Р1 = 9,8hdaq, 9,8 – переводной… Таблица 1Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Лабораторная работа № 2. Определение эквивалента карбоната натрия
Цель работы: провести определение эквивалентной массы карбоната натрия по известному эквиваленту диоксида углерода.
Оборудование и реактивы
Выполнение работы.
2. Тем же раствором наполнить бюретку. 3. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в… 4. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы.Содержание протокола лабораторной работы
Масса навески карбоната натрия, m = ……….г.
Объем соляной кислоты, VHCl = …………….мл.
Объем насыщенного раствора хлорида натрия в бюретке в начале эксперимента V1 = ……..мл.
Объем насыщенного раствора хлорида натрия в бюретке в конце эксперимента V2 = ……..мл.
Объем выделившегося углекислого газа Vизм = V1 − V2 = ……….мл.
Высота столба насыщенного раствора хлорида натрия в бюретке, h = …………..мм.
Атмосферное давление в лаборатории Pатм = ……..мм.рт.ст.
Температура в лаборатории, Т = ……°С.
Обработка результатов эксперимента
вычислить массу диоксида углерода. 2. Для определения давления следует из атмосферного давления Ратм вычесть давление столба жидкости рр-ра:Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Лабораторная работа № 3. Исследование скорости химических реакций и химического равновесия
Большинство химических реакций являются обратимыми. Все обратимые процессы протекают не полностью, а лишь до состояния равновесия, которое… Цель работы: изучить зависимость скорости реакции от концентрации реагентов и…Общие сведения
Средняя скорость реакции равна изменению молярной концентрации реагента в единицу времени при постоянстве объема системы. Единица измерения в СИ: моль/м3с. Истинная скорость реакции равна модулю производной концентрации по времени:
 .
.
Скорость реакции пропорциональна числу столкновений между молекулами реагентов, которое определяется произведением их концентраций. Если в акте реакции участвуют несколько молекул одного из реагентов, то его концентрацию надо перемножить соответствующее число раз, то есть возвести в степень. Для одностадийной реакции типа:
aА + bВ = ¼
скорость будет равна:
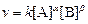 ,
,
где [А] и [В] – молярные концентрации реагентов, k – коэффициент пропорциональности, называемый константой скорости реакции. Константа скорости не зависит от времени протекания реакции и концентрации реагентов, но зависит от природы участников реакции, температуры и присутствия катализаторов. Если реакция протекает в несколько стадий, то значения a и b равны стехиометрическим коэффициентам в уравнении самой медленной стадии реакции, лимитирующей скорость всего процесса. Их называют частными порядками реакции по данным реагентам. Общий порядок реакции n равен сумме частных порядков:
n = a + b.
Реакция разложения тиосульфата натрия, которую мы будем изучать в данной работе, является процессом первого порядка, n = 1. Следовательно, скорость пропорциональна концентрации тиосульфата в первой степени:
–dС/dt = kС
Проинтегрируем это уравнение от исходной концентрации С0 до концентрации в текущий момент времени Сt:

Полученное уравнение позволяет рассчитать концентрацию реагента в любой момент времени. Необходимое для расчетов значение константы скорости определяют по экспериментальной зависимости концентрации реагента от времени протекания реакции. Для реакции первого порядка зависимость lnС = f(t) прямолинейная, при этом ее угловой коэффициент равен константе скорости.
Скорость реакции резко зависит от температуры. Известно эмпирическое правило Вант-Гоффа: «При увеличении температуры на 10 K скорость химических реакций возрастает в 2–4 раза»:
 ,
,
где g – температурный коэффициент скорости реакции.
Причина столь значительной температурной зависимости скорости реакций в том, что для перестройки химических связей в молекулах в ходе элементарного акта реакции требуются большие затраты энергии. Расчеты показывают, что лишь одно из 1010–1020 столкновений молекул реагентов заканчивается химическим превращением. В остальных случаях кинетической энергии частиц оказывается недостаточно для перестройки связей. Минимальное количество кинетической энергии молекул, необходимое для протекания элементарного акта реакции при их столкновении, называют энергией активации. Домножив ее на число Авогадро, получим молярную энергию активации Еа, которую измеряют в Дж/моль. Из закона Максвелла и Больцмана следует, что число частиц с высокими энергиями теплового движения, а значит и число активных столкновений, увеличивается экспоненциально с ростом температуры, чем и обусловлены высокие температурные коэффициенты скорости химических реакций.
В 1889 г. знаменитый шведский химик Аррениус вывел уравнение, связывающее константу скорости с температурой и энергией активации, согласно которому, константа скорости находится в экспоненциальной зависимости от температуры:
 ,
,
где R – универсальная газовая постоянная, равная 8,314 Дж/моль×K; kmax – предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными. Уравнение Аррениуса используют чаще в логарифмической форме:
lnk = lnkmax – Ea/RT,
согласно которой, графическая зависимость lnk = f(T–1) является прямолинейной. Ее строят по опытным данным. Отрезок, отсекаемый на оси ординат при экстраполяции прямой, равен lnkmax. Угловой коэффициент равен –Ea/R. Определив параметры уравнения Аррениуса, можно рассчитать скорость реакции при любой заданной температуре.
Большинство химических реакций являются обратимыми, то есть могут протекать как в прямом, так и в обратном направлениях. Рассмотрим обратимую реакцию:
aA + bB = cC + dD
Скорости прямой и обратной реакций связаны с концентрациями реагентов следующими уравнениями:
vпр = kпр[A]a[B]b;
vобр = kобр[C]c[D]d.
С течением времени скорость прямой реакции будет уменьшаться вследствие расхода реагентов А и В и понижения их концентраций. Напротив, скорость обратной реакции по мере накопления продуктов С и D будет возрастать. Поэтому через некоторый промежуток времени скорости прямой и обратной реакций сравняются друг с другом. Установится состояние системы, в котором отсутствуют потоки вещества и энергии, называемое химическим равновесием. Все обратимые процессы протекают не полностью, а лишь до состояния равновесия, в котором из условия vпр = vобр следует математическое выражение закона действующих масс, который позволяет рассчитывать состав равновесной реакционной смеси:
 ,
,
где K – константа химического равновесия, которая зависит от температуры и природы реагентов, но не зависит от концентрации последних.
Переход от одного равновесного состояния к другому в результате изменения внешних условий (температуры, давления, добавки одного из реагентов) называют смещением равновесия. Если изменение условий вызвало рост концентрации продуктов реакции, то говорят: равновесие сместилось в сторону прямой реакции. Напротив, уменьшение выхода продуктов означает смещение равновесия в сторону обратной реакции.
На практике важно добиться максимально возможного смещения равновесия в сторону прямой реакции (или обратной, если требуется подавить образование вредных веществ). Условия для этого выбирают на основе принципа, сформулированного известным французским металлургом Ле-Шателье: «равновесие смещается в сторону реакции, ослабляющей оказываемое на систему внешнее воздействие». Например, при повышении температуры равновесие смещается в сторону эндотермической реакции, протекающей с поглощением тепла. При добавлении в систему одного из реагентов, равновесие смещается в сторону реакции, в которой этот реагент расходуется.
Контрольные вопросы
1. Что называется скоростью химической реакции?
2. Какие факторы влияют на скорость химической реакции?
3. Что называется порядком реакции по данному веществу?
4. Что такое общий (суммарный) порядок реакции?
5. От каких факторов зависит величина константы скорости реакции?
6. Как влияет величина концентрации реагирующих веществ на скорость процесса?
7. Что называется кинетическим уравнением реакции?
8. Как влияет температура на скорость реакции?
9. Как формулируется правило Вант-Гоффа?
10. Какие величины входят в уравнение Аррениуса?
11. Что такое энергия активации?
12. За счет изменения какой величины катализаторы влияют на скорость процесса?
13. Что такое химическое равновесие?
14. Что такое константа равновесия?
15. Какие факторы влияют на положение химического равновесия?
16. От каких факторов зависит величина константы равновесия?
17. Какова формулировка принципа Ле-Шателье?
18. Как влияют катализаторы на положение химического равновесия и константу равновесия?
19. Как на основании экспериментальных данных определить константу скорости реакции первого порядка?
20. Как на основании экспериментальных данных определить величину энергии активации?
Оборудование и реактивы
В штативе: тиосульфат натрия – 1 н. раствор, серная кислота – 2 н. раствор, роданид (тиоцианат) аммония – 0,5 н. раствор, хлорид железа (III) – 0,5 н. раствор, роданид аммония – 0,0025 н. раствор, хлорид железа (III) – 0,0025 н. раствор, сульфат меди – 1 н. раствор, хлорид аммония – кристаллический. В вытяжном шкафу: соляная кислота – концентрированный раствор. Получать в лаборантской: термометр, пробирки – 7 шт., химический стакан объемом 150 мл; мел (карбонат кальция).
Выполнение работы
Опыт 1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде
Таблица 13. Приготовление растворов Номер пробирки Число капель …Опыт 2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде
Обе пробирки с растворами поместить в термостат, отметить температуру по термометру и термостатировать их в течение 1–2 минут. Быстро вылить кислоту в пробирку с раствором тиосульфата, оставив последнюю в… Повторить опыт еще дважды, повышая температуру воды в термостате примерно на 10 K.Опыт 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
Взять два небольших по возможности одинаковых кусочка мела. Один из них положить на кусочек фильтровальной бумаги и стеклянной палочкой измельчить его в порошок. Полученный порошок поместить в пробирку. Второй кусочек мела целиком опустить в другую пробирку. В обе пробирки одновременно добавить одинаковое количество (10−20 капель) концентрированной соляной кислоты. Отметить время полного растворения мела в каждом случае.
Опыт 4. Влияние катализатора на скорость реакции
В две пробирки внести по 10 капель 0,5 н. раствора роданида калия и по 1 капле 0,5 н. раствора хлорида железа (III). Что наблюдается? В одну из пробирок добавить 1 каплю 1 н. раствора сульфата меди. В обе пробирки внести по 10 капель тиосульфата натрия. Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия.
Опыт 5. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония
Сопоставить цвета растворов во всех пробирках и сделать выводы о направлении смещения равновесия, учитывая, что в реакции: FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl цвет раствора определяет интенсивно окрашенный тиоцианат железа Fe(CNS)3.Содержание протокола лабораторной работы
Опыт 1 – таблица 2. Зависимость времени реакции от количества тиосульфата натрия
| Номер пробирки | С(Na2S2O3) (относительные единицы) | Время реакции t, с |
| 1 (4) | ||
| 2 (8/4) | ||
| 3 (12/4) |
Опыт 2 – таблица 3. Зависимость времени реакции от температуры
| № п/п | Температура, °С | Время, t, сек. |
Опыт 3 – таблица 4. Зависимость времени реакции от степени измельчения
| № пробирки | Состав системы | Время, t, сек. |
| Мел кусочком + HCl | ||
| Мел в порошке + HCl |
Опыт 4 – таблица 5. Зависимость времени реакции от состава системы.
| № пробирки | Состав системы | Время, t, сек. |
| 10 капель NH4CNS 0,5 н. 1 капля FeCl3, 0,5 н. | ||
| 10 капель NH4CNS 0,5 н. 1 капля FeCl3, 0,5 н. 1 капля CuSO4, 1 н. |
Опыт 5 – таблица 6. Зависимость положения равновесия от состава системы
| № пробирки | Состав системы | Добавленный реактив | Наблюдения |
| ……..капель 0,0025н. FeCl3 ……..капель 0,0025 н. NH4CNS | нет | ||
| FeCl3 | |||
| NH4CNS | |||
| NH4Cl |
Обработка экспериментальных данных
Опыт 1
1. Заполнить таблицу 7.
Таблица 7
Зависимость скорости реакции от концентрации тиосульфата натрия
| № пробирки | С(Na2S2O3) (относительные единицы) | lnCотн = ln(Ci/C1) | Время реакции t, с | Скорость реакции v = 1/τ, с−1 |
| 0,693 | ||||
| 1,10 |
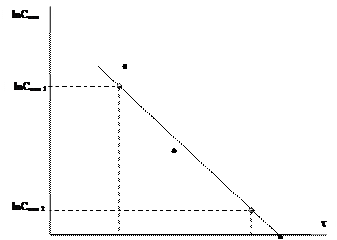
2. По данным таблицы 7 построить график зависимости скорости реакции от концентрации тиосульфата натрия.
3. По данным таблицы 7 построить график зависимости в координатах lnCотн – t. Провести линию тренда – должна быть прямая зависимость. Определить тангенс угла наклона прямой. Значение тангенса угла наклона соответствует величине константы скорости реакции.
Как определять тангенс угла наклона!
Транспортиром не измерять!!!!!!!!!!
1. Выбрать на графике 2 точки подальше друг от друга.
2. По осям координат определить значения lnCотн и t для этих точек (см. рис.).
3. 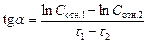 .
.

 4. Составить кинетическое уравнение, учитывая, что порядок реакции по обоим реагирующим веществам равен 1.
4. Составить кинетическое уравнение, учитывая, что порядок реакции по обоим реагирующим веществам равен 1.
Опыт 2
1. По данным таблицы 3 заполнить таблицу 8.
Таблица 8
Зависимость скорости реакции от температуры
| № п/п | Температура T, K | Время реакции t, сек. | Скорость реакции v = 1/τ, с−1 | g | Ea, кДж/моль | |
| T1 | g1 | Ea, 1 | ||||
| T2 | ||||||
| g2 | Ea, 2 | |||||
| T3 |
2. Значение температурного коэффициента (коэффициента Вант-Гоффа) рассчитать по формуле:
 ,
,
рассматривая попарно Т2 − Т1 и Т3 − Т2.
3. Значение энергии активации рассчитать исходя из формулы:
 ,
,
рассматривая попарно Т2 − Т1 и Т3 − Т2.
4. Определить среднее значение коэффициента Вант-Гоффа gср.
5. Определить среднее значение энергии активации Ea, ср.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Опыт 1
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 1 и таблица 2)
= обработка экспериментальных данных (таблица 7, графики, расчеты, значение константы скорости, кинетическое уравнение)
= вывод по опыту 1.
4. Опыт 2
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 3)
= обработка экспериментальных данных (таблица 8, расчеты)
= вывод по опыту 2
5. Опыт 3
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 4)
= написать уравнение соответствующей реакции. Почему скорость растворения мела в этих двух случаях различна?
= вывод по опыту 3
6. Опыт 4
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 5)
= Написать уравнения реакций взаимодействия хлорида железа (III) с тиоцианат калия, в результате которого образуется Fe(SCN)3 красного цвета и восстановления железа (III) в железо (II) тиосульфатом натрия, протекающую по уравнению:
2Fe(SCN)3 + 2Na2S2O3 = Na2S4O6 + 2Fe(SCN)2 + 2NaSCN
=Что являлось катализатором в данном опыте?
= вывод по опыту 4
7. Опыт 5
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 6)
= Написать уравнения реакции взаимодействия хлорида железа (III) с тиоцианатом калия, в результате которого образуется Fe(SCN)3 красного цвета;
= Как смещается равновесие при добавлении к реакционной системе хлорида железа и роданида аммония?
= Какой из реагентов больше смещает равновесие реакции в сторону образования продуктов реакции? Почему?
= Как влияет на положение равновесия добавление в систему тиоцианата аммония? В какую сторону смещается равновесие реакции?
= вывод по опыту 5
Лабораторная работа № 4. Приготовление раствора и определение его концентрации
Сущность работы: растворы часто готовят путем разведения более концентрированного раствора до необходимой величины концентрации. Концентрацию…Общие сведения
Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми.
В растворах выделяют растворитель и растворенное вещество. Растворителем называют компонент, который образует непрерывную среду. остальные компоненты, которые распределены в среде растворителя в виде дискретных частиц, называются растворенными веществами. Состав раствора (концентрация) чаще всего выражается следующими способами.
Массовая доля или процентное содержание w – соотношение масс растворенного mв вещества и раствора mр-р, выраженное в долях или процентах.
 .
.
Концентрация, выраженная в граммах на литр, Сг/л – показывает, какая масса растворенного вещества mв, выраженная в граммах, содержится в единице объема раствора Vр-р:
 , г/л.
, г/л.
Молярная концентрация или молярность, СМ – число молей растворенного вещества nв в одном дм3 (л) раствора:
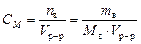 , моль/л.
, моль/л.
Моляльная концентрация или моляльность, Сm– число молей растворенного вещества, приходящееся на один килограмм растворителя:
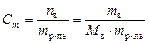 моль/кг.
моль/кг.
Мольная доля или мольные проценты xi – число молей компонента (растворителя или растворенного вещества) содержащееся в одном моле раствора:
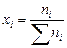 .
.
Нормальная концентрация или нормальность, CN – количество эквивалентов растворенного вещества nэв, содержащееся в одном литре раствора:
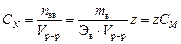 экв/л,
экв/л,
где z – количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле.
Для кислот z соответствует основности кислоты, т. е. числу атомов водорода в составе кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием.
Для оснований z соответствует кислотности основания, т.е. числу гидроксильных групп в составе основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой.
Для солей z рассчитывают как произведение числа атомов и степени окисления металла в составе соли.
Для окислителей и восстановителей в окислительно-восстановительных реакциях z – изменение их степени окисления в ходе реакции.
Прием количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации, называют титрованием. Состояние системы, в котором аналитическая реакция прошла полностью в соответствии со стехиометрическим уравнением при отсутствии избытка реагента, называют точкой эквивалентности. Задача титрования – определить эквивалентный объем добавляемого реагента – титранта, необходимый для установления точки эквивалентности, так как в ней числа эквивалентов определяемого вещества и титранта равны между собой. Из определения нормальной концентрации следует, что число эквивалентов вещества в растворе равно произведению нормальности на объем раствора. Следовательно:
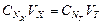 .
.
Отобрав для титрования мерной пипеткой точный объем пробы Vx, зная нормальность титранта 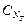 и определив эквивалентный объем VT, можно вычислить концентрацию пробы
и определив эквивалентный объем VT, можно вычислить концентрацию пробы 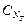 .
.
До эквивалентной точки в ходе титрования в растворе присутствует избыток определяемого вещества, а после – избыток титранта. Поэтому в эквивалентной точке свойства раствора резко изменяются, в частности, изменяется окраска специально подобранных цветных индикаторов, что позволяет определить эквивалентный объем титранта.
Контрольные вопросы
1. Что такое раствор?
2. Какие существуют способы выражения концентрации раствора?
3. Что называется растворенным веществом?
4. Какой компонент раствора принимается за растворитель?
5. По какому уравнению осуществляется перерасчет от нормальной концентрации к молярной?
6. Что называется титрованием?
7. Какое состояние химической системы называется «точка эквивалентности»?
8. Что является задачей титрования?
9. Как экспериментально определить точку эквивалентности при титровании кислоты щелочью?
10. По какому уравнению рассчитывается концентрация анализируемого вещества при ттровании?
Оборудование и реактивы
В лаборатории: штатив с лапкой. Получать в лаборантской: колба мерная объемом 100 мл – 1 шт., колба коническая объемом 100 мл – 2 шт., пипетка мерная объемом 5 мл – 1 шт., бюретка объемом 25 мл – 1 шт., цилиндр мерный объемом 100 мл – 1 шт., ареометр – 1 шт.; кислота соляная – раствор концентрацией 10 %, гидроксид натрия – раствор концентрацией 0,2 н., фенолфталеин.
Выполнение работы
Приготовление раствора
Таблица 1 Плотности водных растворов соляной кислоты при 20 °С Плотность… 2. Рассчитать, какой объем исходного раствора соляной кислоты следует взять для приготовления 100 мл раствора заданной…Определение концентрации приготовленного раствора титрованием
2. Бюретку на 25 мл наполнить титрованным раствором едкого натра. Кончик бюретки должен быть заполнен раствором, а уровень жидкости доведен точно до… 3. Эквивалентную точку определить по переходу окраски фенолфталеина от… 4. Титрование повторить 2−3 раза, измеренные эквивалентные объемы щелочи усреднить.Протокол лабораторной работы
2. Расчет объема соляной кислоты, необходимого для приготовления 100 мл раствора кислоты заданной концентрации. 3. Объем аликвоты соляной кислоты, взятый для титрования, Va = ……., мл. 4. Концентрация раствора щелочи CNaOH = …….., экв/л.Обработка результатов эксперимента
Рассчитать концентрацию соляной кислоты по результатам титрования
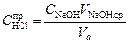
и определить отклонение от заданного значения концентрации соляной кислоты
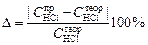 .
.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Результаты эксперимента согласно протоколу лабораторной работы.
5. Обработка результатов эксперимента.
6. Выводы.
Лабораторная работа № 5. Исследование реакций в растворах электролитов
Цель работы: Ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения.
Общие сведения
Электролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.
Количественно способность электролита распадаться на ионы характеризуют степенью диссоциации:
a = n/n0,
где n – число продиссоциированных молей; n0 – исходное число молей электролита.
Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению:
АВ = А+ + В−
При постоянной температуре отношение произведения концентраций конечных и исходных веществ постоянно и называется константой диссоциации:
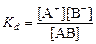 ,
,
где [А+], [В-], [АВ] – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг.
По степени и величине константы диссоциации все электролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе диссоциируют практически полностью, слабые - частично. Закон действующих масс справедлив лишь для слабых электролитов.
К сильным электролитам относят:
= Кислоты: азотную HNO3, серную H2SO4, соляную HCl, бромисто- и йодистоводородные HBr и HI, хлорную HClO4.
= Гидроксиды щелочных металлов, стронция и бария.
= Соли.
Остальные электролиты являются слабыми. Мало диссоциированными соединениями являются также комплексные ионы в растворе. Константы их диссоциации даны в справочниках.
Правила написания молекулярно-ионных уравнений реакций в растворах электролитов.
= Сильные электролиты записывают в диссоциированной форме, в виде отдельных составляющих их ионов.
= Слабые электролиты, сложные ионы, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной, недиссоциированной форме.
= Одинаковые ионы в левой и правой частях уравнения сокращают, подобно правилам алгебры.
Отсюда вытекают условия протекания реакций в растворах электролитов.
= Образование или растворение малорастворимого соединения, выпадающего в осадок. Растворимость соединений определяют по таблицам растворимости.
= Образование или разрушение мало диссоциированного соединения, иона или комплекса.
= Выделение или растворение газа.
Примеры написания уравнений реакций.
а) CaCl2 + 2AgNO3 = 2AgCl$ + Ca(NO3)2
Ag+ + Cl- = 2AgCl
б) 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O

Контрольные вопросы
1. Что называется процессом электролитической диссоциации?
2. Что такое степень диссоциации?
3. Как диссоциируют сильные электролиты?
4. Какие формы вещества содержатся в растворе слабого электролита?
5. Какие кислоты и основания относят к сильным электролитам?
6. Каковы основные правила написания молекулярно-ионных уравнений реакций в растворах электролитов?
7. Каковы условия протекания реакций в растворах электролитов?
8. Почему при составлении ионного уравнения осадки записывают в молекулярной форме?
9. Как диссоциируют комплексные соединения?
10. Что такое константа диссоциации?
Оборудование и реактивы
Выполнение работы
К какому классу относятся полученные осадки гидроксидов металлов? Будут ли эти осадки растворяться в избытке щелочи? Являются ли полученные… Опыт 2. Растворение малорастворимых оснований.К полученным в предыдущем опыте… Что происходит при растворении гидроксидов металлов в кислоте? Какое новое мало диссоциированное соединение при этом…Опыт 9. Смещение равновесия диссоциации слабых электролитов.
Б. Влияние соли слабого основания на диссоциацию этого основания. В две пробирки внести по 5−7 капель 0,1 н. раствора аммиака. В каждую…Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций: образование осадка, выделение газа, изменение цвета раствора и т.д.
Пример:
Опыт 1.
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl, образование аморфного осадка бурого цвета.
Опыт 2.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O, растворение осадка, образование раствора желтого цвета.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
По опыту 8 дополнительно заполнить таблицы и ответить на вопросы
| № | Название гидроксида | Химическая формула | Характер гидроксида | Уравнение диссоциации |
Сколько электронов находится на внешнем электронном уровне ионов Mg2+, Al3+ и атома кремния в степени; окисления +4?
В прямой или обратной зависимости находится усиление кислотных свойств гидроксидов от увеличения заряда ионов (степени окисления атомов), гидроксиды которых рассматриваются?
Радиусы ионов Mg2+, Al3+ и атома Si+4 соответственно равны (по Полингу) 0,065; 0,050 и 0,041 нм. Как влияет изменение радиусов ионов на характер химических свойств гидроксидов?
| Ион, гидроксид которого рассматривается | Радиус иона, нм | Внешняя электронная оболочка иона | Характер гидроксида | Уравнение диссоциации |
| Mg2+ | 0,065 | |||
| Ni2+ | 0,069 | |||
| Zn2+ | 0,071 |
Какое влияние оказывает внешняя оболочка ионов на характер диссоциации гидроксидов, если известно, что Mg(OH)2 − более сильное основание, чем Ni(OH)2? Сделать общий вывод о влиянии радиуса, заряда и внешней электронной оболочки ионов на характер диссоциации гидроксидов.
При написании схем диссоциации амфотерных гидроксидов учесть, что в щелочных водных растворах они переходят в комплексные гидроксоионы.
По опыту 9
Под влиянием каких ионов метиловый оранжевый принимает розовую окраску? На изменение концентрации каких ионов указывает изменение окраски метилового… Объяснить, как смещается равновесие диссоциации кислоты при добавлении к ней ацетата натрия.Лабораторная работа № 6. Исследование гидролиза солей
Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
Общие сведения
Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются. К ним относятся, например, хлориды, нитраты и сульфаты щелочных металлов, стронция и бария. Различают три типа гидролизующихся солей:
Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты: А- + Н2О = НА + ОН-, в растворе появляются ионы ОН-, поэтому среда – щелочная, рН > 7. Например, Na2CO3 образован сильным основанием NaOH и слабой угольной кислотой H2CO3. Диссоциация карбоната натрия описывается уравнением:
 .
.
С водой взаимодействует карбонат-ион по реакции:
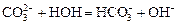 .
.
Распределяя катионы натрия по образующимся в ходе гидролиза анионам, получим молекулярное уравнение гидролиза:
Na2CO3 + H2O = NaHCO3 + NaOH.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания: М+ + Н2О Û МОН + Н+, в растворе появляются ионы Н+, поэтому среда кислая, рН < 7. Например, FeSO4 образован слабым основанием Fe(OH)2 и сильной кислотой H2SO4. Сульфат железа (II) диссоциирует по реакции:
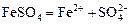 .
.
С водой реагирует остаток слабого основания – катион Fe2+:
Fe2+ + HOH ® FeOH+ + H+.
Так как в ходе гидролиза образуются ионы H+, то среда в растворе FeSO4 будет кислой.
Молекулярное уравнение гидролиза:
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4.
Степень гидролиза солей этих двух групп невелика, не превышает нескольких процентов. Поэтому гидролиз многозарядных ионов протекает не далее первой ступени, то есть ограничивается взаимодействием иона только с одной молекулой воды.
Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону: М+ + А- + Н2О = МОН + НА. Например, ацетат натрия CH3COONa образован слабым основанием NH4OH и слабой кислотой CH3COOH, соответственно с водой взаимодействует и катион аммония и ацетат-ион:

Молекулярная форма реакции:
CH3COONH4 + H2O = CH3COOH + NH4OH
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Степень гидролиза соли, образованной слабой кислотой и слабым основанием многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами гидролиза являются труднорастворимые соединения или газы, то гидролиз протекает полностью. Пример необратимого, полного гидролиза:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
Чем слабее кислота или основание, образующиеся в результате гидролиза, тем выше глубина протекания процесса.
С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Контрольные вопросы
1. Что такое гидролиз?
2. Что является продуктами гидролиза?
3. Какие соли не гидролизуются?
4. Каковы основные типы гидролиза?
5. Как протекает гидролиз соли, образованной сильной кислотой и слабым основанием?
6. Как протекает гидролиз соли, образованной слабой кислотой и сильным основанием?
7. Как протекает гидролиз соли, образованной двумя слабыми электролитами?
8. Что такое степень гидролиза?
9. От каких факторов зависит степень гидролиза?
10. Как можно подавить гидролиз?
11. Что называется взаимным усилением гидролиза?
Оборудование и реактивы
Выполнение работы
Опыт 2. Образование основных и кислых солей при гидролизе.
Б. Гидролиз сульфита натрия. Две капли раствора сульфита натрия нанести на индикаторную бумагу и определить рН. По отсутствию запаха сернистого газа…Опыт 3. Факторы, влияющие на степень гидролиза солей.
В другие две пробирки налить одинаковый объем растворов солей алюминия и магния. Определить рН каждого раствора по универсальной индикаторной… Пробирки с растворами оставить для дальнейших испытаний. Б. Влияние температуры. Растворы из опыта 3А нагреть на водяной бане (греть 3-4 минуты). Отметить изменение окраски…Протокол лабораторной работы
№ Формула соли Окраска лакмуса Окраска фенол-фталеина рН раствора по универсальной индикатороной… Результаты опытов 3А и 3Б занести в таблицу: № Формула… В остальных случаях записать использованные реактивы и результаты наблюденийСодержание отчета по лабораторной работе
Опыт 1. Привести таблицу с результатами эксперимента. Написать уравнения реакций гидролиза в молекулярной и ионной формах. Сделать выводы о характере растворов (кислый или щелочной).
Опыт 2. А. Написать молекулярное и ионное уравнения реакции образования ацетата алюминия и ионное уравнение его гидролиза. Ответить на вопросы, приведенные ниже.
Продуктом какой ступени гидролиза является образовавшийся осадок основной соли?
При гидролизе каких солей могут получаться основные соли?
Б. Составить молекулярное и ионное уравнение гидролиза сульфита натрия. Ответить на приведенные ниже вопросы.
На присутствие каких ионов в растворе указывает найденное значение рН раствора сульфита натрия?
В результате какого процесса эти ионы появились?
Какая соль является продуктом гидролиза сульфите натрия по первой ступени?
Написать молекулярное и ионное уравнения реакции гидролиза сульфита натрия.
При гидролизе каких солей получаются кислые соли?
Опыт 3.
По результатам опыта 3А и 3Б заполнить таблицу
| № | Формула соли | Kd1*) слабого электролита | Цвет фенолфталеина | Цвет лакмуса | рН раствора по универсальной индикаторной бумаге | Изменение окраски после нагревания |
*) Для гидроксидов металлов найти в справочной литературе значение констант нестойкости гидроксокомплексов 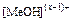 , где х – степень окисления металла.
, где х – степень окисления металла.
Составить молекулярные и ионные уравнения гидролиза.
Ответить на ниже приведенные вопросы.
В каком растворе при гидролизе по аниону концентрация ионов ОН– более высокая?
Степень гидролиза какой соли больше? Почему?
Степень гидролиза какой соли при одинаковых концентрациях и температуре должна быть больше: А1Сl3 или MgCl2?
В растворе какой соли концентрация ионов Н+ выше?
Сделать общий вывод о влиянии силы кислоты и основания, образующих соль, на степень ее гидролиза.
Опыт 3В. Написать ионные уравнения первой и второй ступеней гидролиза хлорида сурьмы (III) и общее уравнение ее гидролиза до образования Sb(OH)2Cl.
Написать формулу для вычисления константы гидролиза хлорида сурьмы (III) для первой ступени. Показать при помощи этой константы, как влияет разбавление на степень гидролиза этой соли.
Сделать общий вывод о влиянии разведения на степень гидролиза солей. Степень гидролиза каких солей не меняется при разбавлении раствора? Добавлением какого реактива можно уменьшить степень гидролиза хлорида сурьмы?
Опыт 3Г. Составить уравнение гидролиза хлорида олова (II) в молекулярной и ионной форме. Ответить на вопросы.
Почему при растворении хлорида олова в воде образуется осадок основной соли?
Добавлением какого реактива можно уменьшить степень гидролиза хлорида олова (II)?
Опыт 4 и 5. Составить ионные и молекулярные уравнения гидролиза. Объяснить причину растворения цинка в растворах солей цинка и алюминия.
Лабораторная работа № 7. Приготовление буферного раствора
Цель работы: научиться выбирать состав буферного раствора с заданным значением рН, рассчитывать количества компонентов, необходимые для приготовления буферного раствора. Познакомиться с понятием емкости буферного раствора и научиться ее определять. Освоить современные методы измерения водородного показателя растворов с помощью рН-метров.
Общие сведения
Буферными называют растворы, способные поддерживать постоянное значение концентрации ионов водорода или гидроксила при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Способность раствора поддерживать определенную кислотность среды называют буферным действием. Буферное действие основано на связывании добавляемых ионов Н+ или ОН- в молекулы малодиссоциированных соединений. Основные типы буферных растворов следующие:
Смесь слабой кислоты и ее соли, например, ацетатный буфер: CH3COOH + CH3COONa. Механизм буферного действия следующий:
а) при добавлении кислоты ионы Н+ связываются анионами соли в молекулы слабой кислоты по реакции:
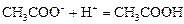 ;
;
б) при добавлении щелочи ионы гидроксила нейтрализуются слабой кислотой по реакции:
 .
.
Смесь слабого основания и его соли, например, аммиачный буфер: NH4OH + NH4Cl. Буферное действие обусловлено протеканием следующих процессов:
а) при добавлении кислоты ионы Н+ нейтрализуются слабым основанием по реакции:
 ;
;
б) при добавлении щелочи ионы гидроксила связываются катионами соли в молекулы слабого основания:
 .
.
Расчет рН кислого буфера проводят на основании константы диссоциации слабой кислоты:
 ,
,
где pKd – показатель константы диссоциации слабой кислоты, pKd = –lgKd; Сс и Ск – концентрации соли и килоты соответственно, моль/л
Для основного буфера можно вывести аналогичную формулу, но для расчета гидроксильного показателя:
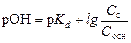 ,
,
где pKd – показатель константы диссоциации слабого основания; Сс и Сосн – концентрации соли и основания соответственно, моль/л
Водородный показатель основного буфера вычисляют по формуле:
рН = 14 − рОН.
Интегральной емкостью буферного раствора называют число молей сильной кислоты или щелочи, которое требуется прибавить к 1 л буферного раствора для изменения его рН на единицу. После этого раствор практически утрачивает буферное действие. Дальнейшее добавление сильной кислоты или щелочи вызывает резкое изменение рН раствора. Поэтому емкость буферного раствора можно определить экспериментально путем титрования сильной кислотой или, соответственно, щелочью с цветными индикаторами. Рассчитывают емкость буферных растворов на основе формул вычисления рН. Емкость кислого буфера по щелочи, ВЩ рассчитывают исходя из уравнения:
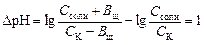 ,
,
при решении которого получается формула:
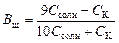 .
.
Емкость кислого буфера по кислоте вычисляют на основе уравнения:
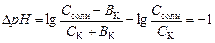 ,
,
из которого выводят расчетную формулу:
 .
.
Емкости основного буфера по кислоте и по щелочи определяются согласно уравнениям:
 и
и  .
.
Выбор состава буферного раствора. Отношение Сс/Ск или Сс/Сосн выбирают в пределах 0,1<Ссоли/Ск-ты <10. По таблицам констант диссоциации подбирают слабую кислоту с pKd=pH±1(или слабое основание с pKd = pOH ±1), исходя из заданного значения рНвычисляют отношение концентраций Сс/Ск (или Сс/Сосн).
Контрольные вопросы
1. Что такое буферный раствор?
2. На протекании каких реакций основано буферное действие?
3. Каковы основные типы буферных растворов?
4. Из каких основных компонентов состоит буферный раствор?
5. По какому уравнению вычисляется рН кислого буферного раствора?
6. По какому уравнению вычисляется рН основного буферного раствора?
7. Что такое интегральная буферная емкость?
8. Как экспериментально определить величину интегральной буферной емкости?
9. По какому уравнению вычисляют теоретическое значение интегральной буферной емкости кислого буферного раствора по кислоте и по щелочи?
10. По какому уравнению вычисляют теоретическое значение интегральной буферной емкости основного буферного раствора по кислоте и по щелочи?
Оборудование и реактивы
Выполнение работы
I. выбрать реактивы для приготовления буферного раствора.
Определение состава буфера с заданным рН начинают с подбора слабой кислоты или слабого основания таким образом, чтобы показатель их константы диссоциации отличался от заданного значения рН или рОН не более, чем на единицу в соответствии с формулой рKd = рН ± 1. При этом пользуются справочными данными.
II. Рассчитать объемы реактивов для приготовления буферного раствора.
Для ацетатного буферного раствора объемы кислоты и соли можно вычислить исходя из системы уравнений: , pKd(CH3COOH) = 4,756. Для аммиачно-хлоридного буферного раствора следует рассчитать объемы гидроксида натрия и хлорида аммония. Необходимый…III. Приготовить буферный раствор и определить его рН
2. Пробу буферного раствора отобрать в химический стакан объемом 50 мл 3. Включить рН-метр. 4. Вынуть электрод рН-метра из раствора хранения и протереть его кусочком фильтровальной бумаги.IV. Определить буферную емкость
1. В две конические колбы объемом 50 мл отбирают пипеткой по 5 мл буферного раствора. 2. К каждой пробе добавляют по 3−4 капли фенолфталеина 3. Титруют 0,05 М раствором NaOH до перехода окраски индикатора от бесцветной к розовой.Протокол лабораторной работы
2. Реактивы для приготовления буферного раствора и их концентрации. Для ацетатного буфера – С(СН3СООН) = …………, моль/л С(CH3COONa) = ……….., моль/лОбработка результатов эксперимента
, моль/л, где СТ и VТ – концентрация и эквивалентный объем титранта, а Va – аликвотный… 2. Рассчитать теоретическое значение буферной емкости.Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные согласно протоколу лабораторной работы
5. Обработка экспериментальных данных
6. Выводы
Лабораторная работа № 8. Исследование растворимости солей
Цель работы – определить, каким закономерностям подчиняется растворимость малорастворимых соединений.
Общие сведения
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора.
Рассмотрим равновесие между солью и ее насыщенным раствором. При этом учтем, что все соли – сильные электролиты, полностью диссоциирующие в растворе.
 .
.
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем ее выражение согласно закону действующих масс:
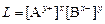 .
.
Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам, при данной температуре – величина постоянная.
Произведение растворимости характеризует сравнительную растворимость веществ: чем больше величина L данного вещества, тем больше его растворимость.
Математическое выражение произведения растворимости используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно приводятся в справочной литературе.
Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, то есть правая часть в формуле произведения растворимости больше левой, то в системе будет происходить образование осадка. При противоположном знаке неравенства осадок будет растворяться.
Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют следующие формулы:
М(ОН)z(т) = Мz+(р-р) + zOH-(р-р);
L = [Mz+][OH-]z.
Из последней формулы находят концентрацию ионов гидроксила, а затем рН гидратообразования.
Контрольные вопросы
1. Какой раствор называют насыщенным?
2. Какая величина соответствует концентрации насыщенного раствора?
3. От каких факторов зависит концентрация насыщенного раствора хорошо растворимых и трудно растворимых веществ?
4. Что такое произведение растворимости?
5. Как величина произведения растворимости связана с растворимостью вещества?
6. При каком условии будет происходить образование осадка?
7. Что называется рН гидратообразования?
8. По какому уравнению рассчитывают теоретическое значение рН гидратообразования?
9. Что такое дробное осаждение?
10. Что такое переосаждение?
Оборудование и реактивы
Выполнение работы
Написать ионное уравнение реакции. При каких условиях выпадает осадок? Пользуясь правилом произведения растворимости, объяснить выпадение осадка… Опыт 2. Дробное осаждение. В двух пробирках получить раздельно хлорид и хромат… Какая соль менее растворима? Какое вещество будет выпадать в осадок в первую очередь из раствора, содержащего ионы…Опыт 3. Сравнение полноты осаждения ионов различными осадителями.
Написать ионные уравнения протекающих реакций. Записать величины произведений растворимости оксалата и хромата бария и объяснить образование осадка… Б. Осаждение солей свинца. Получить хлорид свинца взаимодействием растворов… Написать ионные уравнения реакции образования полученных солей свинца. На основании опыта сделать вывод о…Опыт 4. Условия растворения осадков.
Отметить цвет осадков. К осадкам в каждую пробирку добавить по 2−3 капли раствора аммиака. Размешать содержимое пробирок стеклянной… В каком случае осадок растворяется быстро? Осадок какого вещества практически… Написать уравнения реакций растворения осадков соответствующих галогенидов серебра в водном растворе аммиака,…Опыт 5. Переосаждение малорастворимых веществ
Осадку дать отстояться и кусочком фильтровальной бумаги или пипеткой отобрать жидкую фазу. К осадку добавить 3–4 капли сульфида аммония и перемешать… Б. Получение хромата свинца из сульфата свинца. Получить сульфат свинца: в… Написать уравнения протекающих реакций. Записать величины произведений растворимости полученных, малорастворимых…Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, заполненные таблицы и.т.п.
4. Ответы на вопросы по каждому опыту.
5. Выводы.
Лабораторная работа № 9. Исследование окислительно-восстановительных реакций
Цель работы: познакомиться с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействия между собой и научиться составлять уравнения окислительно-восстановительных реакций.
Общие сведения
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов.
Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов.
Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления равна числу электронов, которое может принять данный элемент на застраивающийся np-подуровень: zmin = N – 8, где N – номер группы. Например, у серы высшая степень окисления равна 6, а низшая: 6 – 8 = −2. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления: фтор −1; кислород −2, кроме пероксидов, в которых степень окисления кислорода −1; щелочные металлы +1; щелочноземельные металлы +2; водород, кроме гидридов и органических соединений, +1.
Степени окисления переменновалентных элементов рассчитывают по правилу баланса зарядов: «сумма степеней окисления всех элементов в соединении равна нулю, а в многоатомном ионе – заряду иона».
Например, в дихромате калия K2Cr2O7 согласно балансу зарядов 2zK + 2zCr + 7zO = 0, следовательно, подставив zK = 1 и zO = −2, получаем zCr = +6; в перманганат-ионе 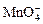 zMn + 4zO = −1, следовательно, zMn = +7.
zMn + 4zO = −1, следовательно, zMn = +7.
Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдает электроны.
Правила составления уравнений окислительно-восстановительных реакций следующие. Возьмем в качестве примера восстановление перманганата нитритом калия в нейтральной среде:
KMnO4 + KNO2 + H2O = ¼
Определяют степени окисления переменновалентных элементов, окислитель и восстановитель. Калий, кислород и водород имеют постоянные значения степеней окисления, указанные выше. По балансам зарядов вычисляем zMn = +7, zN = +3. Поскольку марганец в высшей степени окисления, равной номеру группы, он является окислителем. Азот может повысить степень окисления до номера группы +5, поэтому он является восстановителем.
Составляют ионные уравнения полуреакций окисления и восстановления. Для уравнивания числа атомов кислорода добавляют воду и ионы: H+ в кислой среде или ОН- в щелочной среде.
Восстановление:  .
.
Окисление:  .
.
Приводят число электронов к наименьшему общему кратному, в примере к 6. Для этого уравнения полуреакций домножают на соответствующие коэффициенты, в примере на 2 и 3. Суммируют уравнения полуреакций, сокращая одинаковые члены в левой и правой частях и учитывая нейтрализацию Н+ + ОН- = Н2О. В результате получают ионное уравнение реакции:
 .
.
Составляют молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов:
2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH.
Глубина восстановления перманганата зависит от кислотности среды. В кислой среде перманганат восстанавливается до степени окисления +2 согласно полуреакции:
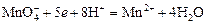 .
.
В нейтральной среде, ввиду недостатка ионов Н+, восстановление идет до MnO2 по приведенной в примере полуреакции. В щелочной среде восстановление заканчивается уже на стадии образования Mn(6+) в форме манганат-иона 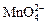 . Уравнение полуреакции:
. Уравнение полуреакции:
 .
.
От кислотности среды зависит также состояние в растворе хрома (VI) вследствие протекания реакций:
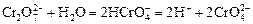 .
.
Cогласно принципу Ле-Шателье, в кислой среде, при избытке ионов Н+, равновесие смещается влево, и хром находится в растворе в форме оранжевого дихромата. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещено вправо, и хром переходит в форму желтого хромата. Окислительная способность хрома (VI) выше в кислой среде. Дихромат – сильный окислитель, восстанавливающийся по полуреакции:
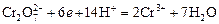 .
.
Хромат – слабый окислитель, поэтому хром (VI) получают обычно окислением хрома (3+) в щелочной среде по полуреакции:
 .
.
Контрольные вопросы
1. Какие реакции называют окислительно-восстановительными?
2. В каком случае элемент является окислителем?
3. В каком случае элемент является восстановителем?
4. Что такое степень окисления?
5. Чему равна максимальная степень окисления элемента?
6. Как определить минимальную степень окисления элемента?
7. Как определить степень окисления соединения в соединении?
8. Как зависит состав продуктов восстановления перманганата калия в зависимости от рН среды?
9. Как зависит состав продуктов восстановления хрома (VI) от рН среды?
10. В какой степени окисления элементы обладают окислительно-восстановительной двойственностью?
Оборудование и реактивы
Выполнение работы
Для всех реакций, выполняемых в ходе работы, необходимо составить уравнения полуреакций окисления и восстановления, а также полные ионные и молекулярные уравнения.
Опыт 1. Окислительные свойства пероксида водорода.Налить в пробирку 3−4 капли раствора пероксида водорода, добавить 2−3 капли 2 н. раствора серной кислоты и столько же раствора иодида калия. К содержимому пробирки добавить крахмал. Обратить внимание на окраску раствора.
Опыт 2. Восстановительные свойства галогенидов.
Б. К 3−4 каплям раствора иодида калия добавить 3−4 капли CCl4 и 2−3 капли бромной воды. Четыреххлористый углерод является… Опыт 3. Восстановительные свойства сульфидов.Налить в пробирку 3−4 капли… Опыт 4. Окислительные свойства сернистой кислоты.Налить в пробирку 3−4 капли раствора сернистой кислоты (или по…Опыт 6. Окислительные и восстановительные свойства нитритов.
Б. К нескольким каплям подкисленного серной кислотой раствора перманганата калия добавить несколько капель раствора нитрита натрия до полного… Опыт 7. Окислительные свойства азотной кислоты.Окислительная способность… А. В две пробирки внести по нескольку крупинок медных стружек. В одну пробирку в вытяжном шкафу прилить 3−5…Опыт 10. Окислительные свойства олова и свинца (IV).
Б. На кончике шпателя внести в пробирку несколько крупинок диоксида свинца, облить их 5−6 каплями концентрированной соляной кислоты. Опыт… Опыт 11. Восстановительные свойства хрома (III).В пробирку внести 1−2… Опыт 12. Окислительные свойства дихромата калия.В три пробирки налить по 8−10 капель раствора дихромата калия и…Опыт 13. Окислительные и восстановительные свойства диоксида марганца.
Б. В пробирку насыпать немного диоксида свинца и прилить 3−5 капель концентрированной азотной кислоты, Смесь нагреть до кипения и прокипятить…Опыт 14. Окислительные свойства перманганата калия в различных средах.
Б. Нейтральная среда. В две пробирки налить по 3 капли раствора перманганата калия; в первую пробирку добавить столько же раствора сульфита натрия,… В. Сильнощелочная среда. В пробирку налить три капли раствора перманганата… Отметить изменение окраски растворов во всех пробирках. Установить, в какой среде окислительные свойства перманганата…Опыт 16. Восстановление Fe (III) в Fe (II).
Б. В пробирку с 3−5 каплями раствора хлорида железа (III) добавить 2−3 капли раствора иодида калия. Объяснить изменение окраски… В обоих опытах доказать присутствие ионов Fe2+ с помощью качественной реакции…Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций: образование осадка, выделение газа, изменение цвета раствора и т.д.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, уравненные методом полуреакций или методом баланса электронов (по указанию преподавателя) и результаты проведения реакций.
Лабораторная работа № 10. Исследование комплексных соединений
Цель работы: познакомиться с методами получения комплексных соединений и их свойствами.
Общие сведения
Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсируют противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральным атомом, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-;
[Co(NH3)4(SO4)]Cl = [Co(NH3)4(SO4)]+ + Cl-.
В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет давать в растворе качественную реакцию на хлорид-ион (образование осадка AgCl) и не будет давать осадок BaSO4 с растворами солей бария.
Первое соединение является анионным комплексом, поскольку содержит в своей структуре и образует при диссоциации в растворе комплексные анионы. Второе соединение является катионным комплексом. Существуют и нейтральные комплексы, у которых внутренняя сфера не имеет заряда, соответственно, внешняя сфера отсутствует, например: [Pt(NH3)2Cl2].
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, но в русском – справа налево. При этом название внутренней сферы произносят в одно слово, используя соединительную гласную «о», название комплексного аниона заканчивают суффиксом «-ат-». Молекулы воды в качестве лигандов обозначают приставкой «аква-», а молекулы аммиака – приставкой «аммино-». Степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов – арабскими цифрами. Например, первое из приведенных выше комплексных соединений мы назовем: гексацианоферрат (III) калия, второе – хлорид сульфатотетраамминокобальта (III), третье – дихлородиамминоплатина (II).
Число связей, образуемых лигандом с центральным атомом, называют дентатностью лиганда. Например, CN-, NH3 – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов, например, координационное число железа в K3[Fe(CN)6] равно 6, координационное число платины в [Pt(NH3)2Cl2] равно 4. Однако в [Co(NH3)4(SO4)]Cl лигандов пять, а координационное число кобальта равно 6, поскольку сульфат-ион бидентатен.
Контрольные вопросы
1. Какие соединения называются координационными или комплексными?
2. Каковы основные структурные единицы комплексного соединения?
3. Каков тип связи во внутренней сфере комплексного соединения?
4. Что такое координационное число?
5. Как оценить дентатность лиганда?
6. Как диссоциируют комплексные соединения?
7. Как протекает диссоциация координационной части комплексного соединения?
Оборудование и реактивы
Выполнение работы
Образование комплексных соединений
Опыт 2. Получение амминокомплекса никеля. Налить в пробирку 3−4 капли раствора сульфата никеля. Добавить каплю разбавленного раствора аммиака,…Опыт 3. Образование и реакции амминокомплекса меди.
Получить комплексное соединение меди, для чего поместить в пробирку несколько капель раствора сульфата меди и по каплям добавлять концентрированный… Полученный раствор разделить в две пробирки и провести те же два опыта,… Учитывая, что данные по мольной электропроводности раствора комплексного соединения указывают на диссоциацию его на 2…Реакции с участием комплексных соединений, не сопровождающиеся разрушением комплексного иона.
Это реакции обмена, в которых комплексные ионы ведут себя аналогично анионам кислородсодержащих кислот, таким как  ,
, 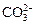 и т.п.
и т.п.
Опыт 9. Образование труднорастворимого гексацианоферрата (III).
Б. Налить в пробирку 3−4 капли раствора гексацианоферрата (III) калия K3[Fe(CN)6]. Добавить 2−3 капли раствора сульфата железа (II).… Запишите уравнения всех проведенных реакций в молекулярной и ионной формах.Опыт 10. Образование труднорастворимых гексацианоферратов (II).
Опыт 11. Образование труднорастворимого гексанитрокобальтата (III) натрия-калия.Реакция служит для обнаружения в растворах катионов калия. Налейте в…Реакции, сопровождающиеся разрушением комплексных ионов.
Опыт 13. Разрушение комплекса при разбавлении раствора.Выполнение работы. Внести в пробирку 2 капли раствора нитрата серебра и добавлять 0,1 н.… Описать наблюдаемые процессы. Написать уравнения реакций: образования иодида… Опыт 14. Разрушение комплекса при осаждении комплексообразователя.В две пробирки с раствором сульфата меди добавить: в…Опыт 16. Комплексные соединения в окислительно-восстановительных реакциях.
Написать уравнения: получения осадка хлорида серебра, его растворения в аммиаке с образованием комплекса серебра и взаимодействия полученного… Б. Восстановление гексацианоферрата (III) калия. В пробирку внести 4−5… Написать уравнение реакции взаимодействия гексацианоферрата (III) калия с иодидом калия, учитывая, что K3[Fe(CN)6]…Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций: образование осадка, выделение газа, изменение цвета раствора и т.д.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
Лабораторная работа № 11. Определение энтальпии реакции нейтрализации
Цель работы: ознакомиться с принципами и практическими приемами определения теплового эффекта реакции нейтрализации. Измерение теплового эффекта реакции основано на первом начале термодинамики. Для определения теплового эффекта реакции необходимо знать теплоемкость системы Сcal и вызванное реакцией изменение температуры DТ.
Общие сведения
Реакция нейтрализации представляет взаимодействие оснований с кислотами, например, NaOH + HCl = NaCl + H2O. В ионной форме должна быть выражена уравнением H+ + OH− = H2O. Образование из ионов Н+ и OH− молекул воды сопровождается выделением значительного количества тепла.
Сильные кислоты и сильные основания в достаточно разбавленных растворах диссоциированы полностью, поэтому общий тепловой эффект реакции нейтрализации для них обусловлен образованием молекул воды из ионов и теплота процесса должна быть близка к стандартной теплоте нейтрализации, вычисленной по закону Гесса.
Слабые кислоты и основания в растворе представлены преимущественно молекулами. Значение теплоты нейтрализации может существенно отличаться от стандартного значения. В этом случае процесс можно разделить на стадии: диссоциация слабого электролита, гидратация ионов  и собственно нейтрализация
и собственно нейтрализация 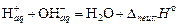 . Тепловой эффект реакции является суммой перечисленных процессов и к теплоте нейтрализации сильного электролита
. Тепловой эффект реакции является суммой перечисленных процессов и к теплоте нейтрализации сильного электролита 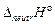 следует добавить эндотермический эффект диссоциации слабого электролита
следует добавить эндотермический эффект диссоциации слабого электролита 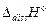 и экзотермический эффект гидратации катиона и аниона
и экзотермический эффект гидратации катиона и аниона  :
:
 .
.
Контрольные вопросы
1. На каком законе термодинамики основано измерение теплового эффекта реакции?
2. Какие величины надо знать или экспериментально определить для установления теплового эффекта реакции?
3. Какие составляющие входят в величину теплового эффекта реакции нейтрализации слабого электролита?
4. Что представляет собой реакция нейтрализации?
5. В каком случае величина теплового эффекта реакции взаимодействия кислоты и щелочи близка к справочному значению?
6. Почему тепловой эффект взаимодействия слабой кислоты и щелочи будет отличаться от справочного значения?
7. Какие стадии можно выделить при реакции слабой кислоты со щелочью?
8. Какие стадии реакции слабой кислоты со щелочью являются экзотермическими процессами?
9. Из каких составляющих складывается тепловой эффект реакции слабой кислоты со щелочью?
Оборудование и реактивы
Весы лабораторные. Стеклянный химический стакан объемом 100–150 мл. Стеклянный химический стакан объемом 300–400 мл. Стеклянный химический стакан объемом 50 мл. Корковая пробка. Стеклянная палочка. Термометр с ценой деления 0,1°С. Мерный цилиндр объемом 50 мл. Раствор сильной кислоты (0,5 н.). Раствор щелочи (0,5 н.).
Выполнение работы
2. Во внутренний стакан калориметра налить мерным цилиндром 25 мл раствора исследуемой кислоты VK концентрацией 0,5 М. 3. Поставить внутренний стакан в калориметр. 4. Поместить в раствор кислоты термометр с ценой деления 0,1°С.Содержание протокола лабораторной работы
1. Название кислоты и ее химическая формула
2. Объем раствора кислоты, взятый для опыта VК = ………….мл
3. Концентрация раствора кислоты СК = ………………….экв/л
4. Название сильного основания и его химическая формула
5. Объем раствора щелочи, взятый для опыта VЩ = ………….мл
6. Концентрация раствора щелочи СЩ = ………………..экв/л
7. Температура раствора начальная Т1 = ……………°С
8. Температура раствора конечная Т2 = …………..°С
Обработка результатов эксперимента
, Дж, где – удельная теплоемкость раствора, упрощенно принимаемая равной… 2. Вычислить тепловой эффект нейтрализации кислоты:Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные по протоколу
5. Обработка экспериментальных данных
6. Выводы
Лабораторная работа № 12. Определение теплоты растворения соли
Цель работы. Освоить принципы экспериментального определения тепловых эффектов, сопровождающих процессы растворения твердых веществ, в частности, растворения солей в воде.
Общие сведения
При растворении одновременно протекают процессы:
= разрушения кристалличеокой решетки твердого вещества и распределения образующихся частиц в растворе, при этом тепло поглощается;
= сольватации (для водных растворов – гидратации), т.е. образование более иди менее устойчивых соединении молекул или ионов растворенного вещества с молекулами растворителя за счет сил межмолекулярного взаимодействия, при этом тепло выделяется.
Суммарный тепловой эффект может быть как положительным, так и отрицательным, в зависимости от того, какой из процессов сопровождается большим по абсолютному значению тепловым эффектом. Таким образом, тепловой эффект процесса растворения DsolvН может быть выражен алгебраической суммой теплоты разрушения кристаллической решетки и теплоты гидратации: DsolvН = D1Н + D2Н Мольной теплотой растворения называется теплота, выделяемая (или поглощаемая) при растворении 1 моль вещества.
Оборудование и реактивы
Весы лабораторные. Стеклянный химический стакан объемом 100–150 мл. Стеклянный химический стакан объемом 300–400 мл. Стеклянный химический стакан объемом 50 мл. Корковая пробка. Стеклянная палочка. Термометр с ценой деления 0,1°С. Мерный цилиндр объемом 50 мл. Соль для исследования.
Выполнение работы
2. Взвесить на лабораторных весах внутренний стакан калориметра с точностью до 0,1 г. 3. Отмерить мерным цилиндром и налить в стакан 25-30 мл дистиллированной воды… 4. Взвесить 0,1 моль соли, указанной преподавателем.Содержание протокола лабораторной работы
1. Объем дистиллированной воды, взятый для опыта  = ………….мл
= ………….мл
2. Масса дистиллированной воды 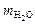 = …………….г
= …………….г
3. Формула соли
4. Масса соли mсоли = …………….г.
5. Масса раствора mр-р = …………….г.
6. Температура воды Т1 = ……………°С
7. Температура раствора Т2 = …………..°С
Обработка результатов эксперимента
, где – удельная теплоемкость раствора, упрощенно принимаемая равной… 2. Вычислить тепловой эффект растворения 1 моль соли:Пример расчета теплоты растворения соли
1. Составить уравнение реакции растворения соли:
 .
.
2. Записать закон Гесса применительно к данной реакции:
 ,
,
символ «aq» означает ион в водном растворе, символ «s» означает твердое вещество.
3. Подставить численные значения и произвести расчет.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные по протоколу
5. Обработка экспериментальных данных
6. Выводы (в выводах – об тепловых эффектах процесса растворения в целом и о тепловых эффектах стадий растворения соли)
Содержание
Введение. 3
Правила работы в лаборатории. 5
Определение эквивалентной массы.. 8
Лабораторная работа № 1. Определение эквивалентной массы металла 10
Лабораторная работа № 2. Определение эквивалента карбоната натрия 14
Лабораторная работа № 3. Исследование скорости химических реакций и химического равновесия 19
Лабораторная работа № 4. Приготовление раствора и определение его концентрации 36
Лабораторная работа № 5. Исследование реакций в растворах электролитов 45
Лабораторная работа № 6. Исследование гидролиза солей. 56
Лабораторная работа № 7. Приготовление буферного раствора. 66
Лабораторная работа № 8. Исследование растворимости солей. 76
Лабораторная работа № 9. Исследование окислительно-восстановительных реакций 85
Лабораторная работа № 10. Исследование комплексных соединений 97
Лабораторная работа № 11. Определение энтальпии реакции нейтрализации 111
Лабораторная работа № 12. Определение теплоты растворения соли 117
Содержание. 122
– Конец работы –
Используемые теги: Общая, Химия0.048
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОБЩая ХИМИя
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов