Термохимические уравнения.
Химические процессы всегда сопровождаются выделением или поглощением теплоты. В первом случае реакции называют экзотермическими, во втором – эндотермическими. Количество теплоты, которая выделяется или поглощается в необратимом процессе, называют тепловым эффектом химической реакции (энтальпией), или иначе изохорическим или изобарическим тепловым эффектом химической реакции. Между ними существует такое взаимоотношение:
QР = QV + ∆ ν RT
При условии, что в результате химического процесса число молей газообразных компонентов реакции не изменяется (QР = QV). Если химическая реакция происходит в конденсируемой системе и изменением объема системы можно пренебречь, то величины изохорического или изобарического теплового эффекта также считают одинаковыми.
Уравнения химических реакций, в которых приведены значение их энтальпии и указанное агрегатное состояние реагентов и продуктов реакции, называют термохимическими. Стехиометрические коэффициенты термохимических уравнений могут быть дробными, поскольку они обозначают молярные количества реагирующих веществ.
Таким образом, при обозначении теплового эффекта реакции Q в правой части уравнения его значение для экзотермической реакции положительное, а для эндотермической - отрицательное. То есть, в отличие от общей термодинамики, в термохимии тепловой эффект считают положительным, если теплота поглощается и реакция будет эндотермическая. Если теплота выделяется, - реакция экзотермическая.
Следовательно, изменение энтальпии касается энергетических изменений в системе, а величина теплового эффекта Q - соответствующих изменений в окружающей среде при условии, что Р = const. Чтобы сравнивать между собой тепловые эффекты разных реакций и проводить термохимические расчеты, было введено понятие теплового эффекта при стандартных условиях.
Тепловым эффектом реакции при стандартных условиях (∆Нf0 ) называют тепловой эффект, измеренный при температуре 298,15 К и давления 101,3 кПа. Его вычисляют по стандартным энтальпиям образования или сгорания компонентов реакции.
Стандартной энтальпией образования (∆Нf0 ) называют тепловой эффект реакции образования одного моля вещества из элементов или простых веществ при стандартных условиях. Для элементов и простых веществ в стойком агрегатном состоянии ∆Нf0 равняется нулю.
Стандартной энтальпией сгорания ∆Нс0 называют теплоту сгорания в атмосфере кислорода одного моля вещества до самых простых оксидов.
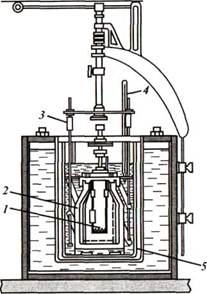
Стандартные энтальпии сгорания веществ определяют в специальных приборах – калориметрах.
Законы термохимии
самым важным выводом из первого закона термодинамики относительно химии является закон, открытый в 1840 г. русским ученым Г. Гессом: тепловой эффект химической реакции не зависит от пути ее протекания, а определяется только начальным и конечным состояниями системы.
Например, сжигая графит в кислороде, можно получить оксид углерода (IV) непосредственно:
С(графит)+ О2г= С02(г); ∆Н = -393,5 кДж
или по стадиям:
С(графит)+ 1/202(r)= СОг; ∆Н1 = -110,5 кДж;
CO(r) + 1/202 (r) = C02(r); ∆Н2 = -283,0 кДж.
Общий тепловой эффект в обоих случаях будет одинаков:
∆Н = ∆Н1 + ∆Н2 = -393,5 кДж.
Следовательно, для экспериментального определения теплового эффекта какого-то сложного химического процесса нет надобности определять тепловые эффекты каждой стадии. Это имеет исключительно большое значение для биологических процессов,которые являются сложными. Так, глюкоза, основной энергетический материал организма человека и животных, испытывает в мышцах сложные превращения, образовывая конечные продукты окисления - углекислый газ и воду. В термохимических вычислениях, в частности для определения калорийности пищевых продуктов, достаточно знать тепловой эффект суммарной реакции:
С6Н12О6 + 602 = 6Н20 + 6СО2; ∆Н ° = -2802,8 кДж
не определяя тепловые эффекты многих промежуточных реакций.
Большое значение в термохимических вычислениях имеют следствия, которые вытекают из закона Гесса.
Первое следствие.Энтальпия разложения любого химического соединения равняется энтальпии ее образования по абсолютной величине и противоположная по знаку (это следствие иначе называют законом Лавуазье - Лапласа). Это утверждение непосредственно вытекает из того, что тепловой эффект кругового процесса должен равняться нулю.
Второе следствие.Тепловой эффект реакции равняется разнице алгебраических сумм энтальпий образования продуктов реакции и исходных веществ.
Третье следствие.Тепловой эффект реакции равняется разнице алгебраических сумм энтальпий сгорания исходных веществ и продуктов реакции.
Кроме приведенных выше следствий из закона Гесса, для термохимических вычислений используют еще и такие:
а) если две реакции имеют одинаковые продукты, но разные исходные вещества, то разница между тепловыми эффектами этих реакций является тепловым эффектом перехода одного исходного вещества в другое.
Таким образом, применяя закон Гесса, можно вычислить тепловые эффекты отдельных реакций, особенно промежуточных стадий, которые экспериментальным путем определить невозможно.
Кроме того, закон Гесса дает возможность определить тепловые эффекты других химических процессов, например, гидратации ∆Н гидрат, нейтрализации ∆Н нейтр. и тому подобное.
Определение теплоты гидратации.Количество теплоты, которая выделяется при присоединении к одному молю твердой безводной соли соответствующего количества кристаллической воды до образования стойкого кристаллогидрата, называют теплотой гидратации.Ее вычисляют по разнице энтальпий растворения безводной соли и соответствующего кристаллогидрата.
Энтальпией растворения называют количество теплоты, которая выделяется или поглощается при растворении одного моля вещества в большом количестве растворителя (200-500 моль).
Энтальпия реакции нейтрализации - это тепловой эффект реакции нейтрализации молярной массы эквивалента кислоты (основания) соответствующим количеством основания (кислоты).
Теплоемкость. Зависимость тепловых эффектов химических реакций от температуры
Для количественной оценки теплоты, которую получает тело во время нагревания, используют понятие теплоемкости.
Теплоемкость — это количество теплоты, какое необходимое для нагревания единицы количества вещества на 1 К. Соответственно различают Молярную теплоемкость, если нагревают один моль (С ) и удельную теплоемкость, когда нагревают 1 г вещества (Суд). Молярную теплоемкость измеряют в Дж/(мольК), удельную - в Дж/(г-К).
Изобарная и изохорная теплоемкости, так же как энтальпия и внутренняя энергия, отличаются одна от другой на величину работы, необходимую для изменения объема системы. Поскольку в процессе при постоянном давлении выполняется работа, то для повышения температуры системы на единицу необходимо потратить большее количество теплоты, поэтому Ср > Сv:
Cp = Cv + R
Закон Кирхгофа: температурный коэффициент теплового эффекта равняется разнице между теплоемкостями исходных веществ и продуктов реакции.
Вычисление тепловых эффектов химических реакций по уравнению Кирхгофа выполняют при составлении тепловых балансов процессов на химических и фармацевтических производствах.