Кинетика ферментативных реакций
Скорость ферментативных реакций зависит от следующих основных факторов:
1. концентрации фермента;
2. концентрации субстрата;
3. температуры;
4. рН среды;
5. присутствия активаторов;
6. присутствия ингибиторов.
Концентрация фермента
Между скоростью ферментативной реакции и концентрацией фермента имеется прямопропорциональная связь.
 υ
υ
 |
[E]
2. Концентрация субстрата
Для ферментативных реакций характерно явление насыщения фермента субстратом. Заключается оно в том, что при увеличении концентрации S скорость сначала увеличивается, достигает максимального значения при некоторой концентрации субстрата а и остается постоянной. Происходит это потому, что при концентрации а весь фермент связан в фермент-субстратный комплекс.
Зависимость скорости ферментативной реакции от концентрации субстрата может быть описана уравнением:
υ = υmax/(1+ Kм/[S]),
где: Км – константа Михаэлиса, которая соответствует концентрации субстрата, при которой скорость реакции равна 1/2 υmax.
υ
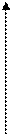 |
υmax
 |

 1/2 υmax
1/2 υmax
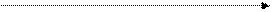 |
Км [S]
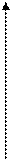 3. Температура. Зависимость скорости ферментативной реакции от температуры имеет следующий вид:
3. Температура. Зависимость скорости ферментативной реакции от температуры имеет следующий вид:
υ

 t опт.
t опт.
 20 40 60 80
20 40 60 80
tº, С
В интервале температур от 0 до 45-50ºС зависимость скорости реакции подчиняется правилу Вант-Гоффа (при увеличении температуры на каждые 10ºС скорость реакции увеличивается в 2-4 раза). При температуре выше 50ºС фермент начинает денатурировать, и скорость реакции снижается. При температуре выше 80ºС фермент теряет активность и при 100ºС полностью инактивируется. При температур около 0ºС фермент обычно не разрушается, но активность их падает до нуля.
Температура при которой фермент наиболее активен, называют оптимумом действия фермента. Температурный оптимум действия большинства ферментов теплокровных животных – 37-40ºС, растительных ферментов – 50-60ºС.
4. рН среды
Влияние изменения рН среды на молекулу фермента заключается в ионизации кислотных и основных групп активного центра, что сказывается на электростатическом соответствии между ферментом и субстратом и их способностью формировать фермент-субстратный комплекс. Значение рН при котором фермент имеет наибольшую активность называют рН оптимумом действия фермента. Для некоторых ферментов он резко выражен, для других граница рН более широкая. рН оптимум действия большинства ферментов лежит в области физиологических значений ( 6,0-8,0).
 υ
υ
 |
рНопт рН
5. Активирование ферментов
Активаторы – увеличивают скорость ферментативных реакций.
Активаторами могут быть вещества различной химической природы. Например, пепсин активируется НС1 панкреатическая липаза – желчными кислотами, амилаза слюны – NaCl1/
Наиболее часто активаторами ферментов являются ионы двухвалентных и иногда одновалентных металлов.
Механизм активирующего действия может быть различным:
1. способствует присоединению субстрата к активному центру фермента и образованию ES-комплекса;
2. обеспечивают присоединение кофермента к апоферменту;
3. аллостерические активаторы – способствуют образованию более выгодной пространственной конфигурации активного центра;
4. активация частичным протеолизом и др.
6. Ингибирование.
Ингибиторы – вещества, замедляющие химическую реакцию Ингибиторы ферментов также имеют различную природу и различный механизм действия.
Основные виды ингибиторов:
1 – антиферменты – вещества белковой природы, образуют труднодиссоциируемые комплексы с ферментами (например, ингибиторы протеаз в растительном сырье);
2 – неспецифические ингибиторы – группа ингибиторов, вызывающих денатурацию белковой молекулы фермента (кислоты, щелочи, соли тяжелых металлов). К этому виду ингибирования можно отнести также нагревание, воздействия излучения и прочие физические факторы, вызывающие инактивацию ферментов. Это неспецифическое ингибирование.
3 – ингибиторы, способные специфически связывать ту или иную функциональную группу в молекуле фермента, снижая ее активность;
4 – аллостерическое ингибирование.
Типы ингибирования
Различают обратимое и необратимое ингибирование.
Необратимым называют ингибирование, которое вызывает стойкие изменения фермента (например, денатурация).
При обратимом ингибировании фермент способен восстановить свою активность.
Обратимое ингибирование делится на конкурентное и неконкурентное.
Конкурентное ингибирование вызывают вещества, имеющие структурное подобие с субстратом. Т.о. ингибитор в результате структурного соответствия с субстратом реагирует с активным центром фермента, образуя фермент-ингибиторный комплекс (EI). Это ингибирование обратимое. Неактивный EI-комплекс способен к диссоциации. Субстрат и ингибитор конкурируют за связывание активного центра фермента. При высокой концентрации субстрата он оттесняет ингибитор и степень торможения реакции уменьшается.
На конкурентном ингибировании связано лечение бактериальных инфекций с помощью сульфаниламидных препаратов. Они имеют структурное сходство с р-аминобензойной кислотой, которая используется бактериями для синтеза фолевой кислоты – фактора их роста. Т.о. торможение синтеза фолевой кислоты в присутствии сульфаниламидов обусловливает бактериостатический эффект последних.
Неконкурентное ингибирование вызывают вещества не имеющие структурного сходства с субстратом. Они могут присоединяться к различным частям молекулы фермента, вызывая блокирование отдельных функциональных групп или ионов металла в молекуле фермента, препятствуя образованию ES-комплекса.
Разновидностью неконкурентного ингибирования является аллостерическое ингибирование. В этом случае ингибитор соединяется с аллостерическим центром фермента, изменяя структуру его активного центра. Аллостерическое ингибирование обратимо.