рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Лекции по курсу: Биохимия Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 10
Реферат Курсовая Конспект
Лекции по курсу: Биохимия Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 10
Лекции по курсу: Биохимия Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 10 - раздел Химия, Министерство Образования И Науки Российской Федерации Федеральное Аг...
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования «Северо-Кавказский Государственный Технический Университет»
Лекции по курсу: «Биохимия»
Ставрополь, 2006.
Оглавление.
Оглавление. 2
Введение. 6
Аминокислоты. 7
Структура белков. 8
Конформация белков. 8
Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 10
Пептиды.. 10
Белки.. 11
Роль белков в организме человека. 11
Методы разделения белков и пептидов: 12
Признаки коллоидного состояния. 12
Сходство растворов ВМС и коллоидных растворов. 12
Отличие растворов ВМС от коллоидных растворов. 13
Сходство растворов ВМС с ионно-молекулярными растворами.. 13
Специфические свойства растворов ВМС.. 13
Анализ мембранного равновесия Доннана. 14
ФЕРМЕНТЫ... 14
Общие черты ферментов и неорганических катализаторов. 15
Отличие ферментов от неорганических катализаторов. 15
Строение ферментов. 16
Активный центр ферментов. 16
Механизм действия ферментов. 17
Специфичность. 18
Кинетика ферментативных реакций.. 18
Ингибиторы.. 20
Определение активности фермента. 21
Классификация ферментов. 22
Тема: ФЕРМЕНТЫ, КАК БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ... 26
Классификация ферментов. 26
Свойства ферментов. 28
Специфичность действия ферментов. 28
Активирование и ингибирование ферментов. 29
Регуляция путём ковалентной модификации.. 29
Путь нековалентной модификации.. 31
Типы ингибирования. 32
Конкурентное ингибирование. 32
Неконкурентное ингибирование. 32
Регуляция путем изменения биосинтеза ферментов. 33
Компартментализация (отделение, отсек) в клетке. 33
Изоферменты.. 33
Анализ уравнения Михаэлиса—Ментен: 35
Количественная характеристика активности фермента. 37
Количественная характеристика активности ферментов в биологических жидкостях. 37
Энзимодиагностика. 37
Наследственные нарушения (энзимопатии) 38
Энзимотерапия. 38
Липиды. 39
Классификация липидов. Характеристика фосфолипидов и восков. 39
Воска. 40
Фосфолипиды.. 40
Фосфатидилхолины (лецитины). 40
Фосфатидилэтаноламины. 41
Обмен липидов. 41
Ресинтез жирных кислот в стенке кишечника. 45
Транспорт липидов. 45
Цикл трикарбоновых кислот (цикл Кребса) 47
Первая реакция. 47
Вторая реакция. 47
Третья реакция. 47
Четвертая реакция. 48
Пятая реакция. 48
Шестая реакция. 48
Седьмая реакция. 49
Тема УГЛЕВОДЫ... 49
КЛАССИФИКАЦИЯ УГЛЕВОДОВ.. 50
МОНОСАХАРИДЫ. 50
Стериоизомерия моносахаридов. 50
Циклические (полуацетальные) формы моносахаридов. 51
Основные реакции моносахаридов. 53
ОЛИГОСАХАРИДЫ... 54
ПОЛИСАХАРИДЫ... 55
ГЕТЕРОПОЛИСАХАРИДЫ. 57
Промежуточный обмен углеводов в организме. 58
ВИТАМИНЫ... 60
Классификация витаминов. 62
Витамин.. 62
Активная форма. 62
Источники.. 63
Жирорастворимые витамины.. 65
Витамины группы А (ретинол, антиксерофтальмический) 65
Витамины группы К (филлохиноны, менахиноны,антигеморрагический) 67
Витамины группы Е (токоферол, антистерильный. Витамин размножения) 68
Водорастворимые витамины.. 68
Витамин В1 (тиамин, антиневрический) 68
Витамин В2 (рибофлавин, витамин роста) 69
Витамин В6 (пиридоксин, антидермический) 70
Витамин В12 (кобаламин,антианемический) 72
Витамин С (аскорбиновая кислота, антискорбутный витамин). 72
Витамин Р (рутин, цитрин, витамин проницаемости) 73
Витамин РР (никотиновая кислота, никотинамид, ниацин, антипеллагрический) 74
Химия нуклеиновых кислот. 74
Общая характеристика нуклеиновых кислот. 74
Химическое строение РНК и ДНК. 74
Структура нуклеиновых кислот. 78
Вторичная структура ДНК характеризуется правилом Э. Чаргаффа (закономерность количественного содержания азотистых оснований): 79
Тема: ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ И НУКЛЕОТИДОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА. 84
Этапы репликации: 85
Транскрипция. 86
Этапы транскрипции: 86
Биосинтез белка. 86
Регуляция транскрипции. Теория Оперона. 87
Тема: ЭНЕРГЕТИЧЕСКИЙ ОБМЕН. Цикл лимонной кислоты - цикл трикарбоновых кислот (ЦТК), цикл Кребса - конечный общий путь окисления белков, липидов, углеводов.ЦТК - амфиболический цикл. 87
Цикл лимонной кислоты — ЦТК — цикл Кребса. 88
Энергетическая роль ЦТК.. 88
Регуляция цикла Кребса. 88
Биоэнергетика. Биологическое окисление.. 89
Роль кислорода в метаболизме. 89
Токсичность кислорода. 89
Макроэргические молекулы.. 90
Нуклеозидтрифосфаты.. 90
Введение.
Электронная версия лекций свободно распространяется среди студентов и аспирантов Сев-КавГТУ, и используется в образовательном процессе. Может быть полезна в научных работах, т.к. достаточно полно охватывает предмет биохимии.
Текст проверен на орфографию в редакторе Word.
Внимание! Следует соблюдать осторожность при изменении шрифтов, отступов, стилей и других параметров, способных вызвать смещение текста. В нем находится множество схем, таблиц и рисунков которые при сдвиге распадаются на составляющие разного рода (например, графика – текс, таблица – текст и др.).
Аминокислоты.
1 – моноаминомонокарбоновые (глицин, аланин, лейцин и др.); 2 – диаминомонокарбоновые (лизин, аргинин); 3 - моноаминодикарбоновые (аспарагиновая и глутаминовая кислоты);Структура белков
Первичная структура. Представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями. Первичная структура каждого индивидуального белка закодирована в молекуле ДНК (участке, называемом геном) и реализуется в ходе транскрипции (переписывании информации на м-РНК) и трансляции (синтез пептидной цепи).
Конформация белков
Вторичная структура белка – это пространственная структура, образующаяся в результате взаимодействий между функциональными группами аминокислот,… Наиболее распространенной формой вторичной структуры является a- спираль…Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
Пептиды
Биологическое значение пептидов. Пептиды обладают значительной биологической активностью, являясь регуляторами ряда процессов жизнедеятельности. В…Белки
Белки — полимеры 22 природных аминокислот со специфической структурой.
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи, образуется за счет пептидных связей, возникающих за счет альфа-карбоксильной группы одной аминокислоты и альфа-аминогруппы последующей аминокислоты.
Вторичная структура — способ укладки полипептидной цепи в альфа-спираль или b - структуру за счет менее прочных водородных связей (Нd+ …Оd-).
Третичная структура — пространственная укладка a - спирали или полипептидной цепи в определенную конформацию за счет четырех видов связей:
1. 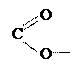 водородных: Нd+ …Оd-,
водородных: Нd+ …Оd-,
2. ионных (солеобразующих): —NH3 + . . . ,
3. дисульфидных: —S—S—;
4. гидрофобных (сил Ван-дер-Ваальса).
Третичная структура — субъединица.
Четвертичная структура— «комплекс субъединиц способных к диссоциации, (Джон Бернал), или объединение в определенном порядке двух и большего количества субъединиц в молекулу олигомерного белка.
Например, молекула гемоглобина состоит из четырех субъединиц (по 17000 Д каждая).
Роль белков в организме человека
Методы разделения белков и пептидов: Электрофоретические — основаны на разделении белков в постоянном электрическом поле в зависимости от… Дисперсные системы в зависимости от раздробленности частиц могут быть:Анализ мембранного равновесия Доннана
Вывод.. В клетке при наличии ВМС концентрация электролита всегда больше, чем во внеклеточной жидкости, что обусловливает повышенное осмотическое…ФЕРМЕНТЫ
Ферменты (энзимы) – биологические катализаторы, ускоряющие химические реакции обмена веществ в организме. Катализ – это процесс изменения скорости химической реакции под действием… Механизм действия катализаторов заключается в следующем.Отличие ферментов от неорганических катализаторов
2. Каталитическая активность проявляется в очень мягких условиях (умеренные температуры 37-40ºС, нормальное давление, близкие к нейтральным… 3. Ферменты обладают высокой специфичностью действия, т.е. каждый фермент… 4. Активность ферментов в клетках строго контролируется и регулируется;Строение ферментов
По строению ферменты делятся на: - простые или однокомпонентные; - сложные или двухкомпонентные (холоферменты).Активный центр ферментов.
Активный центр фермента – это часть его молекулы, непосредственно взаимодействующая с субстратами участвующая в акте катализа. Активный центр фермента формируется на уровне третичной структуры. Поэтому при… Активный центр в свою очередь состоит из:Механизм действия ферментов
1. поляризации химических связей в молекуле субстрат и перераспределение электронной плотности; 2. деформации связей, вовлекаемых в реакцию; 3. сближения и необходимой взаимной ориентации молекул субстрата (S).Специфичность
Специфичность бывает трех видов: 1. - относительная или групповая специфичность – фермент действует на… 2. – абсолютная специфичность - фермент действует только на один строго определенный субстрат (например, фермент…Кинетика ферментативных реакций
Скорость ферментативных реакций зависит от следующих основных факторов: 1. концентрации фермента; 2. концентрации субстрата;Определение активности фермента
За единицу активности фермента (Е- рус./нем. или U- англ./исп.) принимают такое количество фермента, которое в стандартных условиях катализирует… В международной системе единиц Си (1972 г.) предложена, вместо старой… Для характеристики активности ферментов на практике часто используют следующие понятия:Классификация ферментов
Современная классификация ферментов разработана в 1961 г. Комиссией по ферментам Международного биохимического союза. В основу классификации положен тип катализируемой реакции, которая является специфичным для каждого фермента.
Согласно этой классификации все ферменты делят на 6 главных классов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции;
2. Трансферазы – катализируют реакции межмолекулярного переноса групп атомов и радикалов;
3. гидролазы– катализируют реакции расщепления при участии воды;
4. лиазы – катализируют реакции внутримолекулярного негидролитического расщепления, с образованием двойной связи или присоединения по двойной связи;
5. изомеразы – катализируют реакции изомеризации;
6. лигазы (синтетазы) – катализируют реакции синтеза с затратой энергии.
1. Оксидоредуктазы – делятся на подклассы в зависимости от типа реакции окисления:
а). Дегидрогеназы – отнимают от субстрата 2 атома водорода в виде двух протонов и двух электронов. Делятся на аэробные и анаэробные дегидрогеназы.
- 
 аэробные дегидрогеназы (оксидазы) передают отнятый водород на кислород с образованием воды или перекиси водорода:
аэробные дегидрогеназы (оксидазы) передают отнятый водород на кислород с образованием воды или перекиси водорода:
 H
H

 S + 1/2O2 S + H2O
S + 1/2O2 S + H2O
H







 CH2OH CH2OH
CH2OH CH2OH



|





|
|
 ОH O2 H2O2 H
ОH O2 H2O2 H
 | |||||
|  | ||||
OH H OH
H OH H OH
Глюкоза глюколактон
- анаэробные дегидрогеназы (редуктазы) катализируют перенос атомарного водорода на промежуточный субстрат. В общем виде:

 H H
H H

 S + S1 S + S1
S + S1 S + S1
H H
Все оксидоредуктазы – сложные ферменты. Непосредственными переносчиками водорода от субстрата являются коферменты дегидрогеназ. Большинство дегидрогеназ в качестве коферментов содержат НАД, НАДФ.


 НАД НАДН2
НАД НАДН2
|


 СН3 – СН - СООН СН3 – СН - СООН
СН3 – СН - СООН СН3 – СН - СООН
ОН О
Молочная кислота ПВК (пировиноградная кислота)
в). оксигеназы – катализируют реакции, в ходе которых кислород включается в состав окисляемого субстрата.
Делятся на моно- и диоксигеназы:
- монооксигеназы (гидроксилазы) – включают в состав субстрата один атом молекулы кислорода, а второй восстанавливается до Н2О. Донором Н2 обычно является НАДФН2.
 НАДФН2 НАДФ
НАДФН2 НАДФ
 S - H + O2 S –OH + H2O
S - H + O2 S –OH + H2O
- диоксигеназы – присоединяют к субстрату оба атома O2
 S + O2 SO2
S + O2 SO2
г). пероксидаза и каталаза – гемсодержащие ферменты. Катализирующие реакции с участием Н2O2.
Простетическая группа имеет одно и тоже строение, содержит трехвалентное железо.
Пероксидаза окисляет органические соединения в организме с помощью O2 или разлагает ее с выделением активного кислорода:
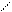 H
H

 S + Н2O2 S + 2 H2O
S + Н2O2 S + 2 H2O
H
 Н2O2 H2O + O
Н2O2 H2O + O
Каталаза разлагает Н2O2 на H2O и молекулярный кислород:
 2 Н2O2 2 H2O + O2
2 Н2O2 2 H2O + O2
д). цитохромы – система ферментов, катализирующих перенос электронов на молекулярный кислород:
 O2 + 4e 2О2-
O2 + 4e 2О2-
Цитохромы являются гемопротеинами и завершают все окислительные процессы в клетках.
2. Трансферазы
Делятся на подклассы в зависимости от характера переносимых группировок:
а). метилтрансферазы –переносят метильную группу:

 R-CH3 + R1-H R-H + R1- CH3
R-CH3 + R1-H R-H + R1- CH3
б). аминотрансферазы (трансаминазы) – переносят аминогруппу в реакциях переаминирования с кетокислотами:


 R1 R2 R2
R1 R2 R2


 СН-NH2 + C=O R1 - CO-COOH + CH-NH2
СН-NH2 + C=O R1 - CO-COOH + CH-NH2
COOH COOH COOH
в). фосфотрансферазы – переносят остаток фосфорной кислоты:
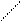
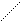 OH OH
OH OH



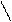 R – P=O + R1 -H R- H + R1 -P=O
R – P=O + R1 -H R- H + R1 -P=O
OH OH
Если донором фосфорного остатка является АТФ, то фосфотрансферазы еще называют киназами!!!
|

|

 CH2OH CH2O-РО3Н2
CH2OH CH2O-РО3Н2
 |  | ||||||
 | |||||||
 | |||||||




 ОН ОН ОН ОН
ОН ОН ОН ОН
Н ОН Н ОН
глюкоза глюкозо-6-фосфат
 г). гликозилтрансферазы – переносят остаток моносахарида - гликозил;
г). гликозилтрансферазы – переносят остаток моносахарида - гликозил;
д). ацилтрансферазы – переносят кислотный остаток R-C=O и др.
3. Гидролазы
Делятся на подклассы в зависимости от характера субстрата. Основными из них являются:
а). эстеразы - ускоряют гидролиз сложных эфиров спиртов с органическими и неорганическими кислотами.
Важнейшие подподклассы эстераз:
- гидролазы эфиров карбоновых кислот (представитель – липаза).
Липаза ускоряет гидролиз внешних сложноэфирных связей в молекуле триглицеридов

 СН2-О-СО-R СН2-ОH
СН2-О-СО-R СН2-ОH



 CH –O-CO-R + 2H2O CH – O-CO – R + 2R-COOH
CH –O-CO-R + 2H2O CH – O-CO – R + 2R-COOH
СН2-О-СО-R СН2-ОH
- фосфатазы – гидролизуют фосфорные эфиры. Например, глюкозо-6-фосфатаза:




 CH2O- РО3Н2 CH2OH
CH2O- РО3Н2 CH2OH
|
|





 + 2H2O + Н3РО4
+ 2H2O + Н3РО4
ОН ОН ОН ОН
ОН ОН
Глюкозо-6-фосфат глюкоза
б). гликозидазы – расщепляют гликозидные связи в молекулах углеводов. Представители: сахараза, мальтаза,амилаза и др.
 CH2OH CH2OH CH2OH
CH2OH CH2OH CH2OH
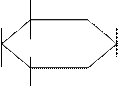 |  | ||||||
 | |||||||
 | |||||||
|







 ОН ОН ОН ОН
ОН ОН ОН ОН
ОН ОН ОН
Мальтоза глюкоза
в). пептидгидролаза – ускоряют гидролиз пептидных связей в белках и пептидах. Пептидгидролазы делятся на подподклассы:
1. Протеиназы или пептидил-пептидгидролазы или эндопептидазы. Они расщепляют пептидные связи внутри белковой молекулы, разлагая ее до пептидов. К ним относятся пепсин, трипсин, химитрипсин и др. ферменты. Их важная особенность – селективный характер действия. Они гидролизуют пептидные связи, образованные только определенными аминокислотами.
2. Пептидазы или экзопептидазы, отщепляющие концевые аминокислоты. К ним относятся:
- аминопептидазы (отщепляют N-концевые аминокислоты);
- карбоксипептидазы (отцепляют С - концевые аминокислоты).
г). амидазы – гидролизуют амиды кислот. Представители: уреаза, аспарагиназа и др.
 NH2-CO - NH2 + H2O 2 NH3 + CO2
NH2-CO - NH2 + H2O 2 NH3 + CO2
Мочевина уреаза
4. Лиазы
Систематические названия ферментов этого класса образуют из названия субстрата,затем указывают отщепляемую группу и затем добавляют слово лиаза. Делятся на подклассы в зависимости от действия на связи:
а). С – С – лигазы. К ним относятся ферменты декарбоксилазы.
Например:

 CН3
CН3

 СО CН3 – С=О + CO2
СО CН3 – С=О + CO2
СООН пируват- Н
ПВК декарбоксилаза
б). С-О- лигазы (гидролиазы). К ним относятся гидратазы
+ Н2О

 СООН-СН=СН-СООН ОН-СН-СООН
СООН-СН=СН-СООН ОН-СН-СООН
 фумаровая к-та - Н2О СН2 – СООН (яблочная к-та)
фумаровая к-та - Н2О СН2 – СООН (яблочная к-та)
фумаратгидратаза
в). С-N-лиазы и др. Например, аспартат-аммиак-лиаза, катализирующая расщепление аспартата до фумарата и аммиака.
5. Изомеразы
Систематическое название ферментов этого класса образуют по схеме: субстрат-тит реакции изомеризации-изомераза. При внутримолекулярном переносе групп ферменты имеют тривиальные названия мутызы.Катализируют различные реакции изомеризации (90 ферментов). Например превращение глюкозы-6-фосфат во фруктозу –6-фосфат.
CH2O- РО3Н2 CH2O- РО3Н2
 | |||||||
 | |||||||
| |||||||
|





 ОН
ОН
 | |||||
 |  |

 ОН ОН глюкозофосфат- ОН CH2OН
ОН ОН глюкозофосфат- ОН CH2OН
 ОН изомераза
ОН изомераза
ОН
α-глюкоза-6-фосфат β-фруктоза-6-фосфат
CH2O- РО3Н2 CH2OН
 | |||||
 | |||||
 | |||||

 ОН ОН фосфоглюкомутаза
ОН ОН фосфоглюкомутаза

 ОН O- РО3Н2
ОН O- РО3Н2
ОН ОН
Глюкоза-6-фосфат глюкоза-1-фосфат
Мутаротаза осуществляет взаимные превращения α- и β- изомеров.
6. Лигазы (синтетазы)
Систематическое название образуется по схеме: А : В лигаза (образующая АДФ), где А и В – соединяющиеся молекулы, в скобках указывается продукт расщепления нуклеозидтрифосфата, который использовался в данной реакции. Делятся на подклассы, ускоряющие реакции синтеза различных связей.
а). С-С-лигазы. Представителями лиаз, образующих С-С-связи, являются карбоксилазы, вызывающие удлинение углеродных цепей.
Например, пируваткарбоксилаза:

 CН3 СООН
CН3 СООН


 СО + CO2 + АТФ СН2 + АДФ + Фн
СО + CO2 + АТФ СН2 + АДФ + Фн
 СООН С= О
СООН С= О
СООН
ПВК оксилоацетат
б). С-О-лигазы. Такой тип связи возникает при действии аминоацил-тРНК-синтетаз, активирующих аминокислоты и передающих их на т-РНК:
АТФ АМФ + ФФн

 R-CH-COOH + тРНК R-CH-CO~тРНК
R-CH-COOH + тРНК R-CH-CO~тРНК

 NH2 NH2
NH2 NH2
в). С-N-лиазы.Эти ферменты участвуют, например, в синтезе различных амидов. К ним относится аспарагинсинтетаза.
 NH2
NH2

 СООН С=О
СООН С=О


 CH2 NH3 АТФ АДФ + Фн CH2
CH2 NH3 АТФ АДФ + Фн CH2


 СН-NH2 СН-NH2
СН-NH2 СН-NH2
COOH COOH
Асп. Асн.
Тема: ФЕРМЕНТЫ, КАК БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ
Ферменты – биологические катализаторы белковой природы. Синтезируются клетками организма. Некоторые клетки могут содержать до 1000 различных ферментов. За последние 50 лет из всех типов организмов удалось выделить 2500 ферментов. Из них удалось получить в кристаллическом виде, а для 50 ферментов с помощью рентгено-структурного анализа определена трехмерная пространственная структура.
Классификация ферментов
Международным биохимическим союзом были введены номенклатуры: систематическая и тривиальная. Основные черты систематической номенклатуры состоят в следующем:
1. Ферменты по типу реакций, которые они катализируют, подразделяются на шесть классов в каждом из которых имеется несколько подклассов (от 4 до 13);
2. Название ферментов состоит из 2 частей: названия субстрата + типа катализируемой реакции + окончания "аза".
Каждый фермент имеет шифр, состоящий из 4 чисел, разделенных точками. Первое число определяет главный класс, второе - указывает подкласс, третье - подподкласс, четвертое - номер фермента в пределах подподкласса. Например, фермент лактатдегидрогеназа обозначается шифром КФ.1.1.1.27 - это значит, что данный фермент отнесен к 1-му главному классу, 1-му подклассу, 1-му подподклассу и занимает в нем порядковый номер 27.
Однако поскольку многие из этих систематических названий оказались очень длинными, каждому ферменту было присвоено тривиальное (рабочее) название, предназначенное для повседневного употребления. Рабочее название состоит из названия субстрата, на который действует данный фермент, указания на тип реакции и окончания "аза".
1-й класс: оксидоредуктазы - катализируют окислительно-восстановительные реакции. Процессы окисления могут протекать:
1) с участием кислорода-реакции катализируют ферменты:
оксидазы (кислород не внедряется в субстрат);
SH2 + 1/2O2 = S + H2O
монооксигеназы (гидроксилазы) – внедряется в субстрат один атом кислорода:
HSH + 1/2O2 = HS–OH
диоксегеназы – внедряется в субстрат два атома кислорода:
HSH+O2 = HO–S–OH
2) без участия кислорода
дегидрогеназы катализируют дегидрирование (удаление водорода) субстрата:
SH2 = S + 2H
редуктазы катализируют присоединение водорода к субстрату:
S + 2H = SH2
цитохромы осуществляют перенос электронов:
a3(Cu2+) + e- = a3(Cu1+)
2-й класс: трансферазы – катализируют реакции переноса химических групп. Название ферментов данного класса складываются из названий: субстрата-донора + переносимой группы + "аза". Например, если переносится метильная группа, то к названию субстрата добавляется метилтрансфераза; аминогруппа – добавляется аминотрансфераза; ацильная группа – ацилтрансфераза. Но если переносится остаток фосфорной кислоты от нуклеозидтрифосфатов, то фермент называют - киназа. Например, глюкоза + АТФ = глюкозо-6-фосфат + АДФ. Катализирует данную реакцию фермент глюкокиназа.
3-й класс: гидролазы – катализируют гидролиз сложных соединений с присоединением по концам расщепленной связи остатков воды. Название фермента часто складывается из названия связи, которая гидролизуется и окончания "аза". Например: гидролиз пептидной связи осуществляют пептидазы, гликозидной – гликозидазы, сложные эфиры гидролизуются под действием эстераз. Когда гидролизу подвергаются эфиры фосфорной кислоты: монофосфаты и дифосфаты, то ферменты называют фосфатазы и дифосфатазы соответственно. Например:
глюкозо-6-фосфат + Н2О = глюкоза + Н3РО4; фермент: глюкозо-6-фосфатфосфатаза;
фруктозо-1,6-дифосфат + Н2О = фруктозо-6-фосфат + Н3РО4; фермент: фруктозо-1,6-дифосфатдифосфатаза.
Для некоторых ферментов сохранились тривиальные названия: гидролиз крахмала осуществляет амилаза, липидов – липаза.
4-й класс: лиазы – катализируют все реакции негидролитического расщепления веществ и образование новых связей без участия энергии, выделяющейся при гидролизе АТФ. Например, если при разрыве связей выделяется углекислый газ, то фермент – декарбоксилаза (при удалении веществ добавляется приставка "де"), удаляется вода - дегидратаза.
RСООН = RН + СО2; (декарбоксилаза);
RCHOHCHCOOH = RCH = CH – СООН + Н2О (дегидратаза).
А если происходит присоединение этих веществ, то ферменты карбоксилаза и гидратаза соответственно.
5-й класс: изомеразы - катализируют реакции взаимопревращения изомеров. Например: глюкозо-6-фосфат = фруктозо-6-фосфат; реакция осуществляется под действием фермента: глюкозо-6-фосфатизомераза.
6-й класс: лигазы - катализируют соединение более простых молекул в сложные, сопряженное с распадом АТФ. Для того, чтобы назвать фермент, необходимо к названию продукта реакции добавить - синтетаза. Например: аминокислота+тРНК+АТФ = аминокислота-тРНК+АДФ; фермент: аминокислота - тРНКсинтетаза.
Свойства ферментов
- Все ферменты - белковой природы (простые и сложные).
- Все ферменты – термолабильны, т.е. оптимум действия 0-45 градусов Цельсия.
- Ферменты специфичны; различают абсолютную и относительную специфичность.
- Ферменты для своего действия требуют строго определённого значения рН среды.
- Ферменты обладают высокой каталитической активностью (например, холинэстераза за 1 сек. расщепляет 300000 молекул ацетилхолина).
Специфичность действия ферментов
Относительная (групповая) специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным… Например, пепсин расщепляет белки животного происхождения, хотя они могут… Действие этих ферментов распространяется на большое число субстратов, что позволяет организму обойтись небольшим…Активирование и ингибирование ферментов
Основу регуляции каталитической активности ферментов составляет их конформационная лабильность. Различают 5 основных путей регуляции каталитической активности ферментов:
- путь ковалентной модификации
- путь нековалентной модификации
- ингибирование ферментов
- репрессия или индукция генов: изменение биосинтеза ферментов
- компартментализация
Регуляция путём ковалентной модификации
1) частичный протеолиз 2) ассоциация – диссоциация 3) фосфорилирование - дефосфорилирование.Путь нековалентной модификации
Регуляция по типу обратной связи.
Активаторы увеличивают активность ферментов, а ингибиторы уменьшают. Часто биохимический процесс состоит из нескольких стадий, которые…Типы ингибирования
Е — SH + Ag+ ® Е — S — Ag + H+; в противном случае наблюдается обратимое ингибирование. Обратимое…Конкурентное ингибирование
Е + S ® ES ® P + Е; Е + I ® EI ® не образуются продукты реакции Скорость реакции уменьшается, потому что при присоединении ингибитора к активному центру субстрата уменьшается число…Неконкурентное ингибирование
Неконкурентное ингибирование наблюдается, когда ингибитор и фермент не сходны по структуре и ингибитор присоединяется к регуляторному центру фермента. При этом образуется тройной комплекс: фермент-ингибитор-субстрат, который не приводит к образованию продуктов реакции. В данном типе ингибирования влияние ингибитора не может быть преодолено повышением концентрации субстрата.
Регуляция путем изменения биосинтеза ферментов
Рассмотренные ранее способы изменения скорости протекания реакций направлены на изменение активности уже имеющихся ферментов. Существует другой способ регуляции — изменение содержания ферментов. В организме имеются вещества, которые, присоединяясь к белку — регулятору оперона, могут изменять скорость биосинтеза белков-ферментов: наблюдается либо усиление биосинтеза ферментов (индукция генов), либо замедление (репрессия генов).
Компартментализация (отделение, отсек) в клетке
Этот способ регуляции характерен только для высших форм живых организмов и позволяет осуществить наиболее тонкую регуляцию метаболизма. Он направлен на снижение скорости процесса за счет разъединения субстрата с ферментами с помощью мембраны. Перенос групп атомов и субстратов осуществляется за счет челночных механизмов, переводящих субстрат в форму, которая способна проникать через мембрану. Затем по другую сторону мембраны происходит обратное их превращение в первоначальную форму.
Изоферменты
Например, лактатдегидрогеназа (ЛДГ) — олигомер, состоящий из 4 протомеров одного или двух типов, обозначаемых: Н (сердце) и М (мышцы). ЛДГ… Лактатдегидрогеназа катализирует обратимое восстановление пировиноградной… пируват + НАДН + Н+ « лактат + НАД+.Количественная характеристика активности фермента
Удельную активность фермента определяют путем деления числа единиц… Молярную активность фермента определяют путем деления числа единиц ферментативной активности в образце на массу…Количественная характеристика активности ферментов в биологических жидкостях
Активность ферментов крови: a-амилаза — г/ (ч • л) .
АсАТ, АлАТ, ЛДГ, ХЭ, КФК, щелочной фосфатазы — в ммоль/(ч • л).
трипсина — мкмоль/ (мл • ч)
Энзимодиагностика
Количественно определяя нефункциональные ферменты плазмы (индикаторные ферменты), можно диагностировать заболевание. Например, при инфаркте… Наследственные нарушения (энзимопатии) Энзимопатии — заболевания, характеризующиеся нарушением содержания того или иного фермента в организме. Они…Энзимотерапия
Фибринолизин применяют при лечении незаживающих ран, пролежней, для рассасывания тромбов у больных тромбозами. Фермент лидаза используется после операций для предотвращения образования… Среди ингибиторов ферментов используется трасилол — препарат, получаемый из околоушной железы крупного рогатого…Липиды.
Классификация липидов. Характеристика фосфолипидов и восков.
Существует несколько классификаций липидов. Наибольшее распространение получила классификация, основанная на структурных особенностях липидов. По этой классификации различают следующие основные классы липидов:
1. Простые липиды:сложные эфиры жирных кислот с различными спиртами:
- Глицериды (ацилглицерины, или ацилглицеролы - по международной номенклатуре) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот.
- Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов.
2. Сложные липиды:сложные эфиры жирных кислот со спиртами, дополнительно содержащие и другие группы.
- Фосфолипиды: липиды, содержащие, помимо жирных кислот и спирта, остаток фосфорной кислоты. В их состав часто входят азотистые основания и другие компоненты: глицерофосфолипиды (в роли спирта выступает глицерол); сфинголипиды (в роли спирта - сфингозин).
- Гликолипиды (гликосфинголипиды).
- Стероиды.
- Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины.
3. Предшественники и производные липидов:жирные кислоты, глицерол, стеролы и прочие спирты (помимо глицерола и стеролов), альдегиды жирных кислот, углеводороды, жирорастворимые витамины и гормоны.
Воска-сложные эфиры высших жирных кислот и высших одноатомных или двухатомных спиртов с числом углеродных атомов от 16 до 22. Общие формулы можно представить так:

В этих формулах R, R' и R"-возможные радикалы.
Воска могут входить в состав жира, покрывающего кожу, шерсть, перья. У растений 80% от всех липидов, образующих пленку на поверхности листьев и плодов, составляют воска. Известно также, что воска являются нормальными метаболитами некоторых микроорганизмов. Природные воска (например, пчелиный воск, спермацет, ланолин) обычно содержат, кроме указанных сложных эфиров, некоторое количество свободных жирных кислот, спиртов и углеводородов с числом углеродных атомов 21-35.
Фосфолипидыпредставляют собой сложные эфиры многоатомных спиртов: глицерина или сфингозина с высшими жирными кислотами и фосфорной кислотой. В состав фосфолипидов входят также азотсодержащие соединения: холин, этаноламин или серин. В зависимости от того, какой многоатомный спирт участвует в образовании фосфолипида (глицерин или сфингозин), последние делят на 2 группы: глицерофосфолипиды и сфинг: фосфолипиды. Необходимо отметить, что в глицерофосфолипидах либо холин, либо этаноламин или серии соединены эфирной связью с остатка фосфорной кислоты; в составе сфинголипидов обнаружен только холин. Наиболее распространенными в тканях животных являются глицерофосфо- липиды.
Фосфолипиды (глицерофосфолипиды). Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащие соединения. Общая формула глицерофосфолипидов:
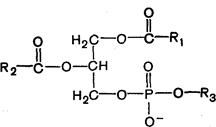
В этих формулах R1 и R2- радикалы высших жирных кислот, а R3- чаще радикал азотистого соединения. Для всех глицерофосфолипидов характерно, что одна часть их молекул (радикалы R1 и R2-) обнаруживает резко сраженную гидрофобность, тогда как другая часть гидрофильна благодаря отрицательному заряду фосфорной кислоты и положительному заряду радикала R3.
Из всех липидов глицерофосфолипиды обладают наиболее выраженными полярными свойствами. Существует несколько групп (подклассов) глицерофосфолипидов. В зависимости от характера азотистого основания, присоединенного к фосфорной кислоте, глицерофосфо-гликолипиды подразделяют на фосфатидилхолины (лецитины), фосфатидилэтаноламины (кефалины) и фосфатидилсерины. В состав некоторых глицерофосфолипидов вместо азотсодержащих соединений входит не содержащий азота шестиуглеродный циклический спирт инозит, называемый также инозитолом. Эти липиды называются фосфатидилинозитолами.
Фосфатидилхолины (лецитины).В отличие от триглицеридов в молекуле фосфатидилхолина одна из трех гидроксильных групп глицерина связана не с жирной, а с фосфорной кислотой. Кроме того, фосфорная кислота в свою очередь соединена эфирной связью с азотистым основанием - холином [НО — СН2 — СН2 — Na+(СН3)3]. Таким образом, в молекуле фосфатидилхолина соединены глицерин, высшие жирные кислоты, фосфорная кислота и холин:
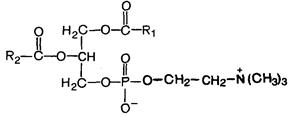
Фосфатидилэтаноламины.Основное различие между фосфатидилхолинами и фосфатидилэтаноламинами - наличие в составе последних азотистого основания этаноламина (НО — СН2 — СН2 — N +Н3).
Обмен липидов
Переваривание жира начинается в желудке, где находится малоактивный фермент желудочная липаза, однако ее роль в гидролизе пищевых триглицеридов у… Расщепление триглицеридов в желудке взрослого человека невелико, но оно в… После того как химус попадает в двенадцатиперстную кишку, прежде всего происходит нейтрализация попавшей в кишечник с…Ресинтез жирных кислот в стенке кишечника.
Из всосавшихся продуктов гидролиза в стенке кишечника происходит ресинтез специфичных для данного организма. Триглицеридов и фосфоглицеридов. При этом происходит последовательное присоединение к моноглицеридам активированных жирных кислот.
При синтезе фосфолипидов глицерин фосфорилируется фосфатглицеролкиназой, превращается в глицерол-3-фосфат, который затем взаимодействует с активированными жирными кислотами, образуя фосфатидную кислоту.
Транспорт липидов
По крови хиломикроны транспортируются к печени и жировой ткани. На поверхности клеток под действием фермента липопротеиназа происходит их гидролиз с… Жирные кислоты, как и глюкоза, является основным энергетическим материалом в…Тема УГЛЕВОДЫ
Углеводы можно разделить на 3 основные группы в зависимости от количества составляющих их мономеров: моносахариды, олигосахариды и полисахариды.КЛАССИФИКАЦИЯ УГЛЕВОДОВ
 |
 |  |  | |||
МОНОСАХАРИДЫ.
Альдозы содержат функциональную альдегидную группу –НС=О, тогда как кетозы содержат кетонную группу >С=О. Название моносахарида зависит от числа… Моносахариды по строению можно отнести к простым углеводам, т.к. они не… Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетонфосфат:Стериоизомерия моносахаридов.
Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат к… Природные моносахариды обладают оптической активностью – способностью вращать плоскость поляризованного луча света –…Циклические (полуацетальные) формы моносахаридов.
Реакция образования полуацетали возможна и в пределах одной молекулы. Внутримолекулярное взаимодействие спиртовой и карбоксильной групп наиболее благоприятно, если оно приводит к…Основные реакции моносахаридов.
Реакции полуацетального гидроксила.
Важным классом гликозидов являются N-гликозиды, в которых гликозидная связь осуществляется через азот, а не через кислород.Реакции с участием карбонильной группы.
Обработка альдоз слабыми окислителями приводит к превращению альдегидной группы в положении атома С-1 в карбоксильную группу с образованием так… АЛЬДОНОВЫЕ КИСЛОТЫОЛИГОСАХАРИДЫ
Дисахариды – наиболее широко известна мальтоза, лактоза и сахароза. Мальтоза образуется как промежуточный продукт при действии амилаз на крахмал…ПОЛИСАХАРИДЫ
Гомополисахариды состоят из моносахаридных единиц только одного типа. Гетерополисахариды содержат два и более типов мономерных звеньев. Гомополисахариды. По своему функциональному назначению гомополисахариды могут быть разделены на 2 группы: структурные…ГЕТЕРОПОЛИСАХАРИДЫ.
Мукополисахариды представляют собой желеподобные, липкие вещества. Они выполняют различные функции, в т.ч. структурную,защитную, регуляторную и др.… Для организма имеют значение следующие из них. Гиалуроновая кислота—основная часть межклеточного вещества, своего рода «биологический цемент», который соединяет…Промежуточный обмен углеводов в организме
1. Поступление глюкозы в клетки тканей. 2. Биосинтез гликогена в печени и мышцах. 3. Распад гликогена в печени и мышцах.ВИТАМИНЫ
Витамины - это низкомолекулярные органические соединения, которые, присутствуя в пище в небольших количествах, являются незаменимыми ее… Два характерных признака, отличающих витамины от всех других органических… - витамины не включаются в структуру тканей человека и животных;Классификация витаминов
С 1956 г. принята Международная химическая номенклатура, согласно которой витамины делятся на: 1). Растворимые в воде; 2). Растворимые в жире; 3). Витаминоподобные соединения.
Несмотря на точное установление химического строения, витамины сохранили названия в виде букв латинского алфавита, отражающие хронологическую последовательность их открытия. Помимо буквенного наименования в скобках дается:
1. обозначение основного биологического эффекта, иногда с приставкой «анти», указывающей на способность данного витамина предотвращать или устранять развитие соответствующего заболевания
2. номенклатурное химическое название каждого витамина.
| Витамин | Рекомендуемая суточная потребность для человека,мг | Активная форма | Биохимическая функция | |||
| Жирорастворимые витамины А (ретинол, антиксерофтальмический) | 2,7 | Ретиналь | Зрительный процесс | |||
| Д (кальциферол, антирахитический) | 0,01-0,025 | 1,25 диоксихолекальци-ферол | Обмен кальция и фосфора | |||
| Е (токоферол, вит. размножения) | - | Транспорт электронов (защита мембранных липидов) | ||||
| К (филлохинон, менахинон, антигеморрагический) | - | Перенос электронов (кофактор в реакциях карбоксилирования. | ||||
| Водорастворимые витамины В1 (тиамин, антиневрический) | 1,2 | Тиаминпирофосфат (ТПФ) | Декарбоксилирование α-кетокислот; перенос активного альдегида (транскетолаза) | |||
| В2 (рибофлавин, витамин роста) | 1,7 | Флавинадениндинуклеотид (ФАД), флавинмононуклеотид (ФМН) | Дыхание, перенос водорода | |||
| В6 (пиродоксин, антидермический) | Пиридоксальфасфат (ПФ) | Трансаминирование и декарбоксилирование аминокислот | ||||
| В12 (кобаламин, антианемический) | 0,003 | Дезоксиаденозил (или метил-) кобаламин | Кофермент ряда метаболических реакций переноса алкильных групп; метилирование гомоцистеина | |||
| Вс (фолиевая кислота, антианемический) | 1-2,2 | Тетрагидрофолевая кислота | Транспорт одноуглеродных групп | |||
| В3 (пантотеновая кислота, антидерматитный) | 3-5 | Коэнзим А (кофермент А) | Транспорт ацильных групп | |||
| РР (никотинамид, никотиновая кислота, антипеллагрический) | НАД, НАДФ | Дыхание, перенос водорода | ||||
| Н (биотин, антисеборейный) | 0,25 | Биоцитин | Кофермент реакций карбоксилирования (транспорт СО2) | |||
| С (аскорбиновая кислота, антискорбутный) | - | Восстанавливающий фактор для ряда монооксигеназ; гидроксилирование прелина; катаболизм тирозина | ||||
| Р (витамин проницаемости, биофлавоноиды, капилляроукрепляющий) | - | |||||
| Витаминоподобные вещества U (S-метилметионин, противоязвенный фактор) | Источники
 Выделен из капустного сока.
Обнаружен в сырых овощах, печени, парном молоке Выделен из капустного сока.
Обнаружен в сырых овощах, печени, парном молоке
| Участие в синтезе холина, метионина и креатина, бактерии используют его также в качестве донора метильных групп | ||||
| В15 (пангамовая кислота, антианоксический) | 2,0 | Печень, семена растений, дрожжи | Участие в биосинтезе холина, метионина и креатина, как источник метильных групп | |||
 Коэнзим Q (или кофермент Q,КоQ, убихинон Коэнзим Q (или кофермент Q,КоQ, убихинон
 n-аминобензойная кислота (ростостимулирующий фактор)
n-аминобензойная кислота (ростостимулирующий фактор)
Инозит (инозитол)
Липоевая кислота (фактор роста молочнокислых бактерий. Выполняет роль кофермента)
(синтезируется в организме в достаточном количестве и не может быть истинным пищевым фактором, однако в определенных условиях – при недостатке белка в пище- развивается вторичная холиновая недостаточность). | Локализован в митохондриях и мембранных структурах бактерий Выделен из экстракта дрожжей. Печень, почки, мясо. дрожжи, меньше в молоке, куриных яйцах, картофеле, хлебе, моркови Печень, мясо, молоко, хлеб из муки грубого помола, овощи, фрукты Дрожжи, печень Печень, почки, мясо, рыбные продукты, капуста | Обязательный компонент дыхательной цепи, участвует в пере-носе электронов Входит в состав молекулы фолевой кислоты. Необходима для нормального процесса пигментации волос, шерсти, перьев и кожи. Оказывает активирующее влияние на действие тирозиназы – ключевого фермента при биосинтезе меланинов кожи, определяющих ее нормальную окраску. При отсутствии в пище этого водорастворимого фактора, помимо остановки роста отмечается своеобразная потеря шерстяного покрова и жировая инфильтрация печени с отложением холестерина. Биологическая роль связана с обменом фосфоглицеридов и образованием одного из наиболее активных вторичных посредников внутриклеточных сигналов (инозитол-1,4,5. –трифосфата) Участвует в окислительном декарбоксилировании в тканях a-кетокислот (ПВК и a-кетоглутаровой) Структурный компонент фосфатидилхолина (лецитина). Является составной частью биологически активного ацетилхолина – медиатора нервного импульса. Участвует в биосинтезе метионина, пуриновых и пиримидиновых нуклеотидов, фосфолипидов и т.д. Исключение холина из пищи – ожирение печени. |
Жирорастворимые витамины
Витамины группы А (ретинол, антиксерофтальмический) Известны 3 витамина группы А: А1, А2 и цис-форма витамина А1 (неовитамин А)Биологическая роль
2. Участвует в транспорте моносахаридов, необходимых для синтеза гликопротеинов; 3. Оказывает влияние на усвоение белка пищи и его обмен в организме и т.д.; … 4. Участвует в окислительно-восстановительных реакциях, т.к. в молекуле вит. А имеются двойные связи, то он образует…Водорастворимые витамины
Первый кристаллический витамин, выделенный Функом в 1912 г. Химическая структура: 2 кольца – пиримидиновое и тиазоловое, соединенные метиленовой связьюБиологическая роль
2. ТПФ участвует в расщеплении и синтезе α-оксикислот (например, кетосахаров), т.е. в реакциях синтеза и расщепления углерод-углеродных… Тиамин-зависимые ферменты – пируватдекарбоксилаза и транскетолаза.Витамин С (аскорбиновая кислота, антискорбутный витамин).
Химическое строение. Витамин С представляет собой лактон кислоты со структурой, близкой структуре L-глюкозы. Благодаря наличию двух асимметрических…Авитаминоз и гиповитаминоз
Биологическая роль. Витамин РР входит в состав НАД и НАДФ, являющихся коферментами большого числа обратимо действующих в… Источники: рис, хлеб, картофель, мясо, печень, почки, морковь и др. Суточная потребность: 18 мг.-Химия нуклеиновых кислот.
Общая характеристика нуклеиновых кислот
Были открыты в 1870 г. немецким ученым Мишером . Нуклеиновые кислоты были открыты в ядре клетки в виде соединений с белком, отсюда и термин (от лат.… В зависимости от химического строения и биологических функций нуклеиновые… - рибонуклеиновые кислоты (РНК);Химическое строение РНК и ДНК.
Нуклеиновые кислоты состоят из мононуклеотидов. Мононуклеотиды нуклеиновых кислот в свою очередь состоят из трех компонентов: Нуклеиновые кислотыАзотистое основание Углеводный компонент Фосфорная кислота
Пуриновые Пиримидиновые Рибоза Дезоксирибоза
Аденин (А) Цитозин (Ц) РНК ДНК Гуанин (Г) Урацил (У) Тимин (Т)РНК ДНК
Рибоза Дезоксирибоза Азотистые основания (А, Г, Ц, У) ( А, Г, Ц, Т)Структура нуклеиновых кислот.
Имеются 3 уровня структуры.
Первичная структура РНК и ДНК.
На одном конце полинуклеотидной цепи всегда есть свободный остаток фосфорной кислоты в 5/ -положении. Этот нуклеотид обозначается как 5/ - концевой… Геном – полное количество ДНК, несущее всю генетическую информацию для данного…Вторичная структура ДНК.
1. У ДНК молярные доли пуриновых и пиримидиновых оснований равны: А+ Г = Ц + Т или (А + Г)/(Ц + Т)=1. 2. В ДНК количество оснований с аминогруппами (А +Ц) равно количеству оснований с кетогруппами (Г + Т):Третичная структура ДНК.
Стабилизировано сверхскрученное состояние ДНК ионными связями с гистонами. Сначала образуются нуклеосомы (структурная единица хроматина), затем цепочка…Структура и функции РНК.
Существуют: 1 – матричные РНК (мРНК); 2 – рибосомные РНК (рРНК);Тема: ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ И НУКЛЕОТИДОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА.
Обмен нуклеотидов в организме включает процессы анаболизма (биосинтез пуриновых — основной и резервный путь — и пиримидиновых нуклеотидов) и… Продукты переваривания: пуриновые и пиримидиновые азотистые основания, пентозы… В норме 90% продуктов переваривания превращаются в конечные продукты: пуриновые основания — в мочевую кислоту и…Транскрипция
Транскрипция — биосинтез молекул РНК на матрице ДНК, локализован в ядре клетки, идет постоянно, независимо от цикла клетки. Субстратами и источниками энергии для биосинтеза РНК являются: АТФ, ГТФ, УТФ,… Ферментом транскрипции является РНК-полимераза ДНК-зависимая.Биосинтез белка
Биосинтез белка (трансляция) протекает в полисомах и приводит к построению полипептидной цепи из аминокислот (первичной структуры белка). Для… Этапами трансляции являются: инициация, элонгация, терминация. Предварительный этап — образование активированных аминокислот с участием фермента аминоацил-т-РНК-синтетазы, 1…Регуляция транскрипции. Теория Оперона
Оперон — участок ДНК, кодирующий строение одного вида белков, содержащий регуляторную зону, контролирующую синтез этих белков. Регуляция транскрипции м-РНК включает индукцию и репрессию генов. Оперон состоит из гена-регулятора, гена-промотора, гена-оператора, структурных генов.Тема: ЭНЕРГЕТИЧЕСКИЙ ОБМЕН. Цикл лимонной кислоты - цикл трикарбоновых кислот (ЦТК), цикл Кребса - конечный общий путь окисления белков, липидов, углеводов.ЦТК - амфиболический цикл.
Катаболизм белков, липидов, углеводов осуществляется в 3 этапа:
1. Переваривание и всасывание (1% энергии).
2. Межуточный обмен (специфические пути катаболизма) (29% энергии).
3. Общий конечный путь распада — терминальное окисление (70% энергии).
Специфические пути включают в себя гликолиз, b-окисление ВЖК, а также дезаминирование, переаминирование и декарбоксилирование аминокислот.
Общий конечный путь распада включает окислительное декарбоксилирование ПВК, цикл Кребса и ЦПЭ.
Окислительное декарбоксилирование ПВК протекает аэробно в матриксе митохондрий под влиянием мультиэнзимного комплекса (3 фермента и 5 коферментов, М = 10 млн.) в 4 стадии.
Пируватдегидрогеназный комплекс присоединен к внутренней мембране митохондрий со стороны матрикса. Суммарная реакция:

Цикл лимонной кислоты — ЦТК — цикл Кребса
Цикл лимонной кислоты представляет собой серию реакций, протекающих в митохондриях, в ходе которых осуществляется катаболизм ацетильных групп (до… Биохимические функции цикла Кребса: Интегративная — объединяет 3 пути… 1) глюконеогенез — превращение ПВК и оксалоацетата в глюкозу,Энергетическая роль ЦТК
За период каждого цикла образуется 1ГТФ, 3 НАДН + Н+ и ФАДН2, которые генерируют образование 12 молекул АТФ (ГТФ — в субстратном фосфорилировании, а восстановленные эквиваленты — в окислительном фосфорилировании). ЦТК — амфиболический цикл, так как он создает окисляющиеся продукты и продукты для анаболизма.
Регуляция цикла Кребса
Регуляторные ферменты цикла Кребса: Пируватдегидрогеназа (ингибиторы: АТФ, НАДН + Н+, цитрат, ацетил-КоА; активаторы: АДФ, НАД+,… Пировиноградная кислота является одним из центральных метаболитов углеводного…Биоэнергетика. Биологическое окисление
Роль кислорода в метаболизме
Организм человека функционирует в аэробных условиях: 90% энергии он получает при участии кислорода. Кислород выполняет две важнейшие функции в… 1) является конечным акцептором электронов и протонов при биологическом… 2) выполняет пластическую функцию: кислород встраивается в процессе микросомального окисления в гидрофобные…Токсичность кислорода
Для организма человека токсичность кислорода обусловлена токсичностью его активных форм, которые могут образовываться при переносе электронов от… В живой клетке происходит детоксикация пероксида водорода и супероксид-иона…Макроэргические молекулы
К макроэргическим относятся соединения, при гидролизе которых выделяется энергия не менее 7 ккал/моль. Это число — условная единица, означающая всего лишь некий уровень отсчета, согласно которому АТФ и несколько других соединений отличаются от остальных природных соединений. Соответственно название «макроэргический» употребляется для объединения соединений в группу веществ макроэргических и для указания их особой важности в переносе энергии в живой клетке.
Нуклеозидтрифосфаты
Наиболее распространенными высокоэнергетическими общими промежуточными продуктами являются нуклеозидтрифосфаты (НТФ), которые могут передавать… Молекула АТФ состоит из аденилатной группы и трех остатков фосфорной группы.… Гидролиз АТФ — термодинамическая движущая сила процессов, которые сами по себе являются термодинамически…– Конец работы –
Используемые теги: Лекции, курсу, Биохимия, Тема, ПЕПТИДЫ, Белки, ИХ, Строение, Свойства, значение, организме, Методы, исследования, Физико-химические, Свойства, белков, 100.183
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Лекции по курсу: Биохимия Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 10
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?




 Холин
Холин




Новости и инфо для студентов