Изоферменты
Изоферменты — это ферменты, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по АК-составу, порядку связывания АК, электрофоретической подвижности, Км, локализации в клетке и органе. Изоферменты выполняют одинаковые биологические функции, но с различной эффективностью.
Например, лактатдегидрогеназа (ЛДГ) — олигомер, состоящий из 4 протомеров одного или двух типов, обозначаемых: Н (сердце) и М (мышцы). ЛДГ существует в 5 формах, легко различающихся с помощью электрофореза. Пять изоферментов ЛДГ имеют следующий полипептидный состав: ЛДГ1 — (Н4); ЛДГ2 — (Н3М); ЛДГ3 —(Н2М2); ЛДГ4 — (НМ3); ЛДГ5 — (М4). Различные ткани человека имеют свои характерные изоферментные спектры. В сердечной мышце и почках наиболее высокой активностью обладают изоферменты ЛДГ1 и ЛДГ2. В печени и скелетной мускулатуре максимальны ЛДГ5. В селезенке, поджелудочной железе, щитовидной железе, надпочечниках - ЛДГ3.
Лактатдегидрогеназа катализирует обратимое восстановление пировиноградной кислоты (ПВК) в молочную (лактат), в котором в роли восстановителя выступает НАДН + Н+.
пируват + НАДН + Н+ « лактат + НАД+.
В тканях, в которых преобладает аэробный распад глюкозы, присутствуют обычно ЛДГ1 и ЛДГ2, для которых характерно низкое сродство к пирувату, и поэтому они не могут эффективно конкурировать за пировиноградную кислоту с пируватдегидрогеназным комплексом. В результате пировиноградная кислота подвергается преимущественно окислительному декарбоксилированию и образующийся в этой реакции ацетил-КоА «сгорает» в цикле трикарбоновых кислот. В тканях, где доминирует анаэробный гликолиз, присутствуют изоферменты с высоким сродством к пирувату: ЛДГ4 и ЛДГ5. В этих тканях пируват расходуется преимущественно в лактатдегидрогеназной реакции.
Механизм биохимической ферментативной реакции можно представить упрощенно в общем виде:

 E + S
E + S  ES
ES 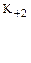 P + E .............................
P + E ............................. 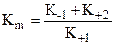
где Е — фермент;
S — субстрат;
ES — фермент-субстратный комплекс;
Р — продукты реакции;
К+1, К-1, К+2 — константы скоростей прямых и обратной реакций.
Константа Михаэлиса—Ментен (Km) характеризует константу диссоциации фермент-субстратного комплекса и численно равна концентрации субстрата (в моль/л), при которой скорость данной реакции составляет 1/2 от максимальной. Она характерна для каждой пары фермент-субстратного комплекса.
Уравнение Михаэлиса—Ментен выражает зависимость скорости биохимической ферментативной реакции от концентрации субстрата:

где Vбиохим.р.— скорость данной биохимической реакции,
Vmax — максимальная скорость биохимической реакции,
S — субстрат,
Кm — константа Михаэлиса—Ментен.
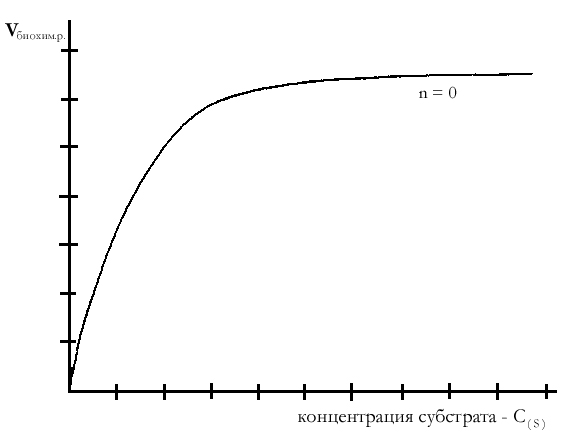
Анализ уравнения Михаэлиса—Ментен:
1) Если концентрация субстрата в реакции низка, т.е. [S] << Кm, то уравнение приобретает вид:

Таким образом, при низких концентрациях субстрата скорость биохимической реакции прямо пропорциональна концентрации субстрата и описывается уравнением I порядка.
2) При высоких концентрациях субстрата, т. е. [S] >> Кm, величиной Кm можно пренебречь, тогда
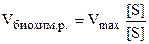 ,
, 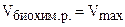
Таким образом, при высоких концентрациях субстрата скорость биохимической реакции становится максимальной и описывается уравнением нулевого порядка.
График зависимости скорости биохимической ферментативной реакции от концентрации субстрата