Порядок виконання роботи
Пункти 1 ÷ 9 виконуються під контролем персоналу лабораторії.
1. Включити компресор.
2. Продути установку повітрям 5 ÷ 10 хв.
3. Встановити з використанням калібрувального графіка капіляра (поз. 4) витрату повітря за завданням викладача: встановити потрібний перепад рідини у реометрі (поз. 3), що в свою чергу визначається відповідною висотою рідини у маностаті (поз. 1) (встановлюється за допомогою напірної склянки (поз. 2)).
4. Виставити регулятором (поз. 13) температуру за завданням викладача, включити електропіч.
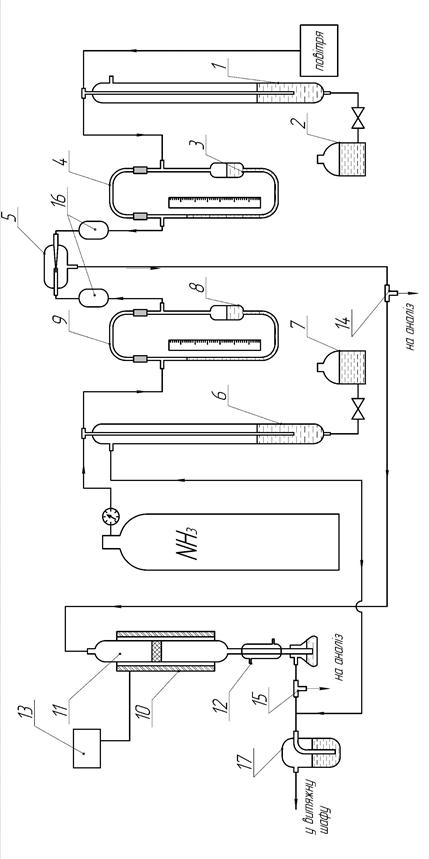
| 1, 6 - маностат; 2, 7 - напірна склянка; 3, 8 - реометр; 4, 9 - капіляр; 5 - змішувач; 10 - електропіч; 11 - реактор; 12 - холодильник; 13 - регулятор температури; 14, 15 - крани відбору проби аміачно-повітряної суміші та нітрозного газу, відповідно; 16 – уловлювачі бризок рідини, 17 – склянка Дрекселя Рисунок 6.1 - Схема лабораторної установки |
5. Обережно відкрити балон з аміаком поворотом вентилю проти годинникової стрілки.
6. Встановити з використанням калібрувального графіка капіляра 9 витрату аміаку за завданням викладача: встановити потрібний перепад рідини у реометрі 8, що в свою чергу визначається відповідною висотою рідини у маностаті 6 (встановлюється за допомогою напірної склянки 7).
7. Провести аналіз АПС на вміст аміаку (див. 6.2.3).
8. Після досягнення заданої температури провести аналіз нітрозного газу на вміст оксидів азоту (див. 6.2.3).
9. Виключити установку: вимкнути електропіч, закрити балон з аміаком поворотом вентилю за годинниковою стрілкою, продути установку повітрям, вимкнути повітряний компресор.
10. Результати аналізу, спостережень і обчислень звести до таблиць 6.1 і 6.2.
6.2.3 Методика аналізу газових сумішей
Аналіз АПС на вміст аміаку. Для аналізу АПС на вміст аміаку застосовують метод евакуйованих колб. Колбу приєднують до вакуум-насоса і створюють розрідження (12÷15 обертів колеса вакуум-насоса), за допомогою лійки заливають у неї 50 см3 0,1 М розчину НCl (відбір піпеткою) і 100 см3 дистильованої води (відмірюють циліндром). У колбі створюють розрідження (45 ÷ 50 обертів колеса вакуум-насоса), приєднують до вакуумметру і замірюють розрідження R1 у колбі. Колбу у перевернутому виді з’єднують до відбірного крана (поз. 14), відкривають кран (поз. 14), плавно і обережно відкривають кран колби до проходження газу через рідину у виді окремих бульбашок. Відбір проби завершують після припинення барботажу газу через рідину у колбі. Залишкове розрідження у колбі в цьому випадку дорівнює нулю R2= 0. Потім у колбі утворюють надлишковий тиск (8 ÷ 10 обертів колеса вакуум-насоса), а розчин з евакуйованої колби переносять до конічної колби і титрують 0,1 М розчином гідроксиду натрію в присутності індикатора метилоранжу (перехід забарвлення із оранжевого в жовте). Обчислення молярної частки аміаку в АПС:
 , (6.6)
, (6.6)
де 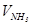 - об’єм аміаку у відібраній пробі газу, см3 - визначається за результатами титрування:
- об’єм аміаку у відібраній пробі газу, см3 - визначається за результатами титрування:
 , (6.7)
, (6.7)
де 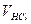 ,
, 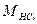 - об’єм, см3 і молярна концентрація, моль/дм3 хлоридної (соляної) кислоти, взятої для аналізу;
- об’єм, см3 і молярна концентрація, моль/дм3 хлоридної (соляної) кислоти, взятої для аналізу;  - об’єм, см3 і молярна концентрація, моль/дм3 гідроксиду натрію, що витрачено на титрування; VН – об’єм не поглинених розчином газів у колбі при відбиранні АПС, см3:
- об’єм, см3 і молярна концентрація, моль/дм3 гідроксиду натрію, що витрачено на титрування; VН – об’єм не поглинених розчином газів у колбі при відбиранні АПС, см3:
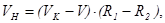 (6.8)
(6.8)
| |
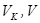 відповідно об’єм колби (вказано на колбі) і об’єм розчину НСl + H2О (V=50+100=150 cм3).
відповідно об’єм колби (вказано на колбі) і об’єм розчину НСl + H2О (V=50+100=150 cм3).
Аналіз нітрозного газу на вміст оксидів азоту. Для аналізу оксидів азоту також використовують метод евакуйованих колб. До колби заливають 20 см3 H2O2 і 100 см3 H2О (відмірюють циліндром) – V = 120 см3. Далі діють аналогічно вище наведеній методиці аналізу. Відбір проби газу на вміст оксидів азоту здійснюють через кран (поз. 15). Оксиди азоту із відібраної проби газу поглинаються водним розчином H2O2:
 ; (6.9)
; (6.9)
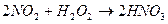
| |
Нітратну (азотну) кислоту, що утворилася, титрують 0,1 М розчином гідроксиду натрію (індикатор - метил-рот, перехід забарвлення від червоного до солом’яно-жовтого). Молярна частка оксидів азоту обчислюється за формулою:
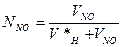 , (6.11)
, (6.11)
де V*H – об’єм не поглинених газів при відбиранні нітрозного газу, см3 - визначається за рівнянням (6.8), але з відповідними значеннями змінних; VNO – об’єм оксидів азоту у відібраній пробі, см3:
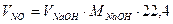 , (6.12)
, (6.12)
де  ,
,  - об’єм, см3 і молярність, моль/дм3 гідроксиду натрію, що витрачено на титрування.
- об’єм, см3 і молярність, моль/дм3 гідроксиду натрію, що витрачено на титрування.
Таблиця 6.1 - Результати виконання аналізу
| Аналіз суміші на вміст: | Розрідження початкове R1, кгс/см2 | Розрідження кінцеве R2, кгс/см2 | Витрата гідроксиду натрію на титрування, VNaOH, см3 |
| аміаку | |||
| оксидів азоту |
6.3 Обробка і представлення результатів
Розрахунок ступеня перетворення аміаку (виходу NO). Згідно рівняння реакції (6.1) з одного моля аміаку утворюється один моль оксиду азоту (ІІ). Без урахування зміни об’єму суміші в ході реакції ступінь перетворення X (дорівнює виходу NO) можна обчислити за формулою:
 . (6.13)
. (6.13)
Розрахунок продуктивності та інтенсивності платинового каталізатора. Продуктивність каталізатора за аміаком, г/год:
 , (6.14)
, (6.14)
де Qс - витрати АПС - визначається як сума витрат повітря і аміаку, см3 /хв (до речі, один з виразів продуктивності установки).
Для платинового каталізатора мірою інтенсивності є напруженість I - відношення продуктивності П до поверхні платинової сітки S (у лабораторному реакторі S = 13,25. см2), г/ (см2.год):
 . (6.15)
. (6.15)
Результати роботи необхідно внести до таблиці 6.2.
Таблиця 6.2 - Результати виконання роботи
| Завдання | Виконання | ||||||
| Т, К | Qповітря, см3/хв | 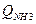 ,
см3/хв ,
см3/хв
| 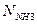
| 
| X | П, г/год | І, г/(см2.год) |
6.4 Техніка безпеки
1. При появі запаху аміаку звернути негайно увагу на це викладача або навчально-допоміжного персоналу.
2. Під час виконання аналізу газових сумішей евакуйовані колби повинні знаходитись у чохлах.
3. При титруванні дотримуватись загальних правил поведінки в лабораторії.
6.5 Контрольні запитання
Допуск до роботи:
1. Мета роботи. Реакції окиснення аміаку. Призначення продукту реакції - оксиду азоту (II). Опис схеми установки окиснення аміаку. Порядок виконання роботи. Правила техніки безпеки. Зона вибуховості AПС. Запобігання можливих вибухів.
2. Методика аналізу NH3 і NO у газовій суміші.
Захист роботи:
1. Область перебігу процесу окиснення аміаку. Рівняння швидкості процесу, шляхи збільшення швидкості.
2. Каталізатори окиснення аміаку. Механізм дії каталізатора: причини збільшення швидкості реакції у присутності каталізатору.
3. Продуктивність і напруженість каталізатора, селективність (вибірковість) каталізатора. Температура запалювання каталізатора.
4. Ступінь перетворення вихідної речовини, вихід продукту реакції.
7 Коксування кам’яного вугілля
Мета роботи: провести коксування кам’яного вугілля, визначити вихід коксу і коксового газу, дослідити склад коксового газу та скласти матеріальний баланс процесу коксування.
7.1 Стислі теоретичні відомості
Тверде паливо – це не тільки джерело енергії, але і цінна сировина для хімічної промисловості. Основними методами хімічної переробки твердого палива є піроліз (суха перегонка), газифікація, гідрування тощо. З процесів піролізу найбільш широкого поширення набув процес коксування, що полягає у нагріванні твердого палива без доступу повітря при температурі 1173÷1373 К (900÷1100 °С).
Тверде паливо містить пальну (органічну) і мінеральну частини. Останню складають карбонати, силікати, фосфати, сульфати, сульфіди металів – заліза, кальцію, калію, натрію і т.п. При коксуванні палива більшість мінеральних речовин піддається розкладанню з утворенням оксидів, які залишаються у вигляді золи. Органічна частина твердого палива представлена різними класами вуглеводнів, кисеньвмісних речовин (спирти, кетони, карбонові кислоти, феноли), азот- і сірковмісних речовин (аміни, гетероциклічні сполуки).
Піроліз органічної маси вугілля – це складний гетерогенний високотемпературний процес, в якому реакції розкладання одночасно поєднуються з реакціями полімеризації і поліконденсації продуктів розщеплення. Роль і характер окремих паралельних і послідовних реакцій з різними енергіями активації в процесі піролізу різних видів твердого палива неоднакові, але, як правило, сумарний ефект процесу – ендотермічний. Отже, для всіх видів піролізу потрібне підведення теплоти. При поступовому нагріванні компоненти вугілля зазнають глибоких фізичних і хімічних перетворень: до 500 К відбувається випаровування вологи, видалення оксидів вуглецю (ІІ, ІV); близько 600 К починається виділення парів смоли і утворення пірогенетичної води; вище 600 К вугілля переходить в пластичний стан; при 750÷850 К спостерігається бурхливе розкладання пластичної маси з виділенням первинних продуктів (газу і смоли) та твердіння її з утворенням напівкоксу. Підвищення температури до 950÷1000 К супроводжується подальшим розкладанням напівкоксу, виділенням з нього газоподібних продуктів; вище 1000 К відбувається переважно зміцнення коксу. Леткі продукти, стикаючись з коксом, що розжарений і нагрітий стінками печі, перетворюються на складну суміш пари (з переважанням сполук ароматичного ряду) та газів, які містять водень, оксид вуглецю (ІІ), метан тощо. Таким чином, коксування – це складний багатофазний процес, що складається з процесів теплопередачі, дифузії і великої кількості хімічних реакцій. В результаті коксування отримують тверді (кокс), рідкі (кам’яновугільна смола, сирий бензол, надсмольна вода) і газоподібні (коксовий газ) продукти.
З 1 т сухого вугілля в середньому отримують 700÷800 кг коксу, 25÷30 кг кам’яновугільної смоли, 300÷350 м3 газу, що містить близько 3 кг аміаку і до 10 кг сирого бензолу.
На процес коксування впливають наступні чинники:
Склад початкової шихти. Сировиною для коксування служить вугілля (марки К), що коксується, яке при високій температурі добре спікається, і утворює міцний і поруватий кокс. Проте в промисловій практиці використовують суміш вугілля різних марок – шихту, що дозволяє розширити сировинну базу коксохімічного виробництва, отримати якісний кокс і забезпечити високий вихід смоли, сирого бензолу і коксового газу. Вугілля повинне мати певну вологість (5÷8 %) та не перевищувати встановлених меж за вмістом золи і сірки, які в процесі коксування переважно переходять в кокс і потім негативно впливають на хід доменного процесу. Перед приготуванням шихти вугілля кожної марки подрібнюється і збагачується гравітаційним методом або флотацією.
Ступінь подрібнення вугілля. З підвищенням ступеня подрібнення шихти збільшується в’язкість пластичної вугільної маси та знижується її здатність до здимання. При такому подрібненні вугілля збільшується загальний вихід газу і вміст в ньому водню.
Щільність завантаження. При підвищенні насипної маси вугільної шихти збільшується продуктивність коксових печей і якість отримуваного коксу. Для підвищення насипної маси шихти до неї додають тверді (оксид кальцію) та рідкі вуглеводневі добавки (гас, мазут тощо).
Швидкість коксування. При підвищенні швидкості коксування зменшується вихід крупних класів коксу і збільшується вихід класу 25÷60 мм (металургійний кокс).
Підвищення температури. При температурах вище 1300 К перебігає глибокий піроліз вуглеводнів, що утворилися; відповідно, знижується вихід смоли і підвищується вихід коксового газу.
Технологічний процес коксування складається з трьох основних стадій: 1) підготовка вугільної шихти, завантаження її в коксову піч; 2) коксування, відбір парогазової фази і вивантаження коксу; 3) переробка парогазової фази («прямого» коксового газу).
З «прямого» коксового газу виділяють кам’яновугільну смолу,
надсмольну воду, аміак, бензол і його гомологи. Звільнений від цих речовин коксовий газ, що зветься «зворотним» коксовим газом, складається в основному з водню, оксиду вуглецю (ІІ) і метану. Використовують його як сировину для хімічних виробництв (отримання аміаку, метанолу і т.д.), як цінне висококалорійне паливо для інтенсифікації металургійних процесів тощо.