Способы выражения численного состава растворов
а) Массовая доля показывает, какую часть от общей массы раствора составляет масса растворенного вещества. Массовую долю допускается выражать в долях единицы, процентах, промилле (тысячная часть процента).
Обозначение массовой доли – ω.
Массовая доля рассчитывается как отношение массы растворенного вещества X к массе раствора и выражается в долях единицы, а умноженная на 100% – в процентах.
Пример. Рассчитайте массовую долю (в долях единицы и процентах) сульфата натрия, если в растворе массой 400 г содержится Na2SО4 массой 20 г
Решение:
m(Na2SO4) 20 г
ω(Na2SO4) = ————————— = ——— = 0.05;
m(раствораNa2SO4) 400 г
m(Na2SO4) 20 г
ω%(Na2SO4) = ———————— × 100% = —— × 100% = 5%.
m(раствораNa2SO4) 400 г
б)Молярная концентрация
В курсе химии используется понятие «количество вещества». Единицей количества вещества является 1 моль.
Моль — количество вещества, содержащее столько реальных или условных единиц, сколько атомов содержится в 0,012 кг (12 г) изотопа углерода-12 (12С).
Обозначение количества вещества – n. Например, n(HСl) = 2 моль, n(NaOH) = 20 моль, n(Fe3+) =15 мкмоль .
Отношение массы (m) вещества X к его количеству (n), называют молярной массой вещества X.
Обозначение молярной массы М(Х):
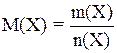
Единица молярной массы 1 г/моль.
Молярная концентрация С(Х) показывает количество вещества X (в молях), которое содержится в растворе объемом 1 л. Она равна отношению количества вещества к объёму раствора:
n(Х) m(Х)
С(Х) = —————— = —————————, моль/л.
V(раствора) М(Х) × V(раствора)
Пример. Рассчитайте молярную концентрацию раствора гидроксида натрия, если в растворе объемом 0.2 л содержится 0.04 моль NaOH.