рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Социология
- /
- Методические рекомендации и социальному развитию
Реферат Курсовая Конспект
Методические рекомендации и социальному развитию
Методические рекомендации и социальному развитию - раздел Социология, Методические Рекомендации ...
Методические рекомендации
К лабораторно-практическим занятиям по общей химии
Федеральное агентство по здравоохранению
и социальному развитию
Северный научный центр РАМН
Северный государственный медицинский университет
Методические рекомендации к лабораторно-практическим занятиям по общей химии
Архангельск Северный государственный медицинский университетЗанятие 1 (Вводное).
Содержание занятия:
1. Инструктаж по технике безопасности.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ СТУДЕНТОВ В ЛАБОРАТОРНЫХ ПРАКТИКУМАХ СГМУ
· Работать в лабораторных практикумах кафедры разрешается только в халатах с… · Рабочее место следует содержать в чистоте, не загромождать его посудой и посторонними предметами.Категорически запрещается выполнять в лаборатории экспериментальные работы, не связанные с выполнением учебного практикума!!!
Занятие 2. Строение атома. Химическая связь и строение молекул
Цель занятия:
Сформировать современные представления о строении атома, о природе химической связи, её влиянии на строение и свойства химических соединений; а также развить культуру речи, логичность и глубину мышления, умение работать с литературой.
Задачи:
Научиться:
· пользоваться системой квантовых чисел для характеристики энергетического состояния электрона в атоме и молекуле;
· составлять электронные формулы атомов элементов и на основании последних уметь определять положение элемента в периодической системе элементов Д. И. Менделеева, принадлежность к семейству элементов (s-, p-, d-, f-), свойства простых веществ (окислитель, восстановитель и т. д.);
· составлять электронно-графические формулы (спиновые схемы) атомов элементов и на основании последних определять валентность атомов элементов в основном и возбужденном состояниях;
· на основании положения элемента в периодической системе определять величину радиуса атома, энергии ионизации, энергии сродства к электрону, электроотрицательности и сравнивать их со значениями этих величин атомов других элементов.
Научиться определять:
· с позиции метода валентных связей (МВС) кратность, прочность и тип (σ, π) связи;
· влияние направленности связи на строение (пространственную конфигурацию) молекул;
· тип гибридизации атомов элементов в простейших соединениях и её влиянии на пространственную конфигурацию молекул;
· предсказывать физико-химические свойства соединений в зависимости от их строения (типа химической связи).
Содержание занятия:
1. Обсуждение вопросов по теме занятия.
2. Контроль усвоения темы (устный или письменный опрос).
Вопросы, предлагаемые для обсуждения на занятии:
1. Квантово-механическая модель атома. Дуализм электрона. Уравнение де Бройля. Вероятностный характер движения электрона в атоме. Принцип неопределенности Гейзенберга. Электронное облако. Атомная орбиталь.
2. Характеристика энергетического состояния электрона в атоме системой квантовых чисел: главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа; их физический смысл и взаимосвязь.
3. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на орбиталях, подуровнях и уровнях.
4. Принцип минимума энергии. Последовательность заполнения электронами атомных орбиталей. Электронные формулы элементов; s-, p-, d-, f-элементы.
5. Заполнение электронами атомных орбиталей одного подуровня, правило Хунда. Электронно-графические формулы (спиновые схемы) элементов.
6. Связь между электронным строением атомов и положением элементов в периодической системе: s-, p-, d-, f- семейства элементов.
7. Радиусы атомов. Закономерности изменения радиусов атомов, энергии ионизации, энергии сродства к электрону, электроотрицательности s- и p- элементов (по группам и периодам).
8. Основное и возбужденное состояние атома.
9. Метод валентных связей. Основные положения метода. Механизм и способы образования ковалентной химической связи. Валентность. Максимальная валентность. Валентно-насыщенное и валентно-ненасыщенное состояние атома (на примере элементов II периода). Длина связи. Энергия связи.
10. Направленность химической связи. Влияние направленности связи на пространственную конфигурацию молекул типа АА, АВ, А2В, А3В. Насыщаемость, кратность связи.
11. Гибридизация атомных орбиталей атомов Ве, В, С на примере образования молекул ВеН2, ВН3, СН4 .
12. σ- и π-Связи.
13. Понятие о нелокализованной π-связи.
14. Полярность и поляризуемость химической связи. Дипольный момент связи (постоянный и индуцированный). Полярная и неполярная ковалентная связь. Ионная связь как предельно поляризованная ковалентная связь. Степень окисления атомов. Гомо- и гетеролитический разрыв связи.
15. Водородная связь. Межмолекулярная и внутримолекулярная водородная связь. Роль водородной связи в процессах ассоциации, растворения и биохимических процессах.
Контрольные вопросы и задачи
1. Вычислить массу фотона, соответствующего длине волны
λ = 589·10-9 м (h = 6.626 × 10-34 Дж/с).
2. Значением какого квантового числа определяется размер электронного облака и энергии электрона? Какие возможные значения может принимать данное квантовое число?
3. Главное квантовое число n = 3. Сколько возможных значений будет иметь орбитальное квантовое число?
4. Значением какого квантового числа определяется форма электронного облака?
5. Какая форма электронного облака соответствует значению квантового числа l = 1?
6. Значениями какого квантового числа определяется ориентация атомных орбиталей в пространстве?
7. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого равно 2?
8. Электронная формула атома имеет вид 1s22s22p63s1 . Укажите и объясните, к какому периоду, группе периодической системы элементов и семейству (s, p, d, f) относится данный элемент?
9. Среди приведенных ниже электронных конфигураций укажите невозможные и объясните причину невозможности их реализации:
а) 1p3, б) 3p6, в) 4s2, г) 2d4, д) 2p7, е) 3f8, ж) 4d10
10. Сколько вакантных d-орбиталей имеется в атоме титана? Напишите для него электронно-графическую формулу (спиновую схему) d-подуровня.
11. Укажите способы образования химических связей в ионе NH4+.
12. Дайте определение валентности. Приведите графические формулы следующих соединений: Mn2O3, MnO3, Mn2O7, и определите валентность марганца в них.
13. Укажите тип связи в соединениях:
а) NaCl, б) Br2 , в) NH3.
14. Руководствуясь разностью относительных электроотрицательностей (ОЭО) атомов элементов в связи Э–О, определите, как меняется характер связи в оксидах элементов III периода периодической системы элементов (ОЭО Na – 0.9; Mg – 1.2; Al – 1.5; Si – 1.8; P – 2.1; S – 2.5; Cl – 3.0; O – 3.5).
15. Что такое гибридизация атомных орбиталей? Какой тип гибридизации орбиталей атома кремния предшествует образованию молекулы SiH4? Какова её пространственная структура?
16. У какого из ионов: Na+ или Clˉ – поляризующая способность выше?
Занятие 3. Комплексные соединения и их свойства
Цель занятия:
Получить системные знания о физико-химических свойствах комплексных соединений.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Выполнение лабораторной работы.
Вопросы, предлагаемые для обсуждения на занятии:
1. Координационная теория Вернера: центральный атом, лиганды, координационное число центрального атома. Характер связей в комплексах с точки зрения метода валентных связей. Комплексообразующая способность s-, d-, p- элементов.
2. Классификация комплексных соединений по заряду и природе лигандов. Катионные комплексные соединения (аквакомплексы, аммиакаты). Анионные комплексные соединения (ацидокомплексы, гидроксокомплексы).
3. Номенклатура комплексных соединений.
4. Ионные равновесия в растворах комплексных соединений. Константы нестойкости и устойчивости комплексных ионов.
5. Внутрикомплексные соединения (хелаты). Внутрикомплексные соединения в биологических объектах.
Лабораторная работа
Познакомьтесь с содержанием лабораторных опытов и оформите их по предлагаемой форме.
а) Электролитическая диссоциация и устойчивость комплексных соединений в растворах
Опыт 1. Гексацианоферрат (III) калия K3[Fe(CN)6] при диссоциации в растворах образует ионы К+ и [Fe(CN)6]3-. Для доказательства этого в две пробирки берут по 3 капли раствора K3[Fe(CN)6]. В первую пробирку добавляют 2 капли раствора едкого натра (реактив на ион Fe3+), а во вторую – 2 капли раствора гидротартрата натрия, NaHC4H4O6 (реактив на ион К+), и отмечают результат их действия. Для сравнения выполняют в третьей пробирке реакцию обнаружения ионов Fe3+ в растворе хлорида железа (III), FeCl3. Полученные результаты сопоставляют, записывают уравнение диссоциации комплексного соединения и делают вывод об устойчивости комплексного иона [Fe(CN)6]3-.
Опыт 2. Хлорид диаминсеребра (I) в растворах диссоциирует следующим образом:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Clˉ
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
Для изучения устойчивости комплексного иона в две пробирки берут по 3 капли раствора хлорид диаминсеребра (I) [Ag(NH3)2]Cl и в них добавляют реактивы на ион серебра: в первую – раствор иодида калия, а в другую – раствор гидроксида натрия. Записывают уравнение диссоциации, отмечают результат, объясняют его и делают вывод об устойчивости комплексного иона [Ag(NH3)2]+. Для объяснения используют данные о произведении растворимости: ПРAgI = 8,3·10-17, ПРAgOH = 1,6·10-8.
б) Катионные комплексные соединения. Получение аммиакатов кобальта и никеля
Опыт 3. В пробирку берут 3 капли раствора сульфата кобальта (II) CoSO4 добавляют по каплям концентрированный раствор аммиака NH3∙H2O (NH4OH) до образования осадка сульфата гидроксокобальта (CoОH)2SO4 и затем наблюдают растворение полученного осадка придальнейшем добавлении NH4OH – образуется сульфат гексаамминкобальта (II):
CoSO4 + 6NH4OH = [Со(NH3)6]SO4 + 6H2O
избыток
Записывают уравнение реакции, название и цвет комплексного соединения.
Опыт 4. Аналогичную реакцию проводят с солью никеля (II) и разбавленным раствором NH4OH. При этом образуется сульфат гексаамминникеля (II):
NiSO4 + 6NH4OH = [Ni(NH3)6]SO4 + 6H2O
избыток
в) Анионные комплексные соединения. Получение и исследование ацидокомплексов магния, серебра, висмута
Опыт 5. В пробирку вносят 2 капли раствора хлорида магния MgCl2, и добавляют по каплям концентрированный раствор карбоната аммония (NH4)2CO3. Отмечают, что образовавшийся при этом осадок карбоната гидроксомагния (MgОH)2CO3 растворяется в избытке реактива. В результате реакции образуется комплексное соединение – дикарбонатомагнезиат (II) аммония:
MgCl2 + 2(NH4)2CO3 = (NH4)2[Mg(CO3)2] + 2NH4Cl
избыток
Опыт 6. В две пробирки вносят по 1 капле раствора нитрата серебра AgNO3, и одну из них оставляют в качестве контрольной. В другую добавляют по каплям насыщенный раствор хлорида натрия и образовавшийся осадок хлорида серебра AgCl растворяют при энергичном встряхивании в избытке реактива. В результате реакции образуется дихлороаргентат (I) натрия:
AgNO3 + 2NaCl = Na[AgCl2] + NaNO3
избыток
В обе пробирки добавляют реактив на ион серебра — по 1 капле раствора гидроксида натрия, отмечают результат и делают вывод о наличии ионов Ag+ в каждом из растворов.
2Ag+ + OHˉ = Ag2O↓ + H+
бурый
Опыт 7. К 2 каплям нитрата висмута (III) Bi(NO3)3, прибавляют по каплям раствор иодида калия КI до образования осадка BiI3. Затем добавляют избыток реактива и наблюдают растворение осадка, при этом образуется тетраиодовисмутат (III) калия:
Bi(NO3)3 + 4KI = K[BiI4] + 3KNO3
избыток
Напишите уравнение реакции и укажите цвет образовавшегося раствора.
г) Анионные комплексные соединения. Получение гидроксомплексов меди и сурьмы
Опыт 8. К 2 каплям раствора сульфата меди (ΙΙ) CuSO4, добавляют 2 капли концентрированного раствора гидроксида натрия, наблюдают образование осадка гидроксида меди (ΙΙ) Cu(OH)2. Затем растворяют его, прибавляя избыток реактива, в результате реакции образуется тетрагидроксокупрат (II) натрия:
CuSO4 + 4NaOH = Na2[Cu(OH)4] + Na2SO4
избыток
Напишите уравнение реакции и отмечают цвет образовавшегося раствора.
Опыт 9. К 3 каплям раствора хлорида сурьмы (ΙΙΙ) SbCl3 прибавляют по каплям раствор гидроксида натрия, наблюдают образование осадка белого цвета. Продолжают добавлять реактив до полного растворения осадка, при этом образуется гексагидроксостибат (III) натрия:
SbCl3 + 6NaOH = Na3[Sb(OH)6] + 3NaCl
избыток
Напишите уравнение реакции и отмечают цвет образовавшегося раствора.
д) Окислительно-восстановительные свойства комплексных соединений
Опыт 10. К 4 каплям раствора перманганата калия KMnO4 добавляют 2 капли раствора серной кислоты H2SO4 и по каплям раствор гексацианоферрата(II) калия, K4[Fe(CN)6]. Отмечают изменение цвета раствора перманганата калия, указывают окислитель и восстановитель в данной реакции, записывают уравнение реакции:
5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = 5K3[Fe(CN)6] + MnSO4 +
+ 3K2SO4 + 4H2O.
е) Внутрикомлексные соединения. Получение и исследование внутрикомплексного соединения железа
Опыт 11. В 2 пробирки вносят по 5 капель хлорида железа (III) FeCl3 и одну из них оставляют в качестве контрольной. В другую добавляют 1 каплю раствора гидроксида натрия, затем к образовавшемуся осадку гидроксида железа (III), Fe(OH)3, 6–7 капель раствора щавелевой кислоты, H2C2O4, отмечая растворение осадка:
FeOH3 + 3H2C2O4 = H3[Fe(C2O4)3] + 3H2O.
Формула внутрикомплексного соединения имеет вид:
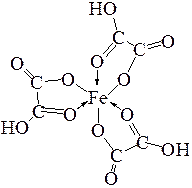
В обе пробирки добавляют реактив на ион Fe3+ — по 1 капле раствора роданида аммония, NH4SCN:
Fe3+ + 3SCNˉ = Fe(SCN)3
Отмечают окраску растворов, делают вывод о наличии ионов Fe3+ в каждом из них. Записывают уравнения реакций.
Работу оформляют в вид таблицы:
| Номер и название опыта | Уравнения реакций (с указанием внешних признаков) | Результаты наблюдений. Вывод (диссоциация, устойчивость, окислительно-восст. свойства и т.д.) |
| Электролитическая диссоциация и устойчивость комплексных соединений в растворах. Опыт 1 | K3[Fe(CN)6] ® …… | 1. Реакция на ион Fe3+ …… 2. Реакция на ион К+ ……… 3. Гексацианоферрат (III) калия, K3[Fe(CN)6], диссоциирует на ионы………… 4. Ион [Fe(CN)6]3- достаточно…… (устойчив, неустойчив) |
| …. |
Примечание. Таблицу расчерчивают на развёрнутом листе тетради. Вторую графу следует чертить не менее 15 см. Между записями опытов делают интервал в 2–3 клеточки.
Контрольные вопросы и задачи
1. Составьте формулу комплексного соединения, в котором комплексообразователь — ион золота (степень окисления +3, координационное число 4), лиганды — хлорид-ионы, внешняя сфера — ионы натрия. Назовите это соединение.
2. Определите степень окисления атома – комплексообразователя в следующих комплексных ионах: [Fe(PO4)2]3-, [FeF6]4-, [CoCl6]3-,[Zn(CN)6]4-
3. Каков заряд (х) комплексных ионов: [Co+2Cl4]x, [Co+3(NO3)6]x, [Ni+2(SO4)2]x, [Cd+2(NH3)6]x?
4. Какова природа связи в координационном соединении: а) между внутренней и внешней координационными сферами; б) между атомом–комплексообразователем и лигандами?
5. Напишите уравнения реакций первичной и вторичной диссоциации и выражение констант нестойкости для следующих комплексных соединений: K2[Cd(SCN)4]; [Pt(NH3)4Cl2]Cl2; K3[Cr(OH)6].
6. Напишите формулы соединений переходного ряда от [Со(NH3)6]Cl3 к K3[Co(NO2)6], последовательно замещая внутреннюю сферу комплекса нитрит-ионами. Назовите эти соединения.
7. Из сочетания частиц Cr3+, Clˉ, H2O и К+ можно составить 7 формул комплексных соединений. Составьте формулы этих соединений, если координационное число комплексообразователя – 6; назовите их; укажите, какие из этих соединений являются электролитами, а какие неэлектролитами.
8. Имеются два водных раствора: в одном растворена соль K3[Fe(CN)6], а в другом – NH4Fe(SO4)2; к каждому из них прилили раствор едкого кали. В одном из этих случаев произошла реакция и один из продуктов реакции выпал в осадок. Напишите молекулярное и ионные (полное и сокращённое) уравнения этой реакции. Укажите цвет образовавшегося осадка.
9. Закончите уравнения реакций взаимного превращения ионов:
[Fe(CN)6]4- ↔ [Fe(CN)6]3- + ē
в зависимости от природы партнёра:
а) K4[Fe(CN)6] + K2Cr2O7 + H2SO4 = …
б) K3[Fe(CN)6] + SnCl2 + HCl = …
Примечание. Для олова характерны степени окисления (+2) и (+4), для хрома — (+3) и (+6).
Занятие 4. Физико-химические свойства
s-элементов и их соединений
Цель занятия:
Сформировать системные знания о физико-химических свойствах s-элементов, их важнейших соединений и применении их в медицине, развить логичность и глубину мышления, умение работать с литературой, химической посудой и реактивами.
Содержание занятия:
1. Контрольная работа по теме «Строение атома и комплексные соединения».
2. Обсуждение вопросов по теме занятия.
3. Лабораторная работа по теме «Физико-химические свойства соединений s-элементов».
Вопросы для подготовки к контрольной работе
1. Квантово-механическая модель атома. Электронное облако. Атомная орбиталь.
2. Характеристика энергетического состояния электрона в атоме системой квантовых чисел: главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа; их физический смысл и взаимосвязь.
3. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на орбиталях, подуровнях и уровнях.
4. Принцип минимума энергии. Последовательность заполнения электронами атомных орбиталей. Электронные формулы элементов; s-, p-, d-, f-элементы.
5. Заполнение электронами атомных орбиталей одного подуровня, правило Хунда. Электронно-графические формулы (спиновые схемы) элементов.
6. Связь между электронным строением атомов и положением элементов в периодической системе: s-, p-, d-, f- семейства элементов.
7. Основное и возбужденное состояние атома.
8. Метод валентных связей. Основные положения метода. Механизм и способы образования ковалентной химической связи. Валентность. Максимальная валентность. Длина связи. Энергия связи.
9. Направленность химической связи. Влияние направленности связи на пространственную конфигурацию молекул типа АА, АВ, А2В, А3В. Насыщаемость, кратность связи.
10. Полярность и поляризуемость химической связи. Дипольный момент связи (постоянный и индуцированный). Полярная и неполярная ковалентная связь. Ионная связь как предельно поляризованная ковалентная связь. Степень окисления атомов.
11. Координационная теория Вернера: центральный атом, лиганды, координационное число центрального атома. Характер связей в комплексах с точки зрения метода валентных связей.
12. Классификация комплексных соединений по заряду и природе лигандов. Катионные комплексные соединения (аквакомплексы, аммиакаты). Анионные комплексные соединения (ацидокомплексы, гидроксокомплексы).
13. Номенклатура комплексных соединений.
14. Ионные равновесия в растворах комплексных соединений. Константы нестойкости и устойчивости комплексных ионов.
15. Внутрикомплексные соединения (хелаты). Внутрикомплексные соединения в биологических объектах.
Вопросы, предлагаемые для обсуждения на занятии:
1. Общая характеристика s-элементов (особенности строения атомов, закономерности изменения радиуса атома, энергии ионизации);
2. Общие закономерности изменение характера оксидов и гидроксидов s-элементов I и II групп (кислотно-основных свойств).
3. Биологическая роль s-элементов (Na, K, Ca, Mg) и применение их соединений в медицине.
Лабораторная работа. Физико-химические свойства s-элементов и их соединений.
Познакомьтесь с содержанием лабораторных опытов и подготовьте их к оформлению – начертите таблицу (см. ниже), напишите названия опытов и уравнения реакций, происходящих в опытах.
| Номер и название опыта | Уравнения реакции (с указанием внешних признаков) | Результаты наблюдений, вывод (условия проведения реакций, характер гидроксидов, растворимость соединений, окислитель, восстановитель) |
| Опыт I. Осаждение ионов натрия из растворов. Обнаружение катионов натрия гексагидроксо(V)стибиатом калия | NaCI + K[Sb(OH6] = Na[Sb(OH6]↓ + KCl белый кристаллический | 1.В центральной или слабощелочной среде. 2. При потирании стеклянной палочкой 3. Отсутствии солей s-элементов П А гр. |
Примечание: Таблицу чертят на развернутом листе тетради. Вторую графу следует чертить не менее 15 см. между записями опытов делать интервал в 2–3 клеточки.
а) Натрий и его соединения
Опыт № 1. Осаждение катионов натрия из растворов. Обнаружение катионов натрия гексагидроксо(V)стибиатом калия K[Sb(OH6].
Гексагидроксо(V)стибиат калия в нейтральном или слабощелочном растворе при комнатной температуре образует с солями натрия белый кристаллический осадок гексагидроксо(V)стибиат натрия:
NaCl + K[Sb(OH6] = Na[Sb(OH6]↓ + KCl
белый кристаллический осадок
Аналогичный осадок с этим реактивом образуют соли магния, кальция, стронция, бария, поэтому проведением реакции открытия катиона натрия в растворе следует убедиться в отсутствии этих ионов в растворе.
В пробирку берут 2 капли раствора хлорида натрия, добавляют 2 капли раствора реактива K[Sb(OH6] и потирают о внутреннюю стенку пробирки стеклянной палочкой для ускорения образования осадка. Отмечают характер (аморфный, кристаллический) и цвет осадка. Записывают уравнение реакции и делают вывод об условиях ее проведения.
б) Калий и его соединения
Опыт № 2. Осаждение катионов калия из растворов. Обнаружение катиона калия гидротартратом натрия NaHC4H4O6.
Гитротартрат натрия (кислая соль винной кислоты) в нейтральной среде при комнатной температуре образует с солями калия кристаллический осадок гидротартрата калия:
KCl + NaHC4H4O6 = KHC4H4O6↓ + NaCl
белый кристаллический осадок
Аналогичный осадок с данным реактивом образуют соли кальция, поэтому перед проведением реакции открытия катиона калия следует убедиться в отсутствии этих ионов в растворе.
В две пробирки берут по 2 капли раствора хлорида калия, в каждую из них добавляют по 2 капли раствора реактива NaHC4H4O6 и потирают стенки пробирки стеклянной палочкой до образования осадка. Отмечают свет и характер осадка. В первую пробирку добавляют 3–4 капли соляной кислоты, а во вторую — 3–4 капли раствора щелочи (KOH или NaOH) и пробирки встряхивают до растворения осадка. Записывают уравнения реакций образования и растворения осадка в кислоте и щелочи. Делают вывод об условиях проведения реакций.
в) Получение и кислотно-основные свойства гидроксидов бериллия, магния, кальция.
Опыт № 3. В две пробирки берут по 3 капли раствора сульфата бериллия и в каждую пробирку добавляют по каплям раствор щелочи (каждый раз встряхивая пробирку) до образования осадка гидроксида бериллия. В первую пробирку добавляют избыток щелочи, а во вторую — 4–5 капель соляной кислоты. Пробирки встряхивают и отмечают растворение осадков.
Аналогично проводят опыты с солями магния и кальция (опыты 4 и 5).
При оформлении каждого опыта приведите уравнение реакций образования гидроксида и растворение его в кислоте и щёлочи. Укажите цвет осадка. Сделайте вывод о характере гидроксида (кислотный, амфотерный, основной).
Опыт № 6. Магний и его соединения. Реакция с карбонатом аммония (NH4)2CO3
В две пробирки берут по 2 капли раствора хлорида магния, в каждую из них добавляют по 2 капли раствора карбоната аммония и наблюдают выпадение белого аморфного осадка карбоната гидроксомагния:
2MgCl2 + 2(NH4)2CO3 + H2O = (MgOH)2CO3 ↓ + 4NH4Cl + CO2 ↑
белый аморфный осадок
В первую пробирку добавляют 3–4 капли раствора хлорида аммония, во вторую — 3–4 капли уксусной кислоты и пробирки встряхивают до растворения осадков. Записывают уравнение реакций и делают вывод об условиях ее проведения.
Опыт № 7. Магний и его соединения. Реакция с гидрофосфатом натрия Na2HPO4
В две пробирки берут по 2 капли раствора хлорида магния, в каждую из них добавляют по 2 капли раствора гидрофосфата натрия и наблюдают выпадение белого аморфного осадка гидрофосфата магния:
MgCl2 + Na2HPO4 = MgHPO4↓ + 2 NaCl
белый аморфный осадок
В первую пробирку добавляют 3–4 капли соляной кислоты, а во вторую — 3–4 капли уксусной кислоты и обе пробирки встряхивают до растворения осадков. Записывают уравнение реакций образования и растворения осадка. Делают вывод об условиях ее выполнение и применении.
Данная реакция используется для обнаружения ионов магния в растворах.
Опыт № 8. Кальций и его соединения. Реакция с хроматом калия K2CrO4
В пробирку берут 3 капли раствора хлорида кальция, добавляют 3 капли насыщенного раствора хромата калия и стенки пробирки потирают стеклянной палочкой. Отмечают результат опыта (осадок выпал, не выпал) и делают вывод о растворимости хромата кальция.
Опыт № 9. Стронций и его соединения. Реакция с хроматом калия K2CrO4
Реакция используется для обнаружения ионов стронция в растворах. В две пробирки берут по 2 капли раствора нитрата стронция, в каждую из них добавляют по 2 капли раствора хромата калия и стенки пробирки потирают стеклянной палочкой до образования желтого кристаллического осадка хромата стронция:
Sr(NO3)2 + K2CrO4 = SrCrO4 ↓ + 2KNO3
жёлтый кристаллический
В первую пробирку добавляют 4–5 капель соляной (азотной) кислоты, а во вторую — 4–5 капель уксусной. Пробирки встряхивают и наблюдают действие кислот на осадок в той и другой пробирке.
Записывают уравнения реакций образования и растворения осадка. Делают вывод об условиях выполнения реакций и ее использовании.
Опыт № 10. Барий и его соединения. Реакция с сульфатом натрия Na2SO4
В пробирку берут 2 капли раствора хлорида бария, добавляют 2 капли раствора сульфата натрия и наблюдают выпадение белого мелкокристаллического осадка сульфата бария:
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
белый кристаллический осадок
К осадку добавляют 4–5 капель соляной (азотной) кислоты и наблюдают действие кислоты на осадок. Записывают уравнение реакции образования осадка и делают вывод о растворимости сульфата бария в воде и сильных кислотах.
Опыт № 11. Барий и его соединения. Реакция с хроматом калия K2CrO4
В две пробирки берут по 2 капли раствора хлорида бария, в каждую из них добавляют по 2 капли раствора хромата калия и наблюдают выпадение жёлтого мелкокристаллического осадка хромата бария.
В первую пробирку добавляют 3–4 капли соляной (азотной) кислоты, во вторую — 3–4 капли уксусной. Пробирки встряхивают и отмечают, в какой из пробирок произошло растворение осадка.
Записывают уравнения реакций образования и растворения осадка, делают вывод об условиях ее выполнения и применении. Сравнивают свойства хромата бария со свойствами хромата стронция.
Реакция используется для обнаружения ионов бария в растворах.
Опыт № 12. Барий и его соединения. Реакция с карбонатом аммония (NH4)2CO3
В две пробирки берут по 2 капли раствора хлорида бария, в каждую из них добавляют по 2 капли раствора карбоната аммония и наблюдают выпадение белого аморфного осадка карбоната бария.
В первую пробирку добавляют 3–4 капли уксусной кислоты, а во вторую — 3–4 капли раствора хлорида аммония. Пробирки встряхивают и наблюдают, в какой из пробирок произошло растворение осадка.
Записывают уравнение реакций образования и растворения осадка, делают вывод об условиях выполнения реакции и сравнивают свойства карбоната бария со свойствами карбоната гидроксомагния.
Контрольные вопросы и задачи
1. У какого из гидроксидов — KOH или NaOH, KOH или Ca(OH)2 — оснόвные свойства выражены сильнее? Почему?
2. Почему калий взаимодействует с водой более энергично, чем литий или натрий?
3. Напишите уравнения реакций взаимодействия (сгорания) Li, Na, K с кислородом. Назовите продукты реакций.
4. Напишите уравнение реакции взаимодействия пероксида натрия с оксидом углерода (IV). Составьте электронный баланс и укажите, для каких практических целей используется данная реакция.
5. Напишите уравнение реакции взаимодействия гидрида калия с водой. Составьте электронный баланс и укажите окислитель и восстановитель.
6. Какой тип гибридизации проявляет атом бериллия в соединениях:
а) BeCl2;
б) K2[BeF4]?
7. Составьте уравнения реакций следующих превращений:
Са → CaH2 → Ca(OH)2 → Ca(HCO3)2 → CaO → Ca(OH)2 → CaCO3
8. Рассчитайте массовую долю щелочи в растворе, полученном при взаимодействии натрия массой 20 г и воды объемом 100 мл.
9. Кальций какой массы необходимо растворить в 150 мл воды, чтобы получить раствор с массовой долей 10%?
10. В растворе находятся следующие ионы: Na+, Be2+, Ca2+. Какой реактив из перечисленных можно использовать для их обнаружения: а) NaOH, б) HCl, в) K[Sb(OH)6],
г) K4[Fe(CN)6]?
Занятие 5. Физико-химические свойства
p-элементов и их соединений
Цель занятия:
Получить представление о строении и свойствах р-элементов, а также их соединений. Познакомиться с биологической ролью р-элементов и применении неорганических соединений р-элементов в медицине.
Содержание занятия:
1. Обсуждение вопросов по теме занятия.
2. Лабораторная работа по теме: «Физико-химические свойства соединений p-элементов».
3. Представление отчета о выполненной работе.
Вопросы, предлагаемые для обсуждения на занятии:
1. Положение р-элементов в периодической системе, особенности строения их атомов.
2. Закономерности изменения окислительно-восстановитель-ных свойств р-элементов в зависимости от степени окисления.
3. Изменение кислотно-основных свойств оксидов и гидроксидов р-элементов по группам.
4. Биологическая роль р-элементов (О, N, Р, галогенов) и применение их соединений в медицине.
Лабораторная работа. Физико-химические свойства p-элементов и их соединений.
Опыт № 1. Получение и изучение кислотно-основных свойств гидроксида алюминия. Осаждение ионов Al3+ из раствора тетрагидроксо(III)алюмината.
В 2 пробирки вносят по 4 капли раствора сульфата алюминия и прибавляют по каплям раствор гидроксида натрия (все время осторожно встряхивая пробирку) до образования осадка Al(OH)3 белого цвета. В одну пробирку добавляют избыток щелочи, в другую – несколько капель соляной (серной) кислоты, отмечают результат. Делают вывод о химическом характере гидроксида алюминия. Записывают уравнения реакций получения гидроксида алюминия и растворения его в щелочи и кислоте.
Al(OH)3 ↓ + NaOH = Na[Al(OH)4]
К полученному раствору тетрагидроксо(III)алюмината натрия добавляют несколько капель насыщенного раствора хлорида аммония и наблюдают выпадение осадка гидроксида алюминия (если осадок сразу не выпадает – раствор кипятят).
Na[Al(OH)4] + NH4Cl = Al(OH)3 ↓ + NaCl + NH3 ↑ + H2O
Углерод, кремний, олово, свинец расположены в главной подгруппе IV группы периодической системы (IVА группа). Углерод и кремний являются биогенными элементами. Для всех этих элементов характерны положительные степени окисления II и IV. Для углерода и кремний характерна и отрицательная степень окисления IV. Соединения углерода и кремния, в которых степень окисления II, немногочисленны и сравнительно малостойки. Оксиды олова (II), свинца (II) и соответствующие им гидроксиды проявляют амфотерные свойства. Оксиды и гидроксиды углерода (IV) и кремния (IV) проявляют кислотные свойства (угольная кислота H2CO3 и кремниевая кислота H2SiO3 — слабые кислоты), оксиды и гидроксиды олова (IV) и свинца (IV) амфотерны (с преобладанием кислотных свойств). Для соединений углерода, олова, свинца в степени окисления +2 характерны восстановительные свойства, в степени окисления +4 — окислительные.
Опыт № 2. Образование малорастворимых карбонатов – реакция с хлоридом бария.
В 2 пробирки берут по 2 капли раствора карбоната натрия и добавляют по 2 капли раствора хлорида бария. Отмечают образование осадка BaCO3 белого цвета. Испытывают растворимость осадка в уксусной и соляной (азотной) кислотах. Записывают уравнения реакций образования осадка и растворения его в кислотах.
Опыт № 3. Получение и изучение свойств гидроксида
свинца (II).
В две пробирки вносят по 2 капли раствора ацетата свинца (II) и прибавляют по каплям раствор гидроксида натрия до образования осадка гидроксида свинца (II) Pb(OH)2 белого цвета. В одну пробирку добавляют избыток щелочи, в другую – несколько капель азотной кислоты. Отмечают результат и делают вывод о химическом характере гидроксида свинца. Записывают уравнения реакций получения гидроксида и его растворения в кислоте и щелочи (образуется гексагидроксо(II)плюмбат натрия).
Pb(OH)2↓ + 4NaOH = Na4[Pb(OH)6]
Опыт № 4. Обнаружение ионов Pb2+ осаждением серной кислотой.
К 2 каплям раствора ацетата свинца (II) Pb(CH3COO)2 добавляет две капли раствора серной кислоты. К полученному осадку добавляют 8 капель раствора едкого натра, смесь нагревают и наблюдают растворение осадка.
Pb(CH3COO)2 + H2SO4 = PbSO4↓ + 2CH3COOH
PbSO4↓ + 6NaOH = Na4[Pb(OH)6] + Na2SO4
Опыт № 5. Окислительные свойства соединений свинца (IV).
В пробирку вносят по 3 капли растворов иодида калия и серной кислоты и небольшое количество оксида свинца (IV) PbO2. Пробирку нагревают на песчаной бане и отмечают появление желтой окраски раствора (после отстаивания осадка). В электронном уравнении указывают окислитель и восстановитель
PbO2 + 2KI + 2H2SO4 = PbSO4 ↓ + I2 + K2SO4 + 2H2O
| Pb4+ + 2ē → Pb2+ | ||
| Iˉ – ē → I° |
Опыт № 6. Окислительные свойства нитритов (NO2ˉ). Обнаружение NO2ˉ-ионов.
В пробирку вносят по 2 капли растворов иодида калия и уксусной кислоты, затем прибавляют 1 каплю раствора нитрита калия KNO2 и отмечают появление красно-бурой (желтой) окраски раствора.
2KNO2 + 2KI + 4CH3COOH = 2NO↑ + 4CH3COOK + I2 + 2H2O
| N+3 + ē → N+2 | ||
| Iˉ – ē → I° |
Опыт № 7. Восстановительные свойства нитритов.
К двум каплям раствора перманганата калия прибавляют одну каплю раствора серной кислоты и 2 капли раствора нитрита калия. Отмечают обесцвечивание раствора перманганата.
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + 2MnSO4 + K2SO4 +
+3H2O
| N+3 – 2ē → N+5 | ||
| Mn+7 + 5ē → Mn2+ |
Опыт № 8. Окислительные свойства нитратов. Обнаружение иона NO3ˉ.
К 4 каплям сульфата железа (II) прибавляют 2 капли раствора нитрата калия и перемешивают. Затем, наклонив пробирку, по стенке осторожно прибавляют 4 капли концентрированной серной кислоты так, чтобы жидкости не смешивались. На границе двух слоев жидкости появляется темно-бурое кольцо комплексной соли [Fe(NO)]SO4.
2KNO3 + 6FeSO4 + 4H2SO4 = 3Fe2(SO4)3 + K2SO4 + 2NO + 4H2O
| N+5 + 3ē → N+2 | |||
| Fe2+ – ē → Fe3+ |
Опыт № 9. Реакция с растворимыми солями кадмия. Обнаружение сульфид-ионов в растворе.
К 2 каплям раствора сульфида натрия прибавляют 2 капли раствора сульфита кадмия (II) CdSO4 и отмечают образование желтого осадка сульфида кадмия CdS. Записывают уравнение реакции получения осадка.
Опыт № 10. Осаждение ионов SO32- в растворах.
К 2 каплям раствора сульфита натрия прибавляют 2 капли раствора хлорида бария. Отмечают образование белого осадка сульфита бария BaSO3. Испытывают растворимость осадка в соляной (азотной) кислоте. Записывают уравнения реакций получения осадка и растворения его в кислоте.
Опыт № 11. Осаждение сульфат-ионов из растворов. Обнаружение ионов SO42- реакцией с хлоридом бария.
К 2 каплям раствора натрия N2SO4 прибавляют 1 каплю раствора хлорида бария, отмечают образовании белого осадка сульфата бария BaSO4 и испытывают растворимость осадка в соляной (азотной) кислоте. Записывают уравнение реакции получения осадка.
Опыт № 12. Осаждение бромид-ионов из растворов — реакция с нитратом серебра.
К 3 каплям раствора бромида калия KBr прибавляют 2 капли раствора нитрата серебра. Отмечают образование желтоватого творожистого осадка бромида серебра AgBr и проверяют действие на осадок азотной кислоты. Записывают уравнение реакции образования осадка.
Опыт № 13. Восстановительные свойства бромид-ионов. Реакция с хлорной водой. Обнаружение Brˉ-ионов в растворе.
К 3 каплям раствора бромида калия прибавляют 2 капли раствора серной кислоты, 6–8 капель хлороформа (бензола),
3 капли хлорной воды и содержимое пробирки энергично встряхивают. Отмечают появление свободного брома в растворе по желтому (красно-бурому) цвету слоя хлороформа.
2KBr + Cl2 = 2KCl + Br2
| Brˉ – ē → Br° | ||
| CI2° + 2ē → 2Clˉ |
Опыт № 14. Осаждение иодид-ионов из растворов – реакция с нитратом серебра.
К 2 каплям раствора иодида калия прибавляют 2 капли раствора нитрата серебра. Отмечают образование светло-желтого осадка иодида серебра AgI. Проверяют действие на осадок азотной кислоты. Записывают уравнение реакции получение осадка.
Опыт № 15. Восстановительные свойства иодид-ионов. Реакция с хлорной водой. Обнаружение Iˉ-ионов в растворе.
К 2 каплям раствора йодида калия прибавляют 2 капли раствора серной кислоты, 6–8 капель хлороформа (бензола), затем 3 капли хлорной воды и содержимое пробирки энергично встряхивают. Отмечают появление свободного йода в растворе по фиолетово-малиновой окраске слоя хлороформа. Сравнивают результаты опытов 13 и 15.
Избыток хлорной воды обесцвечивает фиолетовую окраску хлороформа вследствие окисления свободного йода до йодноватой кислоты HIO3.
2KI + Cl2 = 2KCl + I2
| Iˉ – ē → I° | ||
| Cl2 + 2ē → 2Clˉ |
Контрольные вопросы и задачи
1. Допишите следующие окислительно-восстановительные реакции:
а) Al + CuSO4 → …;
б) Fe3O4 + C → …;
в) Al + NaOH + H2O → ...
Составьте электронный баланс, укажите окислитель и восстановитель.
2. Водородные соединения натрия, магния, алюминия не являются газообразными, а кремния, углерода, фосфора, серы — газы. Объясните причину этого.
3. Напишите электронные формулы и спиновые схемы атомов следующих элементов: а) № 33, б) № 51. Укажите положение их в периодической системе Д.И. Менделеева (период, группу, подгруппу, семейство).
4. Закончите уравнения окислительно-восстановительных реакций и укажите, чем являются мышьяк и сурьма – окислителем или восстановителем.
а) As + NaClO + H2O → H3AsO3 + NaCl;
б) Sb2S3 + HNO3 + H2O → H3SbO4 + H2SO4 + NO.
5. Требуется растворить кусок серебра в азотной кислоте. Какую кислоту выгоднее взять — концентрированную или разбавленную? В каком случае расход HNO3 будет меньше?
6. Какие из перечисленных осушителей можно использовать для удаления влаги из SO2: а) H2SO4 (конц.), б) КОН (конц.), в) Р2О5, г) К2СО3.
7. Могут ли галогеноводороды в каких-либо реакциях играть роль окислителя? Дайте мотивированный ответ.
8. С какими из перечисленных веществ взаимодействует HBr:
а) Са(ОН)2, б) H2SO4 (конц.), в) HI, г) Mg, д) KClO3. При этом HBr проявляет свойства: а) кислоты, б) основания,
в) окислителя, г) восстановителя.
9. Газ, образовавшийся при полном сгорании 10,08 л (н.у.) сероводорода в кислороде, поглощен раствором гидроксида натрия массой 400 г с массовой долей 20%. Какова масса образовавшейся соли?
10. В растворе находятся ионы NO3ˉ, SO42-. С помощью какого реактива можно определить каждый из этих ионов:
а) NaOH, б) AgNO3, в) HCl, г) BaCl2?
Занятие 6. Физико-химические свойства
d-элементов и их соединений
Цель занятия:
Сформировать системные знания о физико-химических свойствах d-элементов и их важнейших соединений; развить логичность и глубину мышления, умение работать с литературой, химической посудой и реактивами.
На занятии прививаются также такие личностные качества, как аккуратность, внимательность, творческий подход к работе.
Содержание занятия:
1. Обсуждение вопросов по теме занятия.
2. Лабораторная работа по теме: «Физико-химические свойства соединений d-элементов».
3. Представление отчета о выполненной работе.
Вопросы, предлагаемые для обсуждения на занятии:
1. Положение d-элементов в периодической системе, особенности строения их атомов, степени окисления;
2. Изменение кислотно-основных свойств оксидов и гидроксидов d-элементов в зависимости от степени окисления;
3. Биологическая роль Fe, Cu, Co, Ni, Mn и применение их соединений в медицине.
Лабораторная работа. Физико-химические свойства d-эле-ментов и их соединений.
а) Хром и молибден.
Опыт № 1. Получение и изучение кислотно-основных свойств гидроксида хрома (III).
В 2 пробирки вносят по 5 капель раствора нитрата хрома (III) Cr(NO3)3 и прибавляют по каплям раствор гидроксида натрия до образования осадка серо-зеленого цвета Cr(OH)3. в одну пробирку добавляют избыток щелочи, в другую – несколько капель соляной (или серной) кислоты. Записывают уравнения реакций образования и растворения гидроксида хрома (III) в кислоте и щелочи. Делают вывод о химическом (кислотно-щелочном) характере гидроксида хрома (III).
Cr(OH)3↓ + 3NaOH = Na3[Cr(OH)6]
Опыт № 2. Восстановительные свойства соединений хрома (III). Обнаружение ионов Cr3+ в растворе.
В пробирку берут 2 капли раствора нитрата хрома (III), вносят избыток раствора едкого натра до растворения образующегося осадка Cr(OH)3. Затем прибавляют 4 капли раствора пероксида водорода и смесь в пробирке нагревают до перехода зелёной окраски в жёлтую, что указывает на образование в растворе хромат-иона CrO42-.
2Na3[Cr(OH)6] + 3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O
| Cr+3 – 3ē ® Cr+6 | ||
| O2-2 + 2ē ® 2О-2 |
Записывают уравнение реакции, указывают цвет раствора и делают вывод об окислительно-восстановительных свойствах соединений хрома (III).
Для окисления хрома (III) можно также использовать другие окислители, например, Br2.
Опыт № 3. Окислительные свойства соединений хрома (VI).
В пробирку вносят 4 капли раствора дихромата калия K2Cr2O7, 2 капли серной кислоты и 3 капли раствора нитрита калия KNO2. Смесь в пробирке нагревают и отмечают изменение окраски раствора — переход оранжевого цвета в зелёный.
K2Cr2O7 + 3KNO2 + 4H2SO4 = Cr2(SO4)3 + 3KNO3 + K2SO4 +
+4H2O
| Cr+6 + 3ē ® Cr3+ | ||
| N+3 – 2ē ® N+5 |
Записывают уравнение реакции, указывают цвет раствора и делают вывод об окислительно-восстановительных свойствах соединений хрома (IV).
Окислительные свойства дихромат проявляет в реакциях с многими другими веществами, например, H2S, H2SO3, KI, FeSO4 и др.
Опыт № 4. Осаждение ионов CrO42- из раствора. Качественная реакция на ион CrO42-.
К 2 каплям раствора хромата калия K2CrO4 добавляют 2 капли раствора хлорида бария, отмечают результат и составляют уравнения реакции.
б) Марганец и его соединения.
Опыт № 5. Получение и изучение кислотно-основных свойств гидроксида марганца (II).
В 2 пробирки берут по 3 капли раствора сульфата марганца (II) MnSO4, в каждую прибавляют по 2 капли раствора гидроксида натрия. В одну из пробирок к образовавшемуся осадку Mn(OH)2 добавляют щелочь в избытке, в другую — 6–7 капель соляной (или серной) кислоты, отмечают результат их действия, записывают уравнения реакций образования, растворения и окисления осадка и делают вывод о химическом (кислотно-основном) характере и устойчивости гидроксида марганца (II).
Следует обратить внимание на то, что гидроксид марганца (II) — осадок белого цвета — на воздухе быстро окисляется и изменяет окраску.
2Mn(OH)2↓ + O2 = 2H2MnO3↓
| Mn2+ - 2ē ® Mn+4 | ||
| O2° + 4ē ® 2О-2 |
Опыт № 6. Реакция обнаружения иона Mn2+.
В пробирку вносят на кончике шпателя небольшое количество диоксида свинца PbO2, добавляют 6–7 капель концентрированной азотной кислоты и затем одну каплю раствора сульфата марганца (II). Смесь в пробирке нагревают до кипения и кипятят в течении минуты, затем на станке добавляют
5–7 капель дистиллированной воды и после отстаивания взвеси отмечают малиновую окраску раствора.
2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 +
+2H2O
| Mn2+ – 5ē = Mn+7 | ||
| Pb+4 + 2ē = Pb+2 |
Записывают уравнение реакции, указывают условия ее проведения, цвет раствора.
Опыт № 7. Окислительные свойства соединений
марганца (VII).
В пробирку вносят 2 капли раствора перманганата калия и 4 капли серной кислоты, затем 4 капли этилового спирта и смесь в пробирке нагревают.
2KMnO4 + 5C2H5OH + 3H2SO4 = 2MnSO4 + 5CH3CHO + K2SO4 +
+8H2O
| Mn+7 + 5ē = Mn+2 | ||
| 2C-2 – 2ē = 2C-1 |
Записывают уравнение реакции, отмечают изменение цвета раствора и делают вывод об окислительно-восстано-вительных свойствах соединений Mn(VII).
в) Железои его соединения — получение и изучение кислотно-основных свойств гидроксидов железа, обнаружение ионов Fe3+ в растворе.
Опыт № 8.
В 2 пробирки берут по 2 капли раствора сульфата железа (II) FeSO4, в каждую прибавляют по 2 капли раствора едкого натра и наблюдают образование зелёного осадка Fe(OH)2. В одну из пробирок добавляют избыток щелочи, в другую — 6–7 капель соляной (или серной) кислоты, отмечают результат их действия, записывают уравнения реакций образования, растворения и окисления осадка и делают вывод о химическом (кислотно-основном) характере и устойчивости гидроксида железа (II). Следует обратить внимание на то, что гидроксид железа (II) на воздухе быстро окисляется, изменяя окраску.
4Fe(OH)2↓ + O2 + 2H2O = 4Fe(OH)3↓
| Fe+2 – 1ē = Fe+3 | ||
| O2° + 4ē = 2О-2 |
Опыт № 9.
В 2 пробирки вносят по 2 капли раствора хлорида железа (III), по 2 капли раствора щелочи и исследуют кислотно-основные свойства получившегося осадка гидроксида железа (III) так же, как в опыте № 8.
Опыт № 10. Обнаружение ионов Fe2+ в растворе.
В пробирку вносят по 2 капли раствора сульфата железа (II), 2 капли раствора — гексациано(III)феррата калия K3[Fe(CN)6]. Записывают уравнение реакции и отмечают цвет осадка (турнбулева синь). Данная реакция является характерной для иона Fe2+.
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓ + 3K2SO4
Опыты № 11,12. Обнаружение ионов Fe3+ в растворе.
Опыт № 11. К 2 каплям раствора хлорида железа (III) прибавляют 2 капли раствора гексациано(II)феррата калия K4[Fe(CN)6].
Записывают уравнение реакции и отмечают цвет получившегося осадка (берлинская лазурь).
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ + 12KCl
Опыт № 12. К 1 капле раствора хлорида железа (III) прибавляют 2 капли раствора роданида аммония NH4SCN.
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4Cl
Записывают уравнение реакции и отмечают окраску раствора.
г) Медь и серебро.
Опыт № 13. Получение и свойства гидроксида меди (II).
В 3 пробирки берут по 2 капли раствора сульфата меди (II), добавляют по 2 капли раствора гидроксида натрия, отмечают образование осадка гидроксида меди (II) Cu(OH)2 синего цвета.
В одну из пробирок добавляют раствор серной (или соляной) кислоты, в другую — избыток раствора гидроксида натрия, в третью — избыток концентрированного раствора едкого натра. Отмечают результат, записывают уравнения реакций и делают вывод о химическом (кислотно-основном) характере гидроксида меди (II).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
конц.
Опыт № 14. Комплексные соединения меди. Обнаружение ионов Cu2+ в растворе.
К 2 каплям раствора сульфата меди (II) по каплям добавляют раствор NH4OH до образования осадка сульфата гидроксомеди (II) (CuOH)2SO4 и затем отмечают растворение этого осадка при добавлении избытка реактива — образуется сульфат тетраммин меди (II) — раствор синего цвета.
CuSO4 + 4NH4OH (изб.) = [Cu(NH3)4]SO4 + 4H2O
Опыт № 15. Комплексные соединения серебра. Обнаружение ионов Ag+ в растворе.
К 2 каплям раствора нитрата серебра добавляют 1 каплю раствора соляной кислоты и наблюдают образование осадка хлорида серебра AgCl белого цвета. К осадку прибавляют по каплям раствор NH4OH до полного его растворения — образуется хлорид диамминсеребра(I), а затем разрушают это комплексное соединение добавлением избытка азотной кислоты и отмечают образование осадка.
AgNO3 + HCl = AgCl↓ + HNO3
AgCl↓ + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
д) Цинк и его соединения.
Опыт № 16. Получение и свойства гидроксида цинка.
В 2 пробирки берут по 3 капли раствора сульфата цинка и по каплям добавляют раствор гидроксида натрия до образования осадка гидроксида цинка Zn(OH)2 белого цвета. Затем в одну из пробирок добавляют избыток щелочи, наблюдая образование тетрагидроксо(II)цинката натрия, в другую — раствор соляной (или серной) кислоты. Отмечают результат, записывают уравнения реакций и делают вывод о химическом характере гидроксида натрия.
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Опыт № 17. Осаждение ионов Zn2+. Обнаружение Zn2+ в растворе.
Катион Zn2+ осаждается сероводородом из слабокислых растворов. Для создания необходимой кислотности среды при осаждении к раствору соли цинка добавляют ацетат натрия CH3COONa, который нейтрализует сильную кислоту, образующуюся при реакции.
В пробирку берут 3 капли раствора сульфата цинка, добавляют 2 капли раствора ацетата натрия и затем 3 капли сероводородной воды, отмечая образование осадка сульфида цинка ZnS белого цвета.
ZnSO4 + H2S = ZnS↓ + H2SO4
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH
Реакция выполняется в вытяжном шкафу! При работе с сероводородом следует соблюдать осторожность – ядовит!
Контрольные вопросы и задачи
1. Напишите электронные формулы атомов элементов хрома и кислорода и на их основании объясните, почему данные элементы расположены в разных подгруппах VI группы периодической системы.
2. Как изменяется кислотно-основной характер оксидов и соответствующих им гидроксидов марганца с изменением степени окисления его от 2 до 7?
3. Какое координационное число характерно для ртути (II)? Например, напишите пример комплексного соединения ртути (II) c лигандами I- и назовите это соединение.
4. Раствор хлорида ртути (II) в разведении 1:1000 используется в медицине как сильнодействующее дезинфицирующее средство. Почему раствор сулемы нельзя использовать для дезинфицирования металлических предметов?
5. В молекулярном уравнении окислительно-восстановитель-ной реакции
K2Cr2O7 + HCl (разб.) + FeCl2 → FeCl3 + CrCl3 + KCl + …
расставьте коэффициенты, используя метод электронного баланса. Укажите окислитель и восстановитель.
6. В ионном уравнении окислительно-восстановительной реакции
Cr(OH)3 + ОНˉ + ClOˉ → CrO42- + ОНˉ + …
расставьте коэффициенты, используя электронно-ионный метод. Укажите окислитель и восстановитель.
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
FeCl2 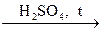 Х1
Х1 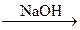 Х2
Х2 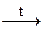 Х3 → Fe ®
Х3 → Fe ®
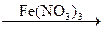 Х4
Х4
8. Рассчитайте массовую долю сульфата железа (III) в растворе, полученном при взвешивании раствора сульфата железа (II) массой 152 г с массовой долей FeSO4 0,1 и раствора перманганата калия массой 100 г с массовой долей 0,2 в сернокислой среде (объём раствора серной кислоты 50 мл), ρ = 1,25 г/мл.
9. Прокаленную смесь цинка массой 32,5 г и серы массой 4 г обработали избытком соляной кислоты. Определите объем выделившихся газов (н.у.).
10. В растворе находятся ионы: Fe2+, Zn2+, Cu2+. Какой реактив можно использовать для их обнаружения: а) K3[Fe(CN)6],
б) КОН, в) K4[Fe(CN)6], г) HBr?
Занятие 7. Первое НАЧАЛО (Первый закон) ТЕРМОДИНАМИКИ. ТЕРМОХИМИЯ
Цель занятия:
Приобрести системные знания об основных понятиях термодинамики, сущности первого начала термодинамики и закона Гесса; научиться производить термодинамические расчеты на основе закона Гесса и следствий из него
Содержание занятия:
1. Обсуждение вопросов по теме занятия и решение типовых задач.
2. Самостоятельное решение задач с последующим их разбором.
Вопросы, предлагаемые для обсуждения на занятии:
1. Понятие термодинамической системы. Системы изолированные, закрытые, открытые. Параметры системы.
2. Понятие термодинамического процесса; их классификация по различным признакам.
3. Термодинамические понятия теплоты, работы системы. Внутренняя энергия – функция состояния системы. Формулировка I начала термодинамики; I закон термодинамики для изохорного и изобарного процессов.
4. Термохимия. Тепловые эффекты химических реакций (энтальпия реакций). Термохимические уравнения.
5. Закон Гесса и следствия из него; применение их в термохимических расчетах.
Контрольные вопросы и задачи
1. Дайте определение, что такое термодинамическая система. Приведите примеры открытых, закрытых и изолированных систем в медицине и биологии.
2. Что такое экстенсивные и интенсивные параметры? Приведите примеры указанных параметров, которые характеризуют состояние живых систем.
3. Приведите классификацию термодинамических процессов. Охарактеризуйте каждый тип процесса.
4. Сформулируйте первое начало термодинамики. На конкретном примере покажите применимость первого начала термодинамики к биологическим системам.
5. Сформулируйте закон Гесса и следствия из него.
6. При биохимическом брожении глюкозы (С6Н12О6) образуется этиловый спирт и выделяется углекислый газ. Рассчитайте изменение энтальпии реакции, напишите термохимическое уравнение.
7. При взаимодействии газообразного метана и сероводорода образуется сероуглерод CS2(г) и водород. Определите изменение энтальпии реакции; напишите термохимическое уравнение. Каково будет изменение энтальпии реакции, если прореагирует 179.2 л метана? (условия нормальные).
8. Рассчитайте ΔН растворения безводного хлорида кальция, если ΔН гидратации CaCl2 до гексагидрата и ΔН растворения гексагидрата равны -94.4 кДж/моль и +19.1 кДж/моль, соответственно.
9. Тепловые эффекты растворения MgSO4 и MgSO4∙7Н2О в воде соответственно равны: -84.8 кДж/моль и 15.9 кДж/моль. Какова теплота гидратации при переходе MgSO4 в MgSO4∙7Н2О?
10. При взаимодействии трёх моль оксида азота (I) с аммиаком образуются пары воды и азота. Тепловой эффект реакции (∆Нр) равен -77.76 кДж. Напишите термохимическое уравнение реакции и вычислите изменение энтальпии образования N2O(г).
11. Рассчитайте энтальпию образования Н2О2(ж), исходя из теплового эффекта реакции:
Н2О2 (ж) = Н2О (ж) + ½ О2 (г) ∆Н = -98.03 кДж.
12. Энтальпия реакции нейтрализации азотной кислоты гидроксидом калия равна -57.3 кДж/моль. Вычислите энтальпию процесса, протекающего при добавлении к 100 мл раствора азотной кислоты с молярной концентрацией 1 моль/л 150 мл раствора гидроксида калия с молярной концентрацией
0.9 моль/л.
13. Вычислить энтальпию растворения лития в воде, используя данные по гидратированным ионам:
2Li(к) + 2 Н2О(ж) ® 2 Li+ + 2 ОНˉ + Н2(г)
∆Н (Li+вод.) = -278.5 кДж/моль
∆Н (OHˉвод.) = -228.9 кДж/моль
14. Реакция горения этилового спирта выражается термохимическим уравнением:
С2Н5ОН(ж) + 3 О2(г) = 2 СО2(г) + 3 Н2О(ж); ∆H = ?
Вычислите энтальпию реакции, если известно, что энтальпия парообразования С2Н5ОН(ж) = +38,58 кДж/моль и известны энтальпии образования С2Н5ОН(г), СО2(г), Н2О(ж).
15. Какое количество теплоты потребуется для разложения карбоната кальция массой 2 кг?
16. В некоторых микроорганизмах при анаэробной (в отсутствии воздуха) ферментации протекает следующая реакция:
С6Н12О6 ® 2 С3Н6О3
глюкоза молочная кислота
Вычислите тепловой эффект этой реакции, если известны тепловые эффекты следующих процессов:
С6Н12О6 (т) + 6 О2 (г) ® СО2 (г) + 6 Н2О(ж) ∆Н = -2808 кДж;
С3Н6О3 (ж) + 3 О2 (г) ® 3 СО2 (г) + 3 Н2О(ж) ∆Н = -1369 кДж.
17. Вычислите энтальпию образования метана, исходя из следующих термохимических уравнений:
Н2(г) + 1/2 О2(г) ® Н2О(ж) ∆Н1 = -285.84 кДж
С(к) + О2(г) ® СО2(г) ∆Н2 = -393.51 кДж
СН4 (г) + 2 О2 (г) ® 2 Н2О(ж) + СО2 (г) ∆Н3 = -890.31 кДж
Занятие 8. Второе НАЧАЛО (второй закон) ТЕРМОДИНАМИКИ. ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Цель занятия:
Приобрести навыки термодинамических расчетов. На конкретных примерах решать вопрос о возможности самопроизвольного протекания реакции в заданных условиях (из анализа величин ∆G, ∆H, ∆S и их зависимость от температуры), а также определения условий, при которых наступает термодинамическое равновесие в системе.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
Вопросы, предлагаемые для обсуждения на занятии:
1. Второй закон термодинамики. Его формулировки и математические выражения. Энтропия. Зависимость её от фазового состояния вещества.
2. Термодинамические потенциалы. Изобарно-изотермичес-кий потенциал — мера способности системы к самопроизвольному процессу.
3. Приложение закона Гесса к определению энтропии и энергии Гиббса.
4. Функции состояния системы. Стандартное состояние системы.
5. Критерии равновесия химической реакции. Связь между термодинамическими параметрами и константой равновесия химической реакции.
Контрольные вопросы и задачи
1. Прямая или обратная реакция будет преобладать в системе.
СН4 (г) + СО2 (г)= 2СО(г) + 2Н2 (г) ?
2. На основании энтальпий образования и абсолютных стандартных энтропий веществ вычислите ∆G°298 реакции
СО (г) + Н2О(ж) = СО2 (г) + Н2 (г).
3. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3 (кр) + 3H2(г) = 2Fe(кр) + 3H2O(г) ∆Н = + 96.61 кДж
Возможна ли эта реакция при стандартных условиях, если ∆S° = 0.1387 кДж/моль∙К? При какой температуре начнется восстановление Fe2O3?
4. Энтальпии образования оксида и диоксида азота ∆Н°298 = +90.25 кДж/моль и +33.85 кДж/моль, соответственно. Вычислите ∆S° и ∆G° для реакции получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?
5. Восстановление Fe2O3 оксидом углерода идет по уравнению:
Fe2O3 (кр) + CO(г) = 3 FeO(кр)+ CO2(г)
Определите ∆G° реакции и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ∆S° в этом процессе?
6. Рассчитайте изменение стандартной энергии Гиббса реакции
4 FeO(кр) + O2 (г) = 2 Fe2O3 (кр) ∆Н°р = -822 кДж
и стандартную энтропию Fe2O3, если ∆S°р = -273.1 Дж/К.
Занятие 9. Химическая кинетика. Катализ. Химическое равновесие
Цель занятия:
Получить системные знания о закономерностях протекания химических и биохимических реакций, влияния различных факторов на скорости реакций.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Выполнение демонстрационных работ.
Вопросы, предлагаемые для обсуждения на занятии:
1. Предмет химической кинетики.
2. Скорость химической реакции (средняя, истинная).
3. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действия масс. Константа скорости реакции. Выражение закона действующих масс для гомогенных и гетерогенных систем. Примеры. Понятия о молекулярности и порядке реакции.
4. Зависимость скорости реакции от температуры. Теория активных соударений, активные молекулы, энергия активации, энергетический барьер реакции.
5. Катализ. Катализаторы. Основные признаки каталитических процессов. Примеры катализа. Свойства катализаторов. Теории гомогенного и гетерогенного катализа – теория промежуточных соединений и адсорбционная. Биологические катализаторы (ферменты), их особенности.
6. Радиационно-химические реакции (радиолиз воды), влияние их на биологические объекты.
7. Необратимые и обратимые химические реакции. Химическое равновесие. Константа равновесия.
8. Смещение (сдвиг) химического равновесия. Принцип Ле-Шателье–Брауна.
Лабораторная работа. Зависимость скорости реакции от концентрации.
Познакомьтесь с содержанием демонстрационных работ и оформите их результаты после выполнения по предлагаемой форме.
В трех пронумерованных стаканчиках готовят растворы различной концентрации:
1 стакан – 10 мл раствора Na2S2O3 + 20 мл Н2О, перемешать;
2 стакан – 20 мл раствора Na2S2O3 + 10 мл Н2О, перемешать;
3 стакан – 30 мл раствора Na2S2O3.
В стакан 1 вливают цилиндром 10 мл раствора H2SO4, перемешивают. В момент сливания растворов включают секундомер и отсчитывают время до появления легкого помутнения.
Аналогично поступают со стаканами 2 и 3.
Na2S2O3 + H2SO4= H2S2O3 + Na2SO4;
H2S2O3 = S↓ + H2SO3
Результаты сводят в таблицу и затем строят график зависимости υ—C, т. е. скорости реакции (ось ординат) от концентрации Na2S2O3 (ось абсцисс).
| № п/п | Объем, мл | Концентрация
С=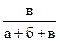
| Промежуток времени от начала отсчета до помутнения t, с | Скорость реакции υ = 1/t | ||
| a Na2S2O3 | б Н2О | в H2SO4 | ||||
| – |
Вывод:…
Контрольные вопросы и задачи
1. В системе 2 SO2(г) + О2(г) = 2 SO3(г) концентрацию оксида серы (IV) увеличили с 0.2 до 0.4 моль/л, а концентрацию кислорода с 0.4 до 1.2 моль/л. Во сколько раз возрастает скорость прямой реакции?
2. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO(г) + О2(г) = 2NО2(г) возросла в 103 раз?
3. Разложение N2O при высоких температурах протекает по уравнению:
2 N2O(г) → 2 N2(г) + O2(г).
Константа скорости данной реакции равна 5∙10-4 моль/л при 900°С. Начальная концентрация N2О = 3.2 моль/л. Определите скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложилось 25% N2O.
4. Скорость реакции увеличится в 4 раза при повышении температуры на 10°С. Во сколько раз возрастет скорость реакции при повышении температуры от 45°С до 75°С?
5. Допустимый срок хранения лекарственного вещества при комнатной температуре (20°С) 3 года. В процессе ускоренного определения его стабильности при 70°С, оно потеряло свои свойства через 40 суток. Соответствует ли лекарственное вещество предъявленным требованиям, если температурный коэффициент скорости реакции равен 2?
6. Реакция при температуре 20°С протекает за 12 мин 48 с. На сколько градусов необходимо повысить температуру системы для завершения этой реакции за 48 с (температурный коэффициент равен 2)?
7. Реакция идет по уравнению: N2(г) + O2(г) = 2 NO(г). Концентрации исходных веществ до начала реакции были (моль/л): [N2] = 0.049; [O2] = 0.01. Вычислите концентрацию этих веществ в момент, когда [NО] стала равной 0,005.
8. Реакция идет по уравнению: N2(г) + 3 Н2(г) = 2 NH3(г). Концентрации участвующих в ней веществ были (моль/л): [N2] = 0.8; [H2] = 1.5; [NH3] = 0.1. Вычислите концентрацию водорода и аммиака, когда [N2] стала равной
0.5 моль/л.
9. Вычислите равновесные концентрации Н2 и I2, если известно, что их начальные концентрации были равны 0.1 и 0.2 моль/л, а равновесная концентрация HI равна
0.1 моль/л. Вычислите константу равновесия в данных условиях.
10. В реакторе объемом 10 л содержится 5.6 г С2Н4, 150 г С2Н6 и водород. Константа равновесия реакции
Н2(г) + С2Н4(г) = С2Н6(г), выраженная через молярные концентрации, равна 50. Рассчитайте массу водорода.
Занятие 10. Химическая термодинамика.
Химическая кинетика и равновесие
Содержание занятия
1. Контрольная работа.
Вопросы для подготовки к контрольной работе
1. I и II начала (законы) термодинамики.
2. Закон Гесса и следствия из него.
3. Энтальпия химических процессов. Стандартные условия.
4. Термодинамические потенциалы (Гиббса, Гельмгольца). Энтропия.
5. Скорость гомогенных и гетерогенных химических реакций.
6. Закон действующих масс.
7. Зависимость скорости реакции от различных факторов (концентрации, температуры, давления).
8. Правило Вант-Гоффа, уравнение Аррениуса.
9. Гомогенный, гетерогенный катализ, теория их объясняющая.
10. Константа химического равновесия и факторы на нее влияющие.
11. Принцип Ле-Шателье–Брауна.
Занятие 11. Учение о растворах. Свойства растворов электролитов
Цель занятия:
Получить системные знания о растворах электролитов, их свойствах и значении для жизнедеятельности живых организмов.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Реферативное сообщение студентов по теме: «Электролиты в организме человека».
Вопросы, предлагаемые для обсуждения на занятии:
1. Слабые электролиты. Степень диссоциации, Факторы, влияющие на степень диссоциации. Применение закона действующих масс к процессу диссоциации слабых электролитов. Константа диссоциации. Закон разведения Оствальда.
2. Диссоциация воды. Ионное произведение воды. Водородный показатель рН как количественная мера активной кислотности и щелочности.
3. Сильные электролиты. Основные положения теории растворов сильных электролитов. Активность, коэффициент активности. Ионная сила растворов.
4. Нарушение электролитного баланса и его следствия.
5. рН раствора гидроксида натрия равен 9. Какова молярная концентрация такого раствора?
6. Что надо добавить: кислоту или щелочь, чтобы изменить рН от 10 до 8?
7. Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора:
а) увеличился на единицу.
б) увеличился в 10 раз.
в) уменьшился в 100 раз?
8. Определите рН и рОН 0.125 М раствора одноосновной кислоты, если α = 0.8.
Контрольные вопросы и задачи
1. Ядовитые микроорганизмы Botulinus не могут развиваться, если рН среды менее 4.5. Можно ли использовать 0,3% раствор пищевой уксусной кислоты в качестве консерванта? (ρ=1 г/мл, α = 0.01).
2. Содержание соляной кислоты в желудочном соке составляет 0,5%. Вычислите рН желудочного сока, приняв его плотность 1 г/мл.
3. В 2 литрах воды растворили 2 г НСl, 1 мл полученного раствора ещё раз растворили в литре воды. Определите рН полученных растворов?
4. Вычислите рН раствора, полученного смешиванием 2 л раствора HCl с молярной концентрацией 0.1моль/л и 400 мл раствора NaOH (ρ = 1,05 г/мл) с массовой долей 10%.
5. Вычислить рН раствора, полученного растворением 54.3 мл 98% раствора серной кислоты (ρ = 1.84 г/мл) в 5 литрах воды. Диссоциацию кислоты считать полной, а плотность полученного раствора 1 г/мл.
6. Борную кислоту применяют наружно как антисептическое средство в виде 2% раствора. Вычислить рН этого раствора, если считать, что кислота диссоциирует по первой ступени и степень диссоциации равна 40%. Плотность раствора принять равной 1 г/мл.
7. Сравните рН растворов соляной кислоты с концентрацией 0,1моль/л и раствора той же кислоты разбавленной вдвое.
8. «Кислотными» дождями называют атмосферные осадки с рН менее 5.6. Может ли растворение СО2 атмосферных осадков дать в воде рН = 5.6? Решите задачу количественно, учитывая, что в 1 л воды растворяется 0.9 г СО2 (степень диссоциации угольной кислоты по I ступени 0,1%).
9. Найдите концентрацию ионов Н+ в 0.01 М растворе циановодородной кислоты при 25°С, если её константа диссоциации составляет 7.2∙ 10-10.
10. Вычислите степень диссоциации и концентрацию ионов NH4+ и ОНˉ в 0.1 М растворе NH4OH при 25°С, если константа диссоциации NH4OH составляет 1.79∙10-5.
11. Найдите концентрацию ионов Н+ в 0.0001 М растворе сероводородной кислоты при 25°С, если её константа диссоциации составляет 5.7∙10-8.
12. Рассчитайте ионную силу раствора сульфата аммония с массовой долей 2% (ρ = 1.01г/мл).
13. Вычислите ионную силу 10% раствора хлорида натрия
(ρ = 1,1 г/мл), применяемого в медицине в качестве гипертонического раствора.
Перечень литературы, необходимый для подготовки реферата:
1. Маскалев Ю.И. Минеральный обмен. М: Медицина, 1985г.
2. Микроэлементы в биологии и их применение в с/х и медицине. Тезисы докладов XI всесоюзной конференции. Самарканд, 1990г.
3. Айвазова Е.А., Сычева Л.Н., Добродеева Л.К. Особенности электролитного обмена у жителей Архангельской области. Архангельск, 1998г.
4. Айвазова Е.А., Сычева Л.Н., Добродеева Л.К. Особенности электролитного обмена у жителей Ненецкого автономного округа. Архангельск,1998г.
5. Большая медицинская энциклопедия.
Занятие 12. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. Осмос и осмотическое давление
Цель занятия:
Сформировать системные знания о коллигативных свойствах разбавленных растворов; научиться использовать закон Вант-Гоффа для расчета соответствующих параметров разбавленных растворов, в том числе биологических жидкостей.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Постановка демонстрационных опытов.
Вопросы, предлагаемые для обсуждения на занятии:
1. Диффузия в растворах. Факторы, влияющие на скорость диффузии. Закон Фика. Роль диффузии в процессах переноса вещества в биологических системах.
2. Сущность осмоса. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа. Гипо-, гипер- .и изотонические растворы. Измерение осмотического давления.
3. Отклонение растворов электролитов от закона Вант-Гоффа. Изотонический коэффициент, его связь со степенью диссоциации электролита. Понятие об осмотической концентрации растворов.
4. Осмотическое давление растворов биополимеров. Осмотическое давление плазмы и сыворотки крови и его биологическая роль.
5. Роль осмоса и осмотического давления в биологических системах. Изоосмия организмов. Формирование отека. Плазмолиз, гемолиз. Применение в медицине гипер- и изотонических растворов.
Лабораторная работа
Опыт 1. Определение осмотического давления раствора сахарозы. Осмометр вынимают из штатива. Затем, наклонив его в сторону боковой (широкой)…Контрольные вопросы и задачи
1. Какие свойства растворов называются коллигативными?
2. Что такое полупронецаемые мембраны? Приведите примеры полупроницаемых мембран.
3. Дайте определение осмоса и осмотического давления. Какие существуют методы определения осмотического давления?
4. Какое из перечисленных утверждений верно: при одинаковой молярной концентрации и температуре максимальное осмотическое давление имеет разбавленный раствор:
а) хлорида натрия; б) хлорида калия; в) хлорида кальция,
г) глюкозы.
5. Будут ли изотоничны водные растворы двух нелетучих неэлектролитов, если температуры и молярные концентрации растворов одинаковы? Ответ мотивируйте.
6. Будут ли изотоничны водные растворы двух нелетучих неэлектролитов (М1 > М2), если температуры растворов и массовые доли этих веществ в растворах одинаковы? Если, на ваш взгляд, растворы неизотоничны, то в котором из них — первом или втором — осмотическое давление выше? Почему?
7. Как будет меняться во времени осмотическое давление подкисленного раствора сахарозы при 80°С? Ответ мотивируйте.
8. Опишите поведение эритроцитов при 37°С в водных растворах следующих веществ:
а) фруктозы, ω = 2%, плотность 1.006 г/мл;
б) сульфата натрия, ω = 16%, плотность 1.151 г/мл, α = 1;
в) мочевины, С = 0.3 моль/л.
9. Раствор, полученный растворением 50 г органического вещества в 1300 мл воды обладает при 20°С осмотическим давлением 0.01 атм и плотностью 1.01 г/мл. Определите молярную массу органического вещества.
10. Какую массу глюкозы следует взять для приготовления
0.5 л водного раствора, изотоничного плазме крови при температуре 37°С?
11. При 20°С смешали 1 л раствора сахарозы, осмотическое давление которого 2.4 атм с 3 л раствора KCl, осмотическое давление которого 4.8 атм. Найти осмотическое давление смешанного раствора, если αHCl = 1.
12. Будут ли изотоничны плазме крови при температуре 37°С следующие растворы:
а) 5%-й водный раствор глюкозы (ρ = 1.08 г/моль);
б) водный раствор, содержащий в 0.1 л раствора дезоксирибозу массой 1.34 г;
в) раствор фруктозы с молярной концентрацией 0,303 моль/л;
г) водный раствор карбоната калия с массовой долей К2СО3 0.7% и плотность 1.005 г/мл (αК2СО3 = 1).
13. Рассчитайте осмотическое давление при 37°С
(R = 0,082 л·атм/К):
а) 0.1 М раствора СаCl2 (αСаCl2 = 1)
б) внутриклеточной жидкости, если состав раствора (моль/л): [Na+] =35; [K+] =115; [Ca2+] =5; [Clˉ] = 20; [HCO3ˉ] = 20; [H2PO4ˉ] = 100; [SO42-] =10.
в) раствора, в 2 л которого содержится 90 г глюкозы
(М =180 г/моль).
Занятие 13. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. закон рауля
Цель занятия:
Сформировать системные знания о коллигативных свойствах разбавленных растворов; научиться использовать закон Рауля для расчета соответствующих параметров разбавленных растворов, в том числе биологических жидкостей.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Тестовый контроль по теме «Коллигативные свойства растворов».
Вопросы, предлагаемые для обсуждения на занятии:
1. Насыщенный пар, давление насыщенного пара над чистым растворителем. Относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего неэлектролита; закон Рауля.
2. Температуры кипения и замерзания растворов. Относительное повышение температуры кипения и понижение температуры замерзания (депрессии) разбавленных растворов неэлектролитов по сравнению с чистыми растворителями; следствия из закона Рауля. Эбуллиоскопическая и криоскопическая постоянные, их физический смысл.
3. Отклонение растворов электролитов от закона Рауля и его следствий. Изотонический коэффициент.
4. Взаимосвязь между коллигативными свойствами растворов. Осмометрия, криометрия и применение их в медико-биологических исследованиях.
Контрольные вопросы и задачи
1. Объясните с помощью принципа смещения химического равновесия повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем.
2. Что называется давлением насыщенного пара? Как оно изменяется над раствором по мере увеличения концентрации нелетучего неэлектролита?
3. Не производя расчетов, укажите, какой из трех растворов с одинаковой массовой долей – хлорида бария, хлорида магния, хлорида кальция – имеет минимальную и максимальную температуру замерзания. Ответ мотивируйте.
4. Барбитуровая кислота, производные которой имеют большое значение в медицине, состоит (по массе) из 42.11 % углерода, 3.58% водорода, 42.11% кислорода и 12.28% азота. Температура кипения раствора, содержащего 10.21 г барбитуровой кислоты в 360 г ССl4, на 1.25 К выше температуры кипения чистого ССl4. Какова молярная масса и молекулярная формула барбитуровой кислоты (ЕССl4 = 5.02).
5. Многие моносахариды отвечают простейшей формуле Сn(H2O)n. Выведите молекулярную формулу ксилозы, водный раствор которой с массовой долей вещества 1.96% замерзает при -0,248°С.
6. Чему равна температура замерзания водного раствора, содержащего глюкозу с массовой долей 3%, если Кводы = 1,86.
7. Какую массу сахарозы следует растворить в 250 г воды, чтобы получить раствор, кипящий при 100.2°С. При какой температуре будет замерзать этот раствор?
8. Понижение температуры замерзания плазмы крови равно 0.56°С. Рассчитайте массу воды, которую необходимо добавить к 100 г 10% раствора NaCl, для получения раствора, изотоничного крови при 37°С.
9. Как можно вычислить величину осмотического давления раствора нелетучего неэлектролита, если известна депрессия (∆Тзам.) раствора?
Занятие 14. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ рН
Цель занятия:
Научиться составлять схему гальванического элемента, представлять электронные уравнения процессов, протекающих на электродах. Научиться определять рН исследуемых растворов.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме занятия.
2. Решение задач.
3. Выполнение лабораторной работы.
Вопросы, предлагаемые для обсуждения на занятии:
1. Сущность метода потенциометрии и его медико-биологическое значение.
2. Механизм возникновения электродного потенциала.
3. Уравнение Нернста. Зависимость электролитного потенциала от различных факторов. Стандартный электродный потенциал. Ряд напряжений металлов.
4. Классификация электродов.
5. Устройство электродов I и II рода. Стеклянный и хлорсеребряный электроды.
6. Гальванический элемент: схема, электродные реакции, расчет ЭДС.
7. Редокс-электроды. Уравнение Петерса. Биологическое значение редокс-потенциала
8. Диффузные и мембранные потенциалы, их биологическое значение.
Лабораторная работа
При измерении рН растворов с помощью приборов «ЭВ-74», «рН-340», «рН-121»…Указания для выполнения и оформления работы
I. Включение прибора(его следует включить за 30 мин до начала работы). 1. Проверить заземление прибора – клемма на задней стенке прибора должна быть… 2. Нажать клавиши «t°» и «-1÷19» на лицевой панели прибора.Контрольные вопросы и задачи
1. Рассчитайте электродные потенциалы магния в растворе его соли при концентрации иона Mg2+ 0,1; 0,01 и 0,001 моль/л при температуре 25°C.
2. Приведите схему медно-никелевого гальванического элемента, определите знаки электродов, составьте уравнения реакций, протекающих на электродах, выведите формулу ЭДС и рассчитайте ЭДС данного гальванического элемента, если С (Cu2+) = 10-2 моль/л, а С (Ni2+) = 10-4 моль/л.
3. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов:
а) Mg | Mg2+|| Pb2+ | Pb
б) Pb | Pb2+ || Cu2+ | Cu
в) Сu | Cu2+ || Ag+ | Ag
4. Потенциал водородного электрода в некотором растворе равен -118 мВ. Вычислите активность ионов водорода в этом растворе.
5. Никелевые пластины опущены в растворы NiSO4 c концентрациями 0.01 и 0.05 моль/л. Привести схему данного гальванического элемента, электродные реакции, рассчитать ЭДС.
6. Приведите схемы гальванических элементов, с помощью которых можно определить стандартный электродный потенциал металла.
Занятие 15. титриметрический анализ. кислотно-основное титрование
Цель занятия:
Приобрести теоретические представления о задачах и методах количественного анализа; усвоить содержание основных физико-химических величин, используемых в титриметрическом анализе и научиться правильно имипользоваться; усвоить основные физико-химические понятия, используемые в титриметрическом анализе; научиться определять численный состав растворов кислот и оснований методом титрования и обрабатывать результаты эксперимента.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме занятия.
2. Решение задач.
3. Демонстрация мерной посуды.
4. Выполнение лабораторной работы.
Вопросы, предлагаемые для обсуждения на занятии:
1. Задачи и классификация методов количественного анализа; медико-биологическое значение количественных определений.
2. Способы выражения численного состава растворов. Молярная концентрация эквивалента. Закон эквивалентов.
3. Мерная посуда, используемая в титриметрическом анализе, и правила работы с ней.
4. Основные понятия титриметрического анализа: титрование, рабочий раствор, точка эквивалентности. Способы приготовления рабочих титрованных растворов.
5. Сущность кислотно-основного титрования. Рабочие растворы метода (титр приготовления, титр установления).
6. Гидролиз солей. Реакция среды в водных растворах гидролизующихся солей. Ступенчатый гидролиз. Степень и константа гидролиза.
7. Кривые титрования (скачок титрования, реакция среды в точке эквивалентности).
8. Выбор индикатора кислотно-основного титрования.
Теоретический материал к занятию
Аналитическая химия — наука, предметом которой является разработка методов определения качественного и количественного состава всевозможных объектов, встречающихся в природе или изготовленных искусственным путем. Это могут быть минералы, почва, природные воды, воздух, искусственные материалы, ткани и органы растений и животных, пищевые продукты. Без знания состава различных тканей и сред живых организмов в норме и патологии невозможны ни понимание сущности протекающих в них процессов, ни диагностика многих заболеваний, ни разработка научно-обоснованных методов лечения. Ни одно лекарство не выпускается в продажу без анализа его качественного и количественного состава. Методы химического анализа используют также для контроля состояния объектов окружающей среды.
Аналитическая химия состоит из двух частей: качественный анализ и количественный анализ. Качественный анализ используют для определения в изучаемом объекте отдельных химических элементов или химических соединений. Задачей количественного анализа является определение точного содержания химических элементов, их соединений в исследуемом объекте.
Медицинскому работнику часто приходится работать со всевозможными растворами. Плазма и сыворотка крови, лимфа, внутриклеточная жидкость, желудочный сок — всё это разбавленные водные растворы различных веществ. Лекарства также часто применяют в виде растворов (для инъекций, микстуры). Если же они применяются в твердом виде, то учитывается их способность растворяться. Анализ растворов настолько удобен в экспериментальном отношении, что в большинстве случаев изучаемый образец стремятся перевести в растворенное состояние и анализировать полученный раствор. Задачей анализа растворов является определение их численного состава.
Способы выражения численного состава растворов
Обозначение массовой доли – ω. Массовая доля рассчитывается как отношение массы растворенного вещества X к… Пример. Рассчитайте массовую долю (в долях единицы и процентах) сульфата натрия, если в растворе массой 400 г…Решение.
С(Х) = ———————— = ————— = 0.2 моль/л; V(раствора NaOН) 0.2 лРешение.
M(½H2SO4) = ½ × M(H2SO4) = ½ × 98 г/моль = 49 г/моль. Расчет молярной концентрации эквивалента раствора серной кислоты: m(H2SO4) 2.45 гРешение.
b(КОН) = ——————— = ————— = 0.1 моль/кг. m(растворителя) 0.5 кгРешение.
m(H2O) 72 г а) n(H2O) = ———— = ————— = 4 моль;Количественный анализ
Классификация методов количественного анализа
Методы количественного анализа можно разделить на химические и физико-химические.
Химические методы анализа основаны на проведении химических реакций между анализируемым веществом и специально подобранными реактивами. По количеству затраченных реактивов или по количеству полученных продуктов реакции рассчитывают состав анализируемого образца. Различают гравиметрический и титриметрический (объёмный) химический анализ.
Гравиметрический анализ основан на полном (количественном) выделении какого-либо компонента из анализируемого образца в виде осадка постоянного, точно известного состава. Полученный осадок высушивают, точно взвешивают и, зная массу осадка, по его химической формуле определяют, сколько в нем содержится искомой составной части. Гравиметрический анализ дает точные результаты, но он очень трудоемок и длителен, поэтому все более вытесняется другими методами анализа.
Титриметрический анализ заключается в точном определении объема раствора химического реактива с известной концентрацией, который необходим для полного протекания реакции с данным объемом анализируемого раствора.
Физико-химические методы анализа связаны с применением сложной и чувствительной аппаратуры. Достоинствами этих методов являются их объективность, возможность автоматизации и быстрота получения результатов. В зависимости от использования того или иного физико-химического свойства анализируемого компонента различают оптические и электрометрические методы анализа. В качестве примера электрометрического метода можно привести потенциометрическое определение рН раствора с помощью электроизмерительных приборов – потенциометров. Из оптических методов наиболее распространена колориметрия, основанная на измерении интенсивности поглощения света растворенным веществом. Интенсивность поглощения зависит от концентрации вещества.
Теоретические основы титриметрического анализа
Из самого определения понятия химического эквивалента вытекает, что в химической реакции обязательно участвует равное число эквивалентов двух… n(1/z1 X1) = n(1/z2 X2)Сущность и основные понятия титриметрического анализа
В титриметрическом анализе к точно отмеренному объему раствора одного вещества медленно, небольшими порциями, приливают раствор другого вещества до полного окончания реакции. Этот процесс называется титрованием, а момент завершения реакции – точкой эквивалентности. Один из двух растворов содержит вещество с неизвестной концентрацией и представляет собой анализируемый раствор. Другой раствор содержит реагент с точно известной концентрацией и называется рабочим раствором или титрантом. В точке эквивалентности количество вещества эквивалента в добавленном рабочем растворе становится равным количеству анализируемого вещества. По достижении точки эквивалентности титрование заканчивают и фиксируют затраченный объем рабочего раствора. На основании закона эквивалентов рассчитывают концентрацию вещества в анализируемом растворе.
Таким образом, для успешного проведения титриметрического анализа необходимо:
а) знать точную концентрацию рабочего раствора;
б) точно измерить объемы растворов обоих реагирующих веществ;
в) надежно фиксировать точку эквивалентности.
В титриметрическом анализе могут использоваться не все химические реакции, а только те, которые отвечают следующим требованиям:
а) реакция должна быть практически необратимой;
б) реакция должна протекать в строгом соответствии с уравнением, без побочных продуктов (это требование часто формулируется как "стехиометричность процесса");
в) реакция должна протекать достаточно быстро;
г) для используемой реакции должен существовать способ фиксирования точки эквивалентности.
Для определения конца реакции титрование проводят в присутствии вспомогательных реактивов — индикаторов. Индикаторы – это вещества, способные в точке эквивалентности менять свою окраску. В некоторых случаях индикатором является одно из реагирующих веществ. Если это вещество окрашено, а продукты реакции бесцветны или имеют другую окраску, то в точке эквивалентности происходит изменение окраски раствора.
Классификация методов титриметрического анализа
В зависимости от типа химической реакции, лежащей в основе, титриметрический анализ делится на следующие методы:
а) методы алкалиметрии (определение кислот) и ацидиметрии (определение оснований) – в основе лежат кислотно-основные реакции;
б) метод оксидиметрии – в основе лежат окислительно-восстановительные реакции. В зависимости от применяемых рабочих растворов оксидиметрию разделяют на перманганатометрию (рабочий раствор – перманганат калия), йодометрию (рабочие растворы – йод и тиосульфат натрия), броматометрию (рабочий раствор – бромат калия), нитритометрию (рабочий раствор – нитрит натрия), цериметрию (рабочий раствор – сульфат церия (IV)), дихроматометрию (рабочий раствор – дихромат калия). В медицине наиболее широко используется перманганатометрия и йодометрия;
в) методы аргентометрии и меркурометрии – в основе лежат реакции осаждения;
г) методы комплексометрии и комплексонометрии – в основе лежит реакция образования комплексных соединений.
По способу проведения анализа различают прямое и обратное титрование, а также метод замещения.
При прямом титровании к раствору определяемого вещества непосредственно добавляют титрант. При обратном титровании определяемое вещество сначало реагирует с точно известным количеством реагента, взятого в избытке. Непрореагировавший избыток титруют рабочим раствором, затем рассчитывают количество реагента, вступившего в реакцию с определяемым веществом. В методе замещения проводят реакцию определяемого вещества с каким-либо реагентом и титруют один из продуктов этой реакции. В этом случае определяемое вещество замещается продуктом реакции, откуда и получил название данный метод.
Метод замещения может быть целесообразным тогда, когда непосредственная реакция исследуемого вещества и реагента не удовлетворяет требованиям, предъявляемым к титриметрическим реакциям.
Приготовление рабочих растворов
В первом случае получается раствор с приготовленным титром, во втором – с установленным титром. Концентрация титрованных растворов должна быть определена с точностью до… Получить растворы с приготовленным титром можно только из химически чистых веществ, имеющих постоянный состав, не…Рабочие растворы в методах кислотно-основного титрования
Непосредственно приготовить растворы точной концентрации для этих веществ невозможно, т.к. гидроксид натрия гигроскопичен и содержит всегда примесь… Предварительно готовят растворы этих веществ с концентрацией, близкой к… Точную концентрацию раствора гидроксида натрия устанавливают по стандартному раствору щавелевой кислоты…Определение точки эквивалентности при кислотно-основном титровании. Индикаторы.
Для экспериментального установления точки эквивалентности пользуются индикаторами – веществами, которые изменяют окраску в зависимости от рН… Момент титрования, когда индикатор изменяет окраску, называется точкой конца… Индикаторы — довольно сложные органические вещества, являющиеся слабыми кислотами или основаниями. Окраска…Кривые титрования
Графическое изображение зависимости рН от объёма добавляемого рабочего раствора (или от степени нейтрализации анализируемого раствора) называется… 1. Нейтрализация сильной кислоты сильным основаниемКонтрольные вопросы и задачи
1. Расчитайте молярную концентрацию раствора хлорида железа (III) с массовой долей FeCl3 10% и плотностью
1.092 г/мл.
2. Рассчитайте массовую долю азотной кислоты в растворе с молярной концентрацией 0.1783 моль/л и плотностью
1.01 г/мл.
3. В биохимическом анализе применяют хлорцинковую смесь, которую готовят растворением 50 г ZnSO4×7H2O и 250 г NaCl в 1 л дистиллированной воды (ρ(Н2O) = 1 г/мл). Рассчитайте массовую и молярную долю веществ в этой смеси.
4. Определите фактор эквивалентности и рассчитайте молярную массу эквивалента вещества, указанного в схемах реакции первым:
а) NaH2PO4 + NaOH → Na2HPO4 + H2O
б) H2SO4 + NaOH → NaHSO4 + Н2O
в) H2SO4 + NaOH → Na2SO4 + H2O
г) Cr2(SO4)3 + H2O + KOH → K2CrО4 + K2SO4 + H2O
д) NaBrO3 + KI + H2SO4 → NaBr + I2 + K2SO4 + H2O
ж) H2S + Br2 → S + HBr
5. Рассчитайте молярную массу эквивалента:
а) фосфорной кислоты в реакции полного обмена протонов;
б) сульфата железа (III) в реакции полного обмена ионов железа.
Рассчитайте молярную концентрацию эквивалента фосфорной кислоты (в реакции а), если 10 г кислоты содержится в объеме раствора 1,5л.
6. На нейтрализацию 10 мл раствора гидроксида натрия потребовалось 10.8 мл раствора щавелевой кислоты с
С(½ Н2С2О4) = 0.112 моль/л. Определите концентрацию раствора гидроксида натрия. Рассчитайте массу гидроксида натрия, необходимую для приготовления 200 мл такого раствора.
7. Для проведения химической реакции требуется сульфат магния массой 18 г. Какой объем раствора с С(½ MgSO4) = 0.02 моль/л содержит эту массу вещества?
8. Для определения содержания хлоридов в сыворотке крови используется 0.1 М водный раствор AgNO3. Рассчитайте массу нитрата серебра, необходимую для приготовления такого раствора объемом 100 мл.
9. На титрование раствора NaOH объемом 15 мл, в присутствии индикатора метилового оранжевого, израсходовано 13.53 мл рабочего раствора HCl с молярной концентрацией эквивалента 0.115 моль/л. Определите молярную концентрацию эквивалента раствора гидроксида натрия.
10. Какова молярная концентрация эквивалента Na2СО3, если в объёме 200 мл содержится 1.06 г карбоната натрия?
11. Какова масса буры Na2В4О7, необходимой для приготовления раствора объемом 0.25 л с молярной концентрацией эквивалента 0.1 моль/л?
12. Для дезинфекции ран в медицине применяется йодная настойка, представляющая собой раствор йода в спирте с массовой долей йода 5%. Вычислите: а) массу йода, содержащегося в йодной настойке массой 15 г; б) объём спирта и массу йода, необходимых для приготовления йодной настойки массой 500 г (плотность спирта 0.8 г/мл).
13. Для определения рекальцификации кровяной плазмы применяют раствор хлорида кальция с молярной концентрацией 0.025 моль/л (р=1г/см3) , который готовят из сухого прокаленного вещества. Какова масса СаСl2, необходимого для приготовления требуемого раствора объемом 250 мл.
Занятие 16. титриметрический анализ. перманганатометрия
Цель занятия:
Сформировать системные знания об окислительно-восстановительных процессах. Приобрести практические навыки по определению содержания восстановителей в исследуемом растворе.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме занятия.
2. Выполнение лабораторной работы.
Вопросы, предлагаемые для обсуждения на занятии:
1. Сущность метода оксидиметрии. Расчёт молярных масс эквивалентов веществ в окислительно-восстановительных реакциях.
2. Перманганатометрия. Сущность метода. Применение в медицине.
а) рабочий раствор–окислитель, его приготовление и определение точной концентрации;
б) особенности восстановления перманганата калия в зависимости от рН среды;
в) индикатор, определение эквивалентной точки титрования;
г) условия титрования (среда, температура) при определении концентрации и массы FeSO4 и Н2О2 при помощи рабочего раствора KMnO4.
Теоретический материал к занятию
В основе метода оксидиметрии лежат окислительно-восстановительные реакции. Окислительно-восстановитель-ными являются реакции, в которых происходит перенос электронов от одних молекул, атомов или ионов (восстановителей) к другим (окислителям). Эти реакции сопровождают многие биологические процессы.
В общем виде окислительно-восстановительные реакции можно представить следующим образом:
Red + Ох ® Ox1 + Red1,
где Ox1/Red – сопряженная окислительно-восстановительная пара, отвечающая полуреакции Red ® Ox1 + Zē;
Ox/Red1 – сопряженная окислительно-восстановительная пара, отвечающая полуреакции Ох + Zē ® Red1.
Возможность протекания окислительно-восстановитель-ной реакции, как и любой другой, определяется знаком ∆G: в стандартных условиях реакция идет слева направо, если
∆G < 0. Если абсолютная величина ∆G достаточно велика (больше 40 кДж), эта реакция протекает практически до конца и направление ее не изменяется даже при сильном отклонении концентрации веществ от стандартных значений.
Метод перманганатометрии является одним из примеров метода оксидиметрии. Он основан на реакциях окисления различных веществ перманганатом калия. Направление окислительно-восстановительных реакций, идущих с участием KMnO4, а, следовательно, количество электронов, присоединяемых ионом MnO4ˉ и отдаваемых молекулой (ионом) восстановителя, зависит от рН среды. Известно, что ионы MnO4ˉ, выступая в роли окислителя, в кислой среде восстанавливаются с образованием иона Mn2+; в сильнощелочной — с образованием иона MnO42ˉ; в слабощелочной и нейтральной — с образованием молекулы MnО2.
Для количественного определения восстановителей окисление проводят в кислой среде, в которой MnO4ˉ-ион проявляет наиболее сильные окислительные свойства и имеет минимальную молярную массу эквивалента (фактор эквивалентности равен 1/5) . Продуктом восстановления перманганат-иона является почти бесцветный ион Mn2+ (Mn7+ + 5е ® Mn2+). Точка эквивалентности фиксируется по изменению окраски титруемого раствора, вызываемому избытком окрашенного рабочего раствора перманганата калия. При титровании розовая окраска перманганат-иона становится заметной от одной избыточной капли рабочего раствора KMnO4. Поэтому не требуется никакого специального индикатора. При определении восстановителей проводят прямое титрование перманганатом калия, при определении окислителей — обратное, с помощью которого можно определить количество веществ, реагирующих с восстановителями, например, с К2Сг2O7 дихроматом калия, который реагирует с солью Мора (NH4)2Fe(SO4)2×6Н2O – избыток соли Мора титруют раствором КМnO4.
Раствор КМnO4 с точной молярной концентрацией эквивалента по точной навеске приготовить нельзя. Это объясняется тем, что КМnO4 всегда содержит примеси (чаще всего МnO2). Кроме того, он легко восстанавливается под влиянием органических веществ, присутствующих в воде. Вследствие этого концентрация раствора КМnO4 уменьшается. Поэтому раствор перманганата калия готовят приблизительно нужной концентрации, а затем ее уточняют через 7–10 дней после приготовления.
В качестве стандартных веществ для установки точной концентрации рабочего раствора КМnO4 обычно применяют оксалат аммония (NH2)2C2O4×H2O, оксалат натрия Na2C2O4 или щавелевую кислоту Н2С2O4×2Н2O. Наиболее удобным является оксалат натрия, т.к. он кристаллизуется без воды и не гигроскопичен. Взаимодействие между оксалатом натрия и перманганатом калия протекает согласно уравнению:
5Na2C2O4 + 2KMnO4 +8H2SO4 = 10СО2 + 2MnSO4 + 8Н2O +
+ 5Na2SO4
Разность окислительно-восстановительных потенциалов пар MnO4¯/Mn2+ (E= +1.52В) и 2СO2/С2O42- (Е = -0.49В) составляет 2.01В. Большая разность потенциалов показывает, что реакция протекает практически необратимо.
Все продукты этой реакции бесцветны, тогда как раствор KMnO4 красно-фиолетовый. Поэтому течение реакции должно сопровождаться обесцвечиванием прибавляемого раствора KMnO4. Обесцвечивание раствора после прибавления перманганата будет происходить до точки эквивалентности. Лишняя же капля KMnO4 окрасит титруемый раствор в длительно не исчезающий розовый цвет.
Лабораторная работа. Определение концентрации и массы FeSO4 при помощи рабочего раствора KMnO4.
Рабочий раствор–окислитель — KMnO4, С(1/5 KMnO4) = . . .
Индикатор — раствор KMnO4.
Условия титрования — кислая среда, комнатная температура.
Уравнение реакции:
2KMnO4 + 10FeSO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 +
+ 8H2O
| Mn7+ + 5е ® Mn2+ Fe2+ – 1е ® Fe3+ | —— | —— |
Методика титрования.
Исследуемый раствор разбавляют дистиллированной водой в мерной колбе до метки и тщательно перемешивают. В колбу для титрования пипеткой отмеряют исследуемый раствор FeSO4 объемом 10 мл, добавляют цилиндром раствор H2SO4 объемом 10 мл с С(1/2 H2SO4) = 2 моль/л и титруют рабочим раствором KMnO4 до появления слабо-розовой окраски.
Результаты титрования (с точностью до сотых долей мл):
V1 = …
V2 = …
V3 = …
————
Vср = …
Расчет концентрации и массы FeSO4 в растворе:
a) C(FeSO4) = , моль/л
, моль/л
б) m(FeSO4) = C(FeSO4) × M(FeSO4) × V¢(FeSO4) × 1000 = ... мг,
где M(FeSO4) = 152 г/моль;
V¢(FeSO4) = 0.1 л — объём задачи.
Примечание: C(FeSO4), m(FeSO4) рассчитывают с точностью до четырёх значащих цифр, затем округляют до трёх значащих.
После титрования студенты делают расчет С, m. Результат проверяют у преподавателя, оформляют работу и сдают на проверку. Приводят в порядок рабочее место и сдают дежурному студенту.
Контрольные вопросы и задачи
1. На титрование раствора щавелевой кислоты объемом 1 мл с
С (1/2Н2С2О4) = 0.01 моль/л израсходован раствор перманганата калия объемом 1.2 мл. Вычислите молярную концентрацию эквивалента раствора перманганата калия.
2. Для проведения реакции
KMnO4 + Н2О2 + H2SO4 ® MnSO4 + . . .
был взят раствор перманганата калия с концентрацией
0.01 моль/л. Чему равна молярная концентрация эквивалента вещества этого раствора?
3. Определите молярную концентрацию эквивалента перманганата калия в приготовленном титранте, если на титрование в кислой среде 0.063 г химически чистого дигидрата щавелевой кислоты пошло 10.25 мл раствора перманганата калия.
Занятие 17. Буферные системы и их свойства
Цель занятия:
Изучить механизм буферного действия буферных систем и приобрести практические навыки определения буферной ёмкости
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Выполнение демонстрационных и лабораторных работ, обсуждение их результатов, оформление научного отчета.
Вопросы, предлагаемые для обсуждения на занятии:
1. Кислотность общая, активная, потенциальная. Влияние активной кислотности на биологические процессы.
2. Буферные системы. Механизм буферного действия.
3. Уравнение Гендерсона-Гассельбаха для расчета С(Н+) и С(ОНˉ) двух основных типов буферных систем. Факторы, влияющие на рН раствора.
4. Буферная ёмкость, её расчет. Факторы, влияющие на буферную ёмкость.
5. Буферные системы крови. Механизм действия буферных систем крови. Понятие о кислотно-щелочном равновесии и щелочном резерве крови.
Лабораторная работа 1. Приготовление буферных смесей.
В семи пробирках готовят ацетатные буферные смеси из растворов уксусной кислоты и ее соли с молярной концентрацией эквивалента 0.1 моль/л, объёмы которых указаны в таблице.
| № пробирки | Состав буферной смеси, мл | рН смеси (расчетн) | Окраска после прибавления индикатора (метилового красного 4.2–6.3) | |
| СН3СООН 0.1 моль | СН3СООNa 0.1 моль/л | |||
| 0.5 0.2 | 9.5 9.8 |
В каждую пробирку прибавляют по 3 капли индикатора метилового красного, перемешивают и сравнивают окраску буферных смесей при хорошем освещении, на белом фоне, глядя сверху вниз сквозь раствор. Окраску растворов отмечают в таблице.
Затем рассчитывают С(Н+) и рН одного из буферных растворов (по указанию преподавателя), результат расчета записывают в таблицу. Значения С(Н+) и рН для остальных шести растворов получают у преподавателя. Чертят на миллиметровой бумаге буферную кривую, показывающую связь рН буферного раствора с объёмом одного из его компонентов. По оси ординат откладывают 10 единиц масштаба (1 мл CH3COONa = 1 см), принимая начало координат за 0. По оси абсцисс, принимая начало координат равным 3, откладывают область значений рН от 3 до 7 (единица рН = 2 см).
Пример расчета рН буферной смеси.
Рассчитать рН буферной смеси, состоящей из раствора СН3СООН объёмом 4.5 мл и молярной концентрацией эквивалента С(СН3СООН) = 0.1 моль/л и раствора СН3СООNa объемом 5.5 мл с молярной концентрацией эквивалента С(СН3СООNa) = 0.1 моль/л
С(Н+) = Кд ∙  = Кд ∙
= Кд ∙ 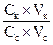
рН = -lg C(H+), откуда рН = -lg Кд + lg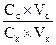
рН = -lg(1,8 ∙ 10-5) + lg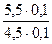 = -(lg1,8 – 5 ) + 0,0872 =
= -(lg1,8 – 5 ) + 0,0872 =
=4,8319 »4,83
Оформление работы:
Привести таблицу и расчеты С(Н+) и рН указанного буферного раствора.
Вклеить график «Буферная кривая».
Лабораторная работа 2. Определение буферной емкости буферного раствора.
Получают у преподавателя исследуемый раствор с известным значением рН0 (записать в тетради).
В две чистые колбы отмеряют пипеткой по 10 мл исследуемого раствора. В одну колбу добавляют 2 капли фенолфталеина и титруют рабочим раствором NaОН с молярой концентрацией эквивалента С(1NaOH) = 0.1 моль/л до появления слабо-розовой окраски, рН раствора при этом станет равным 8.4 (рНщ). В другую колбу добавляют 1 каплю метилоранжа и титруют рабочим раствором HCl = 0.1 моль/л до появления оранжево-розовой окраски, рН раствора при этом станет равным 3.4 (рНк).
Вычисляют буферную емкость раствора по отношению к кислоте (Вк) и щелочи (Вщ) и результат проверяют у преподавателя. Вк и Вщ рассчитывают с точностью до трех значащих цифр и округляют до двух.
Вщ = 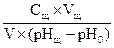 , моль/л; Вк =
, моль/л; Вк = 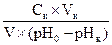 , моль/л
, моль/л
где Vщ, Vк – объемы (в мл) рабочего раствора щелочи или кислоты, затраченный на титрование V мл исследуемого буферного раствора;
Сщ, Ск – молярная концентрация эквивалента рабочего раствора щёлочи или кислоты.
Оформление работы:
Указать рН0 буферного раствора; Vщ, рНщ и индикатор; Vк, рНк и индикатор; привести расчет Вщ и Вк и вывод, указав, во сколько раз Вщ больше (или меньше), чем Вк.
Расчет общей, активной и потенциальной кислотности буферного раствора.
Для расчетов используют данные (рН0 и Vщ) для буферного раствора, полученного у преподавателя при определении буферной ёмкости.
Общая кислотность равна общей концентрации кислоты (С0), выраженной через молярную концентрацию эквивалента и определяемой титрованием рабочим раствором щелочи.
С0 = 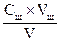 , моль/л;
, моль/л;
Активная кислотность равна концентрации ионов водорода С(Н+) и рассчитывается из значений рН0 буферного раствора.
Пример расчета С(Н+).
Вычислить С(Н+) раствора с рН0 = 5,6.
рН = –lg C(H+) = 5,6; lgC(H+) = –5,6; C(H+) = 10-5,6 = 2,51 ∙ 10-6 моль/л.
Потенциальная кислотностьравна концентрации недиссоциированных молекул кислоты, т.е. разности между общей и активной кислотностями.
Спот = Собщ – С(Н+)
Индикаторы
| Индикаторы | рК | Зона перехода |
| Метиловый оранжевый | 3,7 | 3,1–4,4 |
| Метиловый красный | 5,1 | 4,2–6,3 |
| п-нитрофенол | — | 5,2–7,0 |
| Фенолфталеин | 9,7 | 8,3–10,0 |
Контрольные вопросы и задачи
1. Вычислите рН ацетатного буферного раствора, составленного из 500 мл раствора соли с молярной концентрацией эквивалента
0.1 моль/л и 100 мл раствора кислоты с молярной концентрацией эквивалента 0.5 моль/л, если рК (СН3СООН) = 4.75.
2. Вычислите рН буферного раствора, составленного из равных объёмов растворов слабого основания и его соли одинаковой концентрации, если константа диссоциации основания равна 7.2 ∙ 10-6.
3. Какими процессами объясняется незначительное изменение значения рН буферного раствора при добавлении к нему растворов: а) сильной кислоты, б) щёлочи?
4. Рассчитайте в каких объёмах надо слить раствор слабой кислоты с молярной концентрацией эквивалента 0.6 моль/л и раствор её соли с молярной концентрацией эквивалента 0.2 моль/л, чтобы получить 200 мл ацетатного буферного раствора с рН = 5.2, если рК(СН3СООН) = 4.75.
5. Вычислить, на сколько единиц изменится рН аммиачного буферного раствора, содержащего по 0.1 моль эквивалента каждого из компонентов, если к 1 л его прибавить 0.05 моль эквивалента NаОН рК(NН 4ОН) = 4.74.
6. Рассчитайте, в каком соотношении должны находиться компоненты бикарбонатной буферной системы крови, если рК(Н2СО3) = 6.14.
7. К 20 мл фосфатного буферного раствора добавили 2 мл раствора НСl с молярной концентрацией эквивалента 0.02 моль/л. При этом рН изменился от 7.4 до 7.0. Рассчитайте буферную ёмкость буферной системы по кислоте.
8. Определите потенциальную кислотность буферного раствора с рН = 2.0, если на титрование 10 мл его потребовалось 8 мл раствора NаОН с молярной концентрацией эквивалента 0.1 моль/л.
9. Какие из ниже перечисленных систем обладают буферным действием: а) НСООН + НСООNа; б) NаОН + НNО3;
в) НNО3 + КNО3; г) НСl + НNО3; д) СН3СООН + СН3СООNа; е) NаНСО3 + НСl.
10. Какова биологическая роль буферных растворов в организме человека?
11. Какова роль гидрокарбонатного буферного раствора при поддержании постоянства рН крови, нарушаемого процессами дыхания?
Занятие 18. КОЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ рН
Цель занятия:
Изучить принципы колориметрического метода определения концентраций Н+-ионов в растворе.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Выполнение лабораторных работ, обсуждение их результатов, оформление отчёта.
Вопросы, предлагаемые для обсуждения на занятии:
1. Индикаторы. Механизм действия индикатора.
2. Точка перехода и зона перемены окраски индикатора. Универсальный индикатор.
3. Закон Ламберта–Бера. Принципы колориметрического метода определения концентрации растворов.
4. Буферный и безбуферный методы определения рН раствора.
Лабораторная работа 1. Колориметрический буферный метод определения рН.
а) Ориентировочное определение рН исследуемой жидкости по универсальному индикатору. Выбор буферной системы и индикаторов.
В чистую фарфоровую чешку наливают небольшое количество исследуемого раствора и с помощью универсальной индикаторной бумажки, пользуясь цветной шкалой, определяют приблизительное значение рН. Затем, пользуясь таблицей 1, выбирают индикатор и буферную смесь для приготовления растворов–эталонов и после этого занимают соответствующее рабочее место. Индикатор выбирают так, чтобы в зону перемены окраски его попадала ориентировочно найденная величина рН раствора.
Таблица 1. Значения рН буферных смесей – эталонов
| Индикатор (зона перехода) | Название буферных систем | Объем, мл | рН | |
| соли | кислоты | |||
| Тимоловый синий (1,1–2,8) | Цитратная (лимонная) | 1,0 2,5 | 4,0 2,5 | 2,3 2,9 |
| Метилоранж (3,0–4,4) | 3,5 4,0 4,5 | 1,5 1,0 0,5 | 3,3 3,5 3,9 | |
| Метиловый красный (4,2–6,3) | Ацетатная | 1,0 2,5 3,5 4,0 4,5 | 4,0 2,5 1,5 1,0 0,5 | 4,1 4,7 5,1 5,3 5,7 |
| Бромтимоловый синий (6,0–7,6) или нейтральрот (6,5 – 8,0) | Фосфатная | 1,0 2,5 3,5 4,0 4,5 | 4,0 2,5 1,5 1,0 0,5 | 6,2 6,8 7,2 7,4 7,7 |
б) Приготовление эталонов и определение рН исследуемой жидкости.
В чистых пронумерованных пробирках из бесцветного стекла и одинакового диаметра, пользуясь таблицей 1, готовят пять соответствующих буферных растворов-эталонов, затем в каждую из пробирок добавляют по 3 капли выбранного индикатора и растворы-эталоны перемешивают. В отдельную пробирку отмеривают пипеткой 5 мл исследуемого раствора, добавляют 3 капли того же индикатора и после перемешивания сравнивают окраску с окраской растворов–эталонов.
Примечание. При работе с цитратным буфером исследуемый раствор отмеривают в две пробирки и добавляют в них различные индикаторы (см. табл. 1), чтобы затем сравнивать окраску в каждой из них с соответствующими эталонами. При сравнивании окраски растворов следует пробирки поставить на белый лист бумаги и смотреть на растворы сверху. Значение рН исследуемой жидкости равно значению рН раствора–эталона, если их окраска совпадает.
Работу оформите в виде таблицы 2.
Таблица 2
| Ориентировочная величина рН по универсальному индикатору | Выбранный индикатор (указать зону перехода) | Буферные растворы – эталоны | Точная величина рН | |||
| Название и формулы компонентов | Состав (мл) | |||||
| соль | кис-лота | рН | ||||
Лабораторная работа 2. Определение рН раствора при помощи фотоколориметра КФК- 2МП.
а) Подготовка фотоколориметра КФК–2МП к работе в циклическом режиме.
Общий вид прибора:
 7 6 4
1 – колориметр
2 – микропроцессорная система
3 – фотоприемник
4 – ручка смены кювет
5 – крышка кюветного отделения
6 – светофильтры
7 – сигнальная лампочка
8 – сеть
9 – пуск 7 6 4
1 – колориметр
2 – микропроцессорная система
3 – фотоприемник
4 – ручка смены кювет
5 – крышка кюветного отделения
6 – светофильтры
7 – сигнальная лампочка
8 – сеть
9 – пуск
|
1. Присоедините прибор к сети, откройте крышку кюветного отделения (5) и на задней панели прибора слева включите тумблер «сеть» (8), при этом должна загореться сигнальная лампа (7) (на цифровом табло могут появиться различные символы).
2. Нажмите клавишу «пуск» - на цифровом табло появляется мигающая запятая и горит индикатор «р». Если запятая не появилась, повторно нажмите клавишу «пуск».
3. Выдержите колориметр во включенном состоянии в течение 15 мин. при открытой крышке кюветного отделения.
4. Ручкой (6) установите светофильтр 440 нм, а ручкой (3) — фотоприемник 315–540. Выдержите прибор с закрытой крышкой 5 мин. Если положение ручек (3) и (б) уже было установлено, как указано, операции п.4 можно опустить.
5. Измерение и учет темнового тока «n0». Крышку кюветного отделения закройте и через несколько секунд откройте опять. Через 5 с. нажмите клавишу «Ш (0)». На цифровом табло справа от мигающей запятой высвечивается значение n0, а слева – символ «0». Значение n0 необходимо для внутренней калибровки прибора, для расчетов вам оно не потребуется. Однако, если оно выходит за пределы промежутка от 0.001 до 1.000, следует пригласить преподавателя. После выполнения пунктов 1–5 прибор готов к работе. Крышку кюветного отделения следует оставить открытой.
б) Выбор индикатора и подготовка растворов для фотоэлектроколориметрирования.
1. В чистый фарфоровый тигелек пипеткой (на 10 мл) отмеряют 1 мл исследуемого раствора, добавляют 1 капли раствора универсального индикатора и, сравнивая получившуюся окраску раствора с цветной шкалой для универсального индикатора (приколота к полке), находят примерную величину рН раствора с точностью до 0.5 и записывают в протокол (таблицу).
2. Выбирают один из одноцветных индикаторов ряда нитрофенола (см. таблицу 3). Индикатор выбирают так, чтобы ориентировочно найденная по универсальному индикатору величина рН оказалась в пределах (примерно в средней части) зоны перехода окраски индикатора.
Таблица 3
| № п/п | Индикатор | Точка перехода окраски индикатора рК | Зона перехода окраски индикатора |
| I. | a-динитрофенол | 4,05 | 2,8–4,5 |
| 2. | γ-динитрофенол | 5,15 | 4,0–5,5 |
| 3. | п-нитрофенол | 6,18 | 5,2–7,0 |
| 4. | т-нитрофенол | 8,31 | 6,7–8,4 |
3. В пробирку № 1 с помощью бюретки отмерьте 6 мл раствора карбоната натрия, а в пробирку № 2 — 6 мл исследуемого раствора (пипеткой). В обе пробирки добавляют пипеткой (на 1 мл) точно по 1 мл раствора выбранного индикатора. Содержимое пробирок хорошо перемешивают стеклянными палочками.
4. Одну из кювет прибора (с меткой "В" на дне кюветы) заполните растворителем (дист. водой), другую (с меткой "И") — щелочным раствором выбранного индикатора (проба № 1), а третью (с меткой "З") — исследуемым раствором (проба № 2),предварительно сполоснув эти кюветы небольшим объемом соответствующих растворов.
Примечание: Жидкости в кюветы наливают до метки по нижнему мениску. Рабочие поверхности кювет тщательно протирают сухой чистой марлей. При работе с кюветами нельзя касаться рабочих поверхностей кювет.
б) Измерение оптической плотности растворов в циклическом режиме (с периодом 5 с).
В дальнее гнездо кюветного отделения установите кювету с растворителем (дист. водой), а в ближнее — кювету со щелочным раствором выбранного индикатора (толщина поглощающего слоя кювет 1 см).
Закройте крышку кюветного отделения. Ручку (4) установите в положение "1" (в световой пучок вводится кювета с растворителем).
Нажмите клавишу "Пуск" и "Ц/Р". Вы выбрали циклический режим работы, о чем свидетельствует загорание индикатора "Ц" справа от табло. Прибор готов к выполнению измерений в цикле с интервалом в 5 с.
Нажмите клавишу "К(1)". На цифровом табло слева от мигающей запятой высвечивается символ "1". Это означает, что прибор измерил оптическую плотность раствора сравнения (дистиллированная вода).
Поверните ручку (4) из положения "1" в положение "2" (в световой пучок введена кювета с раствором индикатора).
Нажмите клавишу "Д(5)". На цифровом табло слева от мигающей запятой появляется символ "5", а справа — с интервалом 5 с. высвечивается значение измеренной величины оптической плотности раствора индикатора Динд.. Данные измерений заносят в таблицу 4.
Откройте крышку кюветного отделения. Вместо кюветы с раствором индикатора поставьте кювету с исследуемым раствором (из пробирки № 2) и произведите замеры оптической плотности Диссл., повторив операции по пунктам раздела б). Пригласите преподавателя для проверки результатов работы .
Окончание работы.
1. Отключить тумблер "сеть" на задней панели прибора, выключить прибор из сети.
2. Вымыть кюветы дистиллированной водой и протереть марлей досуха (снаружи) рабочие поверхности кювет.
3. Вымыть пробирки, тигелек и пипетки. Рабочее.место привести в порядок.
Оформление отчета по работе:
1. По формуле α = 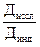 рассчитать степень диссоциации индикатора в исследуемом растворе
рассчитать степень диссоциации индикатора в исследуемом растворе
2. По уравнению рН = рК + lg 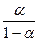
 рассчитайте рН исследуемого раствора, где рК — точка перехода окраски индикатора (см. табл. 3).
рассчитайте рН исследуемого раствора, где рК — точка перехода окраски индикатора (см. табл. 3).
3. Данные занесите в таблицу 4:
Таблица 4
| 1. | Ориентировочное значение рН раствора | |
| Выбранный индикатор (название, зона перезода окраски, рК) | ||
| 3. | Оптическая плотность раствора индикатора Динд | 1. 2. 3. 4. 5. ──── ср.= |
| 4. | Оптическая плотность исследуемого раствора Диссл | 1. 2. 3. 4. 5. ──── ср.= |
| 5. | Степень диссоциации индикатора в растворе α | |
| 6. | рН исследуемого раствора |
Контрольные вопросы и задачи
1. рН Исследуемого раствора, определенного по шкале универсального индикатора, находится в пределах 4—5. Какой индикатор и какую буферную смесь для приготовления растворов — эталонов будете использовать для определения точного значения рН раствора? (см. табл.3).
2. рН Исследуемого раствора, определенного по шкале универсального индикатора, равен 3. Для точного определения рН раствора выбрали индикатор тимоловый синий и цитратную буферную смесь для приготовления растворов—эталонов. Почему окраска раствора не совпала с окраской растворов—эталонов?
3. Почему в качестве стандартных растворов с известным рН удобно брать буферные смеси?
4. рН раствора равен 8.41. Чему равна концентрация ионов водорода?
5. Константа диссоциации слабого однокислотного основания МОН равна Косн = 1 ∙ 10-6. Вычислите концентрацию гидроксид-ионов в растворе этого основания, концентрация которого С = 0.01 моль/л.
6. Смешивают равные объемы растворов серной кислоты с концентрацией С(H2SO4) = 0.2 моль/л и КОН с концентрацией С(КОН) = 0.6 моль/л. Вычислите рН полученного раствора.
7. В растворе слабой одноосновной кислоты с молярной концентрацией С = 10-2 моль/л концентрация ионов водорода составляет 1∙10-3 моль/л. Определите константу диссоциации кислоты.
8. Рассчитать соотношение кислоты и соли в буферной смеси, если готовится раствор объемом 5 мл и его рН = 5
(рКдис. к-ты = 4.73, молярная концентрация эквивалента кислоты и соли 0.2 моль/л).
9. Концентрация гидроксид-ионов в растворе составляет
6∙10-4 моль/л. Определить, будет ли активен в этом растворе пепсин, если зона его активности рН = 1.5–2.5.
10. рН мочи в норме колеблется от 6 до 7. Определить интервал концентраций гидроксид-ионов в этих областях рН.
Занятие 19. физико-химия поверхностных явлений. адсорбция
Цель занятия:
Систематизировать теоретические знания процесса адсорбции на поверхности раздела твёрдое вещество — жидкость, жидкость — жидкость и приобрести практические навыки экспериментального определения величины адсорбции.
Содержание занятия:
1. Обсуждение теоретического материала.
2. Выполнение лабораторной работы «Адсорбция уксусной кислоты на активированном угле».
3. Оформление отчета.
Вопросы, предлагаемые для обсуждения на занятии:
1. Сущность процесса адсорбции. Понятие об адсорбенте, адсорбтиве, адсорбции, хемосорбции.
2. Адсорбция на поверхности жидкого адсорбента: уравнение Гиббса, анализ уравнения (понятие о поверхностно-активных веществах), правило Траубе. Образование поверхностных пленок и их биологическое значение.
3. Адсорбция на поверхности твердых адсорбенов: уравнение Ленгмюра. зависимость адсорбции от различных факторов особенности адсорбции из растворов.
4. Сущность избирательной адсорбции и ее биологическое значение. Правило Паннета–Фаянса.
5. Сущность и значение хроматографического анализа.
Лабораторная работа. Адсорбция уксусной кислоты на активированном угле.
В сухие четыре колбочки вносят по 1 г (полный тигелек) измельченного активированного угля (находится в эксикаторе) и наливают, начиная с раствора наименьшей концентрации, с помощью цилиндра по 25 мл растворов уксусной кислоты (концентрация указана на бутылочках). Колбочки закрывают листком бумаги, встряхивают и оставляют на 20 мин. Встряхивание время от времени повторяют. Растворы фильтруют через сухие фильтры в отдельные колбочки, отбрасывая первые
3–5 мл фильтрата (во избежание ошибок за счет адсорбции кислоты на фильтре). Из каждого фильтрата, начиная с наименьшей концентрации, в колбу для титрования отбирают пипеткой по 10 мл раствора и титруют раствором NaOH с молярной концентрацией эквивалента 0.1 моль/л в присутствии двух капель фенолфталеина до появления слабо розовой окраски. По объёму израсходованной на титрование щелочи определяют концентрацию кислоты после адсорбции. Зная количество кислоты в пробе до и после адсорции, рассчитывают количество кислоты Г, адсорбированной 1 г угля (Г выражают в миллимолях на 1 г адсорбента).
Количество кислоты в каждой пробе до и после адсорбции (no и n) и равновесную концентрацию раствора кислоты (С) рассчитывают по формуле:
1) no(СН3СООН) = Со(СН3СООН) ∙ Vо(СН3СООН) ∙ 103 =
= Со(СН3СООН) ∙ 25 (ммоль);
где Со(СН3СООН) — начальная концентрация растворов кислоты, моль/л,
Vо(СН3СООН) — объём раствора кислоты (0.025 л);
2) n (СН3СООН) = 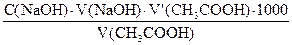 =
=
= V(NаОН) ∙ 0.25 (ммоль);
где С(NаОН) — концентрация раствора щелочи (0.1 моль/л);
V(NаОН) — объём раствора щелочи, израсходованной на титрование кислоты, мл;
V(СН3СООН) — объём раствора кислоты, взятой для адсорбции (0.025 л);
V(СН3СООН) — объём раствора кислоты, взятой для титрования (10 мл).
3) С(СН3СООН) = 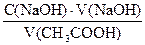 =
= 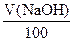 , моль/л;
, моль/л;
где С(NаОН) — концентрация раствора щёлочи (0.1 моль/л);
V(NаОН) — объём раствора щёлочи, израсходованной на титрование,мл;
V(СН3СООН) – объём раствора кислоты, взятой для титрования (10 мл).
Полученные результаты записывают в таблицу.
Приведите расчеты величин no, n, С, Г. Результаты работы и расчеты сведите в следующую таблицу:
| Начальная конц-ия кислоты Со, моль/л | Объём NaOH, израсх. на титрование 10 мл к-ты после адсорб. V(NаОН), мл | Кол-во кислоты в пробе, моль/л | Величина адсорбции Г=no–n, ммоль/г | Равновесная концентрация кислоты
C=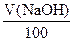 ,
моль/л ,
моль/л
| |
| до адсорбции nо | после адсорбции n | ||||
Начертите на миллиметровой бумаге изотерму адсорбции — график зависимости Г = f (С) в масштабе:
Г — ось ординат: 5 см = 1.00 ммоль/г;
С — ось абсцисс: 2 см = 0.10 моль/л.
При построении графика числовые значения Г и С округлите до сотых долей единицы.
Сделайте вывод о характере зависимости величины адсорбции Г от величины равновесной концентрации С.
Контрольные вопросы и задачи
1. Как изменяется степень заполнения адсорбента адсорбтивом с повышением температуры при химической адсорбции?
2. Приведите эмпирические уравнения адсорбции Фрейндлиха.
3. В чем сущность ионообменной адсорбции? Какие вещества называются катионитами и анионитами.
4. Какие вещества называются поверхностно-активными и инактивными?
5. Почему гидрофобные вещества лучше адсорбируют поверхностно-активные вещества из водных растворов, а гидрофильные — из углеводородных. В чем заключаются особенности адсорбции твердыми адсорбентами различных веществ из растворов?
6. Во сколько раз поверхностная активность уксусной кислоты больше или меньше поверхностной активности масляной кислоты при условии равенства концентраций из разбавленных водных растворов? (Правило Дюкло-Траубе).
7. В раствор объемом 60 мл некоторого вещества с концентрацией 0.440 моль/л поместили твёрдый адсорбент массой 3 г. После достижения адсорбционного равновесия концентрация вещества снизилась до 0.350 моль/л. Вычислите величину адсорбции (a = 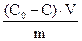 ).
).
Занятие 20. коллоидные растворы и их свойства. получение и очистка золей
Цель занятия:
Научиться получать коллоидные растворы, эмульсии; ознакомиться с методом диализа; научиться определять заряд коллоидной частицы методом электрофореза.
Содержание занятия:
1. Обсуждение теоретических вопросов и решение задач.
2. Выполнение лабораторных работ.
Вопросы, предлагаемые для обсуждения на занятии:
1. Биологическое значение дисперсных систем.
2. Классификация дисперсных систем по размеру частиц, агрегатному состоянию фаз. Понятие о лиофильных и лиофобных системах.
3. Свойства дисперсных систем.
4. Условия, методы получения и очистки коллоидных растворов.
5. Строение мицеллы. Понятие о межфазном (электротермодинамическом) и электрокинетическом потенциалах.
6. Электроосмос. Электрофорез.
7. Способы определения заряда коллоидных частиц.
Лабораторная работа 1. Получение золя берлинской лазури методом диспергирования (пептизации).
В пробирку к 5 мл 2% раствора FeCl3 приливают 1 мл насыщенного раствора К4[Fe(CN)6]. Осадок фильтруют через бумажный фильтр. Через некоторое время воронку с фильтром и осадком переносят в чистую пробирку и к осадку на фильтре добавляют раствор щавелевой кислоты (С = 0.05 моль/л).
Наблюдают изменение цвета фильтрата от жёлто-зелёного до синего.
При оформлении работы составьте уравнение реакции получения берлинской лазури, уравнение диссоциации пептизатора-щавелевой кислоты, напишите формулу мицеллы золя берлинской лазури, указажите его окраску.
Лабораторная работа 2. Получение золя гексацианоферрата(II) меди методом конденсации (реакция двойного обмена).
В колбу отмеряют цилиндром 20 мл 0,1% раствора K4[Fe(CN)6] и добавляют из бюретки 1 мл 1% раствора CuSO4. Получают золь, окрашенный в коричнево-красный цвет.
При оформлении работы составить уравнение реакции получения гексацианоферрата(II) меди, указать окраску золя и составить формулу мицеллы при избытке CuSO4 и при избытке K4[Fe(CN)6].
Лабораторная работа 3. Получение золя гидроксида железа (III) методом конденсации (реакция гидролиза).
В колбу с надписью «Fe(OH)3» цилиндром отмеряют
50 мл дистиллированной воды, нагревают ее до кипения и в кипящую воду быстро, но по частям, приливают 10 мл 2% раствора FeCl3. Золь приобретает красно-бурый цвет. При оформлении работы составить уравнения реакций гидролиза FeCl3,формулу мицеллы и указать окраску золя.
Лабораторная работа 4. Очистка коллоидных растворов при помощи диализа.
Диализу подвергают золь гидроксида железа (III), полученный в предыдущей работе. Работу ставят, руководствуясь приведенной ниже схемой. Через 10 мин часть воды, омывающей пергамент, сливают через резиновую трубочку в чистую пробирку. По окраске этой воды делают вывод, проходят ли коллоидные частицы через мембрану, а затем в этой же пробе проверяют наличие Clˉ-анионов, перешедших в воду из золя (реакция с AgNO3).
При оформлении работы привести подробный рисунок диализатора, указать окраску воды, результат пробы на Clˉ-ион и объяснить их.
Лабораторная работа 5. Получение золя канифоли методом конденсации (метод замены растворителя).
Раствор канифоли и пипетки для него стоят на отдельном столе. В колбу отмеряют цилиндром 20 мл дистиллированной воды, нагревают ее до появления пара, приливают 1 мл 1%-го спиртового раствора канифоли и наблюдают образование опалесцирующего коллоидного раствора.
Лабораторная работа 6. Получение разбавленной эмульсии.
В градуированную пробирку (пипеткой не пользоваться!) наливают 6 мл дистиллированной воды и 2 мл 1%-го спиртового раствора касторового масла, встряхивают и наблюдают образование эмульсии. При оформлении работы привести методику получения эмульсии, указать тип эмульсии (масло/вода или вода/масло), дисперсную фазу и дисперсную среду.
Лабораторная работа 7. Определение знака заряда коллоидных частиц методом электрофореза.
U-образную трубку при помощи пипетки заполняют на 3/4 коллоидным раствором берлинской лазури. В каждое отверстие трубки добавляют по две капли глицерина и раствор перемешивают легким покачиванием. В оба колена на раствор из капельной пипетки, прижав ее к стеклу, наливают раствор KCl высотой 0.7–1 см. Затем в отверстия трубок осторожно опускают электроды так, чтобы они соприкасались только с электролитом. Электроды соединены с источником постоянного тока, цепь замыкают при помощи переключателя. Через
7–10 мин, отключив прибор, отмечают результат работы — усиление (сгущение) окраски у одного из электродов. Зная заряд электрода, делают вывод о знаке заряда коллоидных частиц. При оформлении работы приведите подробный рисунок прибора, время электрофореза, результат опыта и вывод о знаке заряда коллоидных частиц.
Контрольные вопросы и задачи
1. По каким свойствам можно отличить коллоидный раствор от истинного и от грубодисперсной системы.
2. Можно ли реакцией обмена получить устойчивый золь, если реагенты взять в строго эквивалентных количествах? Мотивируйте ответ.
3. При электрофорезе частицы золя хлорида железа, полученного смешением равных объемов раствора нитрата серебра и хлорида калия, перемещаются к отрицательному полюсу. Одинаковы ли были исходные концентрации электролитов? Составьте формулу мицеллы золя.
4. Золь хлорида серебра получен при добавлении 20 мл раствора хлорида натрия (С = 0.01 моль/л) к 10 мл раствора нитрата серебра (С = 0.09 моль/л). Составить формулу мицеллы золя и указать направление движения гранул при электрофорезе.
5. В результате взаимодействия избытка хлорида бария с серной кислотой был получен золь. Приведите строение мицеллы, укажите ее составные части.
6. Какими методами можно определить заряд коллоидной частицы (гранулы)?
7. Какой объем 0.005 М раствора нитрата серебра нужно добавить к 20 мл 0.015 М раствора йодида калия, чтобы получить золь, частицы которого заряжены положительно. Приведите строение мицеллы полученного золя.
Занятие 21. устойчивость и коагуляция золей
Цель занятия:
Научиться оценивать коагулирующую способность и величину порога коагуляции электролита.
Научиться оценивать защитное действие гидрофильных полимеров.
Содержание занятия:
1. Обсуждение теоретических вопросов и решение задач.
2. Выполнение лабораторных работ.
Вопросы, предлагаемые для обсуждения на занятии:
1. Кинетическая и агрегативная устойчивость коллоидных растворов. Факторы, обуславливающие устойчивость коллоидных растворов.
2. Коагуляция. Факторы, влияющие на скорость коагуляции. Кинетика коагуляции. Скрытая и явная коагуляция.
3. Механизм коагулирующего действия электролитов. Правило Шульце-Гарди.
4. Сущность явления коллоидной защиты.
5. Медико-биологическое значение явлений коагуляции, пептизации и коллоидной защиты.
Лабораторная работа 1. Определение знака заряда золей гидроксида железа (III) и берлинской лазури методом капиллярного подъёма.
По капиллярам фильтровальной бумаги, слегка погружённой в коллоидный раствор, будут подниматься вверх отрицательно заряженные частицы, т.к. они не адсорбируются на бумаге, а положительно заряженные частицы подниматься не будут в результате их адсорбции.
Таким образом, по разности высоты подъёма частиц по бумаге можно сделать вывод о знаке заряда золя (или о характере красителя).
Выполнение работы. Узкую полоску фильтровальной бумаги подвешивают на стеклянной палочке, положенной на край стакана так, чтобы только конец полоски был погружён в раствор (при этом бумага не должна касаться стенок стакана). Через 15 мин. измеряют высоту подъема золей.
Данные занести в таблицу:
| Название золя | Высота подъёма, см | Наличие или отсутствие адсорбции | Вывод о знаке заряда коллоидных частиц |
Лабораторная работа 2. Взаимная коагуляция золей.
В 5 пробирках смешивают при энергичном встряхивании золи гидроксида железа (III) и берлинской лазури в объёмах, указанных в таблице. Через 1 час по цвету жидкости над осадком судят о степени коагуляции: полная — жидкость бесцветна, неполная — жидкость окрашена в цвет одного из золей. Данные занести в таблицу:
| № пробирки | Знак заряда гранул | |||||
| Объём золя гидроксида железа (III), мл Объём золя берлинской лазури, мл Цвет жидкости над осадком Степень коагуляции - полная, неполная | 4,8 0,2 | 4,0 1,0 | 2,5 2,5 | 1,0 4,0 | 0,2 4,8 |
Лабораторная работа 3. Зависимость порога коагуляции от заряда иона, вызывающего коагуляцию.
Порогом коагуляции называется наименьшая концентрация электролита в ммолях на 1 л золя, при которой через час после прибавления электролита начинается явная коагуляция (например, помутнение).
В работе определяют порог коагуляции золя гидроксида железа (III), знак заряда которого известен по результатам работы № 1.
Для выполнения работы вначале готовят 3 ряда растворов электролитов с убывающей концентрацией: КСl (6 пробирок), К2SO4(6 пробирок) и К3[Fe(CN)6] (б пробирок).
1 ряд пробирок готовят следующим образом. В первую пробирку пипеткой отмеряют 1 мл раствора KCl (С = 1 моль/л), в следующие 5 пробирок наливают из бюретки по 1 мл дистиллированной воды. Затем во вторую пробирку пипеткой добавляют I мл раствора KCl, содержимое пробирки хорошо перемешивают, опустив пипетку до дна пробирки, продувают воздух, и I мл этого раствора переносят пипеткой в третью пробирку. Раствор в третьей пробирке перемешивают, затем 1 мл его переносят в четвёртую пробирку и т.д. Из последней пробирки отбирают 1 мл раствора и выливают его.
Таким же образом готовят ряды пробирок с раствором К2SO4 (С = 0.01 моль/л) и раствором К3[Fе(СN)6]
(С = 0.001 моль/л). Затем в каждую пробирку добавляют из бюретки по 1 мл золя гидроксида железа (III) и перемешивают содержимое пробирок.
Через 20 мин результат работы вносят в таблицу, отмечая знаком "+" наличие коагуляции (помутнение раствора) и знаком "–" отсутствие коагуляции.
| Ф-ла мицеллы золя | Электролит и его исходная концентрация | Ион эл-лита, вызыв. коагуляцию | Налич./отсут.коагул; конц-ия эл-лита, моль/л | Порог коаг., ммоль/л | Коаг. способн. эл-лита | |||||
| КCl, С= 1 моль/л | ||||||||||
| К2SO4, С= 0,01 моль/л | ||||||||||
| К3[Fе(СN)6] С= 0,001ммоль/л |
Концентрацию каждого электролита в 1 пробирке рассчитывают по формуле:
Сэл = V ∙ С ∙ 500, ммоль/л,
где V = 1 мл — объём раствора электролита в пробирке;
С — молярная концентрация раствора электролита, моль/л;
500 — коэффициент для пересчета числа ммоль электролита на 1 л золя.
Концентрация электролита в каждой последующей пробирке уменьшается вдвое по сравнению с предыдущей, и рассчитывать её следует для тех пробирок, где произошла коагуляция.
При оформлении работы привести таблицу, расчёт концентраций электролитов KCl, K2SO4, K3[Fе(СN)6] в 1 пробирке, сделать вывод о зависимости величины порога коагуляции и коагулирующей способности электролитов от заряда иона, вызывающего коагуляцию.
Лабораторная работа 4. Защитное действие гидрофильных высокомолекулярных соединений (определение "железного числа" желатина и крахмала).
Железное число выражается минимальным числом мг сухого гидрофильного полимера, которое препятствует коагуляции 10 мл золя гидроксида желеаа (III) при добавлении 1 мл полунасыщенного раствора КСl.
Железное число рассчитывается по формуле: Ж.Ч. = А∙10 (мг), где А — масса желатина (в мг) или крахмала в последней из пробирок, где произошла защита.
Берут два ряда по семь пробирок в каждом. В первую пробирку первого ряда наливают пипеткой 2 мл свежеприготовленного 1%-го раствора желатина. В остальные пробирки вносят из бюретки по 1 мл дистиллированной воды и, хорошо перемешивая, последовательно переносят по 1 мл раствора из первой пробирки во вторую, из второй в третью и т.д. Получают ряд растворов с убывающей концентрацией желатина. 1 мл раствора из последней пробирки выбрасывают.
Из 5%-го раствора крахмала готовят такой же ряд. В каждую пробирку того и другого ряда добавляют по 1 мл золя гидроксида железа (III), по 1 мл полунасыщенного раствора KCl, наблюдают, в каких пробирках произошла зашита, и результат вносят в таблицу, отмечая знаком "+" наличие защиты и знаком "–" — отсутствие защиты (коагуляция).
При оформлении работы привести таблицу, расчёт массы желатина и крахмала (мг) в 1 пробирке, условно считая плотность взятых растворов желатина и крахмала равной единице, расчёт "железного числа" для желатина и крахмала, сделать обоснованный вывод: какой из этих гидрофильных полимеров обладает большим защитным действием по отношению к золю Fe(OH)3.
| Высокомолекулярное соединение | Наличие или отсутствие защиты, масса полимера в пробирке, мг | ||||||
Контрольные вопросы и задачи
1. Золь хлорида серебра получен путем смешивания равных объёмов 0,01 М раствора хлорида калия и 0,015 М раствора нитрата серебра. Какой из электролитов K3[Fe(CN)6], K4[Fe(CN)6] или MnSO4 обладает наибольшей коагулирующей способностью. Мотивируйте ответ.
2. Пороги коагуляции электролитов (ммоль/л) для золя сульфида никеля (II) составляют с (NaCl) = 50; с (Na2SO4) = 49; с (СаСl) = 0.5. Какой заряд имеет гранула? При избытке какого электролита можно получить такой золь? Приведите уравнение реакции.
3. Напишите формулу мицеллы золя золота, стабилизированного K3AuO3. Какой из электролитов: NaCl, BaCl2, FeCl3 — имеет наибольший, а какой — наименьший пороги коагуляции по отношению к данному золю.
4. В три колбы налито по 100 мл золя Fe(OH)3. Для явной коагуляции золя потребовалось добавить:
· в первую колбу 10.5 мл 1 М раствора хлорида калия,
· во вторую — 62.5 мл 0,01 М раствора сульфата натрия,
· в третью — 37.0 мл 0,001 М раствора фосфата натрия.
Вычислите пороги коагуляции и определите знак заряда коллоидных частиц.
5. Серебряное число яичного альбумина равно 1.5 мг. Будет ли наблюдаться коллоидная защита, если к 4 мл золя добавить раствор альбумина, содержащий 0.75 мг сухого полимера?
Занятие 22. растворы высокомолекулярных соединений и их свойства
Цель занятия:
Изучить физико-химические свойства высокомолекулярных соединений и свойства их растворов. Научиться использовать полученные данные для понимания биохимической роли высокомолекулярных соединений.
Содержание занятия:
1. Обсуждение теоретических вопросов и решение задач.
2. Выполнение лабораторных работ, обсуждение их результатов, оформление отчёта.
Вопросы, предлагаемые для обсуждения на занятии:
1. Что такое ВМС? Что представляют собой растворы ВМС?
2. Какие факторы определяют устойчивость растворов гидрофильных высокомолекулярных соединений? Какие системы называют гидрофильными (лиофильными)?
3. Схема образования биполярного иона белковой молекулы.
4. Что называют изоэлектрическим состоянием и изоэлектрической точкой белка (рНиэт)? Каковы свойства белка в изоэлектрической точке – устойчивость, способность к электрофорезу, желатинированию, набуханию?
5. Что называют гелем? В чем сущность процессов желатинирования и набухания?
6. Как влияет рН среды на процессы набухания и желатинирования?
7. Биологическое значение процессов набухания и желатинирования?
8. Что называют адсорбцией, адсорбентом, адсорбтивом? В чем сущность избирательной адсорбции? Частицы какого заряда адсорбирует белок в зависимости от рН среды?
Лабораторная работа
Порядок выполнения и оформления работ:
1. Ставят (без оформления) 1-ю часть опыта 2 (получение геля желатина из 6% горячего раствора).
2. Выполняют и оформляют опыт 1. В это же время выполняют 2-ю часть опыта 2.
3. Ставят (без оформления) опыт 4 на отдельных рабочих местах.
4. Выполняют и оформляют опыт 3.
5. Заканчивают и оформляют опыт 2.
6. Заканчивают и оформляют опыт 4.
Опыт 1. Определение изоэлектрической точки белка казеина
В пяти пробирках готовят ацетатные буферные смеси (по таблице), затем в каждую прибавляют по 1 мл раствора казеина и перемешивают. Через 10–15 мин. отмечают, в какой из пробирок наблюдается наибольшее помутнение, и результат вносят, в таблицу:
| № пробирки | |||||
| СН3СООН (С = 0,1 моль/л), мл СН3СООNa (C = 0,1 моль/л), моль/л Золь казеина, мл рН смеси Степень мутности (отметить знаком «+» наибольшее помутнение | — 3.8 | 4.4 | 4.7 | 5.1 | 5.7 |
рНиэт равен рН буферной смеси, в которой отмечается наибольшее помутнение (наибольшая степень коагуляции), т. к., белок при этом наименее устойчив в растворе (общий заряд частицы равен нулю, степень гидратации наименьшая). Если наибольшее помутнение окажется одинаковым в двух соседних буферных смесях, то рНиэт определяют как среднее арифметическое из рН этих двух растворов.
Оформление опыта. Привести таблицу, результат работы (рНиэт казеина) и объяснить его.
Опыт 2. Местное набухание геля желатина под влиянием кислоты
В баночку с плоским дном на 1/3 наливают горячий 6%-й раствор желатина, ставят на снег и в результате застудневания получают гель желатина. Затем, поверхность геля в 4–5 точках аккуратно укалывают капилляром, каждый раз смачивая его в концентрированной СН3СООН (кислота не должна растекаться по поверхности геля) и наливают на гель дистиллированную воду. Через час воду сливают и отмечают набухание желатина в виде бугорков в местах укола.
Оформление опыта. 1) Привести краткое описание и результат работы. 2) Привести объяснение, почему при введении концентрированной кислоты в гель желатина увеличивается степень набухания его в воде.
По окончании занятия гель желатина из баночки выбрасывают в специальную чашку.
В воде и водных растворах фильтровальная бумага отдает в раствор катионы водорода, при этом стенки капилляров бумаги приобретают отрицательный… Примечание. Диссоциацию красителей в растворе схематично можно представить в… краситель окрашенный ионКонтрольные вопросы и задачи
1. Приведите примеры гидрофильных группировок.
2. Как изменяется заряд белковой молекулы при изменении рН среды?
3. Частицы какого заряда будет адсорбировать белок в зависимости от рН среды?
4. Какова формула макромолекулы белка, находящегося в изоэлектрическом состоянии?
5. К какому электроду будут передвигаться частицы белка при электрофорезе, если рНиэт белка равен 4, а рН буферного раствора, в который помещен белок равен 6.
6. Какой из красителей кислый или основной будет адсорбироваться макромолекулой белка в растворе с рН равным 8, если рНиэт белка равен 5,6?
Термодинамические константы некоторых веществ
Список рекомендованной литературы
Основная литература 1. Ершов Ю.А. Общая химия/ Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З.… 2. Глинка Н.А. Общая химия/ Н.Л. Глинка. Интеграл-пресс, 2000.Айвазова Елена Анатольевна
Суханова Галина Прокопьевна
Журавлёва Екатерина Александровна
Антонова Татьяна Георгиевна
Лоскутова Александра Владимировна
Титова Ольга Ефаловна
Щеголев Александр Евгеньевич
– Конец работы –
Используемые теги: методические, рекомендации, социальному, развитию0.052
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Методические рекомендации и социальному развитию
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов