Условия образования химической связи


 Условия образования химической связи:
Условия образования химической связи:

Природа сил химической связи – электрическая.
Квантовая механика позволяет объяснить и описать
Образование всех типов химических связей.
Существует два основных квантово-механических приближенных методов описания ковалентной связи: метод валентных связей (ВС) и метод молекулярных орбиталей (МО ).
 | |||||
| |||||
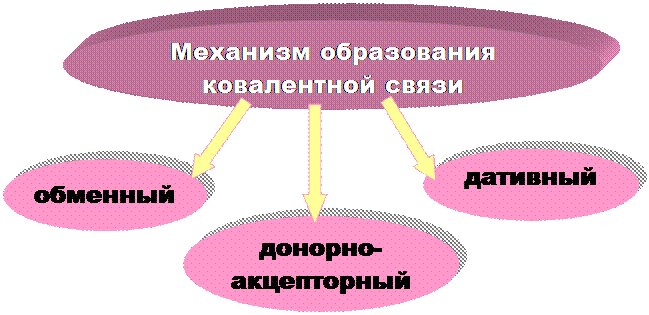 |
Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону.
Донорно-акцепторный механизм - образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
ПРИМЕР: образование иона аммония NН4+ (NН3 + Н+ ® NН4+)

Дативные связи – образуются, когда АО одного атома, могут выступать одновременно в роли и донора и акцептора неподеленных пар электронов.
 |
ПРИМЕР: образование молекулы Cl2
Следствие - энергия связи в молекуле Сl2 ( 243 кДж/моль) выше, чем в молекуле F2 (159 кДж/моль), несмотря на большую длину связи.
…Связь – связь, образуемая при наложении друг на друга и перекрывании d-облаков в 4-х областях
Перекрывание АО разных типов при образовании
s - связей:

Образование тройной связи в молекуле азота N2:
Одна s- связь и две p - связи.
Направления перекрывания атомных орбиталей при образовании d -связей:ЭО(I) = 2,5 ЭО(H) = 2,1
Þ связывающая электронная пара смещена в сторону I: Þ эффективный отрицательный заряд (δ-) у атома I,
эффективный положительный заряд (δ+)у атома Н
Þ возникает электрический диполь.
|
д л и н а диполяlД :
 |
электрический момент диполя связи mсв
(количественная мера полярности связи):
|
mсв некоторых связей:
 |
| молекула | DЭО | mсв×10-30,Кл×м | Вывод |
| Н – Сl | 0,90 | 1,03 | Чем больше DЭО, тем больше mсв и, следовательно, связь более полярная |
| Н – Br | 0,74 | 0,78 | |
| H - I | 0,40 | 0,38 |
mсв ~ 0 - 10 Д (1 Дебай = 3,33.10-30 Кл.м.)
Структура и полярность многоатомных молекул
В многоатомных молекулах имеется несколько связей, возникает электрический момент диполя молекулы.
|
Электрический момент
диполя молекулы ( mм ) Þ
Полярность молекулы зависит от ее геометрической структуры. Молекула неполярна, если mм = S mсв =0 ,
Молекула полярна, если mм = S mсв ¹0 .
примеры:
8 Образование молекулы Н2S:

Þ угловая структура ( Ð920)
ЭО(Н) = 2,1 и ЭО(S) = 2,5 Þ связь полярная, mсв ¹ 0
Структура молекулы Н2S – угловая, и векторная сумма дипольных моментов связи mсв имеет вид:

Mм = Smсв ¹ 0 Þ молекула в целом полярная.
8Образование молекулы SbH3 :
 Sb…5s25p3
Sb…5s25p3
H1s H1s H1s
ЭОSb =1,9 , ЭОH = 2,1 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0 Структура молекулы – пирамидальная mм=Smсв…Если у атома в образовании химических связей участвуют разные по типу АО (s-, p-, d- или f-АО), то химические связи образуются с участием не «чистых», а «смешанных», или гибридных орбиталей.
Форма гибридной орбитали:

 Схема sр -гибридизации
Схема sр -гибридизации 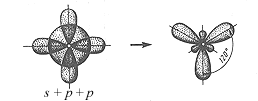 Схема sр2-гибридизации
Схема sр2-гибридизации
 Схема sр3-гибридизации
Схема sр3-гибридизации
| Орбитали, участвующие в гибридизации | Тип гибридизации | Структура молекулы | Валентный угол |
| S + p | sp |  Линейная
Линейная
| 180о |
| S + p + p | sp2 | 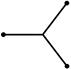 плоский треугольник
плоский треугольник
| 120о |
| S + p + p + p | sp3 |  тетраэдр
тетраэдр
| 109,3о |
Рассмотрим примеры:
8Молекула ВеСl2
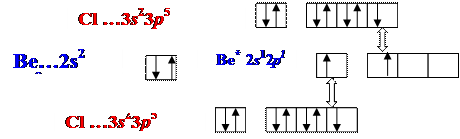
■ sp-гибридизация АО Ве , 2 s - связи, Ð180о
■ пространственная структура Þ линейная.

Cl Be Cl
■ ЭОCl =3,0 , ЭОBe = 1,5 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0
THORN; Cl ¬ Be ® Cl
Mмол = Smсв = 0 Þ молекула в целом неполярная.
8Молекула ВН3
 |
В… 2s22p1 Þ В* …2s12p2 H …1s1
H 1s1 H 1s1 H 1s1
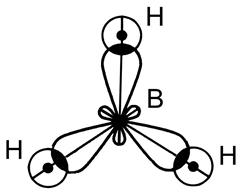
■ sp2–гибридизация АО бора В
■ 3 s - связи, Ð 120° ,
■ ЭОB =2,0 , ЭОH = 2,1 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0
■ структура молекулы - плоский треугольник.
■ mмол = Smсв = 0 Þ молекула ВН3 - неполярная.
8Молекула SnCl4
Sn …5s25p2 Þ Sn* …5s15p3 Cl … 3s23p5
Sn* …5s15p 3
3
Cl 3s23p5 Cl 3s23p5 Cl 3s23p5
■ sp3–гибридизация АО Sn (s-АО и 3 р-АО)
■ структура молекулы Þ тетраэдр, 4 s - связи
Ð 109,30

■ ЭОCl =3,0 , ЭОSn = 1,8 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0.
■ mмол = Smсв = 0 Þ молекула SnCl4 - неполярная.

Молекулы NН3 и Н2О
N…2s22p3 O…2s22p4В гибридизации могут участвовать вакантные АО, АО с неподеленными парами электронов и АО с неспаренными электронами.
●Неподеленные электронные пары (НП) влияют на величину валентных углов Þ силы отталкивания между ними больше, чем между относительно закрепленными электронными парами образующими связь (связывающая электронная пара - СП).
●Уменьшение силы отталкивания электронных пар:
НП-НП > НП-СП > СП-СП
Пространственная структура молекул:Ионные кристаллы - гигантские полимерные молекулы.
▼ Понятие валентности к ионной связи неприменимо.
▼ Ионные связи - прочные.
▼ Твердые кристаллические вещества ионного типа - тугоплавкие, высокопрочные, но хрупкие, растворяются в полярных растворителях (в Н2О).
