рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- Виды связи
Реферат Курсовая Конспект
Виды связи
Виды связи - раздел Энергетика, Виды связи Химическая Связь – Это Совокупность Сил, Действующих Между Атомами Или...
Химическая связь – это совокупность сил, действующих между атомами или группой атомов. В результате действия этих сил образуются молекулы. При обсуждении химической связи обычно пользуются термином валентность. Данное понятие означает меру способности элемента к образованию химической связи. Химическая связь осуществляется в основном за счет так называемых валентных электронов. Описать химическую связь – значит, выяснить, как распределяется электронная плотность в молекуле.
Рассмотрим основные виды связей, за счет которых происходит объединение атомов в молекулы.
Ковалентная связь характеризуется образованием устойчивых электронных пар из электронов, ранее принадлежавших отдельным атомов, входящих в состав молекул. Электроны при движении по молекулярной орбите чаще всего находятся между ядрами, где создается как бы избыток отрицательного заряда, что способствует сближению атомов (рис 1.1).
 Если двухатомная молекула состоит из атомов одного элемента (H2, N2, Cl2 ), то электронная пара в одинаковой степени принадлежит обоим атомам. В подобном случае молекулу и существующую в ней ковалентную связь называют неполярными или нейтральными. В неполярных молекулах центры положительных или отрицательных зарядов совпадают.
Если двухатомная молекула состоит из атомов одного элемента (H2, N2, Cl2 ), то электронная пара в одинаковой степени принадлежит обоим атомам. В подобном случае молекулу и существующую в ней ковалентную связь называют неполярными или нейтральными. В неполярных молекулах центры положительных или отрицательных зарядов совпадают.
 Если же двухатомная молекула состоит из атомов различных элементов, то электронная пара может быть смещена к одному из атомов. В таких случаях ковалентную связь называют полярной, а молекулы с полярной связью, у которых центры положительных и отрицательных зарядов не совпадают, - полярными или дипольными. Дипольная молекула характеризуется величиной электрического дипольного момента m, измеряемого в Кл×м
Если же двухатомная молекула состоит из атомов различных элементов, то электронная пара может быть смещена к одному из атомов. В таких случаях ковалентную связь называют полярной, а молекулы с полярной связью, у которых центры положительных и отрицательных зарядов не совпадают, - полярными или дипольными. Дипольная молекула характеризуется величиной электрического дипольного момента m, измеряемого в Кл×м
m = ql (1.1)
где q - абсолютное значение заряда; l - расстояние между центрами положительного и отрицательного зарядов.
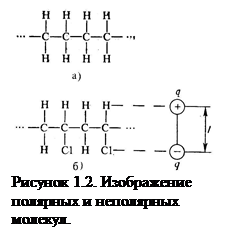
Многоатомные молекулы также могут быть неполярными – при симметричном расположении зарядов или полярными – при асимметричном. Примеры нейтральных и дипольных молекул приведены на рис 1.2. В качестве примера веществ с полярной ковалентной связью можно привести молекулы типа H2O, H2S, HCl, N2O5 и всех кислот.
Вещества, образованные молекулами с ковалентной связью, характеризуются высокой твердостью. Они тугоплавки и химически инертны, что объясняется прочностью ковалентной связи и ее направленностью.
Донорно – акцепторная связь является разновидностью ковалентной связи. Возникает она между атомами элементов, один из которых способен отдать электроны (донор), а другой способен принять эти электроны (акцептор). Примером таких соединений могут служить соединения, образованные элементами третьей и пятой групп периодической системы Д. И. Менделеева, например арсенид галлия GaAs.
 Ионная связь вызывается силами электростатического притяжения между положительными и отрицательными ионами. В качестве примеров ионных соединений можно привести элементы, очень отличающиеся по свойствам, например, типичные металлы и типичные неметаллы. На рис. 1.3 показана ионная связь на примере ионных кристаллов хлористого цезия CsCl и титаната бария BaTiO3. Молекулы вещества с ионной связью полярны.
Ионная связь вызывается силами электростатического притяжения между положительными и отрицательными ионами. В качестве примеров ионных соединений можно привести элементы, очень отличающиеся по свойствам, например, типичные металлы и типичные неметаллы. На рис. 1.3 показана ионная связь на примере ионных кристаллов хлористого цезия CsCl и титаната бария BaTiO3. Молекулы вещества с ионной связью полярны.
К веществам с ионной связью относится большинство солей и некоторые оксиды (Cu2O, ZnO, CdO, Fe2O3, NiO и др.). Ионные соединения по механической прочности и химической стойкости уступают веществам, образованным с помощью ковалентной связи, так как менее прочна, чем ковалентная.
Металлическая связь. Для металлов характерна химическая связь, основанная на обобществлении валентных электронов, принадлежащих не двум, а практически всем атомам в кристалле. Атомы металлов способны отдавать внешние электроны, превращаясь в положительные ионы, или вновь их присоединять, превращаясь в нейтральные атомы. Таким образом, металл можно рассматривать как систему, построенную из положительных ионов, находящихся в среде свободных, коллективизированных электронов (рис. 1.4 а).
Следовательно, металлическая связь определяется одновременно наличием ковалентной связи между нейтральными молекулами и электростатическим притяжением между ионами и свободными электронами, что в итоге обеспечивает монолитность и прочность металла. Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью. Высокая пластичность металлов объясняется отсутствием направленности металлической связи.
Межмолекулярная связь, или связь Ван-дер-Ваальса, наблюдается у ряда веществ между молекулами с ковалентным характером внутримолекулярного взаимодействия. Наличие межмолекулярного притяжения в этом случае возможно при согласованном движении валентных электронов в соседних молекулах (рис.1.4. б). Тогда силы притяжения валентных электронов ядром соседней молекулы оказываются сильнее сил взаимного отталкивания электронных оболочек этих молекул. Вещества с молекулярным характером связи обладают низкими температурами плавления (например, у парафина tпл = 50 –52 0С). Это свидетельствует о том, что связь Ван- дер- Ваальса очень слабая.
1.2. Кристаллическое строение вещества.
В твердых веществах атомы и молекулы расположены в геометрически правильном порядке либо в хаотическом беспорядке. В соответствии с этим вещества, обладающие геометрически упорядоченным расположением атомов или молекул, называют кристаллическими, а вещества с хаотическим расположением атомов или молекул – аморфными.
 Кристаллические вещества. Большинство твердых веществ обладает кристаллической структурой. Каждое вещество обычно образует кристаллы совершенно определенной формы. Внешняя форма кристалла отражает его внутреннее строение и обусловлена геометрически правильным расположением атомов или молекул, образующих кристалл. Это расположение атомов можно представить в виде пространственной кристаллической решетки, которая состоит из бесчисленного множества сопряженных друг с другом элементарных кристаллических ячеек.
Кристаллические вещества. Большинство твердых веществ обладает кристаллической структурой. Каждое вещество обычно образует кристаллы совершенно определенной формы. Внешняя форма кристалла отражает его внутреннее строение и обусловлена геометрически правильным расположением атомов или молекул, образующих кристалл. Это расположение атомов можно представить в виде пространственной кристаллической решетки, которая состоит из бесчисленного множества сопряженных друг с другом элементарных кристаллических ячеек.
Изучение степени упорядоченности вещества позволяет не только отнести вещество к кристаллическим или аморфным, но и определить зернистость структуры, т.е. отличить монокристаллический материал от поликристаллического.
Кристаллические решетки можно классифицировать как по виду частиц, образующих ее, так и по форме элементарной ячейки. Геометрически возможны 14 видов пространственных решеток, являющих основой шести систем кристаллических решеток (триклинная, моноклинная, ромбическая, гексагональная, тетрагональная, кубическая). Элементарные ячейки некоторых кристаллических систем представлены на рис.1.5, а соотношения между их осевыми углами и осевыми единицами приведены в табл. 1.1
Теория идеальных кристаллов очень полезна. Она позволяет объяснить многие свойства кристаллической решетки – плотность, удельную теплопроводность, упругие свойства. Все эти свойства называются объемными или структурно-нечувствительными. Однако все реальные кристаллические тела неидеальны: в них всегда в огромном количестве существуют нарушения структуры, называемые несовершенствами или дефектами. Перечисленные выше свойства в очень слабой степени зависят от этих несовершенств. Однако дефекты структуры оказывают сильное влияние на многие другие свойства кристаллов - прочность, электропроводность, гистерезисные потери в ферромагнитных материалах. Свойства, сильно зависящие от степени совершенства кристалла, называются структурно-чувствительными.
Важнейшими параметрами кристалла являются размеры элементарной ячейки; их определяют как равновесные расстояния в направлении характеристических осей между центрами частиц, занимающих соседние узлы решетки, и называют постоянными решетки. Размещение частиц в пространственной решетке осуществляется таким образом, чтобы обеспечить максимально возможную для данного типа кристалла энергию их связи, а также энергетическую однородность в целом. Для частиц сферической формы наиболее благоприятным часто оказывается такое их размещение, при котором каждая сфера находится в соприкосновении с наибольшим числом ближайших соседей. Подобные пространственные образования называются структурами плотнейшей упаковки.
В зависимости от вида частиц, образующих кристаллическую решетку, различают атомные, ионные, металлические и молекулярные кристаллические решетки.
В узлах атомных решеток находятся нейтральные атомы, которые связаны друг с другом ковалентной связью. Примерами кристаллов этого типа могут служить алмаз, кремний, германий, серое олово, а также кристаллы сложных веществ, таких как кварц, карбид кремния. Сульфид цинка, нитрид алюминия.
В узлах ионных решеток располагаются, чередуясь, положительные и отрицательные ионы. Они связаны друг с другом ионной связью. Примерами кристаллов, в которых преобладает ионный тип связи, могут быть NaCl, CaF2, KF. Многие ионные кристаллы относятся к классу диэлектриков.
В узлах металлических решеток расположены положительные ионы, в промежутках между которыми находятся свободные электроны. Образуются металлические решетки с помощью металлической связи. Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом. Примерами таких кристаллов являются металлы и их сплавы. По энергии кристаллической решетки металлы занимают промежуточное положение между кристаллами с атомными решетками и молекулярными решетками. Плотность большинства металлов значительна, что свидетельствует об очень плотной структуре металлических кристаллов. С другой стороны, такие свойства металлов, как высокие ковкость и тягучесть, указывают на отсутствие жесткости в металлических решетках: их плоскости относительно легко сдвигаются одна относительно другой.
В узлах молекулярных решеток находятся молекулы. Такие решетки образуются за счет ковалентной и ионной связей. Молекулы органических соединений (полимеров) могут иметь вытянутую форму в виде зигзагообразных скрученных цепочек, сетчатую или сложную пространственную форму.
Аморфные вещества. Внутреннее строение аморфных веществ характеризуется беспорядочным расположением атомов и молекул, т.е. в них отсутствует кристаллическое строение. Они делятся на две большие группы: а) простые аморфные вещества – низкомолекулярные жидкости, неорганические стекла, плавленый кварц; б) высокополимерные соединения – каучуки, резины, органические стекла, смолы.
Аморфно-кристаллические вещества. Некоторые вещества могут находится как в кристаллическом так и в аморфном состоянии, Так, оксид кремния SiO2 встречается в природе в виде кристаллов кварца, а также в аморфном состоянии в виде минерала – опала. Аморфное состояние вещества является менее устойчивым, чем кристаллическое, поэтому возможен самопроизвольный переход вещества из аморфного в кристаллическое. Примером такого превращения служит расстеклование – самопроизвольная кристаллизация стекла при повышенных температурах или давлении. В связи с образованием мелких кристалликов стекло меняет свои оптические свойства и превращается в аморфно-кристаллический материал, называемый ситаллом.
– Конец работы –
Эта тема принадлежит разделу:
Виды связи
Характер энергетического спектра металлических проводников полупроводников... Диэлектриками называют материалы у которых в энергетическом спектре зона проводимости и валентная зона разделяются...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Виды связи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов