Электрохимические методы анализа
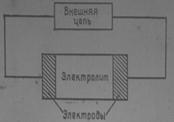
Основаны на исследовании процессов, происходящих в электролитической (электрохимической) ячейке.
Ячейка представляет систему из электродов и электролита.

Электрохимические методы
1. прямые измерения (сигнал=f(Cx))
2. косвенные измерения (индикация конечной точки титрования)
Различия в методах обусловлены природой электродов и внешними цепями.
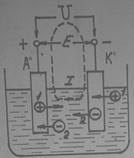
Электрод – электронный проводник, контактирующий с ионным.
Источником тока являются химические реакции на границе электрод-раствор.

В качестве реагентов в реакциях участвуют:
1. вещество, из которого состоит электрод
2. компоненты, входящие в состав электролита
3. посторонние вещества на поверхности электрода
Внутри электролита ток течёт от анода к катоду.
В состав ячейки входят электроды:
1. индикаторный (датчик, потенциал зависит от концентрации)
2. сравнения (формирование опорного сигнала, создание замкнутой цепи, потенциал постоянен)
3. вспомогательный (для токовых измерений, вольтамперометрия)
Потенциал определяется уравнением Нернста
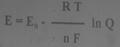
Е0 – потенциал в стандартных условиях
n – число электронов
F – постоянная Фарадея
Q – константа равновесия
R – универсальная газовая постоянная
T – абсолютная температура

А – активности восстановленной и окисленной форм вещества

Понятие активности описывает эффективную концентрацию ионов в растворе, концентрация только тех ионов, которые реально участвуют в реакции a=f(Cэфф).
В разбавленном растворе принимают a=C
Величина E0 определяется с помощью специального водородного электрода.