Растворимость. Равновесие в гетерогенных системах. Произведение растворимости малорастворимых неорганических веществ. - раздел Электроника, Электронные облака орбиталей с разными значениями l имеют разную конфигурацию, а с одинаковыми l похожую Раствори́мость — Способность Вещества Образовывать С Др...
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Равновесия между различными фазами одной системы называют фазовыми, а описывают эти фазовые равновесия посредством фазовых диаграмм или диаграмм состояния. Фазовая диаграмма позволяет установить условия равновесия между числом фаз, числом компонентов и числом степеней свободы (вариантностью) системы.
Фаза (Ф) – гомогенная (однородная по химическому составу и термодинамическим свойствам) часть системы, отделенная от других частей поверхностью раздела. Так, два нерастворимых друг в друге твердых вещества, как и две несмешивающиеся жидкости, образуют две фазы.
Компоненты (К) – химически индивидуальные вещества, наименьшее число которых достаточно для образования фаз системы.
Число компонентов определяется количеством индивидуальных веществ в системе за вычетом числа возможных между ними обратимых взаимодействий. Например, система из трех индивидуальных веществ H2O, H2, O2 будет двухкомпонентной, поскольку для образования всех фаз достаточно любых двух веществ:
| | 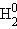 = H2 + 1/2O2. = H2 + 1/2O2.
| |
По числу компонентов системы делятся на одно-, двух-, трех- и многокомпонентные.
Степени свободы (С) – число параметров (температура, давление, состав системы), которые можно произвольно менять без изменения числа фаз в системе.
Правило фаз Гиббса: в изолированной равновесной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз:
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
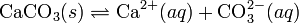
Константа этого равновесия рассчитывается по уравнению:
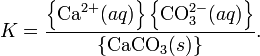
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
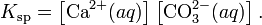
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
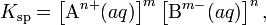
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Все темы данного раздела:
Строение атомов и принцип Паули
Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химичес
Основные типы химической связи. Ковалентная связь. Основные положения метода валентных связей. Сигма- и Пи- ковалентные связи.
атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металл
Sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома уг
Геометрическая форма и полярность молекул.
Гибридизация
Геометрическая форма
Угол между связями
sp
Линейная
180°
sp
Ионная связь как предельный случай поляризации ковалентной связи. Электростатическое взаимодействие ионов.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, обра
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O → H2SO4.
Но не все кислотные оксиды непосредственно реагируют с водой (SiO
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + H2O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате
Основания. Химические свойства оснований. Амфотерные состояния,реакции их взаимодействия с кислотами и щелочами.
Основание — это химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда
Характерные реакции
Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например:
ZnO + H2SO4
Кислоты. Бескислородные и кислородные кислоты. Свойства кислот (серная,соляная,азотная).
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться, и кислотных остатков.
Кислотный остаток имеет отрицательный заряд.
Серная кислота.
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в во
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практик
Влияние концентрации на скорость химической реакции. Закон действующих масс.
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на оживленной улице гораздо выше, чем на пустынной. Так и с молекулами. Очевидно, что в
Влияние температуры на скорость химической реакции. Энергия активации.
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулир
Реакции без участия и с участием электронов. Ионно-обменные и окислительно-восстановительные реакции.
Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановит
Изображение реакций ионного обмена
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают м
Правила написания реакций ионного обмена
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Ат
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяю
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-во
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внут
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Взаимодействие с простыми веществами
Взаимодействие с металлами: 2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2
Массовая доля
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,
Титр раствора
Основная статья: Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
Водные растворы электролитов. Сильные и слабые электролиты. Константа и степень диссоциации. Закон разбавления Оствальда.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
РАСТВОРЫ ЭЛЕКТРОЛИТОВ, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации мол
Электролитическая диссоциация воды. Константа диссоциации воды. Ионное произведение воды.
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и я
PH воды
Для удобства, концентрации [H+] и [HO-] выражают в виде водородного показателя pH и гидроксильного показателя pOH
Диссоциация сильных электролитов. Активность ионов в растворах. Коэффициент активности. Представление об ионной силе растворов.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
Электродный потенциал. Возникновение скачка потенциала на межфазной границе. Водородный электрод. Стандартный водородный электрод.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электроли
Электрохимическая коррозия металлов в различных средах.
Контактная биметаллическая коррозия является разновидностью электрохимической коррозии, вызванной контактом металлов, имеющих разные электродные потенциалы в электролите. При этом коррозия метала с
Химическое взаимодействие металлов с растворами обычных кислот и кислот окислителей.
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl. Ввиду невысокой его растворимости в воде, концентрация со
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
H2SO4
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера
Процесс электролиза. Катодные и анодные процессы. Порядок разряда частиц на аноде и катоде в зависимости от значения их электродного потенциала.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных
Катодные реакции
Последняя реакция протекает свыделением водорода.
При элек
Математический вид
Законы Фарадея можно записать в виде следующей формулы:
где:
КОНФИГУРАЦИЕЙ АТОМОВ И ИОНОВ
Растворимость солей и гидроксидов катионов, лежащая в основе аналитической классификации, как и все другие свойства катионов, функционально связана с положением соответствующих элементов в периодич
Виды титриметрического анализа
Титриметрический анализ может быть основан на различных типах химических реакций:
кислотно-основное титрование — реакции нейтрализации; окислительно-восстановительное титров
Типы титрования
Различают прямое, обратное титрование и титрование заместителя.
При прямом титровании к раствору определяемого вещества (аликвоте или навеске, титруемому веществу) д
Виды титриметрического анализа
Титриметрический анализ может быть основан на различных типах химических реакций:
кислотно-основное титрование — реакции нейтрализации; окислительно-восстановительное титров
Эквивалентная молярная масса вещества
Молярная масса эквивалентов обычно обозначается как или
Число эквивалентности
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивале
Особенности строения атома углерода. Неорганические соединения углерода (оксиды,карбонаты и гидрокарбонаты,карбиды) и их свойства.
Углерод – основа органических, биоорганических соединений и многих полимеров.
Большинство соединений углерода относятся к органическим веществам, но в этой работе мы уделим внимание, так н
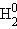 = H2 + 1/2O2.
= H2 + 1/2O2.
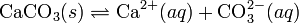
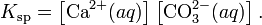
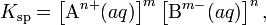







Новости и инфо для студентов