Химическое взаимодействие металлов с растворами обычных кислот и кислот окислителей.
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl. Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
HCl 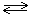 H+ + Cl-
H+ + Cl-
Образующиеся в этом процессе ионы водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H2↑
соль + H2↑
При этом соль представляет собой хлорид металла (NiCl2, CaCl2, AlCl3), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe0 → Fe2+
Co0 → Co2+
Ni0 → Ni2+
Cr0 → Cr2+
Mn0 → Mn2+ и др.
Пример:
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
2│Al0 – 3e- → Al3+ - окисление
3│2H+ + 2e- → H2 – восстановление
Соляная кислота пассивирует свинец (Pb). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца (II), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl2↓ + H2↑
Серная кислота (H2SO4)
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.