Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
H2SO4 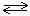 H+ + HSO4-
H+ + HSO4-
HSO4- 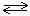 H+ + SO42-
H+ + SO42-
Образующиеся ионы Н+ выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными исредней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Ме + H2SO4(разб.)→ соль + H2↑
Пример:
2 Al + 3 H2SO4(разб.) → Al2(SO4)3 + 3 H2↑
1│2Al0 – 6e- → 2Al3+ - окисление
3│2H+ + 2e- → H2 – восстановление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Fe0 → Fe2+
Co0 → Co2+
Ni0 → Ni2+
Cr0 → Cr2+
Mn0 → Mn2+ и др.
Свинец (Pb) не растворяется в серной кислоте (если ее концентрация ниже 80%), так как образующаяся соль PbSO4 нерастворима и создает на поверхности металла защитную пленку.