Математический вид
Законы Фарадея можно записать в виде следующей формулы:
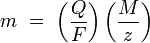
где:
- m — масса осаждённого на электроде вещества в граммах
- Q — полный электрический заряд, прошедший через вещество
- F = 96 485,3383(83) Кл·моль−1 — постоянная Фарадея
- M — молярная масса вещества
- z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества.
Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m.
Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
В простейшем случае постоянного тока электролиза 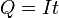 приводит к:
приводит к:
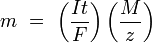
и тогда
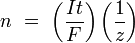
где:
- n — выделенное количество вещества («количество молей»): n = m/M
- t — время действия постоянного тока.
В более сложном случае переменного электрического тока полный заряд Q тока I(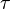 ) суммируется за время
) суммируется за время 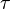 :
:
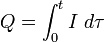
Здесь t — полное время электролиза. Обратите внимание, что тау используется в качестве переменной, ток I является функцией от тау.
39. Качественный анализ неорганических веществ. Характерные и специфические реакции. Аналитическая классификация катионов и анионов. Первая,вторая,третья,четвёртая группа катионов (групповой реактив). Реакции катиона Cu2+.
Основной задачей качественного анализа является определение состава анализируемого образца. Качественный анализ позволяет определить, какие элементы, ионы, молекулы содержит анализируемый образец или какие из них в образце отсутствуют.
Успешное проведение качественного анализа требует достаточных знаний химических и физических свойств веществ, которые могут быть объектом анализа. Именно эти свойства и используются в качественном анализе.
Качественный химический анализ проводят «сухим» или «мокрым» способом. Реакции, проводимые «сухим путем», обычно применяются как вспомогательные, главным образом при предварительных испытаниях вещества неизвестного состава.
Из реакций, проводимых «сухим путем» (не в растворах), чаще применяются реакции образования так называемых перлов, образующихся при сплавлении исследуемого вещества с тетраборатом натрия (бурой) или гидрофосфатом натрия в петле платиновой проволоки. Так, соединения хрома окрашивают перл в изумрудно-зеленый цвет, марганца – в фиолетовый и т.д.
В качественном анализе используются также пирохимические реакции: окрашивание пламени в различные цвета летучими солями некоторых катионов. Анализируемую пробу в петле платиновой проволоки вносят в пламя горелки. По окраске пламени судят о наличии в образце того или иного элемента. Так, калий окрашивает пламя в фиолетовый цвет, натрий - в желтый, медь – в зелёный и т.д. Цветное пламя получается благодаря способности атомов в возбужденном состоянии к электромагнитному излучению в определенной части видимой области спектра. Для анализа «сухим путем» применяют и другие методы (возгонка, растирание и др.).
Анализ вещества, проводимый в растворах, называется анализом «мокрым путем». Это основной путь полного определения состава вещества. Для этого вещество переводят в раствор. Для растворения применяют дистиллированную воду, кислоты, смеси кислот, щелочи, водный раствор аммиака, некоторые органические растворители и др.
В качественном анализе применяют только реакции, обладающие характерными, или аналитическими признаками (аналитическим сигналом). Это образование или растворение осадка, образование окрашенных соединений, выделение газа и т.п. В случае необходимости обнаружения какого-либо компонента фиксируют появление аналитического сигнала – появление осадка, окраски, линии в спектре и т.д. Появление аналитического сигнала должно быть надежно зафиксировано.
Качественные реакции проводят преимущественно в пробирках. Некоторые из качественных реакций - так называемые микрокристаллоскопические реакции - проводят на предметных стеклах, и образующиеся кристаллы рассматривают под микроскопом. Иногда прибегают к выполнению реакций капельным методом. Для этого на полоску фильтровальной бумаги наносят каплю испытуемого раствора и каплю реактива и рассматривают окраску пятна на бумаге.
При проведении качественного анализа можно работать с различными количествами исследуемого вещества. В связи с этим выделяют макроанализ, полумикроанализ, микроанализ, субмикроанализ, ультрамикроанализ .
В зависимости от количества исследуемого вещества их называют также грамм-метод, при котором масса исследуемого вещества берется более 0,5 г (более 10 мл раствора), сантиграмм-метод (масса исследуемого вещества от 0,05 до 0,5 г, или 1-10 мл раствора) и миллиграмм-метод (масса исследуемого вещества от 10-6 г до 10-3 г, или от 0,001 до 0,1 мл раствора). Наиболее распространенным является полумикроанализ (сантиграмм-метод).
Маскирование – это торможение или полное подавление химической качественной реакции с мешающим ионом. При этом не должно происходить образование новой фазы. В качестве маскирующих неорганических веществ применяют цианиды, роданиды, фториды, фосфаты и оксалаты щелочных металлов и аммония. Известна также группа органических веществ, называемых маскирующими комплексообразователями. К ним относятся тиомочевина, винная, лимонная, щавелевая, салициловая кислоты, а также комплексоны. Например, открытию кобальта (2+) в смеси катионов по реакции
Co2+ + 4SCN– = [Co(SCN)4]2–
мешают ионы железа (3+), которые образуют с роданид–ионом окрашенное в красный цвет соединение. Для устранения мешающего эффекта ионы железа «маскируют» ионами фтора, которые с железом образуют очень прочный комплекс, и тогда железо не мешает определению кобальта.
Общие (групповые) реакции характерны для определенной группы ионов или веществ. Например, образование белого осадка с растворами бариевых солей – общая реакция для анионов SO42-, CO32-, SO32- , S2-.
Частные реакции характерны для определенного иона или соединения, например, образование газообразного аммиака при нагревании со щелочью – частная реакция для обнаружения катиона аммония:
NH4+ + OH- = NH3(г) + Н2О.
Количество частных реакций, позволяющих обнаружить, или «открыть», отдельный ион в сложной смеси, весьма ограничено. Поэтому чаще всего открытию индивидуального иона предшествует разделение ионов на группы с помощью общих, или групповых реакций, затем удаление ионов, мешающих открытию индивидуального иона.