Число эквивалентности
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности 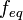 связан с числом эквивалентности z следующим соотношением:
связан с числом эквивалентности z следующим соотношением: 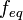 =1/z.
=1/z.
Например, в реакции:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2
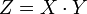
| вещество | реакция | |||
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
| число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
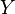
| характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
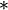 — для инертных газов
— для инертных газов 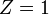
Фактор эквивалентности помогает сформулировать закон эквивалентности.
В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Для проведения анализа этим методом достаточно одного рабочего раствора.
В методах обратного титрования (или, как их еще называют, методах титрования по остатку) используются два титрованных рабочих раствора: основной и вспомогательный. Широко известно, например, обратное титрование хлорид-иона в кислых растворах. К анализируемому раствору хлорида сначала добавляют заведомый избыток титрованного раствора нитрата серебра (основного рабочего раствора). При этом происходит реакция образования малорастворимого хлорида серебра: Ag+ + Cl- → AgCl. Не вступившее в реакцию избыточное количество AgNO3 оттитровывают раствором тиоцианата аммония (вспомогательного рабочего раствора): Ag+ + SCN- → AgSCN. Содержание хлорида можно рассчитать, т.к. известно общее количество вещества (моль), введенное в раствор, и количество вещества AgNO3, не вступившее в реакцию с хлоридом.
Третьим основным видом титриметрических определений является титрование заместителя (титрование по замещению, косвенное титрование). В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором. Например, при иодометрическом определении меди к анализируемому раствору добавляют заведомый избыток KI. Происходит реакция
2Cu2+ + 4I- → 2CuI + I2.
Выделившийся иод оттитровывают тиосульфатом натрия.
Известны и более сложные титриметрические методики анализа, являющиеся комбинацией этих трех основных.