рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Электроника
- /
- Ионные реакции в растворах электролитов
Реферат Курсовая Конспект
Ионные реакции в растворах электролитов
Ионные реакции в растворах электролитов - раздел Электроника, ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ Ионными Реакциями (Реакциями Обмена) Называют Реакции В Растворах...
Ионными реакциями (реакциями обмена) называют реакции в растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Для выявления сущности процессов, происходящих при ионных реакциях, кроме молекулярных, составляют ионные уравнения реакций.
· При составлении ионных уравнений в виде ионов записывают только растворимые сильные электролиты. Все остальные вещества (неэлектролиты, слабые или малорастворимые электролиты) записывают в молекулярной форме.
Примеры реакций обмена:
· с образованием малорастворимых соединений:
Pb(NO3)2 + 2KI = PbI2¯ + 2KNO3
Pb2+ + 2NO3— + 2K+ + 2I— = PbI2¯ + 2K+ + 2NO3—
Pb2+ + 2I— = PbI2¯
· с образованием слабых электролитов:
NaNO2 + HCl = NaCl + HNO2
Na+ + NO2— + H+ + Cl— = Na+ + Cl— + HNO2
H+ + NO2- = HNO2
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2H+ + SO42— + 2Na+ + 2OH— = 2Na+ + SO42— + 2H2O
H+ + OH— = H2O
HCl + NH4OH = NH4Cl + H2O
H+ + Cl— + NH4OH = NH4+ + Cl— + H2O
H+ + NH4OH = NH4+ + H2O
· с образованием газообразных веществ:
Na2CO3 + 2HCl = 2NaCl + СO2 + H2O
2Na+ + CO32— + 2H+ + Cl— = 2Na+ + Cl— + CO2 + H2O
CO32— + 2H+ = CO2 + H2O
5.4. Диссоциация воды. Водородный показатель
Вода является слабым электролитом. Уравнение диссоциации воды упрощенно записывают следующим образом: H2O Û H+ + OH-. Константа диссоциации воды:
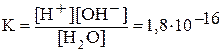 .
.
· Произведение 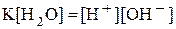 называют ионным произведением воды и обозначают
называют ионным произведением воды и обозначают 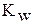 :
:
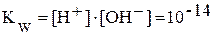 .
.
Ионное произведение воды при постоянной температуре постоянно не только для воды, но и для водных растворов. Зная концентрацию ионов H+, можно рассчитать концентрацию OH-, и наоборот. Понятия кислая, нейтральная и щелочная среда можно оценить количественно по концентрации ионов H+ или OH-. Более удобно для характеристики среды пользоваться водородным показателем:
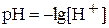 .
.
| Среда | рН | [H+], моль/л | [OH—], моль/л |
| Нейтральная | = 7 | 10 —7 | 10—7 |
| Кислая | < 7 | >10—7 | <10—7 |
| Щелочная | > 7 | <10—7 | >10—7 |
5.5. Гидролиз солей
· Гидролизом солей называют процесс взаимодействия ионов соли с водой, приводящий к смещению ионного равновесия воды и, как правило, изменению рН среды.
Гидролиз солей происходит в тех случаях, когда ионы, образующиеся в результате диссоциации соли, способны образовать с ионами воды малодиссоциирующие частицы. Гидролиз чаще всего является обратимым процессом, так как продукты реакции взаимодействуют между собой с образованием исходных веществ.
Соли, образованные сильной кислотой и сильным основанием, например NaCl, KNO3, CaCl2 и др., гидролизу не подвергаются, их растворы нейтральны.
· Гидролизу подвергаются соли, образованные:
· слабыми кислотами и сильными основаниями (Na3PO4, K2SO3, Na2S и др.);
· слабыми основаниями и сильными кислотами (NH4Cl, AlCl3, ZnSO4 и др.);
· слабыми кислотами и слабыми основаниями (NH4CH3COO, NH4CN и др.).
· Гидролиз солей слабых кислот и сильных оснований.
Гидролиз NaNO2.
Диссоциация соли: NaNO2 = Na+ + NO2—
краткое ионное уравнение:
NO2— + HOH Û HNO2 + OH—(среда щелочная, рН>7);
молекулярное уравнение:
NaNO2 + H2O Û HNO2 + NaOH.
Гидролиз K2CO3 (гидролиз солей многоосновных кислот преимущественно происходит по первой ступени).
Диссоциация соли: K2CO3 = 2K+ + CO32 —
краткое ионное уравнение:
CO32 — + HOH Û HCO3- + OH—(среда щелочная, рН>7);
молекулярное уравнение:
K2CO3 + H2O Û KHCO3 + KOH.
По второй ступени гидролиз практически не идет.
· Гидролиз солей слабых оснований и сильных кислот.
Гидролиз NH4Cl.
Диссоциация соли: NH4Cl = NH4+ + Cl-
краткое ионное уравнение:
NH4+ + HOH Û NH4OH + H+ (среда кислая, рН<7);
молекулярное уравнение:
NH4Cl + H2O Û NH4OH + HСl.
Гидролиз AlCl3 (гидролиз солей многокислотных оснований преимущественно происходит по первой ступени):
AlCl3 = Al3+ + 3Cl—
Al3+ + HOH Û AlOH2+ + H+(среда кислая, рН<7);
молекулярное уравнение: AlCl3 + H2O Û AlOHCl2 + HСl.
По следующим ступеням гидролиз практически не идет.
· Гидролиз солей слабых оснований и слабых кислот.
В этом случае, если соль растворима, в реакции одновременно участвуют и катион, и анион соли, связывающие ионы OH— и H+ из воды, равновесие сильно смещается вправо, гидролиз усиливается. Значение рН раствора зависит от относительной силы кислоты и основания, образующих соль.
Гидролиз CH3COONH4:
CH3COONH4 = NH4+ + CH3COO—
NH4+ + CH3COO — + HOH Û NH4OH + CH3COOH
CH3COONH4 + H2O Û NH4OH + CH3COOH
Константы диссоциации уксусной кислоты и гидроксида аммония равны: 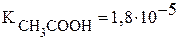 и
и 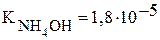 , поэтому реакция раствора данной соли нейтральная.
, поэтому реакция раствора данной соли нейтральная.
Растворимые соли, образованные многоосновными слабыми кислотами и многокислотными слабыми основаниями гидролизованы в растворе практически полностью с образованием кислоты и основания:
Сr2S3 + 6H2O = 2Cr(OH)3 + 3H2S.
Такие соли в водных растворах существовать не могут. В таблице растворимости им соответствует прочерк.
· Совместный гидролиз солей.
Если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al3+, Fe3+, Cr3+, NH4+), а другая - анион слабой кислоты (СO32—, SO32—, S2—, SiO32—), то гидролиз необратим, идёт с образованием кислоты и основания. Пример реакции совместного гидролиза солей:
2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3 + 3H2CO3 + 6NaCl
2Al3+ + 3CO32— + 3H2O = 2Al(OH)3 + 3H2CO3.
– Конец работы –
Эта тема принадлежит разделу:
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ
Квантово механическая модель электронного строения атома Совокупность... Некоторые свойства неорганических... Основные понятия...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Ионные реакции в растворах электролитов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов