рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Электроника
- /
- ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ
Реферат Курсовая Конспект
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ - раздел Электроника, Электронное Строение Атомов...
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ
Квантово-механическая модель электронного строения атома
· Совокупность атомов с одинаковым зарядом ядра называют химическим элементом. Порядковый номер элемента в Периодической системе Д.И.Менделеева равен заряду… Для объяснения явлений, происходящих в микромире, существуют различные теории, концепции, но полного объяснения всех…Оксиды, гидроксиды, соли
Сложные вещества (химические соединения) состоят из атомов разных химических элементов. В зависимости от состава их подразделяют на классы, основные… Оксиды - вещества, состоящие из какого-либо элемента и кислорода: ЭnOm.… Гидроксиды - соединения, в состав которых входят элемент (Э), кроме фтора и кислорода, и гидроксогруппа OH. Общая…Некоторые свойства неорганических соединений
Свойства оксидов и гидроксидов
Из оснóвных оксидов с водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов, при этом… Na2O + H2O = 2NaOH СaO + H2O = Сa(OH)2Свойства солей
3MgCl2 + 2Na3PO4 = Mg3(PO4)2¯ + 6NaCl Кислые соли образуются кислотами, у которых два или более катионов водорода.… Ca(OH)2 + 2H3PO4 = CaHPO4 + 2H2OОсновные понятия
Химические реакции сопровождаются энергетическими эффектами: выделением или поглощением тепла, света, совершением механической или электрической работы. Энергетические эффекты химических реакций изучает химическая термодинамика.В курсе химии рассмотрим только некоторые положения химической термодинамики.
Объектами изучения химической термодинамики являются разнообразные системы. Система– мысленно или реально выделенная часть пространства, содержащая одно или несколько веществ. Фаза – часть системы, одинаковая по физическим и химическим свойствам во всех точках и отделенная от других частей системы поверхностью раздела.
Для описания систем применяют сложный математический аппарат, в котором используют набор термодинамических функций, основные из которых: 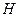 – энтальпия,
– энтальпия, 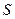 – энтропия,
– энтропия, 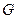 – энергия Гиббса. В пределах данного курса будем приводить значения функций только для стандартных условий.
– энергия Гиббса. В пределах данного курса будем приводить значения функций только для стандартных условий.
· Стандартные условияозначают, что все участвующие в реакции вещества чистые, парциальные давления газов или атмосферное давление, если газы не участвуют в реакции, равно 1,013 · 105 Па, концентрации частиц для реакций в растворах равны 1 моль/л, температура - 298 К. Термодинамические величины, определённые для стандартных условий, обозначают нулём в верхнем правом углу (например, S0).
Энтальпии химических реакций
· Количество тепла, которое выделяется или поглощается в результате химической реакции, называют её тепловым эффектом. Раздел химии, в котором… В дальнейшем тепловые эффекты химических реакций будем характеризовать… Реакции, идущие с выделением тепла, называют экзотермическими, идущие с поглощением тепла – эндотермическими.Энтальпии образования простых веществ приняты за ноль.
Закон, сформулированный Германом Ивановичем Гессом в 1840 году (закон Гесса), – основной закон термохимии: · энтальпия химической реакции зависит только от природы и состояния исходных… Из закона Гесса следует, что термохимические уравнения можно складывать и вычитать так же, как и алгебраические.Скорость химических реакций
Существуют гомогенные (однофазные) и гетерогенные (многофазные) системы, соответственно называют и реакции, происходящие в таких системах. · Скорость химической реакции - число элементарных актов реакции в единицу… Скорость химических реакций зависит от многих факторов: природы реагирующих веществ, концентрации, давления, степени…Химическое равновесие
Если в какой-либо замкнутой системе может идти обратимая реакция, то наступит такой момент, когда скорости прямой и обратной реакций станут… · Состояние системы, характеризующееся равными скоростями прямой и обратной… Химическое равновесие имеет динамический характер. Это означает, что количество любого вещества, расходующегося в ходе…Выражение константы равновесия имеет вид
Особенность записи выражения константы равновесия для гетерогенных равновесий заключается в том, что концентрации твёрдых веществ считают…Принцип Ле Шателье
· если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие сместится в направлении реакции,… Влияние концентраций компонентов системы. При увеличении концентрации… образования этого вещества. Если, например, в системеОсновные понятия
Раствор – гомогенная система, состоящая из двух и более компонентов: растворитель и растворенное вещество (вещества). Растворы могут быть газовые, жидкие, твердые. В этом курсе химии ограничимся рассмотрением жидких растворов.
Важнейшей характеристикой любого раствора является концентрация. Концентрация показывает содержание растворенного вещества в единице массы или объема раствора или растворителя. Рассмотрим основные способы выражения концентрации растворов.
Процентное содержание растворенного вещества (С) - отношение массы растворенного вещества к общей массе раствора, выраженное в процентах:
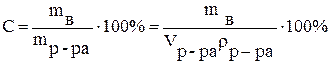 ,
,
где 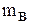 - масса растворенного вещества, г;
- масса растворенного вещества, г;
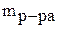 - масса раствора, г;
- масса раствора, г;
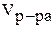 - объем раствора, мл;
- объем раствора, мл;
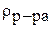 - плотность раствора, г/мл.
- плотность раствора, г/мл.
Молярная концентрация (См) – отношение количества растворённого вещества к объёму раствора, выраженному в литрах:

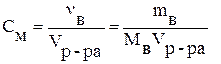 ,
,
где 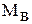 - молярная масса растворенного вещества, г/ моль;
- молярная масса растворенного вещества, г/ моль;
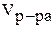 - объем раствора, л.
- объем раствора, л.
Размерность молярной концентрации - моль/л.
· Пример. Вычислите процентную и молярную концентрации раствора H3PO4, содержащего 18 г кислоты в 282 мл воды, если плотность его равна 1,03 г/мл.
Решение
Рассчитываем процентную концентрацию (следует помнить что плотность воды 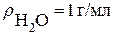 ):
):
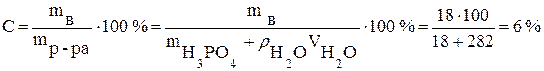 .
.
Чтобы рассчитать молярную концентрацию раствора, выражаем массу растворённого вещества из формулы для процентной концентрации:
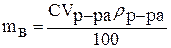 ,
,
а затем полученное выражение подставляем в формулу для молярной концентрации:
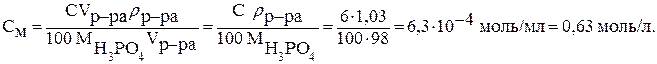
5.2. Растворы электролитов. Электролитическая диссоциация
· Электролиты - это вещества, растворы и расплавы которых проводят электрический ток. К электролитам относят все соли (средние, кислые, оснóвные), основания, кислоты, амфотерные гидроксиды.
Согласно теории электролитической диссоциации Аррениуса, в водных растворах электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы - катионы и анионы.
Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (a). Степень диссоциации равна отношению числа продиссоциировавших молекул (n) к общему числу растворённых молекул (N):
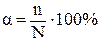 .
.
По степени диссоциации электролиты условно делят на сильные и слабые. Принято считать сильными электролиты, для которых a > 30 %, остальные можно считать слабыми.
· Сильные электролиты:
· почти все соли;
· некоторые неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 и другие;
· основания – гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
· Слабые электролиты:
· многие неорганические и большинство органических кислот – H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, H2S, HF, HCN, CH3COOH и другие;
· основания (кроме гидроксидов щелочных и щелочноземельных металлов) и амфотерные гидроксиды. Гидроксид аммония NH4OH – также слабый электролит.
Сильные электролиты в водном растворе диссоциируют практически полностью, поэтому в уравнениях диссоциации этих электролитов ставят знак равенства (=):
| Al2(SO4)3 = 2Al3+ + 3SO42— NaHCO3 = Na+ + HCO3— CuOHCl = CuOH+ + Cl— | HNO3 = H+ + NO3— NaOH = Na+ + OH— |
Слабые электролиты диссоциированы частично, уравнения диссоциации слабых электролитов пишут со знаком обратимости (Û). Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации – К.
Значения констант диссоциации слабых электролитов при 298 К приведены в справочниках. Чем меньше константа диссоциации, тем слабее электролит:
NH4OH Û NH4+ + OH— ; 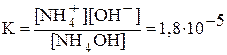 .
.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Каждую ступень равновесного состояния характеризует своя константа диссоциации. Например, при диссоциации H2CO3:
1-я ступень: H2CO3 Û H+ + HCO3—; 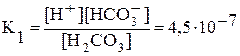 ;
;
2-я ступень: HCO3- Û H+ + CO32—; 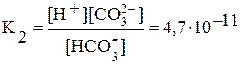 .
.
Диссоциация Fe(OH)2:
1-я ступень: Fe(OH)2 Û FeOH+ + OH —, 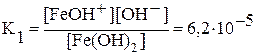 ;
;
2-я ступень: FeOH + Û Fe 2+ + OH —, 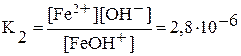 .
.
Амфотерные гидроксиды проявляют свойства слабых оснований и слабых кислот. Диссоциацию гидроксида Pb(OH)2 = H2PbO2 по основному типу характеризуют уравнениями
Pb(OH)2 Û PbOH + + OH —, PbOH + Û Pb 2+ + OH —;
по кислотному типу – уравнениями
H2PbO2 Û H + + HPbO2 —, HPbO2— Û H+ + PbO22 —.
Ионные реакции в растворах электролитов
Для выявления сущности процессов, происходящих при ионных реакциях, кроме молекулярных, составляют ионные уравнения реакций. · При составлении ионных уравнений в виде ионов записывают только растворимые… Примеры реакций обмена:ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Основные понятия
Окислительно-восстановительными (ОВР) называют реакции, проходящие с изменением степени окисления элементов за счет перехода электронов от одних частиц к другим.
Степень окисленияатома – его условный заряд, который вычисляют, исходя из предположения, что молекулы состоят только из ионов. Степень окисления атомов элементов в простых веществах равна нулю, кислорода в большинстве соединений - (–2) , водорода и щелочных металлов - (+1). Высшая степень окисления элемента, как правило, равна номеру группы, в которой расположен элемент в Периодической системе Д.И.Менделеева. Низшая степень окислениядля атомов металлов равна нулю, для атомов неметаллов – суммарному заряду электронов, необходимых для достройки последнего энергетического подуровня. В формулах степень окисления при необходимости показывают арабской цифрой над символом элемента, например 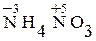 .
.
Пример. Определить степень окисления марганца в соединениях: MnO2, K2MnO4 , KMnO4 .
Решение. Составляем простейшие алгебраические уравнения, обозначив
степень окисления марганца за 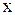 .
.
| Формула соединения | Алгебраическое уравнение | Степень окисления |
| MnO2 | 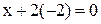
| 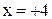
|
| K2MnO4 | 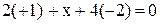
| 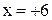
|
| KMnO4 | 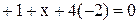
| 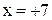
|
· Процесс отдачи электронов называют окислением. Частицы, отдающие электроны, называют восстановителями (Red). Окисление повышает степень окисления атомов восстановителя. Только восстановительные свойства проявляют металлы, а также атомы элементов в низшей степени окисления.
· Процесс присоединения электронов называют восстановлением. Частицы, присоединяющие электроны, называют окислителями (Ох). Восстановление приводит к понижению степени окисления атомов окислителя. Только окислительные свойства проявляют кислород, фтор, а также атомы элементов в высшей степени окисления.
Атомы элементов, имеющие промежуточную степень окисления, а также неметаллы (кроме кислорода и фтора) могут проявлять как окислительные, так и восстановительные свойства. Например:
· проявляют только окислительные свойства - 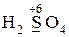 ,
, 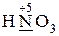 ;
;
· только восстановительные свойства - 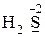 ,
, 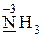 ;
;
· и окислительные, и восстановительные свойства - 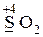 ,
, 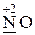 .
.
Составление уравнений ОВР
· применять правила написания ионных уравнений; · соблюдать материальный баланс (число атомов химического элемента в левой и… · соблюдать баланс электронов (число электронов, отданных восстано-вителем и принятых окислителем должно быть…Электродные потенциалы. Направление ОВР
Zn + CuSO4 = ZnSO4 + Cu (1) участвуют две окислительно-восстановительные пары - восстановитель (Zn) и его… Стандартный водородный электрод состоит из платиновой пластинки, покрытой тонким порошком платины, погруженной в…– Конец работы –
Используемые теги: Электронное, Строение, атомов0.064
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов