Элемент, сокращенная электронная формула которого 6d57s2 находится в группе
$$$ 1
При взаимодействии очень разбавленной азотной кислоты с цинком образуется:
А)NH3
B)NH4NO3
C)NO2
D)NO
E)N2
$$$ 2
Элемент, сокращенная электронная формула которого …6d57s2 находится в группе:
А)4
В)5
С)8
D)7
Е)6
$$$ 3
Количество вещества, содержащееся в 30 г цинка: 0.461
$$$ 4
Отрицательная степень окисления, которую может проявить атом, имеющий внешний энергетический уровень: 4s24p3:
А)1
В)3
С)2
D)4
Е)5
$$$ 5
Валентность фосфора в основном валентном состоянии:
А)1
В)3
С)2
D)5
Е)4
$$$ 6
Сокращенная электронная формула, соответствующая иону Sb3-:
А)5s25p2
В)5s25p3
С)5s25p4
D)5s25p5
Е)5s25p6
$$$ 7
Подуровень, который заполняется в атоме электронами после заполнения подуровня 5s:
А)4d
В)4f
С)5p
D)3d
Е)4р
$$$ 8
Масса хлорида калия, содержащаяся в его растворе молярной концентрации 0,3моль/л и объёмом 400 мл равна: 8.88
$$$ 9
Тип химической связи в молекуле HCl:
А)донорно-акцепторная
В)ионная
С)ковалентная, полярная
D)ковалентная, неполярная
Е)водородная
$$$ 10
Квантовое число, определяющее форму электронного облака в пространстве называется:
А)орбитальным
В)спиновым
С)магнитным
D)главным
Е)спектральным
$$$ 11
Максимальная степень окисления золота: 3
$$$ 12
В максимально-возбужденном атоме кремния 14Si имеются неспаренных электронов: 4
$$$ 13
Элемент, электронная формула которого заканчивается 6d27s2 находится в … периоде и группе. 7
$$$ 14
Форма гибридных облаков:
С)

$$$ 15
Молекула типа АВ2, имеющая линейную форму:
А)CaCl2
В)SnI4
С)H2Se
D)H2Te
Е)H2O
$$$ 16
Способ перекрывания электронных облаков, соответствующий образованию p-связи:
D) 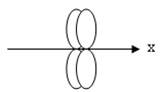
$$$ 17
Какой элемент в следующем ряду сокращенных электронных формул находится в 7 группе?
А)3s23p2;
В)3s23p4;
С)5s24d105p5;
D)4s23d104p3;
Е)6s24f145d106p4.
$$$ 18
Ион, имеющий наименьший радиус:
А)Li+
B)Na+
C)F-
D)Rb+
E)CI-
$$$ 19
min и max степени окисления элементов, электронная формула валентных электронов которых имеет вид …s2p5 (начиная с третьего периода): В)(-1)-(+7);
(-11)-(+7)
$$$ 20
min и max степени окисления сурьмы 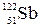 : 5, 3, −3
: 5, 3, −3
$$$ 21
Тип гибридизации центрального атома молекулы SiH4, имеющей форму тетраэдра:
А)sp
В)sp2
С)sp3
D)sp3d
Е)sp3d2
$$$ 22
Величина, характеризующая массу электрона:
А)me=1,0076 г
В)me=9,1×10-28 г
С)me=0,91×10-3 кг
D)me=9,1 а.е.м.
Е)me=9,1×10-31 кг
$$$ 23
Ряд элементов, расположенных в порядке возрастания электроотрицательности:
А)Ca, Cl, Se, Al
В)Na, H, N, F
С)K, N, F, Mg
D)P, Se, O, Ca
Е)O, Br, I, H
$$$ 24
Реакция ионного обмена идет до конца при взаимодействии:
А)AI(NO3)3 и KCI
B)CuSO4 и Zn(NO3)2
C)NaCI и LiNO3
D)HCI и Na2CO3
E)KOH и NaOH
$$$ 25
Сокращенная электронная формула, соответствующая иону хлора (Cl-):
А)3s23p6
В)3s23p5
С)3s23p4
D)3s23p3
Е)3s23p2
$$$ 26
При сжигании 2 моль водорода образуется вода в количестве (моль): 2
$$$ 27
Квантовое число, определяющее ориентацию электронного облака в пространстве называется:
А)главным
В)спиновым
С)магнитным
D)орбитальным
Е)векторным
$$$ 28
Нормальная (эквивалентная) концентрация раствора, в 100 мл которого содержится 4,9г Н2SO4 (M(Н2SO4)=98г/моль) равна: 0,1
$$$ 29
Эквивалентную концентрацию раствора HNO3, содержащего 6,3 г HNO3 в 100мл раствора равна: 1нормальный
$$$ 30
Объём (при н.у.), занимаемый 6,8 г сероводорода равен: 4,48 л
$$$ 31
рОН 0,01М раствора HNO3 равен: 10
$$$ 32
рН 0,01М раствора КОН равен: 2
$$$ 33
Соль, раствор которой имеет щелочную среду:
А)K2SO4
В)K2CO3
С)MgSO4
D)CuCl2
Е)NaNO3
$$$ 34
Соль, не подвергающаяся гидролизу:
А)KNO3
В)K2S
С)MgSO4
D)AlCl3
Е)Na2CO3
$$$ 35
Соль, в результате гидролиза которой образуется основная соль:
А)CsCl
В)Ba(NO3)2
С)FeCl3
D)K2S
Е)Na2CO3
$$$ 36
Титр 0,25н раствора NaOH равен: 0.01
$$$ 37
Слабый электролит – это:
А)HNO3
В)NaOH
С)HNO2
D)Na2SO4
Е)KCl
$$$ 38
Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,860С, тогда как чистый эфир кипит при 35,600С. Вычислите молекулярную массу растворенного вещества. Е(эфира)=2,020. 20.5
$$$ 39
Соль, в результате гидролиза которой образуется кислая соль:
А)KNO3
В)CuSO4
С)NiCl2
D)K2S
Е)Na2SO4
$$$ 40
Массовая доля (%) соли в растворе, содержащем 50 г соли и 200 г воды равна: 20
$$$ 41
Масса нитрата натрия, которую нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор равна: 100
$$$ 42
Соль, раствор которой при гидролизе имеет щелочную среду (рН>7):
А)CuSO4+HOH®¼
В)MgCl2+HOH®¼
С)KNO3+HOH®¼
D)CH3COONa+HOH®¼
Е)Na2SO4+HOH®¼
$$$ 43
Эквивалентная концентрация раствора, в 100 мл которого содержится 49 г H2SO4 равна: 10
$$$ 44
Соль, гидролиз которой идет в три ступени:
А)CrCl3
В)(NH4)2SO4
С)NaCN
D)K2S
Е)Zn(NO3)2
$$$ 45
Соль, раствор которой при гидролизе имеет кислую среду (рН<7):
А)Na2CO3
В)K2SO4
С)CuCl2
D)NaCl
Е)FeS
$$$ 46
Концентрация ионов водорода в растворе, рОН которого равен 3 равна: 10-11
$$$ 47
Определить температуру кипения раствора (0С), содержащего 3,46 г мочевины (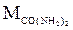 = 60г/моль) в 100 г воды. Эбулиоскопическая константа воды равна 0,520. 55.5
= 60г/моль) в 100 г воды. Эбулиоскопическая константа воды равна 0,520. 55.5
$$$ 48
Нормальная или эквивалентная концентрация раствора, в 100 мл которого содержится 3,4 г AgNO3 (M(AgNO3)=170 г/моль) равна: 0.2
$$$ 49
Газ, выделяющийся при совместном конечном гидролизе солей в реакции AlCl3+Na2CO3+HOH®…: Е)CO2
$$$ 50
Соль, в растворе которой рН будет наибольшим:
А)K2CO3
В)Al(NO3)3
С)FeCl3
D)Cu(CH3COO)2
Е)ZnSO4
$$$ 51
Рассчитать, при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы С6Н12О6. Криоскопическая константа воды равна 1,860. 0
$$$ 52
Азот объемом 11,2 л имеет массу: 14г
$$$ 53
Каково математическое выражение ПР сульфата кальция?
А) 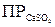 = [Ca2+][SO42-]
= [Ca2+][SO42-]
В) 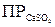 = [Ca2+][4SO2-]
= [Ca2+][4SO2-]
С) 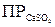 = [Ca2+][SO42-]2
= [Ca2+][SO42-]2
D) 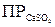 = [Ca2+]2[SO42-]
= [Ca2+]2[SO42-]
Е) 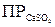 = [Ca2+]2[SO42-]2
= [Ca2+]2[SO42-]2
$$$ 54
Раствор массой 120 г содержит 24 г гидроксида калия (КОН). Вычислите массовую долю вещества в растворе (w, %): 20 %
$$$ 55
Нормальная концентрация раствора, содержащего 10,5 г фтористого натрия (M(NaF)=42 г/моль) в 250 мл водного раствора равна: : 1 нормальный
$$$ 56
Сильный электролит – это:
А)H2CO3
В)H3PO4
С)NaNO3
D)Cu(OH)2
Е)H2S
$$$ 57
Из 400 г 50%-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Определите массовую долю (%) H2SO4 в оставшемся растворе: 66.7
$$$ 58
Температура, при которой должен кипеть раствор, содержащий растворенный неэлектролит количеством вещества 0,062 моль в воде объёмом 200 мл. Эбулиоскопическая константа воды равна 0,520. А)100,160С;
$$$ 59
Раствор массой 125 г содержит 25 г гидроксида натрия (NaOH). Определите массовую долю вещества в растворе (w, %): Е)20.
$$$ 60
Концентрация ионов водорода в растворе, рН которого равен 6 равна: 10-6
$$$ 61
Вычислить осмотическое давление раствора, содержащего 16 г сахарозы (С12Н22О11) в 350 г Н2О при 293 К. Плотность раствора считать равной единице.
В)311кПа;
$$$ 62
Масса сахарозы (С12Н22О11), находящаяся в растворе объёмом 200 мл, если осмотическое давление этого раствора при 00С равно 6,61×105 Па равна: В)19,93г;
$$$ 63
В 1 л раствора содержится 5,85 г NaCI (М(NaCI)=58,5 г/моль). Определите молярную концентрацию раствора: 0,1
$$$ 64
При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при –1,450С. Определите молекулярную массу растворенного вещества (г/моль). Криоскопическая константа воды равна 1,860.
32
$$$ 65
Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу?
А)увеличить в 10 раз
В)увеличить в 2 раза
С)увеличить на 1 моль/л
D)уменьшить в 10 раз
Е)уменьшить на 1 моль/л
$$$ 66
Электролит, при диссоциации которого образуется гидроксокатион:
А)CuSO4
В)NaHCO3
С)Al(Ac)3
D)CuOHCl
$$$ 67 Электролит, при диссоциации которого образуется гидроанион:В)NH4CN
С)Cu(NO3)2
D)K2S
Е)AlCl3
$$$ 72
Вещество электролит:
А)Cu
В)CuO
С)O2
D)CuSO4
Е)NO
$$$ 73
Вещество неэлектролит:
А)ZnCl2
В)Na2SO4
С)CrCl3
D)MnO
Е)Cu(NO3)2
$$$ 74
Сильный электролит - это:
А)HNO3 a=94 %
В)СН3СОOH a= 2 %
С)НCN a=0,15 %
D)NH4OH a=1,35 %
Е)H2CO3 a=0,17 %
$$$ 75
Электролит, который диссоциирует ступенчато:
А)KCN
В)H2SO3
С)NaOH
D)KNO3
Е)HCl
$$$ 76
Реакция, идущая с образованием нерастворимого соединения:
А)Ni(OH)2+HNO3®…
В)CaCO3+HCl®…
С)Zn(OH)2+NaOH®…
D)FeCl3+NaOH®…
Е)H2SO4+KOH®…
$$$ 77
Реакция, имеющая краткое ионное уравнение Н++ОН-=Н2О:
А)CH3COOH+Ca(OH)2®…
В)H2CO3+KOH®…
С)HNO3+NaOH®…
D)H2SO4+Cu(OH)2®…
Е)HCl+NH4OH®…
$$$ 78
Реакция, идущая с образованием газообразного вещества:
А)CaCO3+HCl®…
В)Na2SiO3+HCl®…
С)Na2SO4+BaCl2®…
D)NH4Cl+AgNO3®…
Е)H2CO3+Ca(OH)2®…
$$$ 79
Вещество, проявляющее только окислительные свойства:
А)MnO
В)MnO2
С)K2MnO4
D)KMnO4
Е)MnCl2
$$$ 80
Вещество, проявляющее только восстановительные свойства:
А)S
В)H2SO3
С)H2S
D)H2SO4
Е)Na2SO3
$$$ 81
Соединение, содержащее атом в степени окисления “+4”.
А)Zn(OH)2
В)HClO3
С)KNO2
D)Na2SO3
Е)PbS
$$$ 82
Среди приведенных уравнений, покажите процесс окисления:
А)NO2-®NO3-
В)SO42-®SO32-
С)Cl2®2Cl-
D)MnO4-® MnO2
Е)Cu2+®Cu0
$$$ 83
Среди приведенных уравнений, укажите процесс восстановления:
А)SO32-® SO42-
В)S2-®S0
С)MnO4-®MnO2
D)NH3®NO3-
Е)Cr3-®Cr0
$$$ 84
Эквивалентная масса восстановителя в данной реакции равна:
K2Cr2O7+SnCl2+H2SO4®Sn(SO4)2+CrCl3+K2SO4.
M(K2Cr2O7)=294 г/моль; M(SnCl2)=190 г/моль.
190/2
$$$ 85
Низшая и высшая степень окисления азота равны: : -3 +5
$$$ 86
Число моль ионов водорода, участвующих в восстановлении иона ClO3- в ион Cl- равно: 6 ионов 3моль
$$$ 87
Эквивалентная масса окислителя в реакции равна:
HNO3+H2S®NO+S+H2SО4.
M(HNO3)=63 г/моль; M(H2S)=34 г/моль.
63/3
$$$ 88
Соединение, в котором степень окисления одного из атомов равна “+6”:
А)HNO3
В)KMnO4
С)K2Cr2O7
D)H2S
Е)H2O2
$$$ 89
Тип, к которому относится данная реакция P+H2O®H3PO3+PH3:
А)межмолекулярный
В)внутримолекулярный
С)контрпропорционирования
D)диспропорционирования
$$$ 90 Закончите уравнение реакции. Определите коэффициент перед восстановителем: Mg+HNO3®Mg(NO3)2+NH4NO3+H2O 4С)водородного
Е)золотого $$$ 105А)Ca
В)Cu
С)Ag
D)Au
Е)Pt
$$$ 114
На железной пластинке, опущенной в раствор сульфата меди, выделилось 1,5 г меди. На сколько грамм растворилась железная пластинка? АFe=55,84 г/моль, АCu=63,54 г/моль. 160
$$$ 115
Сколько граммов сахарозы (С12Н22О11) надо растворить в 100 г воды, чтобы понизить температуру кристаллизации на 1 градус? К(Н2О)=1,86.
С)18,4г;
$$$ 116
Количество вещества и масса, которые составляют 1,12 м3 аммиака (при н.у.):
$$$ 117
Соль, при электролизе раствора которой будет выделяться на аноде кислород (О2):
А)CuCl2
В)NaI
С)NaBr
D)KCl
Е)K2SO4
$$$ 118
Ток силой 2,5А, проходя через раствор электролита, за 30мин выделяет из раствора 2,77 г металла. Найдите эквивалентную массу металла. 3
$$$ 119
Тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов - …3s1 и …3s23p5:
A) атомная, ковалентная неполярная
В) молекулярная, ковалентная полярная
С) молекулярная, ковалентная неполярная
D) металлическая решетка, металлическая связь
Е) ионная решетка, ионная связь
$$$ 120 Определите ЭДС гальванического элемента состоящего из магниевой и медной… Е)+2,68 В;С)увеличивают скорость химической реакции, участвуют в ней, но после реакции остаются в неизменной форме
D)уменьшают скорость химической реакции, участвуют в ней и расходуются
Е)не влияют на скорость химической реакции
$$$ 125
В строении атомов алюминия и кремния одинаковое:
А)количество энергетических уровней
С)высшая валентность D)номер группы Е)количество электронов на внешнем энергетическом уровнеА)Al
В)Ca
С)K
D)Fe
Е)Na
$$$ 132
В каких массовых отношениях надо смешать два раствора с массовой долей растворенного вещества 10 и 40%, чтобы получить 20% раствор?
$$$ 133
Ток силой 6 А пропускали через водный раствор серной кислоты в течение 1,5ч. Вычислите массу разложившейся воды.А)3,02г;
$$$ 134
Уравнение, соответствующее образованию основной соли:
А)Zn(OH)2+HNO3®¼
В)KOH+H2SO4®¼
С)NH4OH+H2S®¼
D)NaOH+HCN®¼
Е)LiOH+H3PO4®¼
$$$ 135
Уравнение, соответствующее образованию кислой соли:
А)KOH+HNO3®¼
В)HCl+Fe(OH)3®¼
С)Cr(OH)3+CH3COOH®¼
D)NaOH+H2SO3®¼
Е)Ca(OH)2+HCl®¼
$$$ 136
Докажите амфотерность свинца, дописав уравнение реакции:
Pb(OH)2+2KOH=…+2H2O
А)H2PbO2
В)K2PbO2
С)PbO
D)PbO2
Е)H2PbO3
$$$ 137
Формула, с помощью которой можно привести объем газа к нормальным условиям:
А)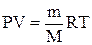
В)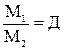
С)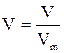
D)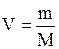
Е)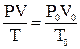
$$$ 138
Объем (л), занимаемый 0,5 моль водорода при н.у.: 11,2
$$$ 139
Количество вещества (моль), находящееся в 11,2 л оксида углерода(IV) при н.у.: 0,5
$$$ 140
Формула, с помощью которой можно определить молярный объем:
А)m=n×M
В)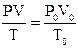
С)N=n×NA
D)V=n×Vm
Е)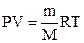
$$$ 141
Выражение, соответствующее уравнению скорости для гомогенной реакции 2NO(г)+O2(г)=2NO2(г):В) u = k ×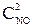 ×
×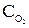 ;
;
$$$ 142
Выражение, соответствующее уравнению скорости для гетерогенной реакции S(к)+O2(г)=SO2(г): D)V=K*C(SO2)
$$$ 143
Молярная масса эквивалента (г/моль) ортофосфорной кислоты (М(Н3РО4)=98г/моль) в реакции Н3РО4+Са(ОН)2=СаНРО4+2Н2О: D)4,9
$$$ 144
Плотность газа по воздуху равна 2,2. Какова относительная молекулярная масса газа? Мвозд=29 г/моль. 2,2*29
$$$ 145
Значения эквивалентных объемов водорода и кислорода при н.у.:
А)11,2 л/моль и 5,6 л/моль
В)11,2 л/моль и 11,2 л/моль
С)11,2 л/моль и 22,4 л/моль
D)22,4 л/моль и 22,4 л/моль
Е)22,4 л/моль и 11,2 л/моль
$$$ 146
Определите количество молей в 56 г N2 при н.у. В)2,0
$$$ 147
В каком случае содержится больше молекул при н.у.?
А)10 г N2
В)10 г O2
С)10 г SO3
D)10 г NH3
Е)10 г SO2
$$$ 148
Масса (г) серной кислоты количеством 0,5 моль. М(H2SO4)=98 г/моль. 49
$$$ 149
Какой объем (л) при нормальных условиях займет аммиак (NH3) массой 34 г? . 44,8
$$$ 150
Формула, выражающая закон эквивалентов:
А)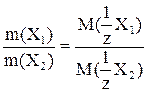
$$$ 151
Число молекул в 3,4 г сероводорода: 6,02 * 10 24
$$$ 152
Определите молярную массу газа (г/моль), если 11 г этого газа занимает объем 5,6л при н.у. 44
$$$ 153
Масса (г) и число молекул, содержащихся в 2 молях фтороводорода:
А)20 г и 12,04*1023 молекул
$$$ 154
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 400С скорость возрастает в 81 раз?
3
$$$ 155
Для какой из обратимых реакций повышение давления сместит равновесие в направлении прямой реакции?
А)H2+I2 Û 2HI
В)CO+H2 Û CO+H2O
С)N2+O2 Û 2NO
D)N2+3H2 Û 2NH3
Е)2HBr Û H2+Br2
$$$ 156
Как изменится скорость реакции 2NO(г)+O2(г)=2NO2(г), если уменьшить объем реакционного сосуда в 3 раза?
А)понижается в 6 раз
В)возрастает в 20 раз
С)не изменится
D)возрастает в 27 раз
$$$ 157 Как изменится скорость реакции N2(г)+3Н2(г) Û 2NН3(г), если увеличить давление в системе в 3 раза?А)возрастает в 2 раза
С)возрастает в 8 раз D)не изменится Е)возрастает в 16 разС)увеличению частоты столкновении молекул
D)возрастанию теплоты реакции
Е)уменьшению теплоты реакции
$$$ 162
Для смещения равновесия реакции 2NO+O2®2NO2+Q влево необходимо:
А) увеличить концентрацию О2
В) повысить температуру
С) увеличить концентрацию NO
D) повысить давление
Е) уменьшить концентрацию NO2
$$$ 163
При увеличении концентрации HCl в 2 раза скорость химической реакции 4HCl(г)+O2(г)®2H2O(г)+2Cl2(г) увеличится в:
А)2 раза
В)32 раза
С)8 раз
D)16 раз
$$$ 164 Во сколько раз увеличится скорость химической реакции, протекающей в газовой фазе, при повышении температуры от 320 до…D)не сместится
Е)сместится в сторону образования Fe3O4
$$$ 167
Для смещения равновесия системы вправо, т.е. в сторону образования аммиака в реакции: N2(г)+3H2(г) Û 2NH3(г), необходимо:
А)увеличить давление
В)уменьшить давление
С)увеличить концентрацию аммиака
D)уменьшить концентрацию азота
Е)увеличить объем газов
$$$ 168
Чтобы сместить равновесие системы 2CO(г)+O2(г) Û 2CO2(г)+Q влево (в сторону исходных веществ) необходимо:
А)увеличить концентрацию СО
В)увеличить концентрацию О2
С)уменьшить концентрацию СО2
D)увеличить температуру
$$$ 169 Выражение закона действующих масс, справедливое для гетерогенной реакции С(тв)+СО2(г)=2СО(г):А)(NH4 )2S
C)NaCI D)NaNO3 Е)KCIЕ)HCI = 0,1; H2SO4 = 0,1
$$$ 181
Количество электронов, которое получает молекула K2Cr2O7 в реакции:
KJ + K2Cr2O7 + H2SO4 ® J2 + K2SO4 + Cr2 (SO4)3 + H2O 3
$$$ 182
Масса растворенного вещества, содержащаяся в растворе массой 1,8 кг, если его массовая доля составляет 20%: 36г
$$$ 183
К 1000 г 80%-ного раствора уксусной кислоты прибавлено 3 л воды. Найти процентную концентрацию полученного раствора. 80/3
$$$ 184
Определите молярную массу эквивалента окислителя в уравнении:
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 +K2SO4 + 10CO2 + 8H2O
$$$ 185
Вычислите стандартную теплоту образования NH3(г), зная, что окисление NH3 протекает по термохимическому уравнению:
4NH3(г)+3О2(г)=2N2(г)+6Н2О(ж);
∆rН0298 = -1530кДж, ∆fН0298(Н2О(ж)) = -285,84кДж.
-101,08 либо 382,5
$$$ 186
Исходя из теплового эффекта реакции Fe2O3(к) +3CO(г)=2Fe(к)+3CO2(г), равного
-26,8 кДж, вычислите теплоту образования (∆fН0298) оксида железа(III). ∆fН0298(CO)=-110,5 кДж, ∆fН0298 (CO2)=-393,51 кДж. - 821,6
$$$ 187
Определите комплексное основание:
А)Na3[Al(OH)6]
В)K2[Zr(OH)6]
С)[Cu(NH3)4](OH)2
D)Ba2[Co(OH)6]
Е)Na2[Pt(OH)6]
$$$ 188
Определите аммиакат.
А)(NH4)2[Be(OH)6]
В)[Co(NH3)6]Cl3
С)K[AuBr4]
D)Na2[SiF6]
Е)K3[Fe(CN)6]
$$$ 189
Степень окисления комплексообразователя в соединении K[Cr(SO4)2]: +1
$$$ 190
Частица-комплексообразователь в соединении [Cu(NH3)2(H2O)2](OH)2:
$$$ 191
Определите пару сильных электролитов.
А)HCN, [Cu(NH3)4](OH)2
В)H[Ag(CN)2], Cu(OH)2
С)[Cu(NH3)4](OH)2, H[Ag(CN)2]
D)Cu(OH)2, HCN
Е)Cu(OH)2, [Cu(NH3)4](OH)2
$$$ 192
Определите аквакомплексное соединение.
А)[Pt(NH3)6]Cl4
В)H2[Si(OH)6]
С)[Fe(CO)5]
D)[Cr(H2O)6]Cl3
Е)[Cu(NH3)4](OH)2
$$$ 193
Координационное число, наиболее характерное для иона Zn2+:
А)4
В)2
С)6
D)8
Е)3
$$$ 194
Определите комплексное соединение, в котором заряд комплекса равен «3+».
А)[Ag(NH3)2]Cl
В)[Cr(H2O)6]Cl3
С)[Pt(NH3)6]Br4
D)[Cu(H2O)4]SO4
Е)[Mg(H2O)6]SO4
$$$ 195
Определите комплекс-анион.
А)[Cr(H2O)2(SO4)2]
В)[Cr(H2O)5Cl]
С)[Cr(H2O)4Cl2]
D)[Cr(NH3)5SO4]
Е)[Cr(NH3)5CN]
$$$ 196
Определите заряд и координационное число комплексообразователя в комплексном соединении H[Co(NH3)2(CN)4]. – 1 и 6
$$$ 197
Определите степень окисления и координационное число комплексообразователя в Na2[Fe(CO)Cl5]. 4 и 6
$$$ 198
Соединение, не вступающее в реакцию нейтрализации:
А)[Cu(NH3)4](OH)2
В)Na3[Al(OH)6]
С)[Co(H2O)6](OH)3
D)[Cd(CN)4](OH)2
Е)[Zn(NH3)4](OH)2
$$$ 199
Из раствора какого соединения не выпадает осадок BaSO4 при приливании раствора BaCl2?
А)K[Cr(SO4)2]
В)[Zn(NH3)4]SO4
С)[Pt(H2O)4]SO4
D)[Cu(NH3)4]SO4
Е)[Ni(NH3)2(H2O)2]SO4
$$$ 200
Определите степень окисления и координационное число комплексообразователя в соединении K[PtNH3Cl5].
А)+2 и 8
В)+4 и 9
С)+4 и 6
D)+2 и 6
Е)+3 и 6