рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Электроника
- /
- А)(NH4 )2S
Реферат Курсовая Конспект
А)(NH4 )2S
А)(NH4 )2S - раздел Электроника, Элемент, сокращенная электронная формула которого 6d57s2 находится в группе B)K2So4 C)Naci D)Nano3...
B)K2SO4
C)NaCI
D)NaNO3
Е)KCI
$$$ 172
Определите рН раствора, если концентрация Н+ ионов равна 10-4 моль/л. 4
$$$ 173
Используя закон действия масс, определите скорость реакции A +3D ® 2C:
А)u = k×[C]
В)u = k×[A]
С)u = k×[D]
D)u= k×[A]×[D]3
Е)u = k×[C]2
$$$ 174
5Na2SO3+2KMnO4+3H2SO4 ®5Na2SO4+K2SO4+3H2O+2MnSO4
в приведенной реакции определите окислитель: A) KMnO4;
$$$ 175
Выразите константу равновесия для реакции: 2Н2 + СО  СН3ОН
СН3ОН
А) 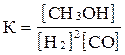 ;
;
$$$ 176
Правильное выражение рН раствора:
А)pH = -lg[H2O]
B)pH = -lg[H+]
C)pH = pOH
D)pH =-ln[H+]
E)pH = lg[H+]
$$$ 177
Определите молярную массу эквивалента соли Fe2(SO4)3: : /6
$$$ 178
Формула, по которой можно определить титр раствора:
А)
B)T = N×Э
C)T = m×V
D)T = m×N
Е)
$$$ 179
Формула, по которой можно определить молярную концентрацию:
A)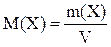
B)
C)
D)N = C×V
E)C = N×V
$$$ 180
Чему равна эквивалентная концентрация растворов HCI и H2SO4, если их титры соответственно равны 0,00359 г/мл и 0,004805 г/мл?
А)HCI = 0,0984; H2SO4 = 0,0981
В)HCI = 0,00985; H2SO4 = 0,009806
С)HCI = 0,000985; H2SO4 = 0,0009806
D)HCI = 0,9850; H2SO4 = 0,9806
– Конец работы –
Эта тема принадлежит разделу:
Элемент, сокращенная электронная формула которого 6d57s2 находится в группе
При взаимодействии очень разбавленной азотной кислоты с цинком образуется... А NH... B NH NO C NO D NO...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: А)(NH4 )2S
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов