Строение молекулы октана.
исследования возник лишь во второй половине XVIII в. После опытов Кавендиша с «горючим воздухом» в 1766 г. природный газ некоторое время отождествляли с водородом. Лишь в
1776 г. Алессандро Вольта установил, что в нём содержится углерод. Точный состав метана был определён Джоном Дальтоном в 1805 г. В последующие десятилетия учёным удалось выделить другие простейшие алканы — бутан (1838 г.), этан (1849 г.), пентан (1849 г.), пропан (1857 г.). В 1866 г. А. М. Бутлеров получил изобутан. Но, пожалуй, наиболее принципиальное значение имел разработанный в 1926 г. немецкими химиками Францем Фишером (1877—1947) и Гансом
КАК ИХ СОСЧИТАТЬ?
Количество возможных изомеров у предельных углеводородов (алканов) потрясает даже искушённое воображение:
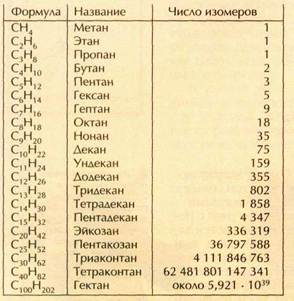
Начиная с С167Н336, число изомеров уже превышает число элементарных частиц в видимой части Вселенной, которое оценивается как 1080. Так, у С200Н402 может быть до 9,430•1083 изомеров. А если учитывать ещё и зеркально-симметричные молекулы — стереоизомеры, эти числа значительно возрастут: с 9 до 11 для гептана, с 75 до 136 для декана, с 336 319 до 3 396 844 для эйкозана, с 5,921•1039 до 1,373•1046 для гектана и т. д. Углеводород с самой длинной цепью — нонаконтатриктан С390Н782 синтезировали в 1985 г. английские химики И. Билл и М. К. Уайтинг.
Не одно поколение школьников и студентов благоговейно разглядывало подобные таблицы в учебниках по органической химии. Однако подметить какую-либо закономерность в цифрах не удавалось.
Первым эту проблему решил английский математик Артур Кэли (1821—1895), один из основоположников топологии. Оказалось, что формулы, по которой можно сразу определить число изомеров для углеводорода состава СnН2n+2, просто не существует. Есть только так называемые рекуррентные (от лат. recurrens — «возвращающийся») формулы, которые позволяют рассчитать число изомеров n-го члена ряда, если уже известно число изомеров (n-1)-го члена. Расчёты для больших значений n, выполненные сравнительно недавно с помощью мощных компьютеров, доведены до углеводорода С400Н802, для которого, с учётом стереоизомеров, получено значение почти неподвластное воображению: 4,776•10199!
Собственно, для химиков практический интерес представляет только число структурных изомеров первых членов ряда. Дело в том, что даже для сравнительно простого алкана, содержащего всего полтора десятка атомов углерода, подавляющее большинство изомеров не получено, и вряд ли это когда-либо произойдёт. Так, последние из 75 изомеров декана синтезированы лишь к 1968 г. И сделано это было только для того, чтобы иметь более полный набор стандартных соединений, по которым можно распознать разные углеводороды, например те, что встречаются в нефти. (Кстати, в нефтях были обнаружены все 18 изомеров октана.)
Кроме того, начиная с гепталекана С17Н36, сначала лишь некоторые изомеры, затем — многие из приведённых в таблице, а потом — практически все служат ярким примером «бумажной химии», т. е. не могут существовать в действительности.
Всё дело в том, что по мере роста числа атомов углерода в молекулах изомеров «сферической» формы затрудняется их размещение в пространстве при замене атомов водорода на метильные группы CH3. Ведь математики рассматривали атомы углерода и водорода как точки, а на самом деле они имеют конечный радиус. Уже на поверхности сильно разветвлённого изомера С17Н36 для размещения всех 36 атомов водорода в 12 метильных группах не хватает места. Это легко проверить, если нарисовать структуру изомеров на плоскости, соблюдая постоянство длин связей С—С и С—Н и всех углов между ними.
Тропшем (1889—1935) способ синтеза жидких алканов из оксида углерода (II) и водорода на кобальтовом или никелевом катализаторе при +200 °С: nСО +(2n+1)Н2®СnН2n+2+nН2О.
Эта реакция используется для промышленного производства синтетического бензина.
У алканов есть ещё одно название — парафины (от лат. parum affinis — «мало сродства»). Действительно, предельные углеводороды редко проявляют «сродство» к реагентам. Однако при определённых условиях они легко вступают в различные реакции, например в реакции замещения, протекающие по радикальному механизму. Проще всего для алканов осуществить взаимодействие с хлором или бромом (фторирование, как правило, приводит к разрушению связей С—С, иод же не реагирует с алканами). Такие реакции происходят на свету, при нагревании или в присутствии пероксидов. В результате хлорирования метана последовательно образуются СН3Сl, СН2Сl2, СНСl3 и ССl4:

Реакции хлорирования гомологов метана, как правило, приводят к образованию смеси различных хлорпроизводных. Например, при хлорировании пропана продуктом реакции будет смесь 1-хлорпропана (45%) и 2-хлорпропана (55%):

В таких реакциях легче всего замещаются третичные атомы водорода в составе молекул алканов, несколько труднее — вторичные, а ещё труднее — первичные:

ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ СnН2n+2

Это связано с разной устойчивостью радикалов: радикал СН3С•НСН3 более стабилен, чем СН3СН2С•Н2. При бромировании различие в реакционной способности радикалов проявляется ещё отчётливее. Так, в случае пропана выход 2-бромпропана СН.—СНBr—СН3 будет составлять уже 97%.
По радикальному механизму протекают и другие реакции алканов, например нитрование и сульфохлорирование. Нитрование проводят при нагревании в автоклаве смеси алкана с 12-процентной азотной кислотой либо с парами азотной кислоты или оксидов азота. В результате
