рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Высокие технологии
- /
- Составление материальных балансов
Реферат Курсовая Конспект
Составление материальных балансов
Составление материальных балансов - раздел Высокие технологии, ТЕХНОЛОГИЧЕСКИЕ РАСЧЕТЫ Пример 5. Составить Материальный Баланс Печи...
Пример 5. Составить материальный баланс печи для сжигание серы производительностью 60 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,5. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Решение
Процесс горения серы описывается уравнением; реакции
S + О2 = SO2
производительность печи
 т/ч = 2500 кг/ч серы
т/ч = 2500 кг/ч серы
Количество окисленной до SO2 серы
2500 × 0,95 = 2375 кг
Осталось в виде паров неокисленной серы
2500 – 2375 =125 кг
Израсходовано кислорода на окисление
 м3
м3
С учетом коэффициента избытка a
1670×1,5 = 2500 м3 или  кг О2
кг О2
С кислородом поступает азота
 м3 или
м3 или  кг
кг
Образовалось в результате реакции двуокиси серы
 кг
кг
или
 м3
м3
Осталось неизрасходованного кислорода
1670×0,5 = 835 м3 или  кг
кг
Полученные данные сводим в таблицу:
Материальный баланс печи для сжигания серы
| Приход | Расход | ||||
| исходное вещество | кг | м3 | продукт | кг | м3 |
| S | S | ||||
| O2 | SO2 | ||||
| N2 | O2 | ||||
| N2 | |||||
| Итого: | Итого: |
Пример 6.Составить материальный баланм производства окиси этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в % (об.): этилен - 3, воздух - 97. Степень окисления этилена Х = 0,5. Расчет следует вести на 1 т окиси этилена.
Решение
Окись этилена является одним из важнейших полупродуктов, имеющих широкое применение в различных синтезах - для получения этиленгликоля, полигликолей, лаковых растворителей, пластификаторов, этаноламинов, различных эмульгирующих и моющих средств; соединения, синтезируемые из окиси этилена, находят применение в производстве синтетических волокон, каучуков и других продуктов.
В настоящее время применяются два основных метода получения окиси этилена:
1. гипохлорирование этилена с последующим отщеплением хлористого водорода от получающегося этиленхлоргидрина;
2. прямое каталитическое окисление этилена. При пропуска пропускании смеси воздуха с этиленом (нижний предел взрываемости эти
леновоздушной смеси - 3,4% С2Н4) на серебряном катализаторе при 250-280°С образуется окись этилена:
 |
Окись этилена из газовой смеси выделяют водной адсорбцией, а остаточный газ направляют во второй контактный аппарат.
По уравнению реакции находи расход этилена на 1 т окиси этилена. Из 28 кг этилена образуется 44 кг С2Н2О или расход С2Н4 на 1000 кго окиси этилена составит:
 кг
кг
С учетом степени окисления:
 кг или
кг или  м3
м3
Объем воздуха в этиленвоздушной смеси составит
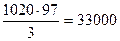 м3
м3
в том числе кислорода 33000×0,21 = 6800 м3 или
 кг
кг
азота 33000×0,79 – 26200 м3 или
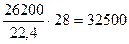 кг
кг
Израсходовано кислорода на окисление
 м3
м3
В продуктах окисления содержится кислорода:
6800 – 255 = 6545 м3 или  кг
кг
Результаты расчетов сведены в таблицу.
Материальный баланс на 1 т окиси этилена
| Приход | Расход | ||||
| исходное вещество | кг | м3 | продукт | кг | м3 |
| Этилен | Окись этилена | ||||
| Воздух | Этилен | ||||
| в том числе: | Кислород | ||||
| кислород | Азот | ||||
| азот | |||||
| Итого | Итого |
Пример 7. Составить материальный баланс отделения окисления аммиака на 1 т азотной кислоты. Степень окисления NH3 до NО - 0,97 и до N2 - 0,03; NO до NO2 - 1,0 и степень абсорбции 0,92. Содержание аммиака в сухой аммиачно-воздушной смеси 7,13% (масс). Воздух насыщен парами воды при 30°С. Относительная влажность 80%.
Решение
Азотную кислоту получают окислением аммиака кислородом воздуха с последующей переработкой образующихся окислов азота.
Балансовое уравнение производства азотной кислоты из аммиака можно записать следующим образом:
NH3 + 2О2 = НNО3 + Н2О + 411,2 кДж/моль
Окисление аммиака до окиси азота производят на платиновом или окиснохромовом катализаторе.
Затем окись азота окисляют до двуокиси и последнюю поглощают водой и азотной кислотой.
В соответствии с балансовым уравнением из 1 кмоль NH3 образуется 1 кмоль НNO3. Количество аммиака, необходимое для производства 1 т НNO3 составит
 т = 303 кг
т = 303 кг
где молекулярная масса: НNO3 – 63; NH3 – 17
или
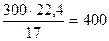 м3
м3
Расход воздуха на 1 т НNO3 составит
 кг
кг
или
 м3
м3
где 29,0 – молекулярная масса воздуха.
В том числе:
кислорода
 м3 или
м3 или  кг
кг
азота
 м3 или
м3 или  кг
кг
Поступает сухих газов 3070 м3. Парциальное давление паров воды при 30°С и относительной влажности 80% составит:
0,8 × 4,22 × 103 = 3,37 × 103 Па
где 4,22 × 103 Па давление насыщенного водяного пара при 30°С.
С газом поступают воды:
 или
или  кг
кг
Расчет состава нитрозных газов. Образуется по реакции
4NH3 + 5O2 = 4NO + 6H2O
окиси азота
400 × 0,97 = 388 м3 или  кг
кг
воды
 м3 или
м3 или  кг
кг
Расходуется кислорода:
 м3 или
м3 или  кг
кг
По реакции:
4NH3 + 3O2 = 2N2 + 6Н2О
образуется азота
 м3 или
м3 или  кг
кг
воды
 м3 или
м3 или 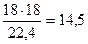 кг
кг
Расходуется кислорода:
 м3 или
м3 или  кг
кг
| Состав нитрозных газов: | кг | м3 | % (об) |
| NO | 518,0 | 10,3 | |
| O2 | 923-693-12,7=217,3 | 4,1 | |
| N3 | 3030+7,5=3037,5 | 66,6 | |
| H2O | 14,5+468+84,5=567 | 19,1 |
Результаты расчетов сведены в таблицу.
Материальный баланс на 1 т HNO3
| Приход | Расход | ||||
| исходное вещество | кг | м3 | продукт | кг | м3 |
| Аммиачно-воздушная смесь: NH3 О2 N2 Н2О | 84,5 | Нитрозные газы: NO О2 N2 Н2О | 217,3 3037,5 | 24,30 | |
| Итого | 4340,5 | Итого | 4339,8 |
– Конец работы –
Эта тема принадлежит разделу:
ТЕХНОЛОГИЧЕСКИЕ РАСЧЕТЫ
Федеральное агентство по образованию... Саратовский государственный технический университет...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Составление материальных балансов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов