Атома водорода.
В 1921 году Штерном и Герлахом был поставлен прямой опыт по обнаружению квантования магнитного момента атомов. В вакуумной камере устанавливался электромагнит со специальной формой наконечников, чтобы создавать сильно неоднородное магнитное поле. Атомный пучок, формируемый испарителем К и системой щелей В,В', проходит вдоль полюсов магнита и попадает на экран (рис. 4).
В отсутствие магнитного поля на экране получалось четкое изображение щели. При включении сильно неоднородного магнитного поля на атомы действует сила, среднее значение которой определяется проекцией магнитного момента  и производной
и производной 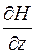
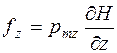
Если величина  принимает любые значения (непрерывна), то при прохождении через магнитное поле полоска Р на экране должна расплываться. Если
принимает любые значения (непрерывна), то при прохождении через магнитное поле полоска Р на экране должна расплываться. Если  принимает квантованные значения
принимает квантованные значения
 ,
,
то возможны (2l+1) различных проекций магнитного момента и на экране вместо одной полоски должны получаться (2l+1) полоски.
Опыт показал, что действительно из одной полоски получается несколько, т.е. квантование проекции магнитного момента было обнаружено, но число полосок было всегда четным, хотя величина (2l+1) всегда нечетная.
Кроме этого факта, не укладывающегося в теорию, было обнаружено спектральными методами, что энергетические уровни имеют тонкую структуру, т.е. состояние с энергией Еn расщепляется на на два подуровня.
 Для объяснения тонкой структуры спектров и опыта Штерна-Герлаха в 1925 году Дж.Уленбек и С. Гаудсмит выдвинули предположение, что помимо трех степеней свободы, определяемых тремя квантовыми числами n, l, m, существует четвертая - внутренняя степень свободы, и состояние электрона должно характеризоваться еще и четвертым квантовым числом. Согласно этой гипотезе у электрона есть собственный момент импульса, так называемый спин
Для объяснения тонкой структуры спектров и опыта Штерна-Герлаха в 1925 году Дж.Уленбек и С. Гаудсмит выдвинули предположение, что помимо трех степеней свободы, определяемых тремя квантовыми числами n, l, m, существует четвертая - внутренняя степень свободы, и состояние электрона должно характеризоваться еще и четвертым квантовым числом. Согласно этой гипотезе у электрона есть собственный момент импульса, так называемый спин  , и связанный с ним собственный магнитный момент
, и связанный с ним собственный магнитный момент 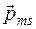 .
.
Анализ опыта Штерна-Герлаха и дублетной структуры атома водорода привел к выводам, что
 ,
,
где  – спиновое квантовое число.
– спиновое квантовое число.
Проекция спина на ось квантуется по обычным правилам
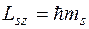
где  – магнитное спиновое квантовое число, которое для электрона может принимать только два значения.
– магнитное спиновое квантовое число, которое для электрона может принимать только два значения.
Первоначально считалось, что спин возникает из-за вращения электрона вокруг своей оси, но из опыта Штерна-Герлаха следует, что гиромагнитное отношение 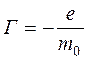 для спиновых моментов в два раза больше по величине, чем для орбитального движения, и для такого классического вращения заряженной частицы вокруг своей оси
для спиновых моментов в два раза больше по величине, чем для орбитального движения, и для такого классического вращения заряженной частицы вокруг своей оси

В 1928 году Дирак показал, что спин электрона автоматически получается в релятивистской квантовой теории, и при этом получается правильное гиромагнитное отношение. В теории Дирака о внутренней структуре электрона никаких предположений не делалось.
Таким образом, спин электрона оказался квантово-релятивистским эффектом, не имеющим классического истолкования.
Паули показал как можно включить спин электрона в нерелятивистскую квантовую теорию, основанную на уравнении Шредингера. При этом необходимо учитывать взаимодействие орбитального и спинового магнитных моментов, что приводит к дополнительной энергии спин-орбитального взаимодействия, зависящей от взаимной ориентации угловых моментов.
Полный момент импульса 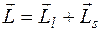 , причем
, причем
 ,
,
где j – квантовое число полного углового момента. Оно принимает значения
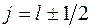 .
.
Проекция полного момента определяется квантовым числом
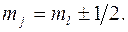
При заданном j возможны 2j +1 квантовое состояние

Число таких состояний у атомов с одним валентным электроном всегда четное, что и объясняет четность расщепления в опыте Штерна-Герлаха.
Наличие спин-орбитального взаимодействия приводит к тому, что энергия электрона зависит от квантового числа j
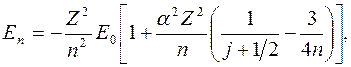
где 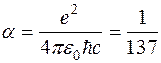 – постоянная тонкой структуры.
– постоянная тонкой структуры.
 |
Из-за малости величины
 поправка к нерелятивистской формуле получается очень малой. Энергия уровней зависит от n и j, но не зависит от l. Поэтому состояния с одним и тем же j, но разными l (разной ориентацией спинов) имеют одинаковую энергию.
поправка к нерелятивистской формуле получается очень малой. Энергия уровней зависит от n и j, но не зависит от l. Поэтому состояния с одним и тем же j, но разными l (разной ориентацией спинов) имеют одинаковую энергию.
В спектроскопии состояние электрона принято обозначать числами n, l, j, 2s+1 и заменять число l=0, 1, 2, 3, 4,... буквой s, p, d, f, g,..., соответственно.
Например, запись 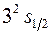 означает, что электрон находится в состоянии с квантовыми числами n=3, l=0, j=
означает, что электрон находится в состоянии с квантовыми числами n=3, l=0, j=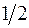 , 2s+1=2 (последняя цифра означает, что для атома с одним валентным электроном состояние является дублетом).
, 2s+1=2 (последняя цифра означает, что для атома с одним валентным электроном состояние является дублетом).
В состоянии 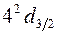 квантовые числа имеют значения n = 4, l =2, j =
квантовые числа имеют значения n = 4, l =2, j =  , причем спин ориентирован вниз (
, причем спин ориентирован вниз (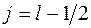 ). В состоянии
). В состоянии 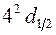 – n=4, l=2,
– n=4, l=2, 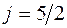 и спин ориентирован вверх (
и спин ориентирован вверх ( ).
).
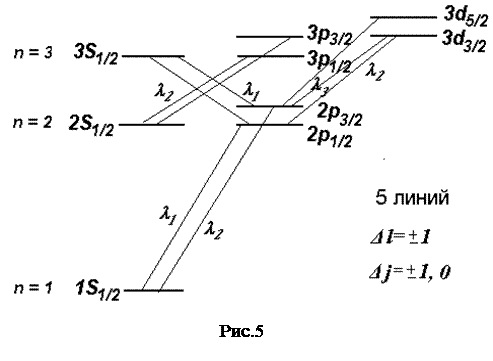
На рис.5 показана тонкая структура нижних уровней атома водорода и переходы между ними, в соответствии с правилами отбора 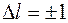 ,
, 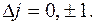
Тонкая структура энергетических уровней обуславливает тонкую структуру спектральных линий, так для перехода из состояния с n=2 в состояние с n=1 получаются две спектральные линии, а для перехода из состояния с n=3 в состояние с n=2 – пять спектральных линий.