Внутренняя энергия идеального газа. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы
Важной характеристикой термодинамической системы является ее внутренняя энергия U – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц.
К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
В курсе физики уже встречалось понятие числа степеней свободы i: это число независимых координат, полностью определяющих положение тела (материальной точки, системы материальных точек) в пространстве. Так, например, положение материальной точки определяется тремя координатами (x, y, z), следовательно, i=3. Тонкий стержень имеет 5 степеней свободы (x, y, z, a, b), т.е. 3 поступательные и 2 вращательные, твердое тело имеет 6 степеней свободы (x, y, z, a, b, g), т.е. 3 поступательные и 3 вращательные.
С учетом этого для одноатомных молекул газа (He, Ne, Ar …) i=3, для двухатомных молекул газа (H2, O2, N2 …) с жесткой связью атомов i=5, для трех- и более атомных молекул газа с жесткой связью атомов (CO2, NH3 …) i=6.
Естественно, что жесткой связи между атомами не существует – атомы могут совершать колебания. С учетом этого полное число степеней свободы iå=i+2iколеб. В классической теории рассматривают молекулы с жесткой связью атомов, для них iколеб.=0.
Итак, независимо от числа степеней свободы молекул, три степени свободы всегда поступательные. Ни одна из них не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <Wk> [см.(16) в лекции 1,2], т.е.
<Wk>/3 = kT/2.
Важнейший закон классической статистической физики – закон равномерного распределения энергии по степеням свободы – утверждает: на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная kТ/2.
Следовательно, средняя кинетическая энергия молекулы, имеющей i степеней свободы, <Wk> = 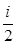 kT . (1)
kT . (1)
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (т.е. молекулы между собой не взаимодействуют), то внутренняя энергия U представляет собой кинетическую энергию его молекул.
Для одного моля
 , (2)
, (2)
для произвольной массы m газа
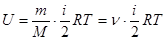 , (3)
, (3)
где М – масса моля, n=m/M – число молей.
Таким образом, внутренняя энергия идеального газа пропорциональна температуре газа и зависит от числа степеней свободы его молекул.