Технологічний процес горіння палива
Для процесу горіння необхідно, щоб горючі речовини і окислювач мали деяку (певну для кожної речовини) температуру, за якої порівняно швидко відбувається їх взаємодія. Температура, за якої хімічний процес різко пришвидчується у разі зіткнення з відкритим вогнем і речовина займається, називається температурою займання. Якщо займання речовини відбувається без стикання з відкритим вогнем, матимемо температуру самозаймання. Подальше горіння продовжується внаслідок безперервного виділення тепла.
Швидкість процесу горіння залежить в основному від умов сумішоутво-рення. Залежно від цього горіння розділяють на кінетичне і дифузійне. Якщо процес утворення суміші палива і повітря передує горінню, то горіння нази-вають кінетичним і якщо процеси відбуваються одночасно– дифузійним. На практиці, як правило, відбувається змішане горіння – дифузійно-кінетичне.
За температуру горіння приймають температуру, до якої нагріваються газоподібні продукти згоряння внаслідок горіння палива. Розділяють температуру горіння теоретичну і дійсну. Теоретична температура горіння – це максимальна температура, яка може бути досягнута за відсутності втрат теплоти від теплообміну. В реальних умовах процес горіння супроводжується теплообміном і тепловими втратами, тому продукти згоряння мають дійсну температуру горіння, яка є нижчою за теоретичну.
Співвідношення палива і окислювача, яке відповідає хімічній реакції повного окислення паливних елементів називається стехіометричним.
Кількість кисню, теоретично необхідна для спалювання 1 кг твердого або рідкого палива, можна визначити на основі стехіометричного відношення для реакцій горіння елементів горючої маси палива (С, Н, S ).
Із рівнянь повного згоряння цих елементів
C + O = CO2(12 + 32® 44),
2H2 + O2 = 2H2O(4 + 32 ® 36), S + O2 = SO2(32 + 32 ® 64),
Враховуючи їх атомну масу, знаходимо, що для спалювання 12 кг вуглецю потрібно 32 кг кисню, тобто для спалювання 1 кг вуглецю потрібно 32/12 = 2,67 кг кисню. Аналогічно, для спалювання 1 кг водню потрібно 8 кг кисню, а для спалювання 1 кг сірки – 1 кг кисню.
Тоді формула для підрахунку теоретично необхідної кількості кисню, кг, для спалювання 1 кг палива буде мати вигляд
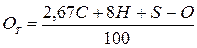 (1.16)
(1.16)
де Q, Н, S, О – хімічні елементи горючої частини палива, % за масою.
Для спалювання палива, як правило, подається повітря, в якому кисень становить 23,2% за масою. Тоді теоретичну необхідну кількість повітря, кг, для спалювання 1 кг палива визначають за формулою
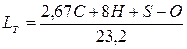 (1.17)
(1.17)
Кількість повітря зручніше визначати в м3/кг. Тоді формула матиме вигляд
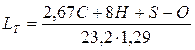 (1.18)
(1.18)
де 1,29 – маса 1м3 повітря.
Для газоподібного палива кількість повітря (м3/м3) визначають за формулою
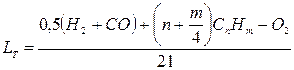 , (1.19)
, (1.19)
де n – число атомів вуглецю; m – число атомів водню; 21 – вміст кисню у повітрі, % за об’ємом.
Склад газу у формулі наведений у процентах за об’ємом.
У виробничих умовах здійснити повне спалювання палива з теоретич-ною необхідною кількістю повітря практично неможливо. Тому для повного спалювання, зазвичай, подають надлишок повітря, тобто процес відбувається не з розрахунковою, а з фактичною (дійсною) кількістю повітря LД.
Відношення дійсної витрати повітря до теоретично необхідної для спалювання 1 кг (1 м3) палива називають коефіцієнтом надлишку повітря (α)
α = LД / LТ (1.20)
Суміш палива і повітря називають пальною сумішшю. Залежно від співвідношення кількості палива і повітря пальна суміш може бути: нормальна α = 1, бідна α > 1,15, багата α < 0,8. За значень близьких до одиниці – збіднена або збагачена.
Коефіцієнт надлишку повітря визначають за формулами:
- у разі повного згоряння
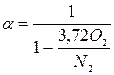 (1.21)
(1.21)
- у разі неповного згоряння
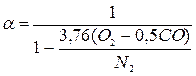 (1.22)
(1.22)
де О2, СО, N2 – процентний вміст за об’ємом у продуктах згоряння відповід-но кисню, оксиду вуглецю (які визначають за допомогою спеціальних при-ладів – газоаналізаторів) і азоту (підраховують за різницею N2 = 100 – (СО2 + O2 + CO)).
Теплота згоряння пальної суміші (Qпс) залежить від кількості теплоти, що виділяється паливом у об’єм повітря
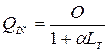 (1.23)
(1.23)
Для різних видів палива теплота згоряння нормальних пальних сумішей приблизно однакова – 2770 кДж/кг.
Пальну суміш, яка змішалася із залишковими газами від попереднього циклу в циліндрі двигуна, називають робочою. Якщо потрібно визначити її теплоту згоряння, то вносять поправку на коефіцієнт надлишкових газів. На практиці теплоту згоряння пальної і робочої суміші порівнюють.
Характер процесу горіння можна визначити за складом продуктів згоряння палива. Для цього існують різні газоаналізатори: хімічні, електрич-ні, магнітні, механічні. Найпоширеніші прості хімічні газоаналізатори, які дозволяють визначити у відпрацьованих газах вміст вуглекислого газу, кисню і оксиду вуглецю. Принцип дії газоаналізаторів полягає у поглинанні розчинами певних складових елементів відпрацьованого газу, який послідов-но пропускають через ці розчини. За відповідним збільшенням об’єму знаходять процентний вміст кожного окремого поглиненого компонента. Так, відсутність оксиду вуглецю свідчить про повне згоряння палива, а наявність СО, СН і Н2 – про неповне.