Убиквитин-зависимая система протеолиза в регулируемой деградации белков
Убиквитин-зависимая система протеолиза проводит поиск потенциальной мишени для протеолитической деградации среди огромного числа внутриклеточных белков. Все белки несут в себе специфические сигналы деградации по аналогии с сигнальными последовательностями, которые направляют вновь синтезируемые белки к определенным органеллам или микрокомпартментам клетки. Однако сигналы протеолитической деградации должны быть более сложными и разнообразными, так как с их помощью не только маркируются белки, удаляемые с помощью протеолиза, но и определяется время удаления, а также скорость их протеолитического расщепления. Для распознавания и декодирования таких сигналов в клетках эукариот имеется убиквитин-конъюгирующая система.
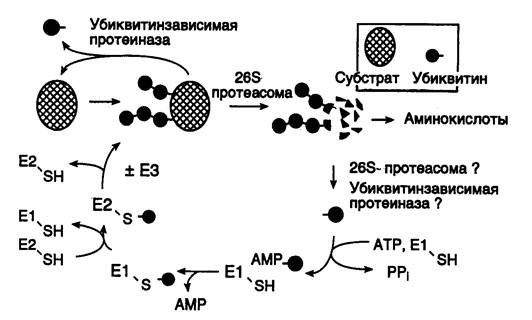
Как в ядре, так и в цитоплазме эта система отделена пространственно и функционально от протеолитических ферментов, организованных в протеасомы. Распознанные данной системой белки-субстраты маркируются путем ковалентного присоединения к ним молекул небольшого стабильного 76-звенного белка – убиквитина. В результате убиквитин соединяется C-концом с боковыми остатками лизина в субстрате. Наличие такой метки в белке, по-видимому, является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам. В большинстве случаев к субстрату присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке. Молекулы белков, содержащие убиквитин, по-видимому, являются для протеасом предпочтительными субстратами. Конъюгацию убиквитина с субстратом можно представить следующим образом (рис. I.41). Вначале убиквитин-активирующий фермент (E1) связывает убиквитин, гидролизует ATP и образует тиоэфирную связь между AMP и убиквитином с последующим переносом молекулы убиквитина на один из своих остатков Cys. Молекула активированного убиквитина далее соединяется с одним из ферментов семейства убиквитин-конъюгирующих ферментов (E2) и часто вслед за этим с убиквитин-лигазой (E3). Процесс конъюгации убиквитина с субстратом может катализироваться как самим E2, так и E2 совместно с E3. Белки E2 и E3 в клетках существуют в виде больших семейств, члены которых различаются по свойствам и внутриклеточной локализации. Мутации в генах семейства E2 у дрожжей показывают, что в ДНК-репарацию, прохождение клеточного цикла, биогенез пероксисом, а также в обеспечение устойчивости к тепловому шоку и ионам кадмия вовлечены разнообразные ферменты. Некоторые из ферментов E2 способны образовывать между собой гетеродимеры, которые, вероятно, в сочетании с различными белками E3 обеспечивают весь большой репертуар субстратных специфичностей убиквитин-конъюгирующих комплексов.