рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Медицина
- /
- Экспрессия генов
Реферат Курсовая Конспект
Экспрессия генов
Экспрессия генов - раздел Медицина, 97Удк 575 Ббк 28.04 П 20 ...
97УДК 575
ББК 28.04
П 20
Ответственный редактор
доктор химических наук Ю.А. Берлин
Рецензенты:
кандидат химических наук В.Г. Коробко
доктор биологических наук В.А. Гвоздев
Патрушев Л.И.
Экспрессия генов. – М.: Наука, 2000. – 000 с., ил.
ISBN 5-02-001890-2
В монографии рассмотрены современные представления о строении и механизмах функционирования генов прокариот и эукариот, а также основные методы их исследования. Книга состоит из двух частей. В первой части обсуждаются структура генома прокариотических и эукариотических организмов, а также механизмы транскрипции, трансляции, репликации, репарации и их регуляции. Во второй части монографии рассмотрены принципы основных методов, используемых в исследованиях генов. Главное внимание уделено современным методам генной инженерии. Обсуждаются наиболее важные аспекты развития современной молекулярной генетики в исследованиях направленного мутагенеза и белковой инженерии, антисмысловых РНК, рибозимов и дезоксирибозимов, трансгеноза и генотерапии, а также достижения в ДНК-диагностике и ДНК-типировании и изучении генома человека.
Для научных работников, аспирантов и студентов, специализирующихся в области химии и биологии.
ТП-97-П-№ 123
Patrushev L.I.
Gene Expression. – Moscow: Nauka, 2000. – 000 p., il.
ISBN 5-02-001890-2
This monograph consisting of two parts presents a comprehensive view of the structure and functioning mechanisms of genes for prokaryotes and eukaryotes as well as the basic methods used for their studies. Its first part discusses the genome structure of prokaryotic and eukaryotic organisms, also covering the mechanisms of transcription, translation, replication, DNA repair and their regulation. The second part of the monograph deals with the principles of the techniques employed in the gene research. The book devotes particular attention to current genetic engineering tools. It embraces the key aspects of recent developments of molecular genetics studies on site-directed mutagenesis, protein engineering, antisense RNA, ribozymes and deoxyribozymes, transgenosis and gene therapy, DNA diagnostics and genotyping human genome.
The book will act as authoritative references for researchers, postgraduates, and students specializing in chemistry and biology.
ISBN 5-02-001890-2
© Издательство "Наука", 2000
ОГЛАВЛЕНИЕ
Предисловие редактора.......................................................................................... 9
Предисловие автора................................................................................................ 12
ЧАСТЬ I. МЕХАНИЗМЫ ХРАНЕНИЯ И РЕАЛИЗАЦИИ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ.................................................................................... 17
ВВЕДЕНИЕ 18
Глава 1. ГЕНОМ............................................................................................................ 25
1.1. Гены и хромосомы................................................................................... 28
1.2. Геном прокариот....................................................................................... 30
1.2.1. Геном вирусов.............................................................................................. 31
1.2.2. Нуклеоид бактериальной клетки............................................................. 32
1.2.3. Геном архебактерий................................................................................... 34
1.2.4. Минимальный размер генома одноклеточных организмов............. 36
1.3. Геном эукариот.......................................................................................... 39
1.3.1. Последовательности нуклеотидов эукариотического генома......... 40
1.3.2. Хроматин....................................................................................................... 44
1.3.3. Роль ДНК-топоизомераз в обеспечении структуры и функционирования хроматина.................................................................................................................. 55
Глава 2. РЕАЛИЗАЦИЯ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ ПРИ ЭКСПРЕССИИ ГЕНОВ 59
2.1. Транскрипция............................................................................................. 60
2.1.1. ДНК-зависимые РНК-полимеразы.......................................................... 61
2.1.2. Единицы транскрипции (транскриптоны)............................................. 70
2.1.3. Этапы транскрипции.................................................................................. 77
2.1.4. Хроматин во время транскрипции....................................................... 107
2.2. Котранскрипционные и посттранскрипционные модификации РНК 119
2.2.1. Процессинг РНК у бактерий................................................................... 120
2.2.2. Редактирование пре-мРНК.................................................................... 126
2.2.3. Другие модификации эукариотических мРНК.................................. 136
2.2.4. Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов РНК-полимеразы II........................ 152
2.3. Функциональная компартментализация ядра............................ 156
2.3.1. Интерфазные хромосомы в ядре.......................................................... 157
2.3.2. Ядрышко...................................................................................................... 160
2.3.3. Пространственная организация синтеза мРНК................................ 162
2.3.4. Ядерные тельца и домены..................................................................... 165
2.3.5. Компартментализованное ядро............................................................ 167
2.4. Биосинтез белка рибосомами бактерий........................................ 168
2.4.1. Рибосомы.................................................................................................... 169
2.4.2. Этапы биосинтеза белка......................................................................... 174
2.4.3. Антибиотики, действующие на уровне трансляции........................ 183
2.5. Трансляция у эукариот......................................................................... 185
2.5.1. Особенности первичной структуры эукариотических мРНК......... 186
2.5.2. Инициация биосинтеза белка эукариотическими рибосомами... 187
2.5.3. Элонгация полипептидных цепей........................................................ 196
2.5.4. Терминация трансляции......................................................................... 198
2.5.5. Трансляция в митохондриях.................................................................. 200
2.5.6. Трансляция в хлоропластах................................................................... 204
Глава 3. ОСНОВНЫЕ ПУТИ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ............ 208
3.1. Регуляция экспрессии генов на уровне транскрипции у прокариот 210
3.1.1. Регуляция на уровне инициации транскрипции.............................. 210
3.1.2. Регуляция синтеза РНК на уровне элонгации и терминации....... 214
3.2. Регуляция экспрессии генов на уровне транскрипции у эукариот 223
3.2.1. Передача сигнала и вторичные мессенджеры................................. 226
3.2.2. Механизмы позитивной регуляции транскрипции.......................... 243
3.2.3. Механизмы негативной регуляции транскрипции........................... 281
3.2.4. Структура хроматина как специфический регулятор экспрессии генов 288
3.2.5. Импринтинг................................................................................................. 300
3.2.6. Метилирование ДНК в регуляции транскрипции............................. 301
3.3. Посттранскрипционная регуляция экспрессии генов............. 312
3.3.1. Направленный транспорт, внутриклеточная локализация и депонирование мРНК 312
3.3.2. Сплайсинг РНК в регуляции экспрессии генов................................ 325
3.3.3. Избирательная деградация мРНК........................................................ 333
3.4. Регуляция экспрессии генов на уровне трансляции................ 337
3.4.1. Регуляция инициации трансляции...................................................... 337
3.4.2. Регуляция элонгации синтеза полипептидных цепей.................... 346
3.4.3. Регуляция терминации трансляции.................................................... 348
3.5. Синтез белков, содержащих остатки селеноцистеина............. 349
3.6. Посттрансляционная регуляция экспрессии генов.................. 351
3.6.1. Последствия фолдинга вновь синтезированных полипептидных цепей 352
3.6.2. Специфические протеиназы в посттрансляционном процессинге белков 354
3.6.3. Убиквитин-зависимая система протеолиза в регулируемой деградации белков 355
3.6.4. Сплайсинг белков..................................................................................... 359
3.6.5. Другие посттрансляционные модификации белков........................ 362
Глава 4. ВОСПРОИЗВЕДЕНИЕ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ........... 365
4.1. Репликация ДНК...................................................................................... 365
4.1.1. Белки, участвующие в репликации ДНК............................................. 366
4.1.2. Репликативная вилка E. coli и бактериофага T4.............................. 369
4.1.3. Особенности функционирования репликативной вилки эукариот 374
4.2. Регуляция репликации ДНК................................................................ 377
4.2.1. Инициация репликации ДНК у E. coli и ее регуляция..................... 379
4.2.2. Регуляция репликации плазмиды ColE1............................................ 386
4.3. Особенности репликации линейных геномов............................ 392
4.3.1. Линейные хромосомы бактерий........................................................... 392
4.3.2. Репликаторы эукариот............................................................................. 395
4.3.3. Репликация теломерных участков эукариотических хромосом... 397
4.3.4. Пространственная организация синтеза ДНК у эукариот.............. 398
Глава 5. ЗАЩИТА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ.................................... 401
5.1. Мутации...................................................................................................... 402
5.1.1. Основные источники мутаций и методы определения мутагенной активности 404
5.1.2. SOS-мутагенез у бактерий...................................................................... 419
5.1.3. Мутаторный фенотип............................................................................... 423
5.1.4. Экспансия ДНК.......................................................................................... 425
5.1.5. Адаптивные мутации............................................................................... 428
5.1.6. Механизмы защиты генома от мутаций.............................................. 432
5.2. Репарация ДНК......................................................................................... 433
5.2.1. Основные механизмы репарации поврежденной ДНК.................. 434
5.2.2. Эксцизионная репарация в клетках животных................................. 435
5.2.3. Гомологичная рекомбинация в репарации ДНК.............................. 446
5.2.4. Репарация ошибочно спаренных нуклеотидов................................ 448
5.2.5. Полимераза поли(ADP-рибозы) в репарации ДНК у эукариот..... 450
5.3. Альтруистичная ДНК............................................................................. 453
5.3.1. Парадокс возможности существования многоклеточных организмов 455
5.3.2. Повышение информационной стабильности генома избыточными последовательностями.................................................................... 458
5.3.3. Селективная защита генов от мутаций............................................... 462
5.3.4. Высокоупорядоченое расположение летальных генов на хромосомах 469
5.3.5. Возможный смысл парадокса С............................................................ 477
Глава 6. СОВРЕМЕННАЯ КОНЦЕПЦИЯ ГЕНА................................................ 483
ЧАСТЬ II. ИСКУССТВЕННЫЕ ГЕНЕТИЧЕСКИЕ СИСТЕМЫ 492
Глава 7. ПРИНЦИПЫ ГЕННОЙ ИНЖЕНЕРИИ................................................. 493
7.1. Основные ферменты, используемые в генной инженерии.. 500
7.1.1. Рестриктазы и ДНК-метилазы............................................................... 500
7.1.2. ДНК- и РНК-лигазы................................................................................... 508
7.1.3. Ферменты матричного синтеза ДНК и РНК........................................ 509
7.1.4. Другие ферменты...................................................................................... 515
7.2. Векторы...................................................................................................... 517
7.2.1. Плазмидные векторы............................................................................... 518
7.2.2. Векторы на основе фага l...................................................................... 521
7.2.3. Космиды и фазмиды................................................................................ 524
7.2.4. Сверхъемкие векторы YAC, BAC и PAC............................................ 526
7.2.5. Интегрирующие и челночные (бинарные) векторы......................... 529
7.2.6. Конструирование экспрессирующих векторов и их функционирование 531
7.2.7. Векторы для переноса ДНК в клетки животных и растений.......... 547
7.3. Клонотеки генов...................................................................................... 549
7.3.1. Получение клонотек генов...................................................................... 549
7.3.2. Введение рекомбинантных ДНК в клетки........................................... 552
7.3.3. Методы скрининга клонотек генов........................................................ 554
7.4. Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток................................................................................. 556
7.4.1. Клетки яичников китайских хомячков (линия CHO)........................ 557
7.4.2. Клетки мышиной миеломы (линия Sp2/0).......................................... 559
7.4.3. Клетки селезенки мышей (линия MEL)............................................... 560
7.4.4. Клетки африканской зеленой мартышки (линия COS)................... 562
7.4.5. Клетки насекомых, зараженные бакуловирусами............................ 563
7.4.6. Сравнение эффективности рассмотренных систем экспрессии. 564
7.5. Бесклеточные белоксинтезирующие системы........................... 565
7.5.1. Прокариотические системы................................................................... 567
7.5.2. Эукариотические системы..................................................................... 570
7.5.3. Проточные системы................................................................................. 571
7.6. Другие современные методы исследования генов.................. 573
7.6.1. Рестрикционное картирование генов................................................. 573
7.6.2. "Прогулки и прыжки по хромосомам".................................................. 574
7.6.3. S1-картирование РНК и ДНК................................................................. 575
7.6.4. Футпринтинг................................................................................................ 576
7.7. Стратегия выделения нового гена.................................................. 577
Глава 8. НАПРАВЛЕННЫЙ МУТАГЕНЕЗ И БЕЛКОВАЯ ИНЖЕНЕРИЯ... 580
8.1. Методы направленного получения мутаций............................... 581
8.1.1. Получение делеций и вставок............................................................... 581
8.1.2. Химический мутагенез............................................................................ 583
8.1.3. Сайт-специфический мутагенез с использованием олигонуклеотидов 585
8.1.4. Полимеразная цепная реакция в направленном мутагенезе....... 592
8.2. Белковая инженерия............................................................................. 594
8.2.1. Библиотеки пептидов и эпитопов........................................................ 595
8.2.2. Белки-репортеры в гибридных белках................................................ 602
8.2.3. Гибридные токсины.................................................................................. 603
8.2.4. Подходы к созданию новых ферментов.............................................. 607
8.2.5. Субтилигаза в лигировании пептидов................................................ 612
8.3. Концепция ксенобиоза......................................................................... 615
Глава 9. АНТИСМЫСЛОВЫЕ РНК, РИБОЗИМЫ И ДЕЗОКСИРИБОЗИМЫ 623
9.1. Антисмысловые РНК и олигонуклеотиды.................................... 623
9.1.1. Механизм действия антисмысловых РНК.......................................... 624
9.1.2. Использование антисмысловых РНК.................................................. 626
9.1.3. Природные антисмысловые РНК......................................................... 631
9.1.4. Антисмысловые РНК и патология: возможный механизм возникновения доминантных мутаций................................................................................................ 634
9.2. Рибозимы и дезоксирибозимы......................................................... 636
9.2.1. Типы рибозимов........................................................................................ 636
9.2.2. Свойства рибозимов................................................................................ 638
9.2.3. Рибозимы как лекарственные средства............................................. 642
9.2.4. Репарация мутантных РНК с помощью рибозимов, осуществляющих транс-сплайсинг............................................................................................. 647
9.2.5. Дезоксирибозимы..................................................................................... 649
9.3. Аптамеры................................................................................................... 651
9.4. Молекулы РНК у истоков жизни........................................................ 654
9.4.1. Молекулы РНК в качестве РНК-репликаз........................................... 655
9.4.2. Возможность синтеза полипептидных цепей молекулами РНК... 658
Глава 10. ТРАНСГЕННЫЕ ЖИВОТНЫЕ И РАСТЕНИЯ.................................. 663
10.1. Способы получения трансгенных многоклеточных организмов 663
10.2. Экспрессия трансгенов........................................................................ 666
10.3. Использование трансгенов у животных....................................... 667
10.3.1. Исследование механизмов экспрессии генов.............................. 668
10.3.2. Токсигены в исследовании дифференцировки соматических клеток в онтогенезе................................................................................................................ 669
10.3.3. Изменение физиологического статуса лабораторных и сельскохозяйственных животных............................................................................................. 670
10.3.4. Моделирование наследственных и приобретенных заболеваний человека 673
10.4. Трансгенные растения......................................................................... 675
10.5. Генотерапия наследственных и приобретенных заболеваний 677
10.5.1. Способы доставки новых генов в геном человека....................... 678
10.5.2. Управление экспрессией трансгенов в клетках-мишенях......... 684
10.5.3. Современные достижения генотерапии онкологических заболеваний 686
10.5.4. Ближайшие перспективы использования генотерапии............. 690
10.5.5. Успехи генотерапии в модельных экспериментах....................... 692
10.5.6. Проблемы, возникающие в связи с практическим применением генотерапии 693
Глава 11. ДНК-ДИАГНОСТИКА И ДНК-ТИПИРОВАНИЕ................................. 695
11.1. ДНК-диагностика наследственных и приобретенных заболеваний 697
11.1.1. Получение клинического генетического материала.................... 697
11.1.2. Диагностика заболеваний.................................................................. 699
11.2. ДНК-типирование.................................................................................... 710
11.2.1. ДНК-типирование микроорганизмов............................................... 711
11.2.2. Идентификация личности на основе минисателлитной ДНК: определение отцовства............................................................................................. 713
11.3. Микроматрицы и микрочипы ДНК.................................................... 720
11.3.1. Методы создания микроматриц ДНК............................................... 721
11.3.2. Ограничения в использовании микроматриц ДНК...................... 723
11.3.3. Использование микроматриц ДНК в фундаментальных и прикладных исследованиях................................................................................... 725
Глава 12. КАРТИРОВАНИЕ И ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ГЕНОМА ЧЕЛОВЕКА................................................................................................. 729
12.1. Основные подходы к картированию генома человека........... 729
12.1.1. Генетические карты сцепления......................................................... 730
12.1.2. ПЦР в исследованиях генома человека......................................... 735
12.1.3. Физические карты низкого разрешения.......................................... 737
12.1.4. Физические карты высокого разрешения....................................... 739
12.2. Определение полной первичной структуры ДНК генома человека 740
12.3. Базы данных получаемой информации........................................ 741
ЗАКЛЮЧЕНИЕ............................................................................................................... 744
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА.......................................................................... 749
Предисловие редактора
Сей факт с сияющим лицом
Вношу как ценный вклад в науку.
Саша Черный
Науку двигают методы и увенчивают теории. Концептуальные прорывы 1950–1960-х годов – прежде всего, двойная спираль, генетический код и механизм биосинтеза белка – легли в основу молекулярной биологии и молекулярной генетики. Этот начальный период бури и натиска завершился химико-ферментативным синтезом структурного гена аланиновой тРНК дрожжей – событием, которое далеко не все тогда оценили по достоинству. Для скудных методических возможностей того времени это был феноменальный coup de force, потребовавший пятилетних усилий группы высококвалифицированных химиков и биохимиков под руководством Гобинда Кораны, чтобы быть выполненным, и целого номера "Journal of Molecular Biology", чтобы быть описанным. Шокированный последним обстоятельством, журнал "Nature New Biology" устами своего рецензента заявил: «Подобно проекту “Аполлон”, все это сделано лишь для того чтобы показать, что это можно сделать, и, как и этот проект, никогда не будет повторено». Редко случается, чтобы пророчество оказалось настолько бездарным: последующие годы принесли сотни искусственных синтезов такого рода, причем во многих из них использовались основополагающие разработки Кораны. Протагонистом противоположной точки зрения явился Артур Корнберг, который сказал, обращаясь к Коране: “То, что Вы сделали, – это атомная бомба 1980 года”.
Первый синтез гена явился предшественником растянутого во времени большого методического взрыва 1970–1980-х годов в молекулярной биологии. К самым ярким вехам этого взрыва, наряду с олигонуклеотидным синтезом (с переходом его от искусства к ремеслу), можно отнести эндонуклеазы рестрикции, молекулярное клонирование, секвенирование нуклеиновых кислот и полимеразную цепную реакцию. В сочетании с многими другими находками, перечислить которые невозможно, это сделало молекулярную биологию методически почти всемогущей. Будущее покажет, достаточно ли этого, чтобы сбросить покровы с тайны живого.
Бурный поток оригинальных публикаций делает особенно важным жанр обзора в различных его видах. Книга – сложнейший из них, хотя современные возможности работы с литературой далеко отодвинули пределы осуществимого в этой области. Л.И. Патрушев поставил перед собой трудную задачу в одиночку охватить значительную часть современного массива достижений и перспектив молекулярной и клеточной биологии, непосредственно связанную с нуклеиновыми кислотами. На этом пути он сумел сделать удивительно много. Достаточно просмотреть оглавление, чтобы убедиться, что в книге не оставлены без внимания почти все основные направления, имеющие прямое отношение к нуклеиновым кислотам. При этом использован новейший материал, включая множество данных, опубликованных в этом году. Работа не прекращалась ни на минуту, и даже последние числа минувшего октября были свидетелями рождения новых разделов. В результате создано большое молекулярно-биологическое полотно, в котором каждый – от студента до (как это ни кощунственно) академика – может найти для себя что-то неожиданное.
По способу изложения материала квалифицировать книгу непросто. Ее не назовешь учебником в строгом смысле слова, хотя систематичность и внутренняя логика несомненны. Нередко от читателя требуется солидная подготовка, способность истолковывать аллюзии и проскакивать над эллипсисами. Зато удовлетворение от проникновения в материал очень велико.
Эта книга – не просто крупномасштабная компиляция. На ней отчетливо видна печать личности автора. Чувствуется, как небезразлично ему все то, что вот уже несколько десятилетий происходит на огромном пространстве молекулярной биологии. Многое ему удалось превосходно, хотя подстерегающие на этом пути тернии пристрастия, в частности несбалансированной нежности к порождениям собственного разума, не всегда увиты лаврами. В то же время, именно таков путь к звездам единой точки зрения, может быть, даже всеохватывающей концепции – в определенном смысле аналога единой теории поля, мысли о которой когда-то превратили в интеллектуальную трагедию закат великого физика.
Предлагаемая книга – плод эрудиции, вдохновения и самоотверженного труда Л.И. Патрушева и тех, чьи мысли и дела он цитирует, обсуждает, превозносит или критикует, – несомненно найдет множество благодарных читателей.
Ю. Берлин
Ноябрь 1999 г.
Предисловие автора
Мы можем понять что-то в природе, только если мы размышляем о ней…
Вернер Гейзенберг
Предметные исследования, осознанно устремляясь к границам и истокам нашего бытия, становятся философскими.
Карл Ясперс
Направления молекулярной генетики, основанные на генной инженерии, начало которым было положено в 1970-х годах работами В. Арбера, П. Берга, Г. Бойера, С. Коэна и других зарубежных ученых, получили в последующие 25 лет стремительное развитие, открывшее новые горизонты биологической науки. Сегодня трудно представить себе какой-либо раздел молекулярной биологии или генетики, в котором не применялись бы достижения этих исследований. Области использования методов молекулярной генетики непрерывно расширяются, все больше охватывая, к примеру, фундаментальную и клиническую медицину, судебно-следственную практику и даже палеонтологию. Однако все эти достижения – лишь внешняя, хорошо видимая часть айсберга. Замена поврежденных генов на здоровые в генотерапии и "клонирование" многоклеточных организмов придают нашей жизни совершенно новое, грозное качество, так как ставят перед человечеством неведомые ранее этические проблемы. Для меня несомненно, что именно с 70-х годов XX в. начался новый этап эволюции биосферы Земли, все последствия которого мы еще не в состоянии предвидеть.
Работая, как и большинство из нас, в узкой области молекулярной генетики, я часто затрачивал значительные усилия на поиск сведений о каком-либо новом методе или молекулярном механизме, описание которых можно найти иногда лишь в труднодоступной англоязычной литературе. Постоянное общение с коллегами показывает, что блуждания по научной литературе в поисках ответа на теоретические вопросы, возникающие в процессе экспериментальной работы, не являются исключительно моими трудностями. Поэтому стремление сохранить время и облегчить жизнь коллегам-экспериментаторам было одной из движущих сил, заставивших написать эту книгу.
Однако не только указанная причина побудила меня взяться за перо. Оборотной стороной лавинообразного накопления научной информации является размывание контуров целостной картины современных молекулярно-генетических знаний. В соответствии с формулировкой Г. Вейля (берущей начало от Г. Галилея), метод естественных наук включает в себя пассивное наблюдение, уточняемое с помощью активного эксперимента, и построение символической конструкции, к которой в конечном счете сводятся естественно-научные теории. Высшей формой символической конструкции является математическая формула. На пути к своей цели – символической конструкции, непротиворечиво объединяющей эмпирические факты, – естественно-научные теории неизбежно проходят предварительные стадии, в том числе и стадию классификации или морфологии.
То, что в основном происходит сегодня в нашей молодой области биологии, напоминает скрупулезные усилия ботаников или зоологов-систематиков, стремящихся как можно полнее описать фауну и флору нашей планеты. Открываются все новые и новые гены, ферменты, биохимические механизмы и метаболические пути, которые переплетаются в сложнейшие сети. Миллиарды пар оснований отсеквенированных последовательностей ДНК призваны внести ясность в наше понимание структуры и функционирования генома. И хотя это совершенно закономерный и необходимый этап развития науки, одних только эмпирических фактов явно недостаточно для наступления ясности.
Складывающуюся ситуацию, в частности хорошо иллюстрирует положение в современной онкологии. Громадные усилия и средства, затрачиваемые в мире на изучение молекулярных механизмов канцерогенеза, приносят обильные плоды в виде новых генов и белков-регуляторов клеточного цикла, передачи сигнала и механизмов регуляции апоптоза. Однако прямолинейные попытки управления экспрессией этих конкретных генов с помощью антисмысловых РНК, рибозимов, анти-генов и других современных молекулярно-генетических подходов пока не привели к удовлетворительным результатам в генотерапии онкологических (и каких-либо других системных) заболеваний. Заболеваемость раком, в том числе и в промышленно развитых странах, непрерывно возрастает и по прогнозам Всемирной организации здравоохранения к 2020 году удвоится. Пока не слишком успешными остаются и попытки борьбы со СПИДом. Такого рода факты ясно показывают, насколько далеки мы сегодня от понимания живого организма как целого.
Кроме эмпирических фактов требуются новые обобщающие идеи и в конечном счете фундаментальные символические конструкции, которые бы продвинули генетику на пути понимания законов генетического контроля жизнедеятельности клетки и организма в целом. В этой связи не менее важной целью написания книги была попытка систематизировать современные достижения в исследовании механизмов регуляции экспрессии генов на всех основных уровнях реализации генетической информации и обсудить ряд новых концепций, рожденных в ходе исследований. Я надеялся, что некоторые не слишком широко известные факты в свою очередь помогут генерировать новые знания. Однако книга не является полностью компилятивной. Наряду с современной классикой в ней представлены и результаты оригинальных исследований, которые включают, в частности концепции ксенобиоза и альтруистичной ДНК, а также гипотезы о функциональном значении редактирования РНК на посттранскрипционном уровне и образовании доминантных мутаций с участием антисмысловых РНК.
Книга состоит из двух частей. В первой части рассматриваются молекулярные механизмы, обеспечивающие хранение генетической информации живых организмов и ее реализацию через экспрессию генов. При этом основное внимание уделяется генетическим системам эукариот. Поскольку любой ген существует благодаря передаче его точной копии соматическим клеткам и в ряду поколений организмов, в конце первой части обсуждаются механизмы репликации ДНК, репарации ее повреждений, а также другие способы стабилизации генетической информации.
Вторая часть книги посвящена обсуждению современных достижений молекулярной генетики в ее прикладных областях. Однако использование термина "прикладные" в этом контексте не совсем корректно. Результаты, полученные в исследованиях трансгеноза, рибозимов или при решении задач белковой инженерии изменили облик всей современной генетики и потребовали пересмотра многих теоретических представлений.
К сожалению, ограничения в объеме книги не позволили реализовать в ней первоначально задуманную главу "Гены и фенотип", а также обсудить современные достижения в исследовании рекомбинации ДНК. По тем же причинам упомянуты не все авторы, работы которых обсуждаются в монографии. Им я приношу свои глубокие извинения. Исчерпывающую библиографию можно найти в современных обзорах из списка рекомендованной литературы, которая предназначена для более глубокого знакомства с предметом.
На протяжении всей книги мне хотелось подчеркнуть единство генетических систем организма. Отдельное рассмотрение систем транскрипции, трансляции, репарации или репликации условно, поскольку их функционирование в клетке тесно взаимосвязано. На это указывает, в частности высокая интеграция многочисленных механизмов внутриклеточной передачи сигнала, полифункциональность отдельных белков и ферментов, колоссальное разнообразие летальных мутаций и плейотропность действия генов.
Работая над книгой, я всегда имел в виду, что ясное представление о целом может быть хорошим помощником в исследовании частных генетических проблем. Но и сама генетика является лишь малой частью творения духа человека. В лаборатории, клинике, на пленэре или в мастерской мы пишем этюды к большой картине, которой, к счастью, никогда не суждено быть завершенной. И в те редкие минуты, когда работа идет особенно хорошо, отчетливо ощущаешь причастность к этому великому движению духовных сфер, во многом определяющему смысл нашей жизни.
В заключение предисловия хочется выразить особую признательность дирекции и Ученому совету Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН за оказанную поддержку в издании книги.
Работа над книгой проходила параллельно с экспериментальными исследованиями в стенах лаборатории биотехнологии ИБХ, руководимой А.И. Мирошниковым, в лице которого я нашел полное понимание. За это я хочу принести ему свою искреннюю благодарность.
Мое мировоззрение как генетика начало складываться и во многом определилось в аспирантуре на семинарах Р.Б. Хесина, а также при личном общении с этим замечательным человеком и сотрудниками его лаборатории. Ко всем этим людям, ученым и учителям, с которыми мне посчастливилось работать в начале жизненного пути, я храню чувство глубокой благодарности.
Я отдаю себе отчет в том, что монография никогда не была бы написана без высокого профессионализма, постоянного интереса и дружеского участия заведующей научно-информационным отделом Института Т.И. Соркиной, от которой исходит сама идея этого издания. В долгих и плодотворных дискуссиях с ней обсуждалась общая структура книги и содержание отдельных глав, а также многочисленные технические детали, о которых перед началом работы я, к сожалению, не имел ни малейшего представления. Одновременно я приношу свою глубокую благодарность сотрудникам отдела В.В. Егоровой, Т.И. Яковлевой, И.М. Приваловой и Л.И. Петровой за большую техническую помощь при подготовке рукописи к печати.
Хотелось бы выразить искреннюю признательность Е.Д. Свердлову за жесткую и конструктивную критику первых двух глав монографии, которая оказала сильное влияние на всю дальнейшую работу над книгой. Сейчас невозможно представить себе выход монографии в свет без учета многочисленных глубоких замечаний Ю.А. Берлина, у которого я многому научился в ходе нашего продолжительного общения.
Пользуясь случаем, хотелось бы выразить особую признательность всем зарубежным коллегам, приславшим оттиски своих недавних публикаций.
И в заключение, но не в последнюю очередь, я хотел бы от всей души поблагодарить свою жену Раю, такт, мудрость и душевная аура которой, несмотря на все мои недостатки, помогают поддерживать творческую атмосферу в семье. Без всего этого написание книги было бы невозможно.
Неоценимая помощь профессионалов не снимает с меня ответственности за фактическую сторону материала, представленного в монографии. Я буду благодарен за любую конструктивную критику всех спорных интерпретаций генетических фактов, а также замеченных ошибок и неточностей, которые, к сожалению, чаще всего можно увидеть только на расстоянии.
Л.И. Патрушев
ЧАСТЬ I. МЕХАНИЗМЫ ХРАНЕНИЯ И РЕАЛИЗАЦИИ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ
Организм. Живой организм представляет собой самовоспроизводящуюся, открытую термодинамическую систему, в которой пути превращения вещества и энергии… Поскольку организм является самовоспроизводящейся системой, он должен обладать… По современным представлениям вся генетическая информация живого организма содержится в его генах и, как любая другая…Глава 1. ГЕНОМ
Термин "геном" был предложен Г. Винклером в 1920 г. для описания совокупности генов, заключенных в гаплоидном наборе хромосом организмов одного биологического вида. Первоначальный смысл этого термина указывал на то, что понятие генома в отличие от генотипа является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось. Сейчас хорошо известно, что ДНК, которая является носителем генетической информации у большинства организмов и, следовательно, составляет основу генома, включает в себя не только гены в современном смысле этого слова. Большая часть ДНК эукариотических клеток представлена некодирующими ("избыточными") последовательностями нуклеотидов, которые не заключают в себе информации о белках и нуклеиновых кислотах. Таким образом, основную часть генома любого организма составляет вся ДНК его гаплоидного набора хромосом.
Однако генетическую информацию в клетках содержат не только хромосомы ядра. Жизненно важная генетическая информация бывает заключена и во внехромосомных молекулах ДНК. У бактерий к таким ДНК относятся плазмиды и некоторые умеренные вирусы, в клетках эукариот – это ДНК хлоропластов, митохондрий и других пластид. Более того, объемы генетической информации, заключенной в клетках зародышевой линии (предшественники половых клеток и сами гаметы) и соматических клетках, в ряде случаев существенно различаются. В онтогенезе соматические клетки могут утрачивать часть генетической информации клеток зародышевой линии, амплифицировать группы последовательностей и(или) значительно перестраивать исходные гены. Следовательно, под геномом организма в настоящее время понимают суммарную ДНК гаплоидного набора хромосом и каждого из внехромосомных генетических элементов, содержащуюся в отдельной клетке зародышевой линии многоклеточного организма. Однако сформулировать определение генома отдельного биологического вида в целом не так просто. В таком определении необходимо учитывать, во-первых, генетические различия, связанные с полом организма, поскольку мужские и женские половые хромосомы различаются. Во-вторых, из-за громадного числа аллельных вариантов генов и сопутствующих последовательностей, которые присутствуют в генофонде больших популяций, можно говорить лишь о некоем усредненном геноме, который сам по себе может обладать существенными отличиями от геномов отдельных особей.
Как видно из табл. I.1, размеры геномов организмов разных видов значительно отличаются друг от друга. При этом часто не наблюдается корреляции между уровнем эволюционной сложности биологического вида и размером его генома.
Таблица I.1
Средний размер гаплоидного генома у некоторых групп организмов
Суммарное количество ДНК в гаплоидном геноме принято обозначать латинским символом С. В 1978 г. Т. Кавалье-Смит описал в качестве парадокса… Структурная организация генома является фундаментальным таксономическим… Клетки эукариот содержат оформленное ядро, и редупликация их генома сопровождается митозом. В надцарство эукариот…Гены и хромосомы
Отдельные элементы регуляторной области генов, например энхансеры, могут располагаться на значительном (>60 т.п.о.) расстоянии от структурной… Однако помимо интронов в геноме эукариот имеется большое количество других… Как у прокариотических, так и у эукариотических организмов все гены располагаются группами на отдельных молекулах ДНК,…Геном прокариот
Геном вирусов
После проникновения вируса в клетку может происходить его размножение, часто сопровождаемое гибелью самой клетки (вирулентный путь развития). Кроме… Все известные ДНК-содержащие вирусы позвоночных имеют геном, заключенный в…Нуклеоид бактериальной клетки
Каждый, кому приходилось разрушать бактериальные клетки в мягких условиях, например с помощью лизоцима или детергентов, наблюдал
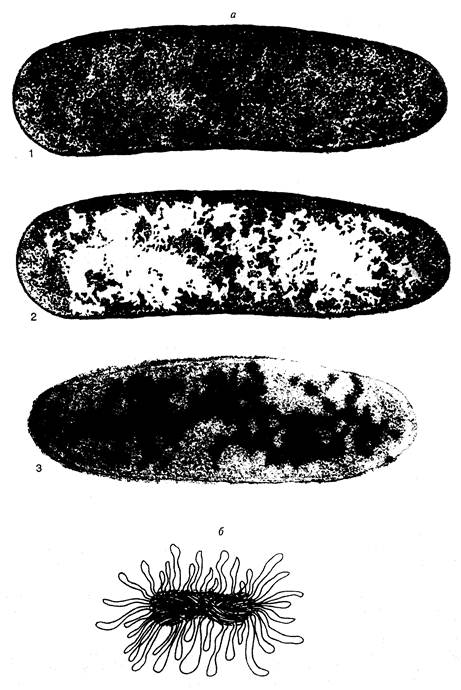
Рис. I.1. Нуклеоид E. coli
а – электронно-микроскопические фотографии срезов бактериальных клеток, полученные методом криофиксации. 1 и 2 – один и тот же снимок (последний ретуширован). На фотографии 2 белыми пятнами отмечены области цитоплазмы, свободные от рибосом. На фотографии 3 видны молекулы ДНК, специфически окрашенные с помощью антител;
б – модель нуклеоида в функционально-активном состоянии А. Райтера и А. Чанга. Изображены многочисленные петли активно транскрибируемой ДНК
замечательную картину превращения легко подвижной суспензии бактериальных клеток в вязкую желеобразную массу, простое перемешивание которой требует усилий. Это происходит из-за того, что компактно упакованные гигантские хромосомы бактериальных клеток (длина хромосомной ДНК E. coli составляет ~4,6 млн. п.о.) после разрушения оболочки клеток выходят в окружающую среду и свободно в ней распределяются. В лизатах бактериальных клеток их ДНК прочно ассоциированы с белками, освобождение от которых требует проведения многократных фенольных депротеинизаций. Такой простой опыт наглядно указывает на то, что в бактериальных клетках их единственная хромосома сильно компактизована и, возможно, пространственно упорядочена.
Электронно-микроскопическое изучение срезов бактериальных клеток в разных условиях и более ранние исследования бактерий с помощью светового микроскопа продемонстрировали компактное распределение ДНК в бактериальной клетке. Поскольку такие структуры отдаленно напоминали ядра эукариот, они получили название нуклеоидов, или ДНК-плазмы. Эти термины подчеркивают генетические функции нуклеоида, но в то же время и существенные морфологические отличия от обычных интерфазных ядер эукариот, прежде всего, отсутствие ядерной оболочки, которая бы отделяла гены бактерии от окружающей их цитоплазмы. Исследование бактериальных клеток с помощью электронной микроскопии в мягких условиях без предварительной химической фиксации показало, что нуклеоиды представлены в виде диффузно окрашенных областей, свободных от рибосом (рис. I.1,а). При этом вытянутые участки ДНК на внешней части нуклеоидов направлены в окружающую цитоплазму. С помощью специфических антител установлено, что молекулы РНК-полимеразы, ДНК-топоизомеразы I и гистоноподобного белка HU ассоциированы с нуклеоидами. Вытянутые участки ДНК по периферии нуклеоидов обычно интерпретируют как сегменты бактериальной хромосомы, вовлеченные в транскрипцию. Полагают, что эти участки состоят из петель ДНК бактериальной хромосомы, которые в зависимости от физиологического состояния клетки находятся в транскрипционно-активном состоянии или втягиваются внутрь нуклеоидов при подавлении транскрипции. Модель функционально-активного нуклеоида А.Райтера и А.Чанга представлена на рис. I.1,б. По мнению авторов, размытая структура поверхности нуклеоидов, видимая под электронным микроскопом, отражает подвижное состояние активно транскрибируемых петель ДНК. В этой модели четко прослеживается аналогия со структурой хромосом типа ламповых щеток у животных.
Таким образом, нуклеоид бактериальных клеток не является статическим внутриклеточным образованием или компартментом, которые можно четко определять морфологически. Напротив, во время различных фаз роста бактериальных клеток нуклеоид непрерывно меняет форму, что, по-видимому, сопряжено с транскрипционной активностью определенных бактериальных генов. Так же как и в хромосомах эукариот, ДНК нуклеоида ассоциирована со многими ДНК-связывающими белками, в частности гистоноподобными белками HU, H-NS и IHF, а также топоизомеразами, которые оказывают большое влияние на функционирование бактериальных хромосом и их внутриклеточную компактизацию. Однако детальные молекулярные механизмы конденсации бактериальной ДНК с образованием лабильных "компактосом" (по аналогии со стабильными нуклеосомами эукариот) пока неизвестны. В последнее время возрастает интерес к бактериальному так называемому LP-хроматину (low protein chromatin), для которого характерно относительно низкое содержание белкового компонента. Аналогичный LP-хроматин обнаруживают у вирусов, в митохондриях, пластидах и у динофлагеллят (жгутиконосцев). Следовательно, этот тип структурной организации генетического материала претендует на универсальность и ассоциирован с определенными формами регуляции экспрессии генов, свойственными прокариотическим организмам.
В последние годы наблюдается прогресс в исследовании первичной структуры бактериальных хромосом. Определена полная последовательность нуклеотидов хромосом паразитических бактерий: микоплазмы Mycoplasma genitalium и Haemophilus influenzae. В 1997 г. усилиями интернационального коллектива ученых была определена полная первичная структура хромосом E. coli и Bacillus subtilis длиной в ~4,6 и 4,2 млн п.о. соответственно Все это позволяет надеяться, что в ближайшее время произойдут новые открытия в области исследований структуры бактериальных геномов и функционирования их генов.
Геном архебактерий
Архебактерия Methanococcus jannaschii, первичная структура генома которой была полностью определена в 1996 г., обнаружена в горячих морских… Многие ДНК-локусы M. jannaschii не обнаруживают гомологии с уже известными… При сравнительном анализе генов системы транскрипции оказалось, что РНК-полимеразы M. jannaschii и эубактерий…Минимальный размер генома одноклеточных организмов
Считается, что геномы M. genitalium и H. influenzae произошли путем последовательного уменьшения размера генома соответственно грамположительных и… Ранее были использованы еще два подхода для определения минимального размера… Таким образом, исследования, проведенные на геномах M.genitalium и H. influenzae, дают в настоящее время наиболее…Геном эукариот
Геном эукариот существенно отличается от генома прокариот по ряду признаков, среди которых необходимо отметить его избыточность. Содержание ДНК у… Повышенное содержание ДНК в геноме эукариот нельзя объяснить одним лишь…Последовательности нуклеотидов эукариотического генома
Эволюционное возникновение мозаичной (интрон–экзонной) структуры генов эукариот, так же как и консервативный характер наследования размеров и… Не менее загадочным с эволюционной точки зрения остается и феномен появления в… Другой тип повторов – диспергированные повторяющиеся последовательности ДНК, не организованные в крупные блоки, а…Хроматин
Рис. I.2. Схематическое изображение петельно-доменного уровня компактизации хроматина
а – фиксация петли хромомера на ядерном матриксе с помощью MAR/SAR-последовательностей и белков; б – "розетки", образованные из петли хромомера; в – конденсация петель "розеток" с участием нуклеосом и нуклеомеров
Важным результатом взаимодействия ДНК с белками в составе хроматина является ее компактизация. Суммарная длина ДНК, заключенной в ядре клеток человека, приближается к 1 м, тогда как средний диаметр ядра составляет ~10 мкм. Длина молекулы ДНК, заключенной в одной хромосоме человека, в среднем равняется ~4 см. В то же время длина метафазной хромосомы составляет ~4 мкм. Следовательно, ДНК метафазных хромосом человека компактизована по длине, по крайней мере, в ~104 раз. Степень компактизации ДНК в интерфазных ядрах значительно ниже и неравномерна в отдельных генетических локусах. С функциональной точки зрения различают эухроматини гетерохроматин. Эухроматин характеризуется меньшей по сравнению с гетерохроматином компактизацией ДНК, и в нем главным образом локализуются активно экспрессирующиеся гены. В настоящее время широко распространено мнение о генетической инертности гетерохроматина. Поскольку его истинные функции сегодня нельзя считать установленными, эта точка зрения по мере накопления знаний о гетерохроматине может измениться. Уже сейчас в нем находят активно экспрессирующиеся гены.
Гетерохроматизация определенных участков хромосом часто сопровождается подавлением транскрипции имеющихся в них генов. В процесс гетерохроматизации могут быть вовлечены протяженные участки хромосом и даже целые хромосомы. В соответствии с этим считается, что регуляция транскрипции генов эукариот в основном происходит на двух уровнях. На первом из них компактизация или декомпактизация ДНК в хроматине может приводить к длительной инактивации или активации протяженных участков хромосом или даже целых хромосом в онтогенезе организма. Более тонкая регуляция транскрипции активированных участков хромосом достигается на втором уровне при участии негистоновых белков, включающих многочисленные факторы транскрипции.
Структурная организация хроматина и хромосом эукариот. Вопрос о структурной организации хроматина в интерфазных ядрах в настоящее время далек от своего разрешения. Это связано, прежде всего, со сложностью и динамичностью его структуры, которая легко меняется даже при незначительных экзогенных воздействиях. Большинство знаний о структуре хроматина было получено in vitro на препаратах фрагментированного хроматина, структура которого значительно отличается от таковой в нативных ядрах. В соответствии с распространенной точкой зрения различают три уровня структурной организации хроматина у эукариот: 1) нуклеосомная фибрилла; 2) соленоид, или нуклеомер; 3) петельно-доменная структура, включающая хромомеры.
Нуклеосомные фибриллы. В определенных условиях (при низкой ионной силе и в присутствии двухвалентных ионов металлов) в изолированном хроматине удается наблюдать регулярные структуры в виде протяженных фибрилл диаметром 10 нм, состоящих из нуклеосом. Эти фибриллярные структуры, в которых нуклеосомы расположены как бусы на нитке, рассматриваются в качестве низшего уровня упаковки ДНК эукариот в хроматине. Нуклеосомы, входящие в состав фибрилл, расположены более или менее равномерно вдоль молекулы ДНК на расстоянии 10–20 нм друг от друга. В состав нуклеосом входят четыре пары молекул гистонов: H2a, H2b, H3 и H4, а также одна молекула гистона H1. Данные по структуре нуклеосом в основном получены с использованием трех методов: рентгеноструктурного анализа низкого и высокого разрешения кристаллов нуклеосом, межмолекулярных сшивок белок–ДНК и расщепления ДНК в составе нуклеосом с помощью нуклеаз или радикалов гидроксила. На основании таких данных А. Клугом была построена модель нуклеосомы, в соответствии с которой ДНК (146 п.о.) в B-форме (правозакрученная спираль с шагом 10 п.о.) намотана на гистоновый октамер, в центральной части которого расположены гистоны Н3 и Н4, а на периферии – Н2а и Н2b. Диаметр такого нуклеосомного диска составляет 11 нм, а его толщина – 5,5 нм. Структура, состоящая из гистонового октамера и намотанной на него ДНК, получила название нуклеосомной кóровой частицы. Кóровые частицы отделены друг от друга сегментами линкерной ДНК. Общая длина участка ДНК, включенного в нуклеосому животных, составляет 200 (±15) п.о.
Полипептидные цепи гистонов содержат структурные домены нескольких типов. Центральный глобулярный домен и гибкие выступающие N- и С-концевые участки, обогащенные основными аминокислотами, получили название плеч (arm). С-концевые домены полипептидных цепей, участвующие в гистон–гистоновых взаимодействиях внутри кóровой частицы, находятся преимущественно в виде a-спирали с протяженным центральным спиральным участком, вдоль которого с двух сторон уложено по одной более короткой спирали. Все известные места обратимых посттрансляционных модификаций гистонов, происходящих на протяжении клеточного цикла или во время дифференцировки клеток, локализованы в гибких основных доменах их полипептидных цепей (табл. I.2). При этом N-концевые плечи гистонов H3 и H4 являются самыми консервативными участками молекул, а гистоны в целом – одними из наиболее эволюционно консервативных белков. С помощью генетических исследований дрожжей S. cerevisiae было установлено, что небольшие делеции и точковые мутации в N-концевых частях генов гистонов сопровождаются глубокими и разнообразными изменениями фенотипа дрожжевых клеток. Это указывает на чрезвычайную важность целостности молекул гистонов в обеспечении правильного функционирования эукариотических генов.
В растворе гистоны Н3 и Н4 могут существовать в виде стабильных тетрамеров (Н3)2(Н4)2, а гистоны Н2А и Н2В – в виде стабильных димеров. Постепенное повышение ионной силы в растворах, содержащих нативный хроматин, приводит к освобождению сначала димеров Н2А/Н2В, а затем тетрамеров Н3/Н4.
Дальнейшее уточнение тонкой структуры нуклеосом в кристаллах было проведено недавно в работе К. Люгера с соавт. (1997 г.) с помощью рентгеноструктурного анализа высокого разрешения. Было установлено, что выпуклая поверхность каждого гистонового гетеродимера в составе октамера огибается сегментами ДНК длиной 27–28 п.о., расположенными по отношению друг к другу под углом 140о, которые разделены линкерными участками длиной в 4 п.о.
В соответствии с современными данными пространственная структура ДНК в составе кóровых частиц несколько отличается от B-формы: двойная спираль ДНК перекручена на 0,25–0,35 п.о./виток двойной спирали, что приводит к образованию шага спирали, равному 10,2 п.о./виток (у В-формы в растворе – 10,5 п.о./виток). Стабильность комплекса гистонов в составе кóровой частицы определяется взаимодействием их глобулярных частей, поэтому удаление гибких плеч в условиях мягкого протеолиза не сопровождается разрушением комплекса. N-концевые плечи гистонов, по-видимому, обеспечивают их взаимодействие со специфическими участками ДНК. Так, N-концевые домены гистона Н3 контактируют с участками ДНК на входе в кóровую частицу и выходе из нее, тогда как соответствующий домен гистона Н4 связывается с внутренней частью ДНК нуклеосомы.
Упомянутые выше исследования структуры нуклеосом высокого разрешения показывают, что центральная часть сегмента ДНК длиной в 121 п.о. в составе нуклеосомы образует дополнительные контакты с гистоном H3. При этом N-концевые части полипептидных цепей гистонов H3 и H2B проходят через каналы, образуемые малыми бороздками соседних супервитков ДНК нуклеосомы, а N-концевая часть гистона H2A контактирует с малой бороздкой внешней части супервитка ДНК. В совокупности данные высокого разрешения показывают, что ДНК в составе коровых частиц нуклеосом огибает гистоновые октамеры неравномерно. Кривизна нарушается в местах взаимодействия ДНК с поверхностью гистонов, и такие изломы наиболее заметны на расстоянии 10–15 и 40 п.о. от центра супервитка ДНК.
Таблица I.2
Свойства гистонов животных
Структура фибриллы хроматина типа "бусин на нитке" наблюдается in vitro при очень низкой ионной силе и в отсутствие двухвалентных катионов… В ядрах ДНК в основном входит в состав фибрилл диаметром 25~30 нм, которые… Энергия, необходимая для образования соленоида, частично черпается из энергии взаимодействия нуклеосом друг с другом.…Роль ДНК-топоизомераз в обеспечении структуры и функционирования хроматина
Рис. I.3. Основные этапы каталитического цикла топоизомеразы II
Внизу изображен механизм переноса нити ДНК через двухцепочечный разрыв. Точками отмечены места ковалентного присоединения фермента к 5'-концам ДНК в двухцепочечных разрывах. VM26, mAMSA, антрациклины – ингибиторы топоизомеразы II, фиксирующие ковалентный комплекс фермент-ДНК и предотвращающие лигирование двухцепочечного разрыва; L – число зацеплений ДНК в суперскрученной молекуле.
релаксируют ДНК без затраты энергии путем внесения одноцепочечных разрывов. В отличие от этого, ДНК-топоизомеразы II функционируют в виде димеров, осуществляя ATP-зависимое расщепление обеих цепей ДНК с последующим переносом цепей через разрыв и его лигированием (рис. I.3).
Для внесения одноцепочечного разрыва в ДНК все ДНК-топоизомеразы используют остаток Tyr, который осуществляет нуклеофильную атаку фосфатной группы ДНК с образованием фосфотирозина. В результате ферменты оказываются ковалентно связанными с 5'- или 3'-концами ДНК в одноцепочечном разрыве. Образование такой ковалентной связи исключает необходимость затраты энергии при восстановлении фосфодиэфирной связи в одноцепочечном разрыве на заключительных стадиях реакции. У ДНК-топоизомераз типа I имеется один каталитический остаток Tyr на молекулу мономерного белка, тогда как димеры ДНК-топоизомераз II содержат по одному каталитическому остатку на каждую субъединицу, что обеспечивает создание ступенчатого двухцепочечного разрыва в молекуле релаксируемой ДНК.
Обнаружены, по крайней мере, два подтипа ДНК-топоизомераз I – IA и IB, которые, будучи неродственными ферментами как по первичной, так и по пространственной структурам, выполняют аналогичные функции с помощью различных механизмов. До недавнего времени ДНК-топоизомеразы IA считали исключительно прокариотическими ферментами, однако они были найдены и в клетках эукариот, включая клетки человека, и названы ДНК-топоизомеразами III.
ДНК-топоизомераза IA релаксирует ДНК, содержащие только отрицательные супервитки, работает в присутствии ионов Mg2+ и ковалентно соединяется с 5'-концами ДНК в образующихся врéменных одноцепочечных разрывах. Это сближает ДНК-топоизомеразы IA и II между собой, что было подтверждено также структурными исследованиями. В отличие от этого, ДНК-топоизомеразы IB способны релаксировать ДНК как с положительными, так и отрицательными супервитками, не требуют для своего функционирования ионов металлов и взаимодействует ковалентно с 3'-концами ДНК. ДНК-топоизомеразы IB найдены исключительно в клетках эукариот (за единственным исключением вируса вакцины).
В клетках человека ДНК-топоизомераза IB/III специфически ингибируется камптотецином (camptothecin), который в настоящее время рассматривается в качестве перспективного противоопухолевого препарата. Это соединение взаимодействует преимущественно с ковалентным комплексом топоизомераза I–ДНК, что подавляет реакцию восстановления фосфодиэфирной связи и освобождение фермента из комплекса. В результате происходит быстрое накопление двухцепочечных разрывов ДНК и вступление клеток в апоптоз.
ДНК-топоизомераза II является жизненно важным ферментом любого эукариотического организма. Кроме релаксации суперскрученных молекул ДНК она может осуществлять образование или развязывание узлов, а также образование или разделение катенанов (кольцевых замкнутых ДНК, сцепленных друг с другом). Реакции развязывания узлов и разделения катенанов являются прерогативой именно ДНК-топоизомеразы II и не выполняются ДНК-топоизомеразами I.
У дрожжей ДНК-топоизомераза II требуется для разделения катенанов сестринских хроматид хромосом в анафазе митоза и абсолютно необходима для сегрегации хромосом в мейозе, а также конденсации хроматина в процессе формирования метафазных хромосом. Выяснена важная роль ДНК-топоизомеразы II и в формировании высших уровней структуры хроматина, а именно участие фермента в образовании петель хроматина во время конденсации хромосом.
ДНК-топоизомераза II локализована в ядре и в больших количествах ассоциируется с ДНК как в интерфазных, так и метафазных ядрах. С помощью специфических антител показано, что молекулы фермента располагаются преимущественно вдоль центральной продольной оси обоих плеч хромосом у многих организмов. Такое аксиальное распределение ДНК-топоизомеразы II в хромосомах наблюдали даже после удаления из них большей части гистонов в результате многократных солевых экстракций. Специфическая локализация этого фермента в хромосомах очень показательна в свете обсуждавшихся выше петельно-доменных особенностей организации хроматина в ядрах. Создается впечатление, что ДНК-топоизомераза II находится в виде гомодимера в основании петель, взаимодействуя с MAR/SAR-последовательностями ДНК хроматина. Хотя топоизомераза II не обнаруживает строгой специфичности в отношении расщепляемых последовательностей нуклеотидов, на выбор сайтов большое влияние оказывают структурные компоненты хроматина. Показано, что in vivo существуют два класса сайтов, по которым происходит расщепление ДНК этим ферментом: одни из них локализованы в активно транскрибируемых участках хроматина, гиперчувствительных к действию нуклеаз, а другие – непосредственно в MAR/SAR-последовательностях. Ассоциация ДНК-топоизомеразы II с активно транскрибируемыми участками хроматина указывает на ее возможную важную роль в регуляции экспрессии генов, что и было продемонстрировано в недавних экспериментах. Таким образом, ДНК-топоизомераза II является одним из ключевых ферментов, необходимых для разрешения сложных топологических проблем, возникающих при изменении структуры хроматина в процессах репликации ДНК, транскрипции генов и сегрегации хромосом в митозе и мейозе. Определенные изоформы (a или b) этого фермента, по-видимому, играют важную роль в поддержании динамической структуры хроматина интерфазных и митотических хромосом.
Имеющиеся в настоящее время данные свидетельствуют о высокоупорядоченной организации генома у любого, особенно эукариотического, организма. Первым уровнем такой упорядоченности является консервативное линейное распределение генов и других последовательностей нуклеотидов вдоль молекул ДНК хромосом, которое служит важным таксономическим признаком. Другим не менее жизненно важным свойством генома эукариот и, по-видимому, таксономическим признаком является его упорядоченное распределение в объеме интерфазных ядер. Высокоспецифическое пространственное распределение хроматина эукариот в интерфазных ядрах можно рассматривать в качестве второго уровня его упорядоченности. Находясь в деконденсированном состоянии после завершения митоза, интерфазные хромосомы не перемешиваются внутри интерфазных ядер, но занимают вполне определенные микрокомпартменты. Определенные участки хромосом, маркированные специфическими (в частности MAR/SAR) последовательностями, служат для прикрепления ДНК хромосом к компонентам ядерного матрикса и ядерных мембран. Такие контакты необходимы для эффективной реализации генетической информации в процессе экспрессии генов, эффективной конденсации хроматина и разделения хромосом в митозе и мейозе. Кроме того, пространственно организованное распределение генетического материала в интерфазных ядрах обеспечивает дифференциальную защиту от мутаций отдельных генетических локусов и, по-видимому, может контролировать темп и направление эволюционных изменений как отдельных локусов, так и организмов в целом (подробнее см. раздел 5.3). К сожалению, исследование пространственной организации генома в интерфазных ядрах (архитектоники ядра) сопряжено с большими методическими трудностями и сегодня еще только начинается.
Глава 2. РЕАЛИЗАЦИЯ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ ПРИ ЭКСПРЕССИИ ГЕНОВ
Конечным результатом экспрессии генов, кодирующих белки или нуклеиновые кислоты, должно быть образование этих полноценных в функциональном отношении макромолекул, сопровождаемое формированием определенного фенотипа организма. В соответствии с основным постулатом молекулярной биологии генетическая информация в процессе ее реализации передается однонаправленно от нуклеиновых кислот к белкам. При этом реализуется следующая обобщенная схема: ДНК « РНК ® белок, которая подчеркивает, что в ряде специальных случаев возможна передача генетической информации от РНК к ДНК с использованием механизма обратной транскрипции. До сих пор не обнаружена передача генетической информации от белков к нуклеиновым кислотам. На первом этапе экспрессии генов происходит переписывание генетической информации, заключенной в генах, на матричные (информационные) РНК (мРНК – messenger RNA, mRNA), которые являются местом промежуточного хранения этой информации при ее реализации. В некоторых случаях уже сами РНК являются конечным результатом экспрессии генов, и после ряда ферментативных модификаций они непосредственно используются в клеточных процессах. Это относится, прежде всего, к рибосомным и транспортным РНК (рРНК и тРНК), которые вместе составляют основную часть суммарной РНК клетки. К таким РНК принадлежат и малые ядерные РНК (мяРНК), участвующие в процессинге предшественников мРНК эукариот, РНК, входящие в состав ферментов, и природные антисмысловые РНК.
Синтез РНК происходит в результате сложной последовательности биохимических реакций, называемой транскрипцией. Появление русифицированного термина "мРНК" связано с тем, что на втором этапе реализации генетической информации, называемом трансляцией, последовательность нуклеотидов мРНК согласно генетическому коду однозначно определяет последовательность аминокислотных остатков синтезируемых белков, т.е. является матрицей, в соответствии с последовательностями нуклеотидов которой происходит соединение аминокислотных остатков друг с другом в полипептидных цепях белков во время их биосинтеза. Таким образом, экспрессию генов определяют два глобальных молекулярно-генетических механизма: транскрипция генов и трансляция синтезированных мРНК рибосомами, которая завершается образованием полипептидных цепей, кодируемых генами. Однако процесс экспрессии генов не ограничивается их транскрипцией и трансляцией. Существенными моментами экспрессии генов являются посттранскрипционные и посттрансляционные модификации мРНК и белков, которые включают процессинг их предшественников (удаление избыточных последовательностей и другие ковалентные модификации последовательностей РНК и белков). Посттранскрипционные модификации предшественников мРНК обеспечивают подготовку мРНК к эффективной трансляции рибосомами и определяют продолжительность ее существования в цитоплазме. Посттрансляционные модификации белков также необходимы для их полноценного функционирования.
Транскрипция
ДНК-зависимые РНК-полимеразы
РНК-полимераза E. coli. Наиболее изученной из бактериальных ферментов является РНК-полимераза E. coli. Она осуществляет транскрипцию всех… В отличие от эубактерий, которые, как уже упоминалось выше, при транскрипции… РНК-полимераза I эукариот (Pol I).Как и большинство других высокомолекулярных полипептидов, большие субъединицы…Рис. I.4. Структурные и функциональные домены больших субъединиц эукариотической РНК-полимеразы I (а) и особенности структуры промоторов эубактерий и эукариот (б)
а – Полипептидные цепи двух больших субъединиц изображены в виде горизонтальных прямоугольников, в которых черным цветом и латинскими буквами отмечены участки, консервативные у большинства известных РНК-полимераз. Кислая область и участки Ia-Id характерны для РНК-полимераз I. Обозначены зоны полипептидных цепей, формирующие активный центр фермента и необходимые для выполнения соответствующих функций (например связывания Mg2+). Пунктирные стрелки указывают на участки субъединиц, контактирующие друг с другом.
б – Незаштрихованными прямоугольниками обозначены известные структурные элементы промоторов, необходимые для инициации или активации транскрипции. Внутри прямоугольников приведены названия факторов транскрипции, взаимодействующих с соответствующими элементами промоторов, а также названия сайтов или взаимодействующих с ними белков, находящихся над сайтами. Стрелки « обозначают фиксированные расстояния между элементами промоторов, а ® – 5¢-концевые части элонгируемых транскриптов. Черными прямоугольниками обозначены участки промоторов, защищаемые от действия ДНКазы I или других агентов Es70, а также эукариотическими транскрипционными комплексами, обеспечивающими базальный уровень транскрипции. tss – точка инициации транскрипции. Другие обозначения см. в тексте
полипептидных цепях с помощью направленного мутагенеза заменяли соответствующие аминокислоты и мутантные субъединицы использовали в сборке ферментов из отдельных субъединиц in vitro с последующим анализом свойств таких реконструированных ферментов. На рис. I.4,а суммированы данные, полученные для двух самых больших субъединиц (RPA194 и RPA116) Pol I мышей, которые являются функциональными аналогами β'- и β-субъединиц РНК-полимеразы E. coli.
РНК-полимераза I эукариот является большим ферментом, построенным по меньшей мере из 11 субъединиц. Минимальный фермент Pol I содержит два обсуждавшихся выше больших полипептида с молекулярной массой 194 и 116 кДа, которые ассоциированы с несколькими малыми субъединицами (от трех до 14 в зависимости от метода очистки), молекулярные массы которых лежат в пределах 15–60 кДа. Третья по величине субъединица Pol I мышей с молекулярной массой 53 кДа, названная PAF53 (polymerase associated factor 53), играет важную роль в узнавании Pol I своих промоторов и, по-видимому, является структурным и функциональным аналогом белка RPA49 дрожжей. Pol I дрожжей в отсутствие субъединиц RPA49 и RPA35.5 (так называемая Pol I*) эффективно транскрибирует при низких концентрациях солей искусственную матрицу poly[d(A-T)], но не нативную двухцепочечную ДНК. Полагают, что эти субъединицы необходимы для эффективного образования инициационных комплексов (см. ниже).
Используя антитела к отдельным субъединицам Pol I и последующую иммунопреципитацию, установили, что в клетке, по крайней мере, часть Pol I находится в составе больших комплексов, с которыми ассоциированы факторы транскрипции. Пять компонентов такого холофермента Pol I изучены в настоящее время наиболее детально.
Мышиный фактор TIF-IB (Pol I-specific transcription initiation factor B), известный также, как фактор D, обеспечивает Pol I селективность в отношении промоторов генов рРНК (рДНК). Аналогичный белок у человека назван hSL1, у крыс – rSL1 и у X. laevis – Rib 1. Взаимодействие фактора TIF-IB/SL1 с промотором рДНК обеспечивает связь холофермента Pol I с промотором и сборку прединициационного комплекса. Фактор TIF-IB/SL1 состоит из четырех субъединиц, одна из которых является основным фактором транскрипции TBP, необходимым для функционирования РНК-полимераз всех трех классов. (Подробнее об основных факторах транскрипции см. следующий раздел 2.1.3.) Три других субъединицы с молекулярными массами 110, 63 и 48 кДа представляют собой разные TBP-ассоциированные факторы TAFI, индивидуально и специфически взаимодействующие с TBP, а также друг с другом, образуя прочный комплекс. В составе комплекса TAFI48 обеспечивает контакт TIF-IB/SL1 с фактором UBF (см. ниже), а TAFI63 и TAFI110 участвуют в распознавании промотора. Факторы TAFI не обнаруживают гомологии с соответствующими факторами TAFII, специфичными в отношении Pol II. Более того, первый из связавшихся с TBP факторов TAFI предотвращает взаимодействие с TBP факторов TAFII (и наоборот), что делает невозможным образование непродуктивных химерных комплексов. Одновременно взаимодействие TAFI48 с TBP изменяет ДНК-связывающие свойства последнего, после чего тот перестает узнавать TATA-бокс – характерный структурный элемент Pol II-промоторов, и, следовательно, теряет способность обеспечивать инициацию транскрипции Pol II.
Другой белок, входящий в состав холофермента Pol I, UBF (upstream binding factor) высоко консервативен у разных видов животных. UBF является членом семейства факторов транскрипции, содержащих ДНК-связывающий HMG-домен (high mobility group domain) – основную последовательность из 80 аминокислот. С помощью ЯМР-спектроскопии установлено, что полипептидная цепь HMG-домена организована в три α-спирали, расположенные в виде буквы L, которые формируют три ДНК-связывающих поверхности с внешней стороны L. В клетке UBF присутствуют в двух формах – UBF1 и UBF2 с молекулярными массами 97 и 95 кДа, которые образуются в результате альтернативного сплайсинга. UBF1 содержит пять HMG-доменов, фланкированных N-концевым димеризующим мотивом и короткой кислой C-концевой последовательностью. Интересно, что соседние HMG-домены одного и того же UBF обладают гораздо меньшей гомологией, чем соответствующие домены UBF разных видов (например шпорцевой лягушки и человека). Полагают, что каждый HMG-домен обеспечивает особую, эволюционно консервативную функцию молекулы UBF. Такими функциями могут быть распознавание специфических последовательностей ДНК, создание молекулярных интерфейсов для белок–белковых взаимодействий между Pol I и TIF-IB/SL1, а также различными репрессорами и активаторами транскрипции рДНК. С-Концевая последовательность UBF содержит несколько фосфорилируемых остатков Ser и необходима для активации транскрипции рДНК. Одной из основных характеристик белков, содержащих HMG-бокс, является их способность изгибать молекулу ДНК и прочно связываться с ее крестообразными структурами. Всеми этими свойствами обладает UBF, и они детально исследованы.
Белок CPBF (core promoter binding factor), выделенный из асцитных клеток аденокарциномы молочных желез крыс, специфически взаимодействует с коровым участком промотора рДНК (о структуре промотора см. в разделе 2.1.2.). CPBF, прочно взаимодействующий с Pol I, состоит из двух субъединиц USF1 и USF2 с молекулярными массами 44 и 39 кДа соответственно. Гомодимеры USF1 и USF2 являются сильными ингибиторами транскрипции Pol I, тогда как гетеродимеры USF1/USF2 стимулируют транскрипцию in vitro. Полагают, что CPBF участвует в регуляции транскрипции Pol I in vivo.
TIF-IA – другой компонент холофермента Pol I, также участвует в регуляции синтеза рРНК этим ферментом. В его отсутствие инициационный комплекс не может образовывать первой фосфодиэфирной связи, а следовательно, и инициировать синтез РНК. TIF-IA освобождается после инициации транскрипции и может вновь входить в состав собирающихся прединициационных комплексов. По этим и ряду других критериев TIF-IA рассматривают в качестве функционального аналога бактериального фактора σ70. TIF-IA является мономерным глобулярным белком с молекулярной массой 70–80 кДа. Активность этого фактора или его внутриклеточное содержание уменьшается при подавлении синтеза белка, истощении сыворотки или дифференцировке клеток и возрастает в ответ на митогенные стимулы, что коррелирует с подавлением или стимуляцией синтеза рРНК.
Хроматографически и с помощью иммунопреципитации было установлено, что жизненно важный фактор TIF-IC в растворе ассоциирован с Pol I. Этот фактор необходим как для сборки инициационных комплексов, так и образования первой фосфодиэфирной связи. Его присутствие предотвращает неспецифическую инициацию транскрипции и ее преждевременную терминацию, что проявляется в образовании гомогенных транскриптов правильной длины. По этим критериям фактор TIF-IC рассматривают в качестве функционального аналога TFIIF (RAP30/74) Pol II (см. ниже).
РНК-полимераза II (Pol II).Pol II человека содержит более 10 субъединиц, которые трудно назвать субъединицами в обычном смысле из-за слабой ассоциации друг с другом. Некоторые из них принадлежат к основным факторам транскрипции (GTFs – general transcription factors). Вообще же понятие холофермента Pol II эукариот не является устоявшимся. Лишь недавно в лабораториях Р.Янга и Р.Корнберга было установлено, что некоторые основные факторы транскрипции уже находятся в комплексе с РНК-полимеразой до ее включения в прединициационный комплекс. По мнению Янга, которое становится все более обоснованным, в состав холофермента Pol II дрожжей входят по меньшей мере 14 белков и белковых комплексов, перечисленных в табл. I.3.
Таблица I.3
Характеристики белковых компонентов холофермента
РНК-полимеразы II дрожжей
Транскрипция с участием холофермента Pol II стимулируется активатором GAL4–VP16, что не происходит в присутствии только одних очищенных основных… Субъединичное строение РНК-полимераз разного происхождения, вероятно, отражает… РНК-полимеразы бактерий и эукариот должны, во-первых, узнавать разные промоторы, во-вторых, реагировать на различные…Единицы транскрипции (транскриптоны)
Промоторы эубактерий. В 1964 г. Ф. Жакобом, А. Уллманом и Ж. Моно была впервые сформулирована концепция промотора как особого регуляторного элемента… Структура обобщенного минимального промотора для холофермента РНК-полимеразы… Влияние мутаций в областях –10 и –35 на активность промотора, как правило, хорошо коррелирует с тем, насколько новая…Рис. I.5. Межмолекулярные взаимодействия на промоторе РНК-полимеразы II
РЭ1–РЭn – последовательности нуклеотидов регуляторных элементов промотора, ФТ1–ФТn – взаимодействующие с ними регуляторные факторы транскрипции, ОФТ – основные факторы транскрипции, КТ – коактиваторы транскрипции, +1 – точка инициации транскрипции
Обобщенная схема промотора РНК-полимеразы II в составе инициационного комплекса представлена на рис. I.5. На ней отображены многочисленные белок–белковые и белково–нуклеиновые взаимодействия при инициации транскрипции. На этой схеме также указано наличие во многих промоторах консервативной последовательности CA, которая находится непосредственно перед нуклеотидом А+1. У некоторых промоторов, в частности ассоциированных с генами домашнего хозяйства, может отсутствовать явно выраженная TATA-последовательность. Проксимальные и дистальные регуляторные элементы промоторов построены из коротких транскрипционных элементов длиной в 10–15 п.о., с которыми непосредственно взаимодействуют факторы транскрипции. Проксимальные регуляторные элементы, как правило, имеют простую структуру, включающую один или несколько транскрипционных элементов (ТЭ). В то же время энхансеры устроены более сложно. Следует заметить, что в активном промоторе дистальные и проксимальные регуляторные элементы сближены друг с другом, в результате чего происходит "выпетливание" разделяющих их протяженных последовательностей ДНК.
Промоторы РНК-полимеразы III. Как уже упоминалось выше, гены, транскрибируемые РНК-полимеразой III, можно разделить на три основных класса (см. рис. I.4,б). К 1-му классу относят гены 5S рРНК, которые содержат внутреннюю регуляторную область (internal control region – ICR). Три элемента ICR, с которыми взаимодействует основной фактор транскрипции TFIIIA, локализованы между нуклеотидами +50 и +64. Комплекс TFIIIA–ICR стабилизируется после взаимодействия с TFIIIA фактора TFIIIC, хотя для последнего в промоторе отсутствует специфический участок связывания (подробнее о факторах транскрипции см. в разделах 2.1.3 и 3.2). Мутации, локализованные в окрестностях точки инициации транскрипции промоторов классов 1 и 2, оказывают сильное влияние на транскрипцию этих генов, что указывает на возможное присутствие в этих промоторах дополнительных регуляторных элементов.
Гены тРНК относят ко второму классу. Для промоторов этих генов характерно наличие внутренних блоков регуляторных последовательностей A и B. Блок А локализован между нуклеотидами +10 и +20, тогда как блок B удален от него на расстояние 30–60 п.о. по направлению к 3’-концу гена. Эти регуляторные элементы узнаются непосредственно фактором TFIIIC, который образует с ними очень прочный комплекс. По крайней мере, четыре полипептидные цепи, входящие в состав комплекса TFIIIC–промотор, контактируют друг с другом и покрывают участок ДНК между положениями –25 и +75. Канонический регуляторный элемент в окрестностях точки инициации транскрипции был локализован путем анализа последовательностей нуклеотидов в соответствующих генах тРНК.
Гены третьего класса кодируют малые ядерные РНК, например U6-РНК у высших эукариот, и содержат только регуляторные элементы, расположенные перед точкой инициации транскрипции. У большинства генов этого класса регуляторные элементы состоят из ТАТА-последовательности с центром в положении –30 и из проксимального элемента PSE (proximal sequence element) с центром в положении –60. Несмотря на наличие ТАТА-элемента, обычно определяющего положение точки инициации транскрипции, в данном случае именно PSE фиксирует положение этой точки. Аналогичную функцию у промоторов РНК-полимеразы II выполняет ТАТА-последовательность. Состав белковых компонентов, образующих комплекс с PSE, в настоящее время до конца не выяснен. Обнаружены два различных PSE-связывающих белковых комплекса, названные SNAP и PTF. Активность промоторов третьего класса зависит от наличия ТАТА-связывающего белка (TBP). Белок ТВР, входящий в состав фактора транскрипции TFIIIB, взаимодействует непосредственно с ТАТА-элементом промотора. Поскольку для инициации транскрипции на этих промоторах требуется наличие PSE-элемента, предполагают, что PSE-связывающий фактор взаимодействует с ТВР-компонентом фактора TFIIIB. Интересно, что промотор гена U6-РНК животных, узнаваемый РНК-полимеразой III, отличается от промотора гена U2-РНК, с которым взаимодействует РНК-полимераза II, только отсутствием ТАТА-элемента U2-промотора. У растений оба этих промотора содержат такие регуляторные элементы, а изменение расстояния между ТАТА-элементом и расположенным перед ним регуляторным элементом превращает промотор U6 из Pol III-зависимого в Pol II-зависимый. Несмотря на наличие у промоторов этих РНК-полимераз характерных черт, описанных выше, механизмы, по которым РНК-полимеразы II и III различают свои промоторы, остаются невыясненными.
Промоторы РНК-полимеразы I. Несмотря на то, что участки генома, кодирующие рРНК, относятся к одним из наиболее консервативных, регуляторные последовательности, обеспечивающие инициацию транскрипции у разных видов, сильно дивергированы. Одно из объяснений этого явления основывается на факте вхождения рДНК в мультигенное семейство (гены рРНК многократно повторены в геноме). В этой связи мутации в регуляторной области одного гена, которые благоприятно сказываются на его экспрессии, могут быстро распространиться в семействе последовательностей благодаря генной конверсии, неравному кроссинговеру и/или последовательным актам их эксцизии и реинтеграции в геном. В соответствии с этой интерпретацией, промоторные последовательности рДНК обнаруживают мало гомологии даже у таких близких видов, как человек и мышь. Тем не менее, общий план строения промоторов рДНК практически не различается у всех исследованных эукариот. Промоторы РНК-полимеразы I содержат два кόровых регуляторных элемента (CPE – core promoter element), локализованных между положениями –75 и –50, а также –30 и +1 (см. рис. I.4, б). Основной промотор лишь слабо связывает TBP-содержащий белковый комплекс SL1 (у людей и крыс), в состав которого, кроме того, входят еще три видоспецифических фактора транскрипции (TBP associated factor – TAF), специфичных в отношении РНК-полимеразы I. Сборка прединициационного комплекса (см. раздел 2.1.3) в этом случае не зависит от специфического взаимодействия TBP и ДНК, так как промоторы РНК-полимеразы I не содержат TATA-последовательности. Как уже упоминалось выше, TAFI63 и TAFI110, входящие в состав комплекса SL1, являются ДНК-распознающими компонентами комплекса. С помощью футпринтинга (см. раздел 7.6.4) было установлено, что комплекс SL1 остается связанным с промотором на протяжении нескольких раундов инициации синтеза РНК РНК-полимеразой I. Стабильное взаимодействие комплекса SL1 с промотором требует участия дополнительного ДНК-связывающего белка UBF, который сам по себе обладает способностью слабо связываться с удаленной регуляторной последовательностью UCE (upstream control element), расположенной между нуклеотидами в положениях –90 и –150. Синергизм в стимулирующем действии SL1 и UBF на транскрипцию РНК-полимеразой I может быть обусловлен наличием непосредственных контактов между этими двумя факторами. Другим регуляторным элементом, удаленным от точки инициации транскрипции промотора Pol I, является энхансер, построенный из коротких повторяющихся последовательностей.
Последовательность CPE обеспечивает специфичность транскрипции генов рРНК, и ее достаточно для инициации. В этой связи последовательность UCE и энхансер не рассматриваются в настоящее время как части промотора РНК-полимеразы I. Кроме того, соответствующие промоторы простейших, грибов и растений последовательность UCE не содержат, а белок UBF не является необходимым компонентом бесклеточных систем транскрипции. Как будет подробно рассмотрено ниже, образование прединициационного комплекса РНК-полимеразой II требует участия фактора TFIIB. Аналогичный в функциональном отношении белковый фактор BRF также необходим для инициации транскрипции РНК-полимеразой III. Соответствующий белковый компонент РНК-полимеразы I еще не идентифицирован. Помимо фактора, связывающего кóровую последовательность – CPBF, в инициации синтеза рРНК принимает участие фактор, связывающий энхансер 1, – E1BF (enhancer 1-binding factor), который не входит в состав холофермента Pol I. Оба фактора заметно повышают базальный уровень синтеза рРНК в бесклеточных системах транскрипции.
Этапы транскрипции
В обычных условиях холофермент РНК-полимераз эубактерий для инициации транскрипции не требует дополнительных факторов. В отличие от этого для точной…Рис. I.6. Цикл транскрипции и последующие пути реализации генетической информации
Связывание молекул РНК-полимеразы с ДНК и поиск промоторов. Механизм поиска промоторов на ДНК молекулами РНК-полимеразы в настоящее время до конца не выяснен. Принято считать, что после первоначального непрочного связывания с ДНК в случайных местах молекулы РНК-полимеразы перемещаются вдоль двойной спирали ДНК до тех пор, пока не обнаруживают последовательности нуклеотидов промоторов, на которых взаимодействие фермента с ДНК становится более прочным. Во время движения молекулы РНК-полимеразы могут периодически отделяться от ДНК и связываться с ней на новом месте, что ускоряет процесс поиска промоторов. Как уже упоминалось выше, в связывании с ДНК участвует b-субъединица РНК-полимеразы E. coli, а a- и особенно s-субъединицы необходимы для специфического распознавания промоторов. Установлено, что холофермент РНК-полимеразы E. coli (минимальный фермент, содержащий s-субъединицу) закрывает в области промотора участок ДНК длиной ~50 п.о. При этом a-субъединицы контактируют с ДНК в области -35-го нуклеотида промотора.
Инициация транскрипции. Инициация транскрипции начинается со сборки на промоторе прединициационного комплекса, в состав которого входят молекулы РНК-полимеразы и матричной ДНК. Если в случае РНК-полимеразы E. coli и других прокариот для осуществления этого процесса нет необходимости в присутствии других белковых факторов, то механизм сборки инициационного комплекса с участием РНК-полимеразы II носит более сложный характер. В настоящее время существуют две модели инициации транскрипции РНК-полимеразой II. В соответствии с одной из них на промоторе происходит постепенная (ступенчатая) сборка инициационного комплекса из отдельных компонентов. Другая модель акцентирует внимание на то, что Pol II может входить в состав инициационного комплекса в виде холофермента, состоящего из многих субъединиц. Хотя вторая модель становится доминирующей, ниже будет подробнее рассмотрена первая модель, более наглядно описывающая процесс инициации транскрипции у эукариот.
Сборка такого комплекса начинается с последовательного связывания с промотором основных факторов транскрипции (табл. I.4). Обычно факторами транскрипции называют белки или белковые комплексы, непосредственно не участвующие в каталитическом акте образования РНК, но необходимые для прохождения основных этапов транскрипции и ее регуляции. По функциональному признаку принято различать три класса факторов транскрипции. К первому классу относятся основные факторы транскрипции, обеспечивающие нерегулируемый базальный уровень транскрипции и функционирующие в клетках всех типов.
Таблица I.4
Субъединичный состав и характеристика основных факторов транскрипции (GTF) РНК-полимеразы II человека
Рис. I.7. Схема инициации транскрипции РНК-полимеразой II и освобождения промотора
а – сборка прединициационного транскрипционного комплекса; б – инициация транскрипции и освобождение промотора
Ко второму классу относятся факторы транскрипции, специфически взаимодействующие с определенными последовательностями ДНК, которые являются основными регуляторами транскрипции и обеспечивают тканеспецифическую экспрессию генов. И, наконец, третий класс факторов транскрипции (в том числе многочисленные TAF-белки (TAB-associated factors)) представлен недавно открытыми белками – коактиваторами транскрипции, которые действуют согласованно с основными и тканеспецифическими факторами, обеспечивая более тонкую регуляцию транскрипции. О двух последних классах факторов транскрипции речь пойдет в разделе 3.2.2.
Первым с TATA-последовательностью промотора взаимодействует белковый комплекс TFIID (transcription factor II D), в состав которого входят белок, связывающий TATA-последовательность (TBP), а также еще по меньшей мере девять белковых субъединиц (см. рис. I.7,а). Белок TBP необходим и для осуществления транскрипции РНК-полимеразами I и III, он является универсальным фактором транскрипции у эукариот. Взаимодействие TBP с TATA-последовательностью характеризуется значительным изменением структуры ДНК в этом месте, сопровождаемым частичным разворачиванием двойной спирали. После взаимодействия с TATA-последовательностью TFIID приобретает способность ассоциироваться с факторами TFIIA и TFIIB. Присутствие TFIIB делает возможным вхождение РНК-полимеразы II в прединициационный комплекс. Присоединение РНК-полимеразы II к комплексу сопровождается связыванием с ней дополнительных факторов TFIIE, TFIIF, TFIIH и TFIIJ, что завершается образованием так называемого закрытого прединициационного комплекса (см. рис. I.7,б). Свое название комплекс получил благодаря тому, что участок ДНК промотора, входящий в его состав, в основном сохраняет свою исходную вторичную структуру – обе цепи ДНК связаны друг с другом водородными связями. В инициационном комплексе происходит локальное плавление, т.е. раскрытие соответствующего участка ДНК, и комплекс становится способным к инициации транскрипции. Аминокислотные последовательности отдельных субъединиц факторов TFIIB, TFIIE и TFIIF обнаруживают явную гомологию с последовательностями s70-фактора РНК-полимеразы E. coli. Это может указывать на определенную общность функций и эволюционного происхождения про- и эукариотических факторов транскрипции.
После сборки прединициационный закрытый комплекс претерпевает температурно-зависимые конформационные изменения, что необходимо для образования активного инициирующего транскрипционного комплекса. Показано, что в закрытом комплексе холофермент РНК-полимеразы E. coli взаимодействует с молекулой ДНК лишь с одной ее стороны, тогда как в промежуточном и открытом комплексах b- и b‘-субъединицы РНК-полимеразы полностью охватывают молекулу ДНК в окрестностях точки инициации транскрипции. Конформационный переход промежуточного прединициационного комплекса в открытый сопровождается локальным плавлением двойной спирали ДНК между нуклеотидами в положениях -10 и +3 с образованием коротких одноцепочечных участков ДНК. При наличии открытого инициационного комплекса в присутствии четырех рибонуклеозидтрифосфатов может происходить инициация транскрипции, сопровождаемая синтезом коротких (до 7–8 нуклеотидов) олигорибонуклеотидов, непрерывно освобождающихся из транскрипционного комплекса в том случае, если синтез РНК не может быть продолжен (например из-за отсутствия очередного нуклеотида). Эта стадия синтеза РНК получила название абортивной транскрипции. После синтеза РНК длиной более девяти нуклеотидов фермент покидает промотор, у РНК-полимеразы E. coli происходит отделение s-фактора от инициационного комплекса, формируется стабильный элонгирующий комплекс, и реакция транскрипции вступает в фазу элонгации.
Фаза абортивной транскрипции характерна для прокариотических и эукариотических РНК-полимераз. Однако переход от стадии абортивной транскрипции к продуктивной элонгации у эукариот характеризуется рядом особенностей. В отличие от РНК-полимеразы E. coli (а также эукариотических РНК-полимераз I и III), РНК-полимераза II содержит в С-концевом домене большой субъединицы гексапептидный повтор (до 52 повторяющихся последовательностей) CTD (carboxy terminal domain), который является субстратом протеинкиназы. В прединициационном комплексе эта последовательность аминокислотных остатков частично фосфорилирована, тогда как у активно элонгирующей РНК-полимеразы CTD фосфорилирован полностью по остаткам Ser и Thr. Несмотря на то, что in vitro многие протеинкиназы обладают способностью фосфорилировать CTD, биологические функции в данном процессе приписывают протеинкиназе фактора TFIIH. Дополнительные исследования показали, что эта протеинкиназа идентична киназе cdk7, участвующей в регуляции клеточного цикла. Предполагается, что in vivo частичное фосфорилирование CTD-домена удерживает молекулу РНК-полимеразы II на промоторе, и его полное фосфорилирование необходимо для того, чтобы фермент покинул промотор и перешел к элонгации вновь синтезируемых цепей РНК. Этот процесс получил название "освобождение промотора" (promoter clearance (escape)) (см. рис. I.7,б). Кроме того, переход закрытого прединициационного комплекса, образованного РНК-полимеразой II, в открытый инициационный комплекс является ATP-зависимым процессом.
В заключение необходимо еще раз вспомнить о том, что многие клеточные белки могут выполнять более одной функции, что является основой тесного сопряжения биохимических реакций, вовлеченных в процессы реализации генетической информации. В частности, многие (пять из девяти) субъединицы TFIIH служат основными компонентами системы эксцизионной репарации ДНК (см. табл. I.4, а также раздел 5.2.2). Такое сопряжение приводит к более эффективной репарации повреждений ДНК в активно транскрибируемых генах по сравнению с молчащими последовательностями ДНК.
Элонгация цепей РНК. Момент перехода РНК-полимеразы от инициации транскрипции к элонгации точно не определен. Три основных биохимических события характеризуют этот переход в случае РНК-полимеразы E. coli: отделение s-фактора, первая транслокация молекулы фермента вдоль матрицы и сильная стабилизация транскрипционного комплекса, который кроме РНК-полимеразы включает растущую цепь РНК и транскрибируемую ДНК. Все те же явления характерны и для РНК-полимераз эукариот, хотя в этом случае момент перехода от инициации к элонгации еще более неопределенен. И в том, и в другом случае переход от инициации к элонгации сопровождается разрывом связей между ферментом, промотором, факторами инициации транскрипции, а в ряде случаев – переходом РНК-полимеразы в состояние компетентности в отношении элонгации (например фосфорилирование CTD-домена у РНК-полимеразы II). Фаза элонгации заканчивается после освобождения растущего транскрипта и диссоциации фермента от матрицы (терминация).
Биохимические особенности элонгации. РНК-полимеразы являются процессивными ферментами: если фермент освобождает растущую цепь РНК до завершения транскрипции гена, то он не в состоянии связать эту РНК вновь и продолжить транскрипцию. Поэтому каждый новый раунд синтеза РНК начинается с реинициации транскрипции на промоторе. Такие биохимические особенности РНК-полимераз объясняют, почему стабильность транскрибирующего комплекса является одним из его критических свойств.
Рис. I.8. Модели структуры тройного комплекса элонгирующей РНК-полимеразы E. coli (а) и механизма скачкообразной элонгации (б)
а: Т и НТ – соответственно транскрибируемая и нетранскрибируемая цепи ДНК. ДНК I и ДНК II, РНК I и РНК II – сайты связывания соответственно ДНК и РНК, А – активный центр, D и U – соответственно передняя и задняя части движущегося фермента, С – 3¢-конец РНК.
б: Цикл скачкообразной элонгации транскрипции (1), сопровождаемой терминацией синтеза РНК (2) или образованием комплексов полностью прекративших элонгацию (3). I и II – соответственно транскрибируемая цепь ДНК и строящаяся цепь РНК; III – активный центр фермента; IV – напряженное (напряж.) и релаксированное (рел.) состояния полипептидной цепи РНК-полимеразы; цилиндр, охватывающий цепь ДНК – ДНК-связывающий центр I; С–D – расстояние между 3¢-концом РНК и передней границей РНК-полимеразы (п.о.)
Действительно, многие гены эукариот обладают очень большими размерами (длина гена дистрофина человека, например превышает 2000 т.п.о. и его транскрипция продолжается ~ 17 ч), следовательно, преждевременная терминация транскрипции могла бы с большой вероятностью прекратить экспрессию таких генов вообще. Из этих соображений не удивительно, что тройной комплекс РНК-полимераза–РНК–матрица чрезвычайно стабилен. Такие комплексы устойчивы к высокой ионной силе, допускают очистку гель-фильтрацией, преципитацию антителами, остаются активными после проведения электрофореза в неденатурирующих условиях и могут храниться в отсутствие рибонуклеозидтрифосфатов при +4оС в течение нескольких дней без потери активности.
В настоящее время разработаны методы, позволяющие задерживать элонгирующую РНК-полимеразу бактерий в любом участке матрицы путем удаления из реакционной смеси одного из рибонуклеозидтрифосфатов. При таком подходе РНК-полимеразу иммобилизуют на носителе, и процесс транскрипции осуществляют непосредственно в колонке, последовательно добавляя нуклеотид за нуклеотидом после отмывания предыдущего. Это дает возможность последовательно перемещать РНК-полимеразу от одного нуклеотида к другому вдоль матрицы, как бы шагать вдоль матричной ДНК (walking). Такой метод является прекрасным инструментом для исследования механизмов элонгации и обнаружения факторов транскрипции, оказывающих влияние на этот процесс.
Скорости транскрипции матричной ДНК РНК-полимеразами сильно различаются. Обнаружена слабая корреляция между субъединичным строением РНК-полимераз и скоростью, с которой они способны элонгировать ДНК. Так, РНК-полимеразы бактериофагов, состоящие из одной субъединицы, являются наиболее быстрыми среди ДНК-зависимых РНК-полимераз. Они способны элонгировать in vitro растущую цепь РНК со скоростью 200–400 нт/с. Бактериальные РНК-полимеразы транскрибируют ДНК с промежуточной скоростью – 50–100 нт/с, тогда как скорость элонгации РНК-полимеразой II многоклеточных организмов in vitro составляет всего 5–10 нт/с. Эукариотические РНК-полимеразы элонгируют цепи РНК in vivo со скоростью ~20–30 нт/с.
Точность транскрипции, осуществляемой РНК-полимеразами, ниже соответствующего параметра ДНК-полимераз. Частота ошибок в виде включенных в РНК некомплементарных матрице нуклеотидов составляет 10-3–10-5. Это объясняется, прежде всего, тем, что РНК-полимеразы лишены корректирующей системы в виде 3’®5’- и 5’®3’-экзонуклеазной активности. В определенных условиях РНК-полимеразы обладают способностью отщеплять 3’-концевую часть транскрипта, находящегося в составе тройного комплекса (см. ниже). Однако до сих пор не ясно, имеет ли эта активность отношение к коррекции ошибок. С эволюционной точки зрения понятно, почему точность транскрипции в меньшей степени подвержена давлению отбора по сравнению с точностью репликации. Действительно, если ошибки репликации должны сопровождаться изменением генотипа клетки или организма, то ошибки транскрипции не приводят к таким последствиям.
Структура элонгирующего комплекса. Основные черты структуры тройного комплекса, осуществляющего элонгацию цепей РНК, консервативны у всех ДНК-зависимых РНК-полимераз (см. рис. I.8). В каждом элонгирующем комплексе имеются каталитический центр, одноцепочечная область ДНК-матрицы, а также несколько сайтов связывания ДНК и РНК. Для реализации принципа комплементарности при построении растущей цепи РНК участок матричной ДНК, входящий в состав комплекса, находится в расплавленном состоянии, и одна из его цепей служит матрицей при транскрипции. Этот участок ДНК, называемый транскрипционным пузырьком, или транскрипционной сферой (transcription bubble), контактирует с каталитическим центром РНК-полимеразы. По обеим сторонам транскрипционного пузырька имеются участки ДНК, которые при перемещении фермента вдоль матрицы подвергаются плавлению (расплетанию) и повторному отжигу, в результате которого восстанавливается исходная структура ДНК. Считается, что этот процесс не является каталитическим, протекает самопроизвольно и связан с особенностями структуры РНК-полимеразы как таковой.
В молекуле РНК-полимеразы имеются несколько участков связывания матричной ДНК и участок связывания растущей цепи РНК, которые обеспечивают точное расположение 3’-ОН-конца РНК относительно транскрибируемого в данный момент нуклеотида матрицы и соответствующего субстрата. В ранних моделях элонгирующего комплекса постулировалось существование короткого гибрида между матричной ДНК и строящейся цепью РНК, однако в настоящее время эта модель подвергается сомнению. Считается, что если гибрид существует, то его длина составляет лишь 2–12 п.о. Современные модели элонгирующего комплекса предполагают наличие механизма, обеспечивающего выбор правильного нуклеотида из пула субстратов. Хотя в принципе этот процесс может быть исключительно следствием комплементарного взаимодействия нуклеотида и матрицы, более распространена точка зрения, согласно которой ключевую роль здесь играет сама молекула РНК-полимеразы, пространственная структура которой формируется при ее контакте с ДНК и растущим транскриптом.
В современных моделях структуры элонгирующего комплекса предполагают наличие в РНК-полимеразе двух сайтов, удерживающих растущую цепь РНК, и двух участков связывания ДНК-матрицы. В совокупности эти участки связывания обеспечивают замечательную стабильность комплекса. Тем не менее, точное положение этих сайтов связывания нуклеиновых кислот в настоящее время неизвестно. Для РНК-полимеразы E. coli имеются доказательства того, что задняя часть элонгирующего фермента контактирует с двухцепочечной ДНК, а передняя – с одноцепочечной, причем с ее транскрибируемой (матричной) цепью.
Способы блокировки элонгации растущих цепей РНК. Элонгация РНК не происходит с постоянной скоростью. Во время элонгации РНК-полимераза может получать сигналы, вызывающие задержку транскрипции (pause), ее прекращение (arrest), или терминацию. В результате задержки молекула РНК-полимеразы временно останавливает синтез РНК на определенный период времени, после чего спонтанно продолжает транскрипцию. В отличие от этого, элонгирующие комплексы, прекратившие синтез РНК, неспособны продолжить транскрипцию без помощи дополнительных факторов. Сигналы, вызывающие такое поведение РНК-полимеразы, могут быть внутренними, в виде определенной последовательности нуклеотидов транскрибируемой ДНК, или внешними – в виде специфических белков-регуляторов, связавшихся с матрицей. Прекращение транскрипции может быть вызвано и в искусственных условиях при отсутствии одного или нескольких рибонуклеозидтрифосфатов. Как во время задержки, так и во время прекращения синтеза РНК РНК-полимераза остается каталитически активной, стабильно связанной с ДНК и удерживает растущий транскрипт в составе тройного комплекса. Именно эти характерные особенности отличают РНК-полимеразу в состоянии задержки или прекращения синтеза РНК от фермента, находящегося в фазе терминации транскрипции. Во многих случаях, когда невозможно четко дифференцировать три вышеупомянутых состояния транскрипции, говорят просто о блокировке синтеза РНК.
Как остановка, так и прекращение синтеза РНК характеризуются двумя параметрами – временем полужизни блокированного состояния комплекса и эффективностью распознавания сигнала. Под временем полужизни блокировки элонгации понимают промежуток времени, за который половина блокированных молекул РНК-полимеразы вступает в фазу продолжения синтеза РНК. Остановка может быть настолько кратковременной, что время полужизни блокированного комплекса невозможно точно определить; в то же время задержка элонгации может продолжаться в течение нескольких минут, что зависит от локализации и структуры соответствующего сайта на матричной ДНК. Эффективность распознавания сигнала блокировки определяется долей молекул РНК-полимеразы, отвечающих прекращением элонгации на соответствующем сайте, и может принимать значения от нескольких до 90%. Описано несколько сайтов, обладающих эффективностью 100%.
Временные остановки элонгирующей РНК-полимеразы на транскрибируемой ДНК бактериофага Т7 были обнаружены в бесклеточных системах, синхронизированных в отношении инициации синтеза РНК. Неожиданно оказалось, что молекулы РНК-полимеразы, синхронно инициировавшие транскрипцию с одного промотора, быстро и специфически распределяются в составе тройного комплекса вдоль матрицы, оставаясь ассоциированными с растущими цепями РНК дискретной длины. Исследование этого феномена привело к заключению о временных остановках РНК-полимеразы во время транскрипции в определенных участках матрицы и было одним из первых доказательств того, что синтез РНК не является непрерывным процессом. Такие врéменные задержки во время элонгации характерны для многих РНК-полимераз, включая РНК-полимеразы I, II и III эукариотических организмов. Как у прокариот, так и у эукариот имеются многочисленные механизмы, регулирующие эффективность задержки транскрипции в определенных сайтах транскрибируемой ДНК (подробнее см. раздел 3.2).
В отличие от описанной выше врéменной задержки транскрипции, полное прекращение элонгации РНК внутри транскрибируемого гена физически блокирует перемещение вдоль гена других молекул РНК-полимеразы, инициировавших транскрипцию на тех же промоторах. Следствием этого является полное прекращение транскрипции такого гена, что служит одним из распространенных механизмов регуляции экспрессии генов на уровне элонгации РНК. Состояние прекращения элонгации РНК-полимеразой может возникать на некоторых участках матрицы in vitro в отсутствие одного или нескольких рибонуклеозидтрифосфатов. В этом случае, в отличие от временной задержки транскрипции, добавление в бесклеточную систему недостающих нуклеотидов не приводит к возобновлению синтеза РНК. Большинство тройных комплексов, прекративших транскрипцию по такому механизму, являются стабильными, а входящая в их состав РНК-полимераза полностью сохраняет свою активность. Переход элонгирующих комплексов из состояния врéменной задержки в состояние полного прекращения транскрипции происходит постепенно, по мере увеличения времени инкубации бесклеточной системы в отсутствие субстратов. В настоящее время не существует прямых доказательств наличия феномена полного прекращения элонгации in vivo. Однако по ряду косвенных данных, включая открытие белков, реактивирующих такие тройные комплексы, считается, что полное прекращение транскрипции имеет место также в клетках живого организма и является одним из регуляторных механизмов, координирующих экспрессию генов на уровне транскрипции. Задержка и полное прекращение транскрипции во время элонгации цепей РНК становятся возможными благодаря взаимодействиям между РНК-полимеразой, растущей цепью РНК и транскрибируемой ДНК и не требуют участия дополнительных факторов. Несмотря на интенсивные исследования, до сих пор не удается предсказывать места задержки элонгации РНК на матричных ДНК.
Природа сигналов, обеспечивающих задержку элонгирующих тройных комплексов у прокариот. Сигналы, вызывающие задержку элонгации, многокомпонентны. Они включают элементы как РНК, так и ДНК. Во многих сайтах задержки элонгации РНК-полимераза синтезирует участок РНК, который имеет склонность образовывать стабильную вторичную структуру. В этом случае мутации, разрушающие шпильку, уменьшают время полужизни комплекса в состоянии задержки элонгации. И наоборот, мутации, восстанавливающие вторичную структуру, увеличивают время полужизни таких комплексов. Это указывает на то, что сама вторичная структура, а не конкретная последовательность нуклеотидов внутри шпильки существенна для задержки элонгации растущей цепи РНК. В пользу этого вывода свидетельствует и тот факт, что включение в РНК IMP вместо GMP, приводящее к снижению числа водородных связей в шпильках, а следовательно, и их прочности, приводит к элиминации некоторых мест задержки элонгации. Тем не менее, образование шпильки в РНК еще не является достаточным условием задержки транскрипции в соответствующем участке матрицы, так как многие места задержки не содержат таких последовательностей. Последовательности ДНК и РНК, расположенные между основанием шпильки и активным центром РНК-полимеразы, также оказывают влияние на задержку элонгации. Замены нуклеотидов в 3'-концевых частях таких последовательностей сопровождаются изменениями времени полужизни комплекса в состоянии задержки. Полагают, что в этом случае вторичная структура РНК не имеет отношения к наблюдаемым эффектам.
Сигналы задержки элонгации могут действовать не только через РНК, но и на уровне ДНК. Так, последовательности, расположенные даже на 17 нуклеотидов ниже участка задержки транскрипции, оказывают влияние на задержку. Полагают, что одной из причин этого может быть воздействие таких последовательностей на способность РНК-полимеразы создавать локально расплетенный участок матричной ДНК. Альтернативным объяснением является влияние таких участков матричной ДНК на конформацию РНК-полимеразы. В случае РНК-полимеразы E. coli эти участки ДНК находятся в контакте с ферментом в одном из его ДНК-связывающих сайтов. С помощью мутационного анализа было установлено, что на задержку элонгации могут оказывать влияние и последовательности нуклеотидов нематричной цепи ДНК.
Природа прокариотических сигналов, вызывающих прекращение элонгации РНК. Так же как и в предыдущем случае, природа сигналов, вызывающих прекращение элонгации, не вполне ясна. В окрестностях сайтов на ДНК, вызывающих прекращение элонгации, не обнаружено каких-либо канонических последовательностей. К этому феномену может быть причастна вторичная структура РНК, поскольку замещение GMP на IMP, приводящее к ослаблению вторичной структуры РНК, во многих случаях предотвращает прекращение транскрипции в соответствующих участках ДНК. Большинство элонгирующих комплексов, прекративших транскрипцию, было получено в искусственных условиях при недостатке рибонуклеозидтрифосфатов. В отличие от сигналов задержки транскрипции, ни один из сигналов прекращения транскрипции не был обнаружен внутри прокариотических генов.
Сигналы остановки транскрипции на уровне элонгации у эукариот. Участки ДНК, вызывающие задержку и прекращение элонгации у эукариот, охарактеризованы слабо. Имеются данные, что в случае РНК-полимераз I и II такие участки ДНК часто содержат Т-богатые последовательности в нематричной цепи, однако это не является общим правилом. Если такие Т-богатые участки существуют, то в них часто происходит формирование изгиба ДНК, а эффективность блока прямо пропорциональна длине Т-богатой последовательности. Наличие шпилек в транскриптах этих участков не всегда требуется для блокировки транскрипции. В случае РНК-полимеразы II существенным моментом блокировки является взаимодействие каталитического сайта фермента с ниже расположенными последовательностями ДНК. При этом задержанный комплекс с течением времени может превращаться в комплекс, полностью прекративший транскрипцию. Эффективность распознавания РНК-полимеразой участков задержки на ДНК зависит от свойств промотора, на котором произошла инициация транскрипции, а также расстояния сайта блокировки от промотора. Как у прокариот, так и у эукариот специфические белки оказывают сильное влияние на способность РНК-полимеразы распознавать участки задержки и прекращения транскрипции. Многие из этих белков участвуют в регуляции транскрипции на уровне элонгации.
Внешние факторы, блокирующие элонгацию цепей РНК. В дополнение к только что рассмотренным внутренним сигналам, препятствующим элонгации РНК, существует большое число внешних факторов, оказывающих влияние на этот процесс. Имеется много примеров, когда ДНК-связывающие белки блокируют элонгацию цепей РНК вирусными, прокариотическими и эукариотическими РНК-полимеразами как в природных условиях, так и в бесклеточных системах. Однако во многих случаях РНК-полимеразы способны обходить ДНК-связывающие белки без задержки транскрипции. Хотя белки являются основным препятствием на пути элонгации РНК, имеются и другие факторы, оказывающие подобное влияние на элонгацию. В частности, показано, что интенсивное негативное и позитивное суперскручивание ДНК-матрицы может увеличивать время полужизни элонгирующих комплексов в задержанном состоянии. ДНК в Z-форме также может ингибировать элонгацию. Многие вещества, взаимодействующие с ДНК, а также повреждения ДНК ингибируют элонгацию. Интересно, что РНК-полимераза E. coli способна преодолевать участки ДНК с отсутствующими азотистыми основаниями. Еще более удивительной является способность Т7-РНК-полимеразы не замечать короткие бреши в матричной цепи ДНК длиной в 1–5 нуклеотидов. Она может перебираться через бреши даже длиной в 24 нуклеотида, хотя и с меньшей эффективностью. Прохождение РНК-полимеразы через такие бреши сопровождается образованием единого транскрипта, содержащего делецию в соответствующем участке РНК. Способность РНК-полимеразы транскрибировать ДНК, содержащие бреши, зависит от природы 3’-концевого нуклеотида, после которого начинается брешь: 3’-ОН-конец допускает транскрипцию, тогда как 3’-фосфат блокирует элонгацию.
Расщепление транскрипта в комплексах, полностью прекративших элонгацию. РНК-полимеразы в составе тройных комплексов, включая все три РНК-полимеразы эукариот и РНК-полимеразу E. coli, способны осуществлять эндонуклеазное расщепление растущей цепи РНК вблизи ее 3’-конца. Образующийся в результате более протяженный 5’-концевой фрагмент РНК остается прочно связанным с ферментом, тогда как 3’-концевой фрагмент освобождается из тройного комплекса. При этом каталитический центр РНК-полимеразы остается правильно ориентированным в отношении оставшегося транскрипта и ДНК-матрицы, и она способна продолжать транскрипцию, не образуя в синтезируемой РНК внутренних делеций. Реакция расщепления не является пирофосфоролизом, поскольку в результате пирофосфоролиза формируется фрагмент РНК, содержащий 5’-концевой нуклеозидтрифосфат, а при расщеплении транскрипта РНК-полимеразой образуется фрагмент РНК с монофосфатом на 5'-конце. Белки E. coli GreA и GreB, а также эукариотический фактор транскрипции TFIIS стимулируют процесс расщепления. Те же факторы и, кроме того, состав тройного комплекса оказывают влияние на размер освобождающегося в процессе расщепления 3’-концевого фрагмента РНК, который может варьировать от 1 до 17 нуклеотидов. В разных тройных комплексах процесс расщепления может происходить мгновенно или растягиваться на несколько часов. Полагают, что кинетика этого процесса зависит от конформации тройного комплекса, которая может быть различной в разных участках матричной ДНК.
Имеются доказательства того, что расщепление транскрипта катализируется одним активным центром фермента, ответственным, кроме того, за полимеризацию рибонуклеозидтрифосфатов и пирофосфоролиз РНК. В частности, было показано, что неорганический пирофосфат может индуцировать освобождение олигонуклеотидного фрагмента РНК, содержащего 5’-концевую трифосфатную группу, из тройного комплекса, прекратившего синтез РНК. Эти данные интерпретируются в пользу того, что активный центр РНК-полимеразы, прекратившей транскрипцию, смещается от 3’-конца элонгируемого транскрипта к его 5’-концу, где он и катализирует пирофосфоролитическое расщепление РНК. Кроме того, до настоящего времени не обнаружено ингибиторов расщепления транскрипта, которые одновременно не подавляли бы самого синтеза РНК. Не найдено и мутантов, у которых оба этих процесса были бы разделены. И, наконец, расщепление транскрипта и полимеризация субстратов происходят в одинаковых условиях: в присутствии двухвалентных катионов с одним и тем же оптимумом рН реакционной смеси.
Физиологическое значение реакции расщепления транскрипта РНК-полимеразой еще предстоит выяснить. Известно, что факторы GreA и TFIIS, которые стимулируют расщепление РНК, одновременно подавляют образование прекративших транскрипцию комплексов. В соответствии с наиболее распространенной точкой зрения расщепление транскрипта помогает РНК-полимеразе выйти из состояния полного прекращения транскрипции. Полагают, что в тройном комплексе, прекратившем транскрипцию, активный центр РНК-полимеразы постепенно смещается от 3’-конца РНК к 5’-концу и утрачивает способность ее элонгировать. Эндонуклеазное расщепление транскрипта правильно ориентирует новый 3’-концевой нуклеотид РНК относительно активного центра РНК-полимеразы, что реактивирует процесс транскрипции. Другой возможной функцией расщепления РНК молекулой РНК-полимеразы может быть коррекция ошибочно включенных в растущую РНК 3’-концевых нуклеотидов. Если после включения некомплементарного матрице нуклеотида в РНК молекула РНК-полимеразы делает паузу в элонгации, то вырезание 3’-концевого фрагмента растущей цепи РНК и продолжение элонгации можно рассматривать как имитацию РНК-полимеразой хорошо известной 3’®5’-экзонуклеазной корректирующей активности ДНК-полимеразы I E. coli. Такой механизм может помогать РНК-полимеразе в преодолении физических препятствий во время транслокации. Известно, что места задержки транскрибирующей РНК-полимеразы на ДНК распознаются молекулами фермента, находящимися в определенной фазе (рамке считывания) по отношению к этим сайтам. Поскольку отщепление 3’-концевого участка ДНК и обратная транслокация могут перевести фермент в новую фазу по отношению к сайтам задержки на ДНК, то фермент, начиная транскрипцию из нового положения, сможет беспрепятственно преодолевать сайты задержки в процессе элонгации. Одним из таких преодолеваемых при транскрипции барьеров для РНК-полимеразы у эукариот могут быть, в частности нуклеосомы.
Помимо всего прочего, в настоящее время показано, что вышеупомянутые факторы GreA и GreB стимулируют процесс освобождения промоторов бактериальными РНК-полимеразами.
Реитеративный синтез гомополимеров. Молекулы РНК, обычно синтезируемые РНК-полимеразами, строго комплементарны транскрибируемым участкам матричной РНК. Однако в редких случаях in vivo, а также в определенных искусственных условиях РНК-полимеразы способны осуществлять так называемый реитеративный синтез гомополимеров, во время которого молекула РНК-полимеразы, многократно проскальзывая вдоль короткой гомополимерной последовательности (transcriptional slippage), синтезирует длинные комплементарные этой последовательности гомополимеры – поли(А), поли(U) или поли(С). Размеры образующихся при этом гомополимерных продуктов могут более чем в 10–20 раз превышать длину матричной последовательности. Реитеративный синтез протекает особенно эффективно на одноцепочечных ДНК в присутствии ионов Mn2+ вместо Mg2+ и необходимого рибонуклеозидтрифосфата. Если же олигонуклеотидная последовательность матрицы включена в случайную последовательность, то реитеративного синтеза не происходит при наличии в реакционной смеси кроме нуклеотида, составляющего гомополимер, других рибонуклеозидтрифосфатов. Это обусловлено пребыванием тройного комплекса в состоянии обычной элонгации.
Реитеративный синтез гомополимеров РНК-полимеразами может происходить как во время инициации транскрипции, так и в фазе элонгации. При инициации РНК-полимераза может начинать реитеративный синтез при наличии в окрестностях точки инициации транскрипции гомополимера длиной в 3 и даже 2 нуклеотида. Во время элонгации РНК-полимераза предпочитает осуществлять реитеративный синтез на более длинных гомополимерных последовательностях. В частности, в двух исследованных случаях элонгирующая РНК-полимераза E. coli осуществляла реитеративный синтез поли(A) или поли(U) на последовательностях, состоящих из dT или dA, длиной в 10 нуклеотидов.
Несмотря на то что реитеративный синтез гомополимеров является редким событием in vivo, он выполняет определенные функции в регуляции транскрипции. Показано, что проскальзывание РНК-полимеразы вдоль гомополимерных последовательностей матрицы может быть механизмом, изменяющим рамки считывания мРНК при трансляции, редактирующим генетическую информацию мРНК, осуществляющим присоединение к РНК поли(А)-хвостов и 5'-концевых последовательностей к вирусным РНК, а также регулирующим инициацию транскрипции некоторых бактериальных оперонов (например pyrBI или codBA). Поскольку нерегулируемый реитеративный синтез внутри кодирующих частей генов таит большую опасность для их экспрессии, предполагают, что гомополимерные последовательности в транскрипционных единицах являются мишенью для эволюционного отбора, который их элиминирует. Действительно, компьютерный анализ под этим углом зрения последовательностей нуклеотидов E. coli показал отсутствие достаточно протяженных гомополимеров в кодирующих частях генов и их наличие в некодирующих последовательностях бактериального генома.
Современные модели структуры элонгирующих тройных комплексов и механизма элонгации растущих цепей РНК. В 1992 г. М. Чамберлин с сотрудниками разработали модель элонгации РНК, которая содержала целый ряд новых идей. Прежде всего было постулировано, что процессы транслокации РНК-полимеразы вдоль ДНК и присоединение нуклеотидов к растущей цепи РНК в активном центре фермента разделены во времени. Это разделение становится возможным благодаря наличию в молекуле РНК-полимераз двух ДНК-связывающих сайтов, каждый из которых перекрывает на матричной ДНК ~ 10 нуклеотидных пар (см. рис. I.8). Сайт I локализован в задней по отношению к направлению транскрипции части фермента, а сайт II – в передней. Предполагалось также, что эти два сайта могут перемещаться вдоль ДНК в процессе элонгации независимо друг от друга. В соответствии с предложенной моделью, молекула РНК-полимеразы перемещается вдоль ДНК наподобие гусеницы: когда один из сайтов связывания ДНК фиксирован, другой может двигаться вперед. Еще одной новой чертой модели было предположение о том, что растущая цепь РНК удерживается внутри элонгирующего комплекса не 12-нуклеотидным ДНК–РНК-гибридом, а двумя сайтами связывания самой РНК-полимеразы, каждый из которых перекрывает ~10 нуклеотидов матрицы. При этом длина участка РНК, заключенного между сайтами связывания, составляет 30–40 нуклеотидов. Предполагалось также, что перемещение каталитического центра молекулы РНК-полимеразы сопряжено с движением переднего сайта связывания ДНК II и может происходить независимо от переноса заднего сайта I вперед вдоль РНК-связывающего сайта I во время добавления нуклеотидов к растущей цепи РНК, сопровождаемого заполнением этого сайта (см. рис. I.8,б,1).
Согласно предложенной модели элонгация цепей РНК представляется в виде циклического процесса. В начале цикла каталитический центр молекулы РНК-полимеразы располагается у задней границы РНК-связывающего сайта I в соответствии с положением 3’-ОН-конца РНК. Последовательно присоединяя нуклеотиды к растущей цепи РНК, каталитический участок перемещается относительно РНК-связывающего сайта I и в конце концов заполняет этот сайт десятью нуклеотидами вновь синтезированного участка РНК (см. рис. I.8,б,1). Во время этой фазы элонгации ДНК-связывающий сайт I остается фиксированным на ДНК, тогда как ДНК-связывающий сайт II перемещается вперед синхронно с каталитическим участком на десять нуклеотидов. В конце фазы добавления нуклеотидов ДНК- и РНК-связывающие сайты II фиксируются на своих лигандах, а ДНК-связывающий сайт I переносится вперед на десять нуклеотидов в новое фиксированное положение. Это перемещение освобождает РНК-связывающий сайт I, делая его готовым к повторению цикла транслокации.
Волна исследований, последовавшая за появлением этих новых идей, быстро подтвердила реальность основных положений модели элонгации транскриптов, выдвинутых группой М. Чамберлина, и дополнила ее рядом существенных моментов. Оказалось, что перемещение тройного комплекса вдоль транскрибируемой ДНК не всегда скачкообразно. Большую часть транскрибируемых ДНК молекулы РНК-полимеразы проходят монотонно, регулярно присоединяя к растущим цепям РНК нуклеотид за нуклеотидом. Прерывистая, скачкообразная элонгация РНК имеет место лишь на участках матричной ДНК, в которых происходит задержка транскрипции или ее полное прекращение. Встретив препятствие на своем пути в виде специфической последовательности нуклеотидов или белков, ассоциированных с ДНК, молекула РНК-полимеразы в составе тройного комплекса переходит во внутренне напряженное состояние, которое она может разрешить тремя путями: или преодолеть препятствие, переместив свою переднюю границу вперед за пределы препятствия, и продолжить монотонную элонгацию транскрипта, или терминировать транскрипцию (см. рис. I.8,б,2), или полностью прекратить синтез РНК. В последнем случае каталитический участок фермента смещается назад по отношению к синтезированной РНК и ее 3’-концевой нуклеотид становится недоступным для элонгации (см. рис. I.8,б,3). Эндонуклеазное отщепление 3’-концевого фрагмента РНК в комплексе, прекратившем элонгацию, реактивирует транскрипцию. Очищенные РНК-полимеразы, особенно РНК-полимераза II эукариот, из-за частых задержек на матрице в процессе элонгации транскрибируют молекулы ДНК со скоростью, по крайней мере, в 10 раз меньшей, чем in vivo. В этом случае стимулирующее действие на элонгацию оказывают специфические факторы элонгации.
Основные факторы элонгации РНК-полимеразы II. У эукариот имеются белковые факторы элонгации РНК, которые относят к двум различным классам: основным (general) и регуляторным факторам. Как и в случае основных факторов инициации транскрипции, основные факторы элонгации РНК обеспечивают эффективную транскрипцию всех генов, кодирующих белки, тогда как регуляторные факторы специфически контролируют экспрессию отдельных генов или даже целых их семейств. Основные факторы элонгации РНК-полимеразы II и некоторые их свойства перечислены в табл. I.5. Первыми в этой таблице упомянуты белки P-TEFb (positive transcript elongation factor b) и SII, которые препятствуют переходу задержанных элонгирующих комплексов РНК-полимеразы II в состояние полного прекращения транскрипции. Активность фактора P-TEFb, впервые
Таблица I.5
Основные факторы элонгации РНК-полимеразы II
выделенного в гомогенном состоянии из экстрактов Drosophila, подавляется нуклеотидным аналогом – DRB. Фенотипическим проявлением действия этого… Небольшой белковый фактор SII, впервые выделенный из клеток асцитной опухоли… Другая группа основных факторов элонгации супрессирует задержку элонгации цепей РНК, тем самым уменьшая вероятность…Рис. I.9. Аттенюатор триптофанового оперона E. coli и его функционирование
Изображены альтернативные вторичные структуры мРНК в районе аттенюатора, образование которых сопровождается прекращением транскрипции или распространением в область структурных генов оперона
Оставшаяся часть ДНК–РНК-гибрида нестабильна и легко плавится, поскольку образована 3’-концевой олиго(U)-последовательностью РНК и олиго(dA)-последовательностью терминатора. Первым из комплекса освобождается РНК-продукт, а затем минимальный фермент РНК-полимеразы. После объединения со свободным s-фактором образовавшийся холофермент РНК-полимеразы вступает в новый цикл транскрипции. Эффективность терминации транскрипции на таком терминаторе зависит от стабильности терминаторной шпильки РНК: мутации, нарушающие комплементарное спаривание оснований в шпильке, ослабляют терминацию, а мутации, восстанавливающие комплементарность, ее усиливают.
Кроме вышеописанного, у E. coli обнаружены терминаторы транскрипции, распознаваемые РНК-полимеразой только в присутствии белкового фактора терминации r, механизм действия которого хорошо изучен. Этот белок с молекулярной массой 46 кДа обладает РНК-зависимой нуклеозидтрифосфатазной активностью, которая необходима для его функционирования при терминации. Кроме того, для него характерна РНК:ДНК-хеликазная активность. Установлено, что фактор r связывается с растущей цепью РНК в особых неструктурированных участках, называемых рат-сайтами (rut sites, от англ. rut – колея, выбоина), до того, как РНК-полимераза достигает терминатора. В местах r-зависимой терминации транскрипции РНК-полимераза прекращает элонгацию. Считается, что роль r-фактора заключается в вытеснении РНК из транскрипционного комплекса во время таких пауз.
E. coli и другие бактерии имеют еще один тип регулируемых терминаторов транскрипции, называемых аттенюаторами. Впервые обнаружен и лучше других изучен аттенюатор триптофанового оперона, контролирующего биосинтез Trp в бактериальных клетках (см. рис. I.9). В условиях избытка внутриклеточного Trp девять из десяти молекул РНК-полимеразы, начавших транскрипцию триптофанового оперона, прекращают синтез РНК на аттенюаторе, расположенном на расстоянии в 180 п.о. от точки инициации транскрипции. В результате в основном происходит синтез коротких РНК той же длины, называемых лидерными. При уменьшении содержания Trp в клетках доля молекул РНК-полимеразы, преодолевающих аттенюатор, возрастает, что, в конечном счете, сопровождается увеличением внутриклеточного содержания ферментов биосинтеза Trp. Перед аттенюатором находятся несколько участков ДНК, последовательности которых обладают центральной симметрией. Это приводит к тому, что лидерная РНК, включающая в себя последовательности, комплементарные таким участкам, способна образовывать структуры типа шпилек в разных сочетаниях, которые исключают друг друга. Например, если получена шпилька 2/3, то шпильки 1/2 и 3/4 сформироваться уже не могут. К аналогичным результатам приводит и обратное развитие событий. Шпилька 3/4 является терминаторной, присутствующей в r-независимых терминаторах. За ней в лидерной РНК располагается последовательность олиго(U). Поэтому образование шпильки 3/4 сопровождается терминацией транскрипции на аттенюаторе и освобождением лидерной РНК из транскрипционного комплекса. Формирование альтернативных шпилек зависит от положения рибосом, транслирующих лидерную РНК с образованием лидерного пептида, в котором присутствуют два остатка Trp подряд. В условиях недостатка Trp рибосома в процессе синтеза лидерного пептида останавливается на соответствующих кодонах лидерной РНК, прикрывая собой последовательность 1, что препятствует формированию шпильки 1/2, так как образуется шпилька 2/3. В соответствии с этим терминаторная шпилька не может сформироваться, транскрипция не прерывается на аттенюаторе и РНК-полимераза переходит в область структурных генов оперона. Если недостаток триптофана не приводит к прекращению трансляции лидерной РНК, рибосома проходит критический участок лидерной РНК, препятствуя формированию шпильки 2/3, и образуется терминаторная шпилька 3/4, что сопровождается терминацией транскрипции на аттенюаторе.
Терминация транскрипции у эукариот.У эукариот обнаружены три фактора терминации транскрипции, необходимых для освобождения РНК-полимераз из транскрипционных комплексов на терминаторах – по одному для РНК-полимераз I, II и III. Белок N-TEF дрозофилы индуцирует освобождение транскриптов, синтезированных РНК-полимеразой II, и при его функционировании происходит расщепление ATP. У дрожжей белковый фактор Reb-1 связывается с природными терминаторами транскрипции на ДНК, обеспечивая как остановку элонгирующей РНК-полимеразы I на этих терминаторах, так и последующее освобождение РНК из транскрипционных комплексов. Удаление в результате делеции из рибосомной транскрипционной единицы Reb-1-связывающего сайта нарушает правильное образование 3’-концов рРНК in vivo. Мышиный фактор TTF-1, который также является ДНК-связывающим белком, необходим для правильной терминации транскрипции РНК-полимеразой I в клетках этих животных. У них же обнаружен LА-белок, специфически взаимодействующий с РНК, функционирование которого требуется для образования транскриптов полной длины под действием РНК-полимеразы III, что происходит в результате освобождения РНК из транскрипционных комплексов и реинициации транскрипции.
Рассмотрим подробнее механизм терминации транскрипции Pol I. У мышей терминация транскрипции рДНК происходит на 565 п.о. ниже кодирующей части гена 28S РНК. 3'-Конец терминирующего транскрипта картирован за 21 п.о. перед 18-нуклеотидным повтором, названным Sal-боксом (AGGTCGACCAGA/TT/ANTCCG), который входит в состав терминатора транскрипции. Десять таких повторов, фланкированных протяженными кластерами пиримидиновых оснований, локализованы в нетранскрибируемых спейсерах рДНК. У человека длина повтора составляет 11 п.о. (GGGTCGACCAG), и его последовательность соответствует таковой 5'-концевой части мышиного повтора. Последовательности, фланкирующие повторы, оказывают влияние на точность и эффективность терминации транскрипции, а функционирование всего терминатора зависит от его ориентации на ДНК.
С помощью мутационного анализа и футпринтинга было установлено, что фактор терминации транскрипции TTF-I взаимодействует с Sal-боксом и останавливает элонгирующую Pol I. Хотя все факторы терминации транскрипции, обсуждавшиеся выше, распознают разные последовательности нуклеотидов, для них характерно наличие в C-концевых частях двух ДНК-связывающих доменов длиной в 80 аминокислот каждый, гомологичных ДНК-связывающей последовательности онкобелка c-Myb. Хотя более половины полипептидной цепи с N-конца TTF-I могут быть удалены без потери его функций, одних лишь ДНК-связывающих доменов недостаточно для обеспечения белком терминации транскрипции, и для этого требуются прилегающие последовательности аминокислот. Факторы терминации транскрипции TTF-I мышей и Rib-1 дрожжей могут прекращать элонгацию цепей РНК на любой из этих ДНК. Это указывает на высокую эволюционную консервативность механизма терминации транскрипции Pol I.
Связываясь с последовательностями терминаторов, TTF-I изгибает молекулу ДНК и вызывает задержку элонгирующего транскрипционного комплекса на терминаторе. Предполагается, что в этот момент происходит конформационное изменение молекулы Pol I, что ослабляет взаимодействие компонентов комплекса друг с другом (как это имеет место в случае РНК-полимеразы E. coli на ρ-независимых терминаторах транскрипции). Окончательный распад комплекса и освобождение Pol I, а также синтезированной молекулы РНК происходит лишь в присутствии дополнительного фактора PTRF (polymerase and transcript release factor), который контактирует как с Pol I, так и с TTF-I.
Функциональная роль фактора TTF-I не ограничивается лишь участием в терминации транскрипции. Один из терминаторов транскрипции рДНК, так называемый To, расположен за 170 п.о. перед точкой инициации транскрипции генов рРНК. Взаимодействующий с To фактор TTF-I сильно стимулирует транскрипцию генов рРНК, вызывая перестройку структуры хроматина в окрестностях соответствующего промотора. Об изменениях структуры хроматина во время транскрипции см. следующий раздел 2.1.4.
Хотя для каждой из форм РНК-полимераз обнаружен свой специфический белковый фактор, необходимый для правильного освобождения транскриптов из элонгирующих комплексов, этим не ограничиваются механизмы, обеспечивающие терминацию транскрипции у эукариот. Действительно, одним из основных факторов терминации транскрипции у этой группы организмов является сложный белковый комплекс, обеспечивающий процессинг 3’-концевых последовательностей у предшественников мРНК, синтезируемых РНК-полимеразой II (см. ниже). В этом случае терминация транскрипции тесно сопряжена с процессингом пре-мРНК пока неизвестным молекулярным механизмом.
Терминация транскрипции митохондриальных ДНК человека, так же как и терминация синтеза рРНК, требует участия специального белкового фактора. В этом случае фактор mtTERM может ускорять терминацию транскрипции in vivo митохондриальной РНК-полимеразой, а также ферментами бактериального и фагового происхождения. В отличие от терминаторов генов рРНК, митохондриальные сигналы терминации транскрипции в комплексе с фактором mtTERM распознаются молекулами РНК-полимераз в обеих ориентациях, что делает возможной терминацию транскрипции на H- и L-цепях мтДНК. Вследствие этого один общий терминатор может обеспечивать сбалансированное образование продуктов транскрипции с обоих противоположно направленных митохондриальных промоторов.
Хроматин во время транскрипции
Нуклеосомы и инициация транскрипции.Результаты многочисленных биохимических и генетических экспериментов показывают, что присутствие нуклеосом в… Вновь синтезируемая эукариотическая ДНК обладает повышенной чувствительностью… Конкурентные отношения между активацией транскрипции и созреванием хроматина во время клеточного цикла были…Котранскрипционные и посттранскрипционные модификации РНК
Одной из наиболее удивительных посттранскрипционных модификаций пре-мРНК является редактирование их первичной структуры. В результате… Посттранскрипционные модификации РНК особенно характерны для эукариотических…Процессинг РНК у бактерий
РНКаза III участвует также в процессинге предшественников рРНК у E. coli, поскольку 5S, 16S и 23S рРНК исходно синтезируются в составе общего… Полиаденилирование РНК у бактерий. Хотя поли(А)-полимераза E. coli,…Рис. I.10. Локализация сайтов полиаденилирования и пути катаболизма бактериальных РНК
а – обобщенная структура бактериальной полицистронной мРНК и положение сайтов полиаденилирования в РНК классов I-VI; б – альтернативные пути катаболизма бактериальных мРНК с участием поли(А)-полимеразы, полинуклеотидфосфорилазы (ПНФазы) и различных РНКаз; РНКаза Х – гипотетическая рибонуклеаза
и долгое время после этого рассматривалась как исключение из общего правила и биологический курьез. В настоящее время стало ясно, что полиаденилирование РНК у бактерий столь же обычно, как и у эукариот, и выполняет важные биологические функции. Поли(А)-последовательности бактериальных мРНК значительно короче соответствующих эукариотических. Их длина, в среднем, составляет всего 14–16 нуклеотидов (80–200 – у эукариот), а полиаденилированы лишь от 1 до 40% молекул мРНК каждого определенного вида в клетке (~100% в случае эукариот). Более подробное сравнение свойств поли(А)-последовательностей прокариот и эукариот проведено в разделе 2.2.3.
Классы поли(А)-содержащих РНК бактерий. В зависимости от расположения сайта присоединения поли(А)-последовательности все бактериальные РНК разделяют на шесть классов (см. рис. I.10,а). В РНК первого класса происходит полиаденилирование 3’-концевого нуклеотида, следующего сразу за терминаторной шпилькой r-независимого терминатора последней кодирующей области. У РНК второго класса терминаторная шпилька отщепляется посттранскрипционно РНКазой Е, и к образующемуся 3’-концу присоединяется поли(А). Терминаторная шпилька отсутствует и у полиаденилированных мРНК третьего класса, образующихся с участием r-зависимых терминаторов транскрипции, благодаря особенностям структуры таких терминаторов. В укороченных мРНК четвертого класса отсутствует 3’-концевая кодирующая область, а поли(А) начинается непосредственно за межцистронной терминаторной шпилькой. В РНК пятого класса поли(А)-последовательности локализуются на концах укороченных цистронов, а у РНК шестого класса – на концах 5’-концевых некодирующих последовательностей. На основании структуры поли(А)+-мРНК делается вывод, что полиаденилирование у бактерий не зависит от присутствия в РНК специфических регуляторных сигналов, как это имеет место у эукариот, а определяется наличием у них свободных 3’-OH-групп. Такие промежуточные мРНК разной длины, по-видимому, появляются в результате деградации или преждевременной терминации синтеза полноразмерных транскриптов.
Поли(А)-полимеразы. Полиаденилирование бактериальных мРНК катализирует поли(А)-полимераза (ATP:полирибонуклеотид-аденилилтрансфераза), которая осуществляет независимое от матрицы последовательное присоединение остатков аденилата к 3’-OH-концам молекул РНК в соответствии со следующей реакцией:
РНК + nATP ® РНК(А)n + nPPi
У E. coli описаны две поли(А)-полимеразы. Поли(А)-полимераза I кодируется локусом pcnB, первоначально идентифицированным в качестве контролирующего число копий плазмид в бактериальных клетках. Процессированная молекула представляет собой полипептид с молекулярной массой 52 кДа, не обладающий гомологией с соответствующими эукариотическими ферментами, однако содержащий сегмент, гомологичный части полипептидной цепи тРНК-нуклеотидилтрансферазы, которая осуществляет посттранскрипционное присоединение акцепторного CCA-тринуклеотида к молекулам тРНК. Даже умеренная сверхэкспрессия рекомбинантного гена pcnB летальна для E. coli. Полная инактивация гена pcnB с помощью делеций не сопровождается прекращением полиаденилирования мРНК, что указывает на присутствие в геноме E. coli второго аналогичного гена. Такой ген был обнаружен в виде открытой рамки считывания f310, кодирующей полипептид с молекулярной массой 36,3 кДа, обогащенный гидрофобными аминокислотами. Полипептид не обладает гомологией ни с одной из известных бактериальных, вирусных или эукариотических поли(А)-полимераз.
Возможная функциональная роль полиаденилирования РНК у бактерий. Несмотря на то что полиаденилирование РНК интенсивно исследуется более 25 лет, его функциональная роль даже у эукариот полностью не выяснена. Еще меньше известно о роли полиаденилирования РНК у бактерий. Однако из имеющихся данных становится ясно, что влияние полиаденилирования РНК на молекулярные процессы бактериальной клетки весьма разнообразно и распространяется, по крайней мере, на контроль числа копий бактериальных плазмид, стабильность мРНК и ее трансляцию.
Регуляция репликации плазмид через полиаденилирование антисмысловых РНК. Более подробно механизмы регуляции репликации бактериальных плазмид будут рассмотрены в разделе 4.2.2 на примере плазмиды ColE1. Здесь же лишь кратко отметим, что у некоторых групп плазмид, например ColE1 или pBR322, которая является ее производной, регуляция числа копий осуществляется с помощью антисмысловой РНК (РНК I), образующей гибрид с РНК-праймером (РНК II), необходимым для инициации их репликации, и блокирует его функционирование. В соответствии с этим внутриклеточная концентрация РНК I является критическим параметром в регуляции репликации плазмид. Деградация РНК I инициируется отщеплением 5’-концевого пентануклеотида под действием РНКазы Е (РНК I–5) и далее контролируется поли(А)-полимеразой – продуктом гена pcnB. Полиаденилированная РНК I–5 обладает коротким временем полужизни, типичным для бактериальных мРНК (1–2 мин), тогда как немодифицированная РНК I–5 значительно более стабильна (время полужизни – >10 мин). Ускоренная деградация поли(А)-РНК I–5 инициируется полинуклеотидфосфорилазой. У поли(А)--РНК I–5 3’-концевой нуклеотид находится в составе шпильки, что препятствует эффективному действию полинуклеотидфосфорилазы. Однако при наличии короткого поли(А)-хвоста, выступающего за пределы шпильки, РНК I–5 эффективно расщепляется ферментом по 3’-экзонуклеазному механизму. В разрушение поли(А)+-РНК I–5 вносят свой вклад и другие нуклеазы, включая РНКазу Е и РНКазу III. Имеются данные и том, что полиаденилирование само по себе инактивирует РНК I–5, так как оно приводит к характерному изменению ее вторичной структуры.
Влияние полиаденилирования на время полужизни бактериальных мРНК. Описанное выше дестабилизирующее действие полиаденилирования на антисмысловые РНК распространяется и на некоторые бактериальные мРНК. Например, инактивация гена pcnB, кодирующего поли(А)-полимеразу, с помощью делеций сопровождается значительным увеличением времени полужизни мРНК генов lpp, trxA, ompA, а также rpsO на фоне мутаций pnp, rnb и rne, инактивирующих гены полинуклеотидфосфорилазы и соответствующих рибонуклеаз. Поскольку эти результаты были получены в отсутствие РНКазы Е, 3’-концы большинства бактериальных мРНК содержали шпильку, характерную для r-независимых терминаторов транскрипции (см. рис. I.10). Экзонуклеазное расщепление РНК под действием полинуклеотидфосфорилазы и РНКазы II затруднено при наличии такой шпильки и облегчается в присутствии выступающей поли(А)-последовательности (см. рис. I.10,б). Как показано на рисунке, первичный транскрипт в бактериальных клетках может или полиаденилироваться, или подвергнуться экзонуклеазному расщеплению, неэффективному без поли(А)-последовательности, при наличии которой в процесс деградации активно включаются полинуклеотидфосфорилаза и РНКаза II. РНКаза Е может отщеплять как полиаденилированную, так и неполиаденилированную шпильку. Такой незащищенный с 3’-конца транскрипт подвергается атаке 3’-экзонуклеаз, с которой конкурирует полиаденилирование, препятствующее деградации мРНК по этому механизму. Следовательно, полиаденилирование мРНК в бактериальных клетках может выполнять альтернативные функции: дестабилизировать транскрипты при наличии у них 3’-концевых шпилек и стабилизировать "линейные" формы мРНК. Предполагается участие в деградации поли(А)+-мРНК и неизвестной РНКазы Х, поскольку этот процесс может происходить на фоне неактивных полинуклеотидфосфорилазы, РНКазы II и РНКазы Е.
Изображенная на рис. I.10 схема катаболизма первичных бактериальных транскриптов является упрощением, так как предполагает независимое действие нуклеаз. В последнее время, в соответствии с общей тенденцией, накапливаются данные о координированной работе большинства компонентов системы деградации бактериальных РНК в составе сложных мультиферментных комплексов, получивших название деградосом. Полное расщепление РНК с 3’-концевой шпилькой деградосомами требует расхода ATP ATP-зависимой РНК-хеликазой, а также участия белка DnaK, белков теплового шока, энолазы и гликолитического фермента с неизвестной функцией в метаболизме РНК.
Возможная роль полиаденилирования бактериальных мРНК в трансляции. Как будет видно из дальнейшего изложения (см. раздел 2.2.3), поли(А)-последовательности эукариотических РНК постоянно ассоциированы с жизненно важным поли(А)-связывающим белком PAB, который участвует как в регуляции стабильности мРНК, так и их трансляции. Поиск белка с аналогичными функциями у бактерий привел к очистке рибосомного белка S1, который кооперативно связывается с поли(А)-последовательностями мРНК с константой ассоциации 3·106 М–1. Функциональная роль этого взаимодействия в настоящее время не ясна, однако предполагают, что оно может оказывать влияние на трансляцию. Возможно, белок S1 облегчает доставку мРНК к 30S субчастицам рибосом, что должно стимулировать инициацию трансляции.
Полиаденилирование мРНК в митохондриях и хлоропластах. Концепция эндосимбиотического происхождения митохондрий и хлоропластов эукариот из бактерий-эндосимбионтов подкреплена многочисленными экспериментальными данными и является в настоящее время весьма популярной. В этой связи целесообразно рассмотреть особенности полиаденилирования РНК у этих органелл в данном разделе. Полиаденилированные мРНК митохондрий по своей структуре аналогичны мРНК E. coli класса IV (см. рис. I.10,а). Как и у бактерий, полиаденилирование митохондриальных РНК происходит вне зависимости от специфических регуляторных последовательностей, характерных для мРНК эукариот. Средний размер поли(А)-последовательностей мРНК митохондрий в клетках HeLa человека составляет 55 нт, а в клетках асцитных опухолей мышей – 35–55 нт, что соответствует длине поли(А)-последовательностей у бактерий. Поли(А)-полимераза митохондрий клеток гепатомы Морриса обладает молекулярной массой 60 кДа. Она способна добавлять к РНК in vitro поли(А)-последовательности длиной до 600 нт, однако в изолированных митохондриях их размер составляет 20–23 нт. Фермент кодируется ядерным геном.
Длина 3’-концевых поли(А)-последовательностей РНК хлоропластов значительно превышает таковую РНК бактерий и достигает нескольких сотен нуклеотидов, что характерно для эукариотических поли(А)+-РНК. Эти последовательности не обязательно являются гомополимерами остатков аденозина, но могут состоять из кластеров А (75%), перемежающихся последовательностями G (24%), а также C и U (суммарное содержание – 5%), что напоминает свойства некодирующих, обогащенных поли(А) участков мРНК бактериофага Т7. Поли(А)-полимераза хлоропластов гороха (Pisum sativum) состоит из трех субъединиц, среди которых полипептид с молекулярной массой 43 кДа обладает антигенными детерминантами, общими с поли(А)-полимеразой дрожжей, а из двух других гликозилированных субъединиц лишь РНК-связывающий полипептид с молекулярной массой 105 кДа абсолютно необходим для функционирования фермента.
Редактирование пре-мРНК
Выбор последовательностей нуклеотидов в мРНК, которые подвергаются редактированию у трипаносомид, по-видимому, осуществляется с участием небольших… Таблица I.7Различные способы редактирования мРНК
Шесть или более 5’-концевых нуклеотидов gРНК комплементарны последовательности редактируемой мРНК, непосредственно предшествующей блоку нуклеотидов,… Другой тип редактирования РНК характерен для митохондрий слизневиков P.… Своеобразно решают задачу изменения кодирующего потенциала своих мРНК парамиксовирусы, в частности вирусы кори и…Редактирование РНК у животных и их вирусов
Рис. I.11. Экспрессия гена APOB человека и механизм редактирования его мРНК а – схема экспрессии гена; б – механизм дезаминирования остатка C в APOB-мРНК…Другие модификации эукариотических мРНК
Кэпирование. Сразу же после инициации транскрипции чаще всего происходит котранскрипционная модификация 5’-конца мРНК, сопровождаемая присоединением…Рис. I.12. Обобщенная структура кэп-группы эукариотических мРНК
Указаны сайты метилирования, характерные для кэп-групп разных типов. И – инвариантный сайт, метилируемый у кэп-групп всех типов, I, II – сайты, метилируемые у кэп-групп типов 1 и 2 соответственно
цитоплазме, но и необходима в большинстве случаев для ее эффективной трансляции. Так, один из факторов инициации трансляции eIF-4E выполняет функции кэп-связывающего белка и требуется для осуществления кэп-зависимой трансляции мРНК. Кроме того, установлено, что кэпирование мРНК необходимо для эффективного сплайсинга пре-мРНК, ее полиаденилирования и экспорта из ядра в цитоплазму. Кэпированию подвергаются только транскрипты РНК-полимеразы II. На исключительную значимость реакций кэпирования указывает и тот факт, что контролирующие их гены являются жизненно важными.
Как уже упоминалось выше, транскрипция у эукариот и прокариот начинается, как правило, с пуринового рибонуклеозидтрифосфата – ATP, или GTP, причем трифосфатная группа сохраняется в составе мРНК. Таким образом, 5’-концевая последовательность мРНК в ядре на ранних этапах транскрипции представлена в следующем виде: ppp(A/G)pNpNpN... Гуанилилтрансфераза катализирует присоединение к растущей цепи мРНК молекулы GMP, которая оказывается связанной с 5’-концевым пурином 5’–5’-трифосфатной группой. Суммарная реакция первого этапа процесса кэпирования выглядит следующим образом:
G(5’)ppp + ppp(5’)(A/G)pNpNpN...
¯ Гуанилилтрансфераза
G(5’)ppp(5’)(A/G)pNpNpN... + pp + p
Реакция, по-видимому, протекает в две стадии. Вначале фермент связывает молекулу GTP (входящую затем в состав кэп-группы), что сопровождается отщеплением пирофосфата и образованием ковалентной связи фермент–GMP. Далее GMP присоединяется к 5’-концу мРНК, которая в результате теряет g-фосфатную группу. В результате нуклеотид кэп-группы оказывается в обратной ориентации по отношению к остальным нуклеотидам мРНК. Процесс создания кэп-группы этой последовательностью реакций не заканчивается. На заключительных этапах кэпирования происходит метилирование по N7 ранее присоединенной молекулы гуанозина. Такие посттранскрипционные модификации происходят в несколько стадий в цитоплазме клеток после транспорта процессированной мРНК из ядра с участием цитоплазматических ферментов.
Первая стадия метилирования осуществляется ферментом РНК(гуанил-7)-метилтрансферазой, которая переносит метильную группу S-аденозилметионина в положение 7 концевого гуанина кэп-группы (рис. I.12). Кэп-группа, метилированная лишь по этому положению, характерна для одноклеточных эукариот и получила название кэпа 0-го типа. Вслед за этим у большинства многоклеточных эукариот происходит метилирование 2’-ОН рибозы 5’-концевого инициаторного нуклеотида (A или G), который является первым нуклеотидом, включаемым в мРНК при инициации ее синтеза РНК-полимеразой. Метилирование катализирует другой цитоплазматический фермент – 2’-О-метилтрансфераза. Такая основная форма кэпа большинства эукариот получила название кэпа 1-го типа. Очень редко и только у тех мРНК, инициация синтеза которых происходит с ATP, под действием 2’-О-метиладенозин-N6-трансферазы метилируются NH2-группы этого остатка А. Фермент распознает данную концевую группу в качестве субстрата лишь в том случае, если она была предварительно метилирована в положении 2’-OH в результате вышеописанной реакции.
Рис. I.13. Модель процессинга 3¢-концевых последовательностей эукариотических пре-мРНК
Цифрами указаны молекулярные массы белков, входящих в состав процессирующего комплекса. Обозначены кэп-группа, последовательность поли(А)-сайта и регуляторная последовательность, с которой взаимодействует гетеродимерный фактор, стимулирующий расщепление (CstF). Стрелки указывают место расщепления РНК
PAP – поли(А)-полимераза, CPSF – фактор специфичности и расщепления РНК, CF I и CF II – факторы расщепления I и II
У некоторых видов эукариот метильная группа может дополнительно присоединяться ко второму от кэп-нуклеотида нуклеозиду мРНК (см. рис. I.12). Субстратом для этого фермента служит мРНК с кэпом 1-го типа, уже содержащим две метильные группы. В результате происходит метилирование остатка рибозы по 2’-ОН-группе с образованием структуры, получившей название кэпа 2-го типа. Если эта реакция имеет место, то мРНК, содержащие кэп 2-го типа, составляют 10–15% от общей популяции молекул кэпированных мРНК.
Иная структура кэп-группы характерна для некоторых зрелых некодирующих РНК, в частности малых ядерных РНК, обогащенных урацилом (U-мяРНК). В этом случае остаток гуанозина кэп-группы дважды метилирован в положении 2 в дополнение к обычной метильной группе в положении 7: m2,2,7G(5')ppp(5')N. Такое гиперметилирование U-мяРНК требуется для импорта собранных U-мяРНП-частиц в ядро и, возможно, предотвращает вовлечение U-мяРНК в трансляцию.
Полиаденилирование. Одним из обязательных этапов созревания предшественников эукариотических мРНК, синтезированных в ядре, является процессинг их 3’-концевых последовательностей, тесно сопряженный с присоединением кэп-группы. Созревание 3'-конца мРНК является двухэтапным процессом. Вначале предшественник теряет 3’-концевую некодирующую последовательность, после чего, как правило, к 3’-концу присоединяется поли(А)-последовательность путем ферментативной полимеризации остатков AMP:
5’ GpppG__________AAUAAA__¯________UUUUU___ 3’
¯ Расщепление
5’ GpppG__________AAUAAA__OH P____UUUUU___ 3’
¯ Полиаденилирование
5’ GpppG__________AAUAAA__AAAAAAAAAAAAAAA 3’
В настоящее время известно несколько исключений из этого правила: гистоновые мРНК животных и мРНК некоторых вирусов, предшественники которых расщепляются с помощью высокоспецифических эндонуклеаз и не полиаденилируются. Остаются неполиаденилированными и U-мяРНК, которые также являются транскриптами РНК-полимеразы II. В этом случае кэпированный первичный транскрипт мяРНК U1, содержащий на своем 3'-конце несколько избыточных нуклеотидов, экспортируется из ядра в цитоплазму, где и происходит удаление избыточной последовательности, которое в ядре блокировано специфическим белковым ингибитором TPI (3'-terminal processing inhibitor).
Рис. I.14. Модель белкового комплекса, элонгирующего поли(А)
PAP – поли(А)-полимераза, PAB II – поли(А)-связывающий белок II
Места отщепления 3’-концевых некодирующих последовательностей в мРНК животных обычно маркированы специальными последовательностями нуклеотидов (рис. I.13). Имеются, по крайней мере, две такие последовательности, образующие сайты полиаденилирования, или поли(А)-сайты. Одна из них – AAUAAA расположена за 15 нуклеотидов перед расщепляемой фосфодиэфирной связью и практически одинакова у всех исследованных организмов. Другая, менее изученная последовательность располагается сразу же за первой и часто состоит из нескольких остатков U или обогащена GU. Сайт расщепления РНК определяется расстоянием между этими двумя элементами с предпочтительным расщеплением фосфодиэфирной связи на 3’-конце остатка A, находящегося на участке, в котором расщепление разрешено. Имеются данные о том, что последовательности, расположенные выше AAUAAA, могут оказывать стимулирующее влияние на процессинг, но их присутствие необязательно для его правильного осуществления.
С последовательностью AAUAAA взаимодействует фактор CPSF (cleavage and polyadenylation specificity factor), определяющий специфичность расщепления и полиаденилирования РНК. CPSF состоит из четырех субъединиц с молекулярными массами 160, 100, 70 и 30 кДа. Последняя из них, по-видимому, не является необходимой для его функционирования. Самая большая субъединица находится в непосредственном контакте с последовательностью AAUAAA.
С GU-богатой и ниже расположенной последовательностью связывается гетеродимерный белковый фактор CstF (cleavage stimulating factor), стимулирующий расщепление и состоящий из трех субъединиц (77, 64 и 50 кДа). Вторая субъединица контактирует с GU-богатым регуляторным элементом и обладает типичным РНК-связывающим доменом. По отдельности факторы CPSF и CstF лишь слабо взаимодействуют с РНК. Однако их одновременное присутствие приводит к образованию прочного комплекса. Такой кооперативный эффект и взаимодействие двух факторов между собой определяются их большими субъединицами.
В расщеплении РНК непосредственно участвуют еще два фактора: CFI и CFII (cleavage factors). Как и в предыдущем случае, лишь вместе они образуют прочный комплекс с РНК.
Для полного реконструирования бесклеточной системы, осуществляющей процессинг 3’-концов in vitro, в ней помимо вышеупомянутых факторов необходимо наличие поли(А)-полимеразы – фермента, непосредственно осуществляющего полиаденилирование. Присутствие этого фермента требуется не для самого акта расщепления РНК, а, по-видимому, для стабилизации процессирующего белкового комплекса, схематически изображенного на рис. I.13. Сборка такого сложного комплекса зависит от ATP, однако в процессе сборки не происходит расщепления ее b–g-связей. В настоящее время неизвестно, какой именно компонент этого комплекса непосредственно расщепляет фосфодиэфирные связи РНК. Процесс полиаденилирования начинается сразу же за расщеплением РНК и происходит настолько быстро, что неполиаденилированных промежуточных продуктов не обнаруживается. Такое сопряжение двух реакций необходимо для защиты 3’-концевых последовательностей РНК от деградации нуклеазами. При этом сам акт полиаденилирования требует наличия только фактора CPSF, но не трех других: CstF, CFI и CFII.
Поли(A)-полимераза животных состоит из двух субъединиц с молекулярными массами ~ 80 и ~ 43 кДа, которые образуются в результате альтернативного сплайсинга их общей пре-мРНК. Короткий полипептид не обладает ферментативной активностью, и его функции неизвестны. Большая полипептидная цепь содержит С-концевой домен, обогащенный Ser и Thr и не определяющий ни одну из функций фермента, обнаруживаемых in vitro. Предполагают, что регуляторную роль играет множественное фосфорилирование этого домена. С-Концевой домен также содержит один из двух сигнальных последовательностей, необходимых для транспорта фермента в ядро. Вторая сигнальная аминокислотная последовательность локализована на границе С-концевого домена и основного полипептида поли(A)-полимеразы. Сравнительное исследование первичной структуры поли(А)-полимеразы показало наличие в ее полипептидной цепи каталитического домена, характерного для полимераз так называемого семейства X, к которому относятся ДНК-полимераза b, терминальная трансфераза, а также некоторые другие нуклеотидилтрансферазы. Используя 3’-конец расщепленной РНК в качестве затравки, поли(А)-полимераза последовательно присоединяет к нему остатки AMP из ATP по тому же самому механизму, что и другие ДНК- и РНК-полимеразы. Для эффективного функционирования поли(A)-полимераза требует наличия фактора CPSF, а также поли(A)-связывающего белка PAB II (poly(A)-binding protein II), который связывает полиаденилирующий комплекс с РНК после присоединения к ней, по крайней мере, десяти остатков А. В присутствии этих двух факторов поли(А)-полимераза сразу синтезирует поли(А)-последовательность полной длины по процессивному механизму. Гипотетическая структура элонгирующего комплекса представлена на рис. I.14.
Процессивное (непрерывное) полиаденилирование 3’-концов РНК происходит со скоростью ~ 25 нуклеотидов/с до тех пор, пока длина поли(А)-последовательности не достигнет ~ 250 нуклеотидов. После этого процессивная реакция прекращается, и происходит медленное дистрибутивное присоединение остатков AMP разными молекулами поли(А)-полимеразы. Предполагают, что элонгирующий белковый комплекс узнает длину синтезированной поли(А)-последовательности при участии фактора PAB II (см. рис. I.14). По этому механизму связывание определенного числа молекул PAB II с поли(А) прекращает элонгацию поли(А)-последовательности. Такой строгий контроль за длиной поли(А) на 3’-концах процессированных мРНК имеет большое значение для действия механизма, контролирующего время полужизни мРНК в цитоплазме. Без тщательного контроля над этим процессом с помощью селективного деаденилирования невозможно регулировать внутриклеточную деградацию мРНК, а вместе с тем и уровень экспрессии соответствующих генов с участием данного механизма.
Полиаденилирование является универсальным феноменом, играющим важную роль в процессинге и функционировании мРНК как прокариотических, так и эукариотических организмов. Однако сравнение механизмов полиаденилирования у этих групп организмов выявляет существенные различия, суммированные в табл. I.9.
Н. Саркаром (1997 г.) было высказано предположение о возникновении механизма полиаденилирования РНК. Он полагает, что поскольку у бактериальных и эукариотических ферментов, выполняющих аналогичные функции, не обнаружено гомологии в аминокислотных последовательностях, оба фермента возникли недавно из уже значительно дивергировавших функционально родственных предшественников. Такими предшественниками могли быть прокариотические и эукариотические тРНК-нуклеотидилтрансферазы, осуществляющие посттранскрипционный синтез последовательности CCA на 3’-концах тРНК, что по своему механизму близко к полиаденилированию. Подтверждением этого является обнаруженная значительная гомология между тРНК-нуклеотидилтрансферазой и основной поли(А)-полимеразой E. coli, а также между тРНК-нуклеотидилтрансферазой бактерии Sulfolobus shibatae, обитающей в горячих серных источниках, и поли(А)-полимеразами эукариот. Следы такой эволюционной связи обнаруживаются и в современных митохондриях, где в результате полиаденилирования мРНК могут создаваться терминирующие кодоны. По мнению Саркара, различия между системами полиаденилирования прокариот и эукариот, представленные в табл. I.9, можно рассматривать в качестве продукта эволюционной дивергенции сходных биосинтетических функций в процессе независимого возникновения нового регуляторного механизма, обеспечивающего физиологические нужды уже глубоко различающихся групп организмов.
Таблица I.9
Сравнение полиаденилирования мРНК у эукариот и прокариот
Удаление последовательностей интронов с помощью сплайсинга происходит в ядрах эукариот сразу после завершения синтеза пре-РНК. В сплайсинге, как… В заключение этого краткого введения определим с помощью приведенной ниже…Механизм прямой и обратной реакций аутосплайсинга
Интронов группы I
Рис. I.15. Структура интронов I-III групп и механизм аутосплайсинга
а – вторичные структуры типичных интронов типа I (Tetrahymena thermophila), II и III групп (Euglena gracilis). Стрелками обозначены 3¢- и 5¢-сайты сплайсинга, а также места интеграции твинтронов, пунктирными линиями – сайты интронов, сближенные в пространстве, EBS и IBS – соответственно сайты связывания экзонов и интронов; б – предполагаемая вторичная структура интрона группы II; в – двухэтапный механизм аутосплайсинга. Римскими цифрами обозначены предполагаемые двухцепочечные участки РНК, 1, 2 – экзоны
Строчными буквами в таблице изображены нуклеотиды, принадлежащие экзонам, а прописными – интронам. Прямая и обратная реакции не требуют белковых катализаторов. Однако в ряде случаев интроны I и II групп могут кодировать полипептид, названный матуразой (maturase, от англ. mature – созревать), который необходим для эффективного аутосплайсинга и транспозиции интронов in vivo.
Аутосплайсинг интронов группы I начинается с нуклеофильной атаки 2’-OH-группы GTP по фосфодиэфирной связи в 5’-концевом сайте сплайсинга (см. табл. I.10) (присутствие GTP в качестве кофактора необходимо для протекания данной реакции). При этом происходит освобождение 5’-концевого экзона 1. Образовавшиеся половинки молекулы удерживаются рядом друг с другом водородными связями. Освободившаяся 3’-OH-группа экзона 1 далее атакует фосфодиэфирную связь в 3’-концевом сайте сплайсинга, что сопровождается расщеплением этой связи и полным освобождением интрона. Одновременно происходит лигирование двух экзонов. Все этапы этой реакции обратимы. В обратной реакции после связывания соответствующего участка лигированных экзонов "активным центром" вырезанного интрона последний атакует своей концевой 3’-OH-группой фосфодиэфирную связь в месте стыковки экзонов, что сопровождается объединением интрона и экзона 2. На втором этапе 3’-OH-группа экзона 1 атакует фосфатную группу по первой фосфодиэфирной связи интрона, освобождая остаток G, с последующим объединением экзона 1 с остальной частью молекулы.
Аутосплайсинг интронов II и III групп протекает по другому механизму (см. рис. I.15,в). Реакция также осуществляется в два этапа. На первом этапе 2’-OH-группа аденозина, находящегося в точке разветвления интрона, вырезаемого из предшественника РНК, атакует фосфодиэфирную связь 5’-концевого сайта сплайсинга, что сопровождается освобождением экзона 1 и образованием промежуточной структуры в виде лассо. В таком промежуточном соединении 5’-концевой нуклеотид интрона соединен 2’–5’-фосфодиэфирной связью с этим остатком аденозина, образуя петлю на конце интрона. На втором этапе 3’-концевая OH-группа экзона 1 атакует 3’-концевой сайт сплайсинга. В результате происходит объединение экзонов и освобождается интрон с петлей на 5’-конце. В заключение следует отметить одно замечательное свойство этой группы реакций. Поскольку число фосфодиэфирных связей на протяжении всех преобразований остается неизменным, они не требуют затраты дополнительной энергии и протекают самопроизвольно.
Сплайсинг у ядерных пре-мРНК.Исследование механизмов сплайсинга у ядерных пре-мРНК показало, что они существенно не отличаются от только что рассмотренных механизмов, используемых для удаления интронов II и III групп, однако ряд различий имеется.
Структура интронов, удаляемых из предшественников РНК аутосплайсингом, высококонсервативна. У интронов ядерных РНК консервативны лишь короткие последовательности в окрестностях сайтов сплайсинга и точки разветвления. Вторая отличительная особенность сплайсинга у ядерных пре-мРНК – потребность в ATP и мяРНП, формирующих сплайсому. Тем не менее, одинаковые черты этих двух систем сплайсинга более существенны. Малые ядерные РНК, входящие в состав мяРНП и сплайсомы, участвуют в распознавании сайтов сплайсинга и точки разветвления, а также в правильном ориентировании экзонов по отношению друг к другу. Их OH-группы осуществляют атаку фосфодиэфирной связи 5’-концевого сайта сплайсинга на первом этапе реакции. Так же как и в случае интронов II и III групп, для вырезаемого интрона характерна структура типа лассо.
Распознавание канонических сайтов при сплайсинге ядерных пре-мРНК.Для полного прохождения всех реакций сплайсинга его аппарат (сплайсома) должен распознавать на пре-мРНК три критические последовательности нуклеотидов: 3’- и 5’-концевые сайты сплайсинга и точку разветвления. В соответствии с наиболее распространенной моделью поиска экзонов в пре-мРНК с большими интронами, аппарат сплайсинга, прежде всего, отыскивает два близкорасположенных сайта сплайсинга в нужной ориентации. Распознавание конкретной пары сайтов сплайсинга в пре-мРНК дрожжей начинается с взаимодействия по принципу комплементарности между последовательностями этих сайтов и 5’-концевыми участками мяРНК U1, входящих в состав U1-мяРНП-частиц в случае 5’-концевых сайтов сплайсинга, а также белка U2AF65, находящегося в комплексе с U2AF35, с последовательностью 3’-концевого сайта сплайсинга. Эффективность функционирования сайтов сплайсинга зависит от степени соответствия их первичной структуры консенсусным последовательностям.
Сближение двух сайтов сплайсинга, сопровождаемое выпетливанием последовательности интрона, осуществляется с участием SR-белков, обогащенных Ser и Arg, которые взаимодействуют с 70К-белком (70 кДа), входящим в состав U1-мяРНП-частицы, а также U2AF35 на другом конце интрона. Такие комплексы, образованные с участием SR-белков, получили название "коммитированных комплексов".
В то время как 5’-концевые сайты сплайсинга довольно консервативны, 3’-концевые сайты обнаруживают большую вариабельность. U1-мяРНП, находящиеся в комплексе с 5’-концевым сайтом сплайсинга, стимулируют присоединение белков U2AF к 3’-концевому сайту и способствуют правильному распознаванию соответствующего экзона в процессе, получившем название "определение экзона". Эффективное распознавание сайтов сплайсинга соответствующими белками является критическим этапом в правильном и упорядоченном удалении экзонов из пре-мРНК в процессе конститутивного сплайсинга.
Механизмы определения экзонов. Гены позвоночных, как правило, содержат большое число мелких экзонов (средняя длина ~ 137 п.о.), разделенных протяженными последовательностями интронов, длина которых может превышать 100 т.п.о. При этом ферментные системы, осуществляющие сплайсинг, должны распознавать небольшие экзоны, затерянные среди гигантских некодирующих последовательностей, и осуществлять их правильное объединение друг с другом. Как уже упоминалось выше, канонические (консенсусные) последовательности, необходимые для распознавания экзонов, располагаются на концах интронов. Однако в отличие от соответствующих последовательностей интронов дрожжей регуляторные последовательности в окрестностях сайтов сплайсинга животных менее консервативны, и это, на первый взгляд, значительно усложняет задачу распознавания экзонов системами сплайсинга. В действительности распознавание индивидуальных сайтов сплайсинга у животных, по-видимому, не связано с независимым распознаванием канонических последовательностей в окрестностях каждого экзона. В соответствии с наиболее популярной в настоящее время моделью
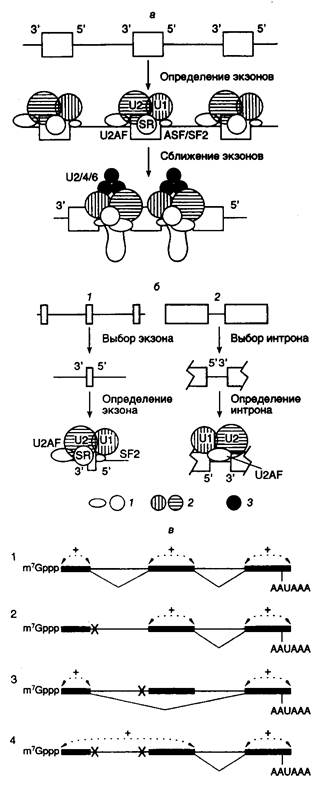
Рис. I.16. Механизм определения экзонов и интронов при сплайсинге ядерных пре-мРНК
а – определение экзонов; б – определение интронов у позвоночных (1) и низших эукариот (2), в – роль кэп-связывающего комплекса (CBC) в определении экзонов. Отмечены белки и РНК, участвующие в этом процессе в составе сплайсом: 1 – белки, 2 и 3 – мяРНП, X – мутации, инактивирующие сайты сплайсинга; + – взаимодействия, обеспечивающие распознавание экзонов; AAUAAA – поли(А)-сайт
определения экзонов у животных, взаимодействие между соседними сайтами сплайсинга в генах с короткими экзонами и длинными интронами происходит не через интроны, а через последовательности экзонов. Предполагается, что у пре-мРНК с длинными интронами система сплайсинга, прежде всего, отыскивает пару близкорасположенных сайтов сплайсинга, фланкирующих короткие последовательности экзонов (рис. I.16,а). После распознавания такой пары с ними взаимодействуют U1- и U2-мяРНП и ассоциированные факторы сплайсинга, включая факторы, распознающие 3’-концевые сайты сплайсинга – U2AF и SC35, а также фактор, узнающий 5’-концевой сайт сплайсинга – ASF/SF2. После завершения процесса определения экзона соседние экзоны входят в контакт друг с другом в результате взаимодействия между факторами, распознающими индивидуальные экзоны. Таким образом, в соответствии с этой моделью процесс сборки активной сплайсомы у позвоночных проходит в два этапа, включающие определение экзонов и их сближение между собой. В генах с небольшими интронами, например у низших эукариот, по-видимому, реализуется альтернативный механизм (см. рис. I.16,б). В этом случае первым этапом сборки сплайсомы является определение интрона.
В результате мутаций, связанных с нарушением сплайсинга, возникает, по крайней мере, четыре фенотипа: игнорирование экзона, который вырезается вместе с интронами; активация новых (криптических) сайтов сплайсинга; возникновение внутри интронов псевдоэкзонов, последовательности которых не вырезаются из пре-мРНК, и игнорирование интронов. Частоты этих мутаций составляют соответственно 51, 32, 11 и 6%. Все фенотипы, за исключением последнего, могут быть объяснены на основе обсуждаемой модели определения экзонов.
Эта же модель позволяет предсказывать максимальные и минимальные размеры экзонов в генах эукариот. Действительно, анализ длин 1600 внутренних экзонов показал, что только 3,5% из них содержат более 300 нуклеотидов и менее 1% – 400 нуклеотидов. Кроме того, доля экзонов, длина которых меньше 50 нуклеотидов, в этой выборке также незначительна. Известно, что в опытах in vitro сплайсинг резко ингибируется, если длина внутренних экзонов превышает 400 нуклеотидов или становится меньше 50 нуклеотидов. Все эти факты делают модель определения экзонов весьма правдоподобной. Более короткие экзоны, длина которых составляет 6 или 7 п.о., часто обнаруживаемые в генах белков мышц, распознаются системой сплайсинга через энхансерные регуляторные последовательности, расположенные в интронах рядом с экзонами. Механизм распознавания очень длинных экзонов остается неизвестным.
Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов РНК-полимеразы II
Ядерный кэп-связывающий комплекс (CBC). Присоединение кэп-группы к любой строящейся цепи мРНК эукариот, что является ее первой (котранскрипционной)… Роль CBC в сплайсинге пре-мРНК.Уже более 15 лет известно, что кэп-структура… Оказалось, что во время сплайсинга больших пре-мРНК кэп-группа оказывает влияние лишь на вырезание ближайшего к ней…Функциональная компартментализация ядра
Концепция функциональной компартментализации эукариотической клетки в настоящее время общепринята и основывается на признании существования…Интерфазные хромосомы в ядре
Эффект положения рассматривается в настоящее время в качестве универсального явления, характерного для всех эукариотических хромосом. Он наглядно… Уже в ранних цитологических экспериментах (С. Рабл, 1885 г.) было показано,… В отличие от теломерных участков хромосом, активно экспрессирующиеся гены локализуются преимущественно во внутренних…Ядрышко
Морфологически в ядрышке различают три основные зоны: фибриллярный центр (1), окруженный плотной фибриллярной (2) и гранулярной (3) областями. С… При этом следует иметь в виду, что наблюдаемая "высокоупорядоченная"… Долгое время ядрышко рассматривалось только в обсуждаемом выше аспекте, т.е. как внутриядерный микрокомпартмент…Пространственная организация синтеза мРНК
Аппарат транскрипции, участвующий в синтезе пре-мРНК, ассоциирован с перихроматиновыми фибриллами, обнаруживаемыми на границах доменов… В опытах по внутриядерной локализации мест синтеза специфических транскриптов… Треки РНК тесно ассоциированы с дискретными внутриядерными структурами, называемыми межхроматиновыми гранулами, или…Ядерные тельца и домены
Свернутые тельца(coiled bodies). Эти внутриядерные ультраструктуры, обнаруживаемые в виде клубка переплетенных нитей в ядрах клеток млекопитающих,… Аналогами свернутых телец являются снурпосомы С ядер ооцитов амфибий. Эти… Ядерные тельца PML. Острая промиелоцитарная лейкемия (PML) часто ассоциирована с транслокацией t(15;17) (перенос…Компартментализованное ядро
Молекулярный аппарат, обеспечивающий внутриядерную экспрессию генов, их репликацию и репарацию, настолько велик, что объединение его компонентов во… Следует особо подчеркнуть роль индивидуальных эукариотических хромосом в…Биосинтез белка рибосомами бактерий
Таким образом, во время трансляции рибосома после связывания мРНК начинает последовательно, кодон за кодоном, перемещаться вдоль матрицы, выбирая из…Рибосомы
Рибосомные белки E. coli. В настоящее время более 50 рибосомных белков выделено в высокоочищенном состоянии. Молекулярная масса самого маленького… Белки в составе 30S субчастицы ассоциированы с 16S РНК, длина которой… Методы исследования пространственной структуры рибосом. Вся информация о пространственной структуре рибосом получена с…Рис. I.17. Карта сборки 50S субчастицы рибосом E. coli из индивидуальных рибосомных белков и рРНК в процессе реконструкции in vitro
Стрелками обозначены межмолекулярные взаимодействия, удерживающие индивидуальные белки (цифры в кружках) в составе субчастицы, и взаимозависимость сборки. Толщина стрелок отражает прочность связей
Одними из первых следует упомянуть кристаллографию и ЯМР-спектроскопию. Имеются значительные достижения в изучении пространственной структуры небольших субдоменов рРНК с помощью ЯМР-спектроскопии, а также в исследовании структуры индивидуальных рибосомных белков с использованием методов ЯМР и кристаллографии. В последнее время закристаллизованы отдельные рибосомные субчастицы и 70S рибосомы галофильных и термофильных бактерий. Получены картины дифракции для 50S субчастиц галофилов с разрешением 3 Å, а также рибосом и субчастиц T. thermophilus с разрешением 7–20 Å. Однако эти картины дифракции, по крайней мере, в 10 раз сложнее тех, с которыми приходилось иметь дело раньше при расшифровке структур несимметричных макромолекул, что сильно затрудняет их интерпретацию. В результате наиболее распространена в настоящее время альтернативная стратегия определения структуры рибосом "по частям": через пространственные структуры индивидуальных рибосомных белков, субдоменов рРНК и их небольших комплексов. Выявленное в ходе этих исследований большое разнообразие пространственных структур рибосомных белков указывает на существование не менее разнообразных механизмов распознавания белками специфических участков РНК, количество которых должно значительно превышать ограниченное число известных механизмов ДНК–белкового узнавания.
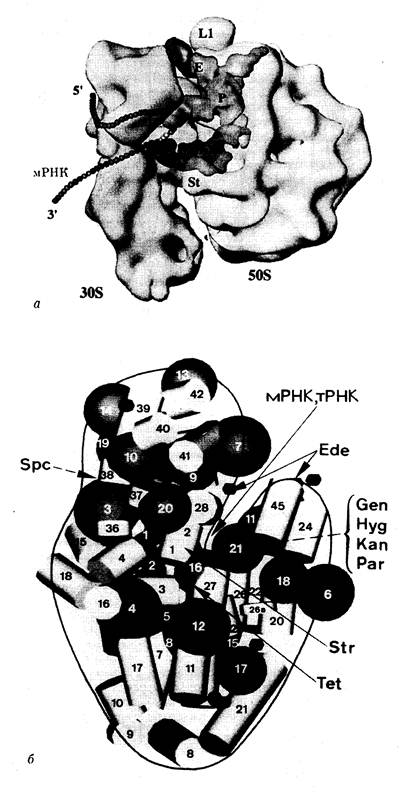
Рис. I.18. Полупрозрачная модель пространственной структуры рибосомы E. coli (а) и расположение рибосомных белков, а также рРНК в ее 30S-субчастице (б)
Указано положение мРНК, тРНК в А-, Р- и Е-участках рибосомы, белка L1 и "выступа" (stalk) 50S субчастицы. Черными шарами обозначены рибосомные белки, светлыми цилиндрами – спиральные участки 16S рРНК, стрелками – места связывания мРНК, тРНК и антибиотиков, цифрами – рибосомные белки и участки рРНК согласно общепринятой номенклатуре
Другим плодотворным направлением исследования пространственной структуры рибосом при низком разрешении является электронная микроскопия (ЭМ). При этом образцы с рибосомами быстро замораживают в жидком этане в тонком слое буфера и исследуют с помощью ЭМ при температуре жидкого азота и низких дозах облучения для сохранения чувствительных к радиации структур в интактном состоянии. На получаемых в результате микрофотографиях могут одновременно содержаться сотни и тысячи по-разному ориентированных индивидуальных рибосом, изображения которых далее подвергаются компьютерному анализу с последующей реконструкцией трехмерной структуры индивидуальной рибосомной частицы. Реконструкцию трехмерных структур работающих рибосом получают в результате анализа микрофотографий ультратонких срезов отдельных бактериальных клеток, активно синтезировавших белок или находившихся в состоянии блока трансляции. Одной из разновидностей ЭМ, активно использующейся для исследования пространственной структуры рибосом, является иммуноэлектронная микроскопия. Первичные и пространственные структуры рибосомных белков, формирующие их эпитопы, значительно различаются, поэтому такие белки редко дают перекрестные иммунологические реакции и их можно четко идентифицировать с помощью специфических антител. При анализе комплексов антител с рибосомами с помощью электронной микроскопии можно видеть, что многие белки локализованы на поверхности рибосомных субчастиц. Оказалось, что пространственное расположение большинства рибосомных белков весьма консервативно. В частности, у грамположительных и грамотрицательных бактерий гомологичные белки занимают одни и те же места на поверхности рибосомных субчастиц.
Важная информация о расположении индивидуальных рибосомных белков в составе рибосом получена и с помощью метода поперечных сшивок. Используя бифункциональные реагенты, например диэпоксибутан или 2-иминотиолан, осуществляют ковалентное соединение рибосомных белков, расположенных по соседству на расстоянии 5–10 Å друг от друга. Поскольку в настоящее время аминокислотные последовательности всех рибосомных белков известны, этим методом можно однозначно определять, какие аминокислотные остатки в соседних белках участвуют в образовании поперечных сшивок.
Целостность рибосом в водных растворах в значительной степени зависит от температуры и ионных условий, особенно от концентрации двухвалентных ионов (Mg2+ и Ca2+). Понижение концентрации ионов Mg2+ приводит вначале к диссоциации рибосом на большую и малую субчастицы, а затем к последовательному упорядоченному освобождению рибосомных белков из субчастиц вплоть до их полного распада с образованием пула отдельных белков и рРНК. Процесс разборки рибосом обратим, и при восстановлении ионных и температурных условий в реакционной смеси возможно реконструирование рибосомных субчастиц из отдельных компонентов с образованием полноценных функционально активных рибосом. На рис. I.17 представлена карта сборки большой субчастицы рибосом E. coli из отдельных компонентов, которая отражает последовательность присоединения рибосомных белков к рРНК, а также два основных этапа сборки. Для перехода ко второму этапу необходимо дальнейшее изменение ионных условий и температуры реакционной среды. Процесс сборки субчастиц рибосом является кооперативным, т.е. присоединение одних рибосомных белков стимулирует включение других. При этом белки, включающиеся в состав рибосомных субчастиц друг за другом, в зрелых субчастицах оказываются расположенными рядом. Реконструирование рибосом из отдельных компонентов in vitro внесло большой вклад в понимание пространственной организации рибосомных субчастиц и функциональной значимости отдельных рибосомных белков.
Метод рассеяния нейтронов на протонах, входящих в состав белков, также способствовал пониманию пространственного расположения белков в рибосомах. Отклонения нейтронов после контактов с протонами белков можно легко отличить от отклонений, которые являются результатом взаимодействия нейтронов с другими атомами, в частности тяжелыми изотопами водорода (2H или 3Н). Если в состав дейтерированных рибосомных субчастиц ввести два рибосомных белка, содержащих обычные протоны, то по рассеянию нейтронов на протонах, характер которого значительно отличается от такового на дейтронах, можно определить расстояния между центрами масс этих двух белков. Усовершенствованный метод нейтронного рассеяния позволяет определять не только расстояния между рибосомными белками, но и пространственную организацию самих полипептидных цепей в составе рибосомных субчастиц. Полученные таким образом нейтронные карты основаны на измерении расстояний между 93 белками. Такие карты имеют фундаментальное значение в интерпретации экспериментальных данных, полученных другими методами, особенно в результате молекулярного моделирования.
При отсутствии данных рентгеноструктурного анализа высокого разрешения молекулярные биологи традиционно обращаются к молекулярному моделированию пространственных структур. В некоторых случаях такой подход бывает весьма успешным, что особенно ярко проявилось при расшифровке пространственной структуры ДНК. Все модели, описанные в настоящее время, учитывают филогенетические особенности вторичной структуры 16S рРНК, и в некоторых из них принимаются во внимание третичные взаимодействия внутри этих макромолекул. В последнее время для таких целей все чаще используется компьютерный анализ. Применение вычислительной техники сводит к минимуму субъективизм в построении моделей и позволяет систематически исследовать возможные конформационные состояния анализируемых молекулярных объектов. При этом выбор конкретного алгоритма в современном моделировании оказывает меньшее влияние на конечный результат, чем выбор имеющихся экспериментальных данных и использование ограничивающих условий.
На рис. I.18 представлена современная модель пространственной структуры 70S рибосомы E. coli, разработанная в лаборатории Д. Франка (США) с учетом данных, которые были получены с помощью всех вышеперечисленных методов.
Этапы биосинтеза белка
Процесс биосинтеза белка рибосомами, как и биосинтез любой другой макромолекулы клетки, условно разделяют на три основных этапа: инициацию,… Инициация трансляции. Биосинтез белка рибосомами начинается с образования…Рис. I.19. Этапы инициации трансляции у E. coli
Вначале после объединения факторов инициации трансляции, GTP, fMet-тРНКfMet и мРНК с 30S субчастицей антикодон тРНК еще не взаимодействует с инициаторным AUG-кодоном (стадии А’ и B’). Такое продуктивное взаимодействие тРНК с мРНК происходит в дальнейшем (стадия C), и этот переход является одной из лимитирующих стадий всего процесса образования инициационного комплекса. С завершением стадии C происходит формирование стабильного тройного (из трех основных компонентов) инициационного комплекса, сопровождаемое конформационными перестройками всех его компонентов. После выхода из комплекса факторов инициации трансляции IF1 и IF3 тройной комплекс приобретает способность связывать большую 50S субчастицу рибосом, что сопровождается дальнейшими конформационными перестройками всей рибосомы (стадия D). В ходе этого процесса происходит расщепление молекулы GTP до GDP и ортофосфата и освобождение из комплекса фактора IF2 (стадия E). Формилметионил-тРНКfMet вместе с инициирующим AUG-кодоном перемещаются в донорный (P) участок рибосомы, освобождая акцепторный (A) участок для следующей аминоацилированной тРНК. В результате инициационный комплекс становится полностью подготовленным для вступления в следующую фазу биосинтеза белка – элонгацию полипептидных цепей.
Элонгация. В соответствии с обсуждаемой моделью принято считать, что после образования тройного комплекса, включающего 70S рибосому, мРНК и инициаторную тРНК, завершается этап инициации трансляции, и процесс биосинтеза белка вступает в фазу элонгации, которая завершается освобождением полипептидных цепей из элонгирующих комплексов. Во время элонгации происходит последовательное присоединение аминокислотных остатков к C-концевым частям строящихся полипептидных цепей, направляемое кодонами транслируемых матричных РНК.
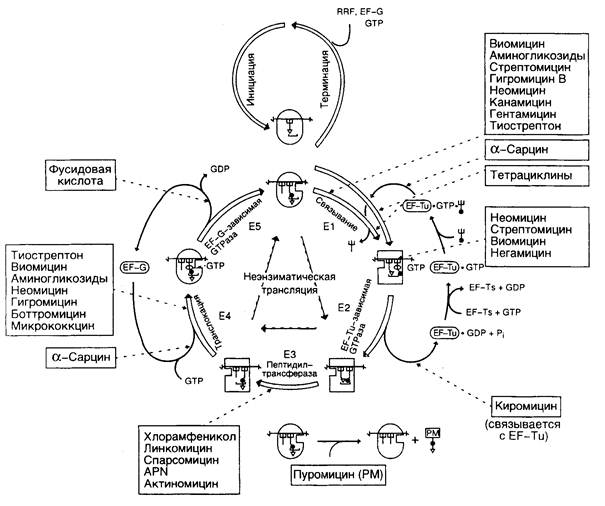
Рис. I.20. Элонгация полипептидных цепей
Стрелки указывают на реакции, подавляемые соответствующими антибиотиками
Этап элонгации начинается со взаимодействия фактора элонгации трансляции EF-Tu, молекулы GTP и очередной аминоацилированной тРНК с A-участком рибосомы (см. рис. I.20, стадия Е1). Вхождение аминоацилированной тРНК в A-участок происходит в соответствии с установленным в нем кодоном транслируемой мРНК. При этом лишь та аминоацилированная тРНК прочно связывается с рибосомой, у которой антикодон комплементарен кодону, установленному в A-участке. После гидролиза GTP и освобождения EF-Tu•GDP из комплекса (стадия Е2) происходит образование новой пептидной связи между карбоксильной группой формилметионина инициаторной тРНК и NH2-группой аминокислотного остатка, находящегося в A-участке рибосомы в составе аминоацил-тРНК (стадия Е3). Эта стадия получила название транспептидации. Обмен GDP на GTP в освободившемся комплексе EF-Tu•GDP происходит с участием фактора EF-Ts.
Образовавшийся в итоге пептид удерживается рибосомой через остаток тРНК, находящийся в A-участке, а освободившаяся тРНК временно сохраняется в так называемом E-участке рибосомы (от англ. exit – выход). Такая соединенная с пептидом тРНК получила название пептидил-тРНК. Образовавшаяся пептидил-тРНК далее переносится из A- в P-участок рибосомы. Эта стадия элонгации (Е4) известна под названием транслокации. Транслокация индуцируется фактором элонгации EF-G, который освобождается из элонгирующего комплекса после расщепления молекулы GTP. Таким образом, энергия еще одной молекулы GTP используется в акте транслокации. После завершения транслокации происходит освобождение фактора EF-G из элонгирующего комплекса. При этом A-участок рибосомы остается свободным. Следующий цикл элонгации начинается с вхождения в A-участок рибосомы в составе тройного комплекса очередной молекулы тРНК (стадия Е1), что сопровождается освобождением формилметионил-тРНКfMet из E-участка, после чего повторяются все остальные вышеперечисленные стадии элонгации. В физиологических условиях рибосома совершает ~ 20 циклов элонгации в секунду. В соответствии с этим для синтеза белка длиной в 200 аминокислотных остатков требуется ~10 секунд.
В рассмотренной классической модели биосинтеза белка с тремя участками связывания тРНК на любой стадии элонгации с рибосомой взаимодействуют две молекулы тРНК. Иными словами, до стадии транслокации тРНК занимают A- и P-участки рибосомы, тогда как после транслокации молекулы ассоциированы с P- и E-участками. Между участками A и E существует аллостерическое взаимодействие, что проявляется в отрицательном кооперативном эффекте связывания молекул тРНК этими участками и означает, что только A- или E-участки рибосомы могут быть заняты молекулой тРНК, и рибосома не содержит одновременно занятыми оба участка.
Молекулярная мимикрия фактора элонгации EF-G. Недавно было обнаружено, что пространственная структура домена IV полипептидной цепи фактора элонгации EF-G имитирует структуру тРНК в ее комплексе с другим фактором элонгации EF-Tu. При этом структура соответствующей части полипептидной цепи EF-G напоминает форму антикодоновой петли тРНК в комплексе с фактором элонгации, ее положение относительно кóровой части EF-Tu и даже распределение электростатических зарядов на поверхности полипептида, которое соответствовало таковому углевод-фосфатного остова тРНК. Это открытие позволило по-новому посмотреть на механизм действия EF-G в цикле трансляции. Такого рода данные позволили предположить, что домен IV фактора EF-G занимает во время некоторых этапов транслокации ту же часть A-участка рибосом, что и тРНК. Однако остается непонятным, каким образом это может физически влиять на прохождение акта транслокации.
Терминация трансляции. Процесс трансляции вступает в завершающую фазу после того, как в A-участок рибосомы попадает терминирующий (бессмысленный) кодон мРНК, а пептидил-тРНК перемещается в донорный P-участок рибосомы. Белковые факторы RF1 и RF2 участвуют в распознавании последовательностей нуклеотидов терминирующего кодона. Фактор RF3, также как и EF-G, имитирует структурные особенности фактора EF-Tu, что дает ему возможность взаимодействовать с А-участком рибосомы. Но поскольку с ним не связана аминоацилированная тРНК, его присутствие в А-участке приводит к обрыву строящейся цепи полипептида. После формирования такого комплекса происходит расщепление сложноэфирной связи между полипептидом и тРНК, а также освобождение синтезированного полипептида. С помощью мутационного анализа было установлено, что молекулы рРНК обеих субчастиц рибосом E. coli участвуют в гидролизе пептидил-тРНК.
Для того чтобы рибосома оставшегося комплекса рибосома–мРНК–тРНК могла вступить в следующий цикл трансляции, она должна освободиться из него. Установлено, что вышеупомянутые рибосомные рилизинг-факторы (RF) совместно с фактором EF-G при участии молекулы GTP обеспечивают диссоциацию комплекса на составные компоненты, которые затем вступают в новый раунд белкового синтеза. Фактор RF4 (иначе называемый RRF – ribosome-recycling factor) не имеет аналога у эукариот. Его роль, по-видимому, заключается в стимуляции перемещения молекулы деацилированной тРНК из P-участка в E-участок рибосомы и(или) удалении оставшегося RF-фактора из A-участка. Это способствует полному освобождению рибосомы и ее вовлечению в новый цикл трансляции в результате инициации или реинициации синтеза белка. Отделившаяся от мРНК рибосома перед вступлением в новый цикл диссоциирует на две субчастицы под действием фактора инициации трансляции IF3. Альтернативно, в том случае, если новый инициирующий кодон полицистронной матрицы находится достаточно близко от стоп-кодона, синтез белка может быть реинициирован.
Реинициация трансляции. Реинициацией трансляции называют повторное вступление рибосом, терминировавших биосинтез белка, в цикл трансляции без предварительного отделения их от мРНК. Реинициация синтеза белка широко распространена у E. coli и играет важную роль в контроле экспрессии генов этого микроорганизма на уровне трансляции. Это связано с тем, что значительная часть бактериальных мРНК полицистронна, а, следовательно, за терминирующим кодоном одного цистрона на небольшом от него удалении располагается инициирующий кодон следующего. Благодаря реинициации имеет место координированная (сопряженная) трансляция нескольких ОРС, объединенных в полицистронной матрице.
Имеются данные о том, что рибосомы E. coli, терминировавшие синтез полипептида, обладают способностью перемещаться на короткие расстояния в окрестностях терминирующего кодона и после встречи с инициирующим кодоном в новом сайте инициации трансляции могут начать следующий раунд трансляции без отделения от мРНК. Новый инициирующий кодон может располагаться выше или ниже стоп-кодона предыдущего гена, а может и перекрываться с ним (например, в последовательности AUGA). Реинициация может происходить с полной эффективностью, если в сайте реинициации имеется адекватная SD-последовательность, а терминирующий и инициирующий кодоны расположены достаточно близко друг к другу (менее эквивалента длины рибосомы). Последнее обстоятельство указывает на быструю кинетику отделения терминировавших рибосом от мРНК.
Важным следствием сопряжения трансляции у прокариот через реинициацию является зависимость экспрессии целой серии генов, принадлежащих одному оперону, от трансляции первой ОРС полицистронной матрицы. При этом следует заметить, что сопряжение экспрессии генов на уровне трансляции может оказывать и негативное влияние на эффективность трансляции нижерасположенных цистронов.
Если обычная инициация трансляции у E. coli на кодоне UUG происходит с очень низкой эффективностью, то реинициирующие рибосомы используют его для начала синтеза белка весьма охотно. Это объясняют отсутствием фактора IF3 в реинициирующем комплексе, который во многом определяет точность выбора инициирующего кодона рибосомами.
На поведение рибосом, терминировавших синтез белка, большое влияние оказывают и факторы терминации трансляции (RF). В опытах с мутантным бактериофагом R17, содержащим амбер-кодон в положении 7 гена белка оболочки, было установлено, что в отсутствие фактора терминации трансляции RF4 вслед за терминацией трансляции на бессмысленном кодоне имела место реинициация трансляции на следующем кодоне мРНК, что завершалось синтезом белка оболочки, укороченного с N-конца на 7 аминокислот. На этом основании полагают, что рилизинг-фактор RF4 в обычных условиях предотвращает распознавание аминоацилированной тРНК кодона, находящегося в А-участке рибосомы, который в мРНК следует за терминирующим.
Альтернативные модели цикла трансляции. В рассмотренной выше классической модели трансляции перемещение молекул тРНК на большой и малой субчастицах рибосом сопряжено друг с другом. В отличие от этого, в активно обсуждающейся модели гибридных состояний (hybrid states model) перемещение тРНК между A- и P-участками 30S субчастицы происходит независимо от перемещения тРНК между A-, P- и E-участками большой субчастицы. В соответствии с этой моделью аминоацил-тРНК попадает в пептидил-тРНК–рибосомный комплекс в составе тройного комплекса EF-Tu·GTP·тРНК и взаимодействует с ней первоначально в гибридном состоянии A/E. В этом состоянии антикодоновая часть тРНК связывается с A-участком 30S субчастицы, а ее CCA-конец, удерживаемый EF-Tu, располагается в E-участке большой субчастицы и, возможно, частично на малой субчастице. Вслед за гидролизом GTP происходит освобождение EF-Tu, что делает возможным перемещение CCA-конца аминоацил-тРНК в A-участок большой субчастицы, приводящее к возникновению A/A-состояния, эквивалентного состоянию взаимодействия аминоацил-тРНК с A-участком в классической модели. После образования пептидной связи аминоацил-тРНК, уже связанная с растущей полипептидной цепью, перемещается в P-участок большой субчастицы, а деацилированная тРНК переходит в E-участок большой субчастицы. Вновь образованная пептидил-тРНК находится теперь в гибридном A/P-состоянии: антикодоновая часть остается в A-участке 30S субчастицы, а CCA-конец занимает P-участок большой субчастицы рибосом. При этом деацилированная тРНК находится в гибридном P/E-состоянии: антикодоновый конец остается в P-участке малой субчастицы, тогда как CCA-конец занимает E-участок большой субчастицы. Далее фактор элонгации EF-G в GTP-зависимой реакции обеспечивает перемещение антикодоновой части тРНК, находящейся в гибридном состоянии, вместе с мРНК относительно 30S субчастицы. При этом пептидил-тРНК переходит в чувствительное к пуромицину P/P-состояние, соответствующее ее взаимодействию с P-участком в классической модели, а деацилированная тРНК находится в E-состоянии и на этом этапе трансляции может взаимодействовать только с E-участком большой субчастицы рибосом.
По крайней мере, три интересных следствия вытекают из модели гибридного состояния. Во-первых, пептидильная часть растущего пептида остается на рибосомах в стационарном состоянии, а во время трансляции перемещается тРНК. Во-вторых, транслокация тРНК происходит в два этапа: во время первой стадии обе молекулы тРНК движутся относительно большой субчастицы, на втором этапе обе молекулы тРНК вместе со связанной с ними мРНК перемещаются относительно малой 30S субчастицы рибосом. В-третьих, в процессе синтеза белка имеют место не два или три состояния связывания тРНК, а шесть или даже, возможно, семь таких состояний.
С помощью физических методов были получены прямые доказательства спонтанного прохождения стадии транслокации, опосредуемой пептидилтрансферазой рибосом. При использовании флуоресцентных зондов, связанных с различными участками тРНК и рибосом, удалось обнаружить изменения в квантовом выходе флуоресценции и анизотропные эффекты при образовании пептидной связи, что указывало на перемещение молекулы тРНК относительно рибосомных белков S21 и L11. На основании этих данных было высказано предположение, что во время пептидилтрансферазной реакции пептидильная цепь остается в постоянном положении относительно рибосомы, а перемещаются молекулы тРНК. Эта модель пептидилтрансферазной реакции получила название модели перемещения (displacement model). Она обладает многими общими чертами с моделью гибридного состояния, однако отличается тем, что в этой модели движение мРНК в пептидилтрансферазной реакции сопровождает перемещение тРНК.
Замечания о точности трансляции. Сама по себе стабильность кодон–антикодоновых взаимодействий не может обеспечивать наблюдаемую высокую точность трансляции. Рибосомы активно участвуют в акте распознавания молекулами тРНК соответствующих кодонов мРНК, повышая точность функционирования этого механизма, по крайней мере, на четыре порядка. Данный эффект объясняют функционированием механизмов, корректирующих ошибки на этом этапе трансляции, которые сопряжены с EF-Tu-зависимым гидролизом GTP во время выбора соответствующей аминоацилированной тРНК. Недавние измерения скорости гидролиза GTP рибосомами в присутствии правильной (cognate) или неправильной (noncognate) тРНК и искусственной матрицы показали, что в первом случае она выше в ~ 104 раз. Это приводит к преимущественному освобождению комплекса EF-Tu·GDP из рибосом, содержащих правильные аминоацил-тРНК в А-участке. Для реализации данного механизма рибосомы должны распознавать правильные и ошибочные кодон-антикодоновые взаимодействия, а также передавать эту информацию своему GTPазному центру.
Мутантные рибосомы, для которых характерна пониженная точность трансляции, как правило, обладают более высоким сродством к тРНК в A-участке. Напротив, у "сверхточных" рибосом такое сродство понижено. В соответствии с этим повышенную точность трансляции можно объяснять в терминах уменьшения неспецифического связывания аминоацилированных тРНК A-участком рибосом и vice versa. Недавно было показано, что сродство тРНК к P-участку таких мутантных рибосом изменяется на противоположное таковому A-участка: у ram-мутантов с низкой точностью трансляции наблюдается пониженное сродство P-участка к тРНК, а у "сверхточных" рибосом это сродство повышено. Таким образом, в настоящее время полагают, что простые реципрокные отношения связывают A- и P-участки рибосом с механизмами, которые управляют взаимодействием мРНК и соответствующих тРНК с рибосомами.
Новая 10Sa РНК, функционирующая в трансляции. В том случае, если транслируемая бактериальная мРНК укорочена в своей 3’-концевой части и рибосома не находит в соответствующей рамке считывания терминирующий кодон, она не может закончить трансляцию с помощью стандартного механизма терминации. Полагают, что, столкнувшись с такой ситуацией, рибосома останавливается на конце мРНК и с ней взаимодействует недавно открытая 10Sa РНК, кодируемая у E. coli геном ssrA, которая запускает процесс деградации частично синтезированного полипептида. Эта необычная РНК, аминоацилированная остатком Ala на своем 3’-конце, подобном стандартной акцепторной последовательности тРНК, сочетает в себе свойства тРНК и мРНК. 10Sa РНК, как и тРНКAla, образует внутреннюю пару оснований G3:U70, которая необходима для специфического распознавания тРНКAla рибосомами. После взаимодействия с рибосомой эта РНК вступает в стандартный цикл трансляции: ее остаток Ala включается в недостроенную цепь полипептида. Вслед за этим рибосома транслирует короткую последовательность нуклеотидов 10Sa РНК, которая теперь функционирует в качестве матрицы, добавляя десять аминокислот – ANDENYALAA – в C-конец укороченной полипептидной цепи, и терминирует трансляцию на UAA-кодоне 10Sa РНК. C-Концевая олигопептидная последовательность освободившегося полипептида далее распознается специфической протеиназой, которая расщепляет этот полипептид, обеспечивая его утилизацию бактериальной клеткой в процессе катаболизма.
Антибиотики, действующие на уровне трансляции
Рис. I.21. Антибиотики – ингибиторы биосинтеза белка у бактерийТрансляция у эукариот
Особенности первичной структуры эукариотических мРНК
Участок мРНК, расположенный между кэп-группой и первым инициирующим кодоном основной открытой рамки считывания (ОРС), которая и несет информацию о… 3'UTR и поли(А)-последовательность оказывают влияние на состояние рибосом…Инициация биосинтеза белка эукариотическими рибосомами
Факторы инициации трансляции. Большинство молекулярных механизмов, осуществляющих регуляцию экспрессии генов на уровне трансляции, реализуется на… Таблица I.11 Факторы инициации трансляции дрожжей S. cerevisiae Фактор Субъединица Предполагаемая …Элонгация полипептидных цепей
Факторы и механизмы элонгации. Эукариотические клетки содержат в большом количестве фактор элонгации eEF1A, который является функциональным… Растущий полипептид выводится в цитоплазму через канал, начало которого… Уникальный фактор элонгации eEF-3 дрожжей. Клетки дрожжей и других грибов обладают дополнительным фактором элонгации…Терминация трансляции
Факторы терминации. По современным представлениям, элонгирующая эукариотическая рибосома распознает стоп-кодоны, находящиеся в одной рамке с… Влияние нуклеотидного контекста на эффективность терминации. Два основных… Результаты исследования возможной роли нуклеотидов, предшествующих терминирующему кодону, в терминации трансляции…Трансляция в митохондриях
Как уже можно видеть из размера мтДНК (ее длина у человека составляет 16569 п.о.), митохондрии не являются самовоспроизводящимися генетическими… Декодирование генетической информации в митохондриях.Сравнение первичной… Другой характерной особенностью генетической системы митохондрий является упрощение самого механизма декодирования…Трансляция в хлоропластах.
В отличие от митохондрий животных, система трансляции хлоропластов высоко гомологична системе бактерий и представлена 70S рибосомами, собственными… 70S рибосомы хлоропластов содержат ~60 рибосомных белков, что превышает их… Геномы хлоропластов, для которых определена полная первичная структура, содержат 27–35 потенциальных генов тРНК. При…Глава 3. ОСНОВНЫЕ ПУТИ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ
В этой главе будет рассмотрена лишь небольшая часть той почти необъятной информации, которая накоплена к настоящему времени в отношении механизмов регуляции экспрессии генов.
Конечным результатом экспрессии любого известного гена на молекулярном уровне является образование молекул РНК или белка, информация о первичной структуре которых закодирована в этом гене. Процесс биосинтеза белка складывается из многих взаимосвязанных этапов. Как уже упоминалось выше, основными из них являются транскрипция, трансляция, а также посттранскрипционные и посттрансляционные процессинг и модификации РНК и белка. Поэтому изменение скорости протекания каждого из данных этапов сопровождается, в конечном счете, изменением внутриклеточного содержания функционально активного продукта экспрессии гена. Следовательно, регуляторное воздействие на любом из этих этапов может привести к изменению уровня экспрессии соответствующего гена в клетках. Регулируемая экспрессия генов предполагает высокоспецифическое изменение внутриклеточного содержания кодируемых этими генами белков и нуклеиновых кислот в ответ на действие продуктов экспрессии других генов или регуляторных сигналов внутри- и внеклеточного происхождения, например низкомолекулярных метаболитов, ксенобиотиков или физических факторов (температура, ионизирующее излучение и т.п.). Избирательность таких воздействий становится возможной благодаря образованию высокоспецифических белок–белковых комплексов, комплексов лиганд–рецептор, распознаванию белками определенных последовательностей нуклеотидов ДНК или РНК, а также вследствие комплементарных взаимодействий нуклеиновых кислот друг с другом.
Избирательное действие низкомолекулярных биорегуляторов на гены происходит опосредованно через соответствующие рецепторы белковой природы. При этом, как правило, реализуется следующая схема: высоко- или низкомолекулярный эффектор (лиганд) специфически связывается с регуляторным белком-рецептором (например репрессором или активатором гена), изменяя конформацию рецептора таким образом, что он приобретает способность распознавать регуляторные последовательности нуклеиновых кислот или других регуляторных белков. Подобные взаимодействия, происходящие на одном из вышеупомянутых этапов биосинтеза белка, далее сопровождаются изменением эффективности экспрессии его гена. Очевидно, что наиболее продуктивно можно оказывать влияние на экспрессию гена через его транскрипцию. При таком способе регуляции должен изменяться внутриклеточный уровень соответствующих мРНК, который может лимитировать биосинтез белков рибосомами. Кроме того, прекращение синтеза мРНК для уменьшения внутриклеточного содержания ненужных в данный момент белков экономично и с энергетической точки зрения, так как с прекращением транскрипции перестает затрачиваться энергия на биосинтез ненужных макромолекул – мРНК или их предшественников. Действительно, регуляция экспрессии генов на уровне транскрипции широко распространена в природе.
Однако этот способ не является единственным. В ряде случаев накопление мРНК в виде внутриклеточного пула без немедленной их трансляции происходит перед определенными стадиями дифференцировки клеток, например в яйцеклетках до оплодотворения. Эти неактивные мРНК могут длительное время храниться и немедленно использоваться после получения клетками соответствующих сигналов. Кроме того, альтернативный процессинг мРНК приводит к образованию из одного и того же предшественника нескольких зрелых мРНК, трансляция которых сопровождается синтезом разных белковых продуктов. Специальные регуляторные механизмы могут изменять соотношения таких процессированных мРНК и, как следствие, внутриклеточное содержание кодируемых ими полипептидов. Использование регуляции данного типа позволяет повысить кодирующие возможности генов путем более сжатого хранения генетической информации. Не меньшую пользу для клетки приносит и регуляция экспрессии генов на других уровнях: трансляционном и посттрансляционном, которые только в совокупности способны обеспечивать поддержание жизненно важного гомеостаза организма.
Это краткое резюме, в котором перечислены основные пути регуляции экспрессии генов на качественном уровне, подразумевает количественные изменения внутриклеточного содержания белков и РНК, закодированных в геноме живого организма, в ответ на соответствующие регуляторные воздействия. Представляется весьма желательным построение количественных моделей регуляции активности генов. Такая постановка вопроса особенно актуальна с учетом тех глубоких перестроек фенотипа, которые сопровождают количественные изменения внутриклеточных концентраций продуктов конкретных генов (например в результате нарушения дозовой компенсации), в ряде случаев приводящие к развитию тяжелейших заболеваний (в частности синдрому Дауна).
Регуляция экспрессии генов на уровне транскрипции у прокариот
Три основных этапа транскрипции – инициация, элонгация и терминация, рассмотренные нами выше, используются бактериальными клетками для регуляции…Регуляция на уровне инициации транскрипции
Механизмы, при помощи которых активаторы стимулируют инициацию транскрипции, могут быть рассмотрены с двух точек зрения – кинетической и… Многие активаторы транскрипции, в том числе и Crp–cAMP, сгибают молекулу ДНК… Последовательности нуклеотидов промоторных участков генов, с которыми взаимодействуют молекулы репрессора, получили…Регуляция синтеза РНК на уровне элонгации и терминации
Основная регуляторная роль терминаторов транскрипции заключается в прекращении синтеза РНК на границе гена и освобождении полученной РНК из… Функционирование аттенюаторов – регулируемых терминаторов транскрипции… Влияние условий роста бактериальных клеток на элонгацию цепей РНК. Механизмы преждевременной терминации транскрипции и…Регуляция экспрессии генов на уровне транскрипции у эукариот
Гены высших организмов подразделяют по функциональному признаку на две большие группы: "гены домашнего хозяйства" (housekeeping genes) и… Сложность жизненного цикла многоклеточных организмов накладывает свои… Тканеспецифический характер экспрессии генов роскоши обеспечивается различными механизмами. В этом случае ключевую…Передача сигнала и вторичные мессенджеры
Все эти сигналы, передающиеся через соответствующие сигнальные молекулы, являются первичными по отношению к тем каскадам биохимических реакций,… Использование эукариотами системы вторичных мессенджеров переводит их на новый… Трансмембранный перенос первичных сигналов.Для того чтобы первичный регуляторный сигнал достиг ядра и оказал свое…Рецепторы мембран, осуществляющие трансмембранный перенос сигнала
Как было упомянуто выше, внеклеточные сигналы, воспринимаемые рецепторами на поверхности клеток, запускают цепь внутриклеточных биохимических… Циклический AMP в роли вторичного мессенджера. В ряде хорошо изученных случаев… cAMP активирует множество cAMP-зависимых протеинкиназ, каждая из которых фосфорилирует определенные белки-субстраты. В…Механизмы позитивной регуляции транскрипции
Все известные факторы транскрипции на основании гомологии первичных структур их полипептидных цепей разделяют на четыре больших суперкласса: 1)… Таблица I.13Классификация факторов транскрипции
| Фактор транскрипции | Характеристика |
| Суперкласс 1: факторы с основными доменами (basic domains) Класс 1.1: факторы с доменами типа "лейциновая застежка" (leucine zipper) (bZIP) | К ДНК-связывающему участку полипептидной цепи, обогащенному основными аминокислотными остатками, примыкает домен типа "лейциновая застежка", в котором каждым седьмым аминокислотным остатком является Leu. Этот домен обеспечивает димеризацию факторов, необходимую для их взаимодействия с ДНК. Все боковые остатки Leu выступают с одной стороны a-спирали и при воздействии двух полипептидных цепей переплетаются друг с другом, как в застежке-молнии, что обеспечивает специфичность димеризации. Во время взаимодействия димера с ДНК основные участки полипептидных цепей также приобретают a-спиральную конформацию. Предполагают, что два a-спиральных участка А и В, разделенные точкой перегиба, при связывании с ДНК захватывают ее наподобие ножниц. При этом ДНК контактирует с полипептидными цепями своей большой бороздкой на протяжении одного витка спирали. В классе семь семейств: 1) AP-1-подобные факторы (включает семь подсемейств: Jun, Fos, Maf, NF-E2, AP-1-подобные факторы грибов, CRE-BP/ATF и прочие факторы; всего 47 факторов); 2) CREB (CREB, ATF-1, CREM, BBF-2, dCREB2, SCO1, HAC1, Pcr1; всего 31 фактор); 3) С/EBP-подобные факторы (C/EBPa–e, CHOP-10; всего 13 факторов); 4) bZIP/PAR (DBP, VBP, Hlf, TEF; всего четыре фактора); 5) G-бокс-связывающие факторы растений (пять подсемейств: CPRF-2, EmBP-1, HBP-1a, TGA-1a, TGA-1b; всего 24 фактора); 6) только ZIP (SWI6, STE4; всего пять факторов); 7) другие факторы bZIP (Giant, OPI1). Общее число известных факторов в классе – 126. |
| Класс 1.2: факторы с доменами типа "спираль–петля–спираль" (helix–loop–helix) (bHLH) | К ДНК-связывающему участку полипептидной цепи, обогащенному основными аминокислотными остатками, примыкают две амфипатические a-спирали (см. ниже), соединенные друг с другом полипептидными петлями разной длины. Мотив "спираль–петля–спираль" (HLH) обеспечивает димеризацию факторов и их взаимодействие с ДНК, а область факторов, обогащенная основными аминокислотами, определяет специфичность ДНК-белкового взаимодействия. Во время димеризации a-спирализация полипептидных цепей факторов может значительно усиливаться, а после связывания димеров с ДНК основные домены также a-спирализуются. В димере все четыре HLH-домена, по-видимому, ориентированы параллельно друг другу. В классе девять семейств: 1) повсеместно распространенные факторы (класс А) (E2A, HEB/SCBP, Daughterless; всего девять факторов); 2) миогенные факторы транскрипции (MyoD, Myogenin, Myf-5; всего восемь факторов); 3) Achaete–Scute (Scute, Achaete, MASH-1; всего девять факторов); 4) Tal/Twist/Atonal/Hen (подсемейства: лимфоидные факторы, мезодермальные Twist-подобные факторы, HEN, Atonal, панкреатические факторы; всего 27 факторов); 5) Hairy (подсемейства: Hairy, Esp, регуляторы грибов; всего 12 факторов); 6) факторы с PAS-доменом (Ahr, Arnt; всего четыре фактора); 7) INO (INO2, INO4); 8) факторы, содержащие только HLH-домен (Emc, Id1, Olf-1; всего девять факторов); 9) другие bHLH-факторы (Deliah, Lc, CBF1). Общее число известных факторов в классе – 82. |
| Класс 1.3: факторы с двойными доменами спираль–петля–спираль/лейциновая застежка (bHLH–ZIP) | ДНК-связывающий участок обогащен остатками основных аминокислот, к которому примыкают две амфипатические a-спирали, соединенные полипептидной петлей, а также домен типа "лейциновая застежка". HLH-мотив обеспечивает димеризацию факторов, необходимую для их взаимодействия с ДНК. В димеризации также участвуют остатки Leu мотива "застежка". У факторов, связавшихся с ДНК, значительно усиливается a-спирализация полипептидных цепей. В димерах HLH-домены ориентированы параллельно друг другу. Область, обогащенная основными аминокислотами, обеспечивает специфичность взаимодействия факторов с ДНК. В классе два семейства: 1) повсеместно распространенные факторы bHLH–ZIP (подсемейства: TFE3, USF, SREBP, AP-4; всего 16 факторов); 2) факторы, контролирующие клеточный цикл (Myc, Mad/Max, E2F, DRTF; всего 26 факторов). Общее число известных факторов в классе – 42. |
| Класс 1.4: NF-1 | В классе одно семейство ядерных факторов NF-1 (22 фактора). |
| Класс 1.5: RF-X | Фактор RF-X1 идентифицирован как трансактиватор энхансера I вируса гепатита В, входит в состав семейства гомодимерных и гетеродимерных факторов транскрипции. В классе одно семейство RF-X, включающее 5 представителей: RF-X1–RF-X5 |
| Класс 1.6: bHSH | В классе одно семейство AP-2 (AP-2α, AP-2β, AP-2γ). Общее число известных факторов в классе – семь. |
| Суперкласс 2: факторы с ДНК-связывающими доменами, содержащими ион цинка в координационном центре Класс 2.1: факторы типа ядерных рецепторов, содержащие мотив "цинковые пальцы" Cys4 | Все факторы содержат домен "цинковые пальцы", характерный для ядерных рецепторов. По два таких домена различного размера, аминокислотного состава и механизма действия присутствуют в каждой молекуле рецептора. Каждый палец содержит четыре остатка Cys, координирующих ион Zn2+. Половина домена, включающая вторую пару остатков Cys, образует a-спираль. Спираль первого пальца взаимодействует с большой бороздкой ДНК. Последовательность между первыми двумя остатками Cys обеспечивает димеризацию факторов, связавшихся с ДНК. В классе два семейства: 1) рецепторы стероидных гормонов (подсемейства: рецепторы кортикоидов (GR), прогестерона (PR), андрогенов (AR), эстрогенов (ER); всего десять факторов); 2) факторы, подобные рецепторам тиреоидных гормонов (подсемейства: рецепторы ретиноевой кислоты (RAR), ретиноида X (RXR), тиреоидных гормонов (T3R), витамина D (VDR), NGFI-B, FTZ-F1, PPAR, EcR, ROR, TII/COUP, HNF-4, CFI, Knirps; всего 69 факторов). |
| Класс 2.2: факторы с разными доменами типа "цинковые пальцы" Cys4 | Каждая молекула факторов содержит по два домена типа "цинковые пальцы" GATA-типа. Каждый палец включает четыре остатка Cys, по-видимому, координирующих один ион Zn2+, однако хелатные агенты не подавляют взаимодействие факторов с ДНК. В классе три семейства: 1) GATA-факторы (подсемейства: GATA-факторы позвоночных и метаболические регуляторы грибов, всего девять факторов); 2) Trithorax (Ttx, Hrx); 3) прочие факторы (BUF2); всего 12 факторов. |
| Класс 2.3: факторы с доменами типа "цинковые пальцы" Cys2His2 | Все факторы содержат мотив "цинковые пальцы" типа TFIIIA/Krueppel, в котором каждый палец включает по два остатка Cys и His, координирующих ион Zn2+. В некоторых случаях один остаток His может быть заменен на остаток Cys. Ион Zn2+ необходим для взаимодействия факторов с ДНК. Первая половина аминокислотной последовательности пальца обычно образует два антипараллельных b-слоя, а вторая половина организована в a-спираль и частично 3–10-спираль. Гидрофобные связи между b-слоями и a-спиралями образуются при участии консервативных остатков Phe и Leu. Факторы взаимодействуют с большой бороздкой ДНК a-спиральными участками полипептидных цепей. Последовательность аминокислот, связывающая пальцы, чаще всего TGEKPI. В классе пять семейств: 1) повсеместно распространенные факторы (TFIIIA, Sp1, YY1; всего пять факторов); 2) регуляторы развития или клеточного цикла (подсемейства: Egr/Krox, Kruppel-подобные факторы, GLI-подобные факторы и прочие факторы; всего 36 факторов); 3) метаболические регуляторы грибов (CE2, CreA; всего шесть факторов); 4) большие факторы с NF-6B-подобными ДНК-связывающими свойствами (HIV-EP1, aA-CRYBP1, AGIE-BP1; всего шесть факторов); 5) регуляторы вирусов (T-Ag). Всего в классе 55 факторов. |
| Класс 2.4: факторы, содержащие кластер из шести остатков Cys, координирующих два иона Zn2+ | Все факторы содержат кластер из шести остатков Cys, координирующих два иона Zn2+. Это означает, что две из шести SH-групп координируют по два иона Zn2+ каждая. Часто встречаются у грибов. В классе одно семейство: метаболические регуляторы грибов (ARG RII, GAL4, UGA3; всего 11 факторов). |
| Класс 2.5: факторы, содержащие домены типа "цинковые пальцы" переменного состава | В классе два семейства: 1) факторы с доменами типа "цинковые пальцы" Cx7Hx8Cx4 (BAF1); 2) факторы с доменами типа "цинковые пальцы" Cx2Hx4Hx4C (Bir3). Всего в классе два фактора. |
| Суперкласс 3: факторы с доменами типа "спираль–поворот–спираль" | |
| Класс 3.1: факторы, содержащие гомеодомены | Все факторы содержат в полипептидных цепях три последовательно расположенных a-спиральных участка. Спираль 3 контактирует преимущественно с большой бороздкой ДНК, однако обнаружены контакты и с малой бороздкой. Пространственное расположение спиралей 2 и 3 напоминает таковое у регуляторов транскрипции прокариот. В классе четыре семейства: 1) факторы, содержащие только гомеодомены (подсемейства: AbdB, Antp, Cad, Cut, Dll, Ems, En, Eve, Prd, HD-ZIP, H2.0, HNF1, Lab, Msh, NK-2, Bcd, XANF, PBS, неопределенное; всего 158 факторов); 2) факторы, содержащие POU-домены (подсемейства: I, II, III, IV, V, VI, другие POU-факторы; всего 58 факторов); 3) факторы, содержащие гомеодомены с LIM-областью (подсемейства: факторы с гомеодоменами, содержащими LIM-область; (ко)факторы с гомеодоменами, содержащими только LIM-область, всего 15 факторов); 4) факторы с гомеодоменами и мотивами типа "цинковые пальцы" (представители: ATBF1, Zfh1; всего четыре фактора). Общее число известных факторов в классе – 235. |
| Класс 3.2: факторы, содержащие парный бокс | Все факторы содержат ДНК-связывающий домен длиной в ~130 аминокислотных остатков. Как правило, его N-концевая половина обогащена основными аминокислотами, а C-концевая половина сильно поляризована. Домен, по-видимому, содержит три a-спиральных участка. В классе два семейства: 1) факторы, содержащие парный бокс и гомеодомен (Prd, Pax-3; всего семь факторов); 2) факторы, содержащие только парный бокс (Pax-1, Pax-2; всего девять факторов). |
| Класс 3.3: факторы, содержащие домены типа "Fork head/winged helix" | Сгруппированы на основании гомологии с факторами транскрипции HNF-3 мышей и Fkh дрозофилы. Домен составлен из ~ 110 аминокислотных остатков, которые компактно организованы в три a-спиральных участка. Третья a-спираль контактирует с большой бороздкой ДНК. Домен образует также несколько контактов с малой бороздкой. Взаимодействие факторов с ДНК приводит к ее изгибу под углом ~13°. В классе три семейства: 1) регуляторы развития (представители: Fkh, Slp1, всего 11 факторов); 2) тканеспецифические регуляторы (представители: HNF-3, SGF-1, всего пять факторов); 3) другие регуляторы (представители: ILF, FKHR, HTLF, всего 26 факторов). |
| Класс 3.4: факторы теплового шока | Взаимодействуют с ДНК, организованной в нуклеосомы, только в присутствии основного фактора транскрипции TBP. В классе одно семейство HSF (девять факторов). |
| Класс 3.5: факторы, содержащие кластеры Trp | Полипептидные цепи факторов содержат кластеры смежных триптофановых остатков. Кластеры разделены участками цепи длиной 12–21 остаток (в семействе Myb 19–21 остаток). В классе три семейства: 1) Myb (Myb и Myb-подобные факторы соответственно 15 и пять факторов); 2) факторы Ets-типа (c-Ets-1, Erg-1; всего 36 факторов); 3) факторы, регулируемые интерфероном (IRF-1, Pip; всего семь факторов). Всего в классе 63 фактора. |
| Класс 3.6: факторы, содержащие TEA-домены | TEA-домен полипептидной цепи, содержит три α-спирали. Между спиралями 1 и 2 расположены 16–18 остатков аминокислот, а между спиралями 2 и 3 – три–восемь остатков, с неупорядоченной пространственной структурой. Установлено, что указанный домен фактора TEF-1 взаимодействует с ДНК и, по крайней мере, еще два участка полипептидной цепи создают контакты фактора с матрицей. В классе одно семейство TEA (представители: TEF-1, Sd, всего четыре фактора). |
| Суперкласс 4: факторы с доменами b-Scaffold, контактирующие с малой бороздкой ДНК Класс 4.1: факторы, содержащие RHR-домен (Rel homology region) | ДНК-связывающий домен Rel-типа содержит два субдомена, каждый из которых организован в два β-цилиндра с пятью петлями, участвующими в контактах с большой бороздкой ДНК. Наибольший вклад в специфичность взаимодействия вносит первая петля N-концевого субдомена, которая сильно консервативна. Участие полипептидных петель в контактах белок–ДНК обеспечивает факторам возможность взаимодействия с разными нуклеотидными последовательностями. Дополнительные взаимодействия осуществляются через α-спиральные участки N-концевых частей факторов, которые образуют прочные контакты с малой бороздкой ДНК. Второй C-концевой домен обеспечивает главным образом димеризацию белков. В классе 3 семейства: 1) Rel/ankyrin-факторы (NF-kB1, RelA; всего 11 факторов); 2) только ankyrin-факторы (IkBa, Bcl-3; всего 8 факторов), 3) NF-AT (6 факторов). Общее число факторов – 25. |
| Класс 4.2: p53 | ДНК-связывающий домен организован в виде β-сэндвича, который является остовом для двух больших петель и мотива типа "петля–слой–спираль". N-Концевые участки трех петель (остатки 112–124) образуют контакты с большой бороздкой ДНК в каноническом сайте связывания, тогда как C-концевая петля (остатки 236–251) связывают малую бороздку в AT-богатом центре сайта связывания. Остаток Arg-248 C-концевой части ДНК-связывающего домена, который чаще всего изменяется под действием мутаций, образует дополнительные контакты с малой бороздкой. Ион Zn2+ связывается остатками Cys-176 и His-179, находящимися в составе мотива "петля–спираль", а также остатками Cys-238 и Cys-242 (в составе С-концевой петли). В классе одно семейство p53 (p53 и p53as). |
| Класс 4.3: факторы, содержащие MADS-бокс | ДНК-сязывающие домены обеспечивают димеризацию факторов. В димере, связанном с ДНК, как это показано для фактора SRF, две амфипатические a-спирали образуют соленоид (coiled coil) и ориентированы вдоль малой бороздки ДНК. Эти спирали формируют контакты с большой и малой бороздками. В месте изгиба ДНК обернута вокруг белка. В центре изгиба малая бороздка сжата, а по бокам большие бороздки растянуты. В классе три семейства: 1) регуляторы дифференцировки (подсемейства: MEF-2A-D, факторы гомеотических генов, регуляторы дрожжей; всего 53 фактора); 2) респондеры внешних сигналов (два представителя: SRF, RLM1); 3) регуляторы метаболизма (один представитель: ARG RI). Общее число факторов – 57. |
| Класс 4.4: факторы, содержащие b-цилиндр (barrel) и a-спиральные участки | В классе одно семейство E2 (E2 и EBNA-1). |
| Класс 4.5: TATA-связывающие белки | Для полипептидов характерны консервативный С-концевой и дивергировавший N-концевой участки. Последний необходим для взаимодействия с промоторами Pol II и Pol III, содержащими TATA-бокс, но не с промоторами Pol I, в которых эта последовательность отсутствует. Может связывать ДНК в виде мономера, сгибая молекулу; входит в состав различных TAF. В классе одно семейство: TBP (с одним представителем TBP). |
| Класс 4.6: HMG-факторы | Белки этого класса обладают гомологией с хромосомными белками, принадлежащими к группе негистоновых белков с высокой электрофоретической подвижностью (HMG). Участок гомологии содержит ДНК-связывающий домен, который в одних случаях, как и у HMG1, обеспечивает белкам неспецифическое взаимодействие с ДНК, а в других (например у фактора LEF-1) – сайт-специфическое. Домен обнаруживает типичную конформацию в форме буквы L с тремя α-спиралями. Третья спираль вместе с N-концевой частью спирали 1 далеко выдвинуты и образуют длинную часть L-образного домена, а C-концевая часть спирали 1 и спираль 2 – короткую. Взаимодействие с малой бороздкой ДНК вызывает резкий (более чем на 90°) ее изгиб в сторону от белка. Общая топология комплекса напоминает таковую комплекса TBP–TATA-бокс. В классе шесть семейств: 1) SOX (SRY, Sox; всего 15 факторов); 2) TCF-1 (всего 12 факторов); 3) HMG2-подобные факторы (SSRP1, Ixr1; всего четыре фактора); 4) UBF (три фактора); 5) MATA (один фактор: mat-Mc); 6) прочие факторы, содержащие HMG-бокс (всего три фактора). Общее число факторов – 38. |
| Класс 4.7: гетеромерные CCAAT-факторы | Включает одно семейство: гетеромерные CCAAT-факторы (CP1A/HAP3, CBF-C/HAP-4). Общее число факторов – шесть. |
| Класс 4.8: Grainyhead | Включает одно семейство Grainyhead. Всего в классе три фактора: CP2, LBP-1a и Grainyhead |
| Класс 4.9: факторы с доменом холодового шока | Обладают протамино-подобным доменом: последовательностью аминокислот с большим суммарным положительным зарядом, содержащей неупорядоченные остатки Pro. Включает одно семейство csd с семью факторами (DbpA–B, FRG, YВ1–3 и др.). |
| Класс 4.10: Runt | Белки этого класса обладают гомологией с характерным участком полипептидной цепи белка Runt дрозофилы. Домен Runt является частью ДНК-связывающего домена этих факторов. Он сформирован в основном β-слоями, которые не содержат α-спиральных участков, и напоминает домен типа пальмовой ветви, обнаруженный у ДНК-полимеразы β крыс. В классе одно семейство: Runt. (PEBP2a, Runt; всего 15 факторов). |
| Суперкласс 0: прочие факторы транскрипции | |
| Класс 0.1: медь-связывающие белки | Медь-зависимый активатор гена металлотионеина (CUP1) у дрожжей. Не содержит доменов типа "цинковые пальцы". В классе одно семейство: регуляторы грибов (всего два фактора: ACE1/CUP2 и AMT1). |
| Класс 0.2: HMGI(Y) | Вспомогательные факторы для других факторов транскрипции, таких как NF-kB или ATF-2. Облегчают их включение в транскрипционный комплекс. В классе одно семейство: HMGI (Y), включающее четыре фактора. |
| Класс 0.3: STAT | Содержат домен, подобный лейциновой застежке, а также ДНК-связывающий домен, определяющий специфичность взаимодействия факторов с ДНК. Содержат домены SH2 и SH3, первый из которых необходим для гомо- и гетеродимеризации факторов, фосфорилированных по остатку Tyr. Опосредуют перенос сигналов фосфорилирования к генам, индуцируемым интерфероном. В классе одно семейство: STAT, включающее восемь факторов. |
| Класс 0.4: факторы, содержащие домен Pocket | В классе два семейства: 1) Rb (Rb – продукт антионкогена ретинобластомы и p107); 2) CBP (один представитель). |
| Класс 0.5: E1A-подобные факторы | В классе одно семейство: E1A (два представителя). |
| Класс 0.6: AP2/EREBP-подобные факторы | В классе три семейства: AP2 (четыре фактора); EREBP (ABI4, EBP, ERF1, TINI, всего 14 представителей); AP2/B3 (RAV1 и RAV2). |
Ниже будут подробнее рассмотрены особенности структуры некоторых наиболее часто встречающихся структурно-функциональных доменов факторов транскрипции и механизмы их регуляторного действия на транскрипцию генов.
Факторы транскрипции в роли позитивных регуляторов (активаторов) синтеза РНК. Изучение механизмов функционирования белковых факторов транскрипции – задача непростая. Прежде всего, это связано с их малой концентрацией в клетках и большими сложностями получения факторов в очищенном состоянии для дальнейших биохимических исследований. Развитие генно-инженерных методов позволило получать факторы транскрипции в неограниченных количествах, что не замедлило принести плоды в виде новой информации (подробнее о методах клонирования генов см. в главе 7).
Для того чтобы фактор транскрипции оказал специфическое действие на синтез РНК определенным геном, он, прежде всего, должен распознать этот ген и связаться с определенной последовательностью ДНК. Затем фактор транскрипции должен взаимодействовать с другими факторами или непосредственно с самой РНК-полимеразой для стимуляции или подавления транскрипции на этом гене. Кроме того, необходимость включения и выключения транскрипции в строго определенных месте и времени (тканеспецифический характер экспрессии генов на разных стадиях онтогенеза организма) предполагает наличие механизмов контроля биосинтеза или активации самих факторов транскрипции для упорядочивания их функционирования. Ниже будут рассмотрены механизмы, обеспечивающие эти три этапа функционирования факторов транскрипции – связывание с ДНК, влияние на процесс транскрипции и регуляция их собственной активности.
Механизмы взаимодействия факторов транскрипции с ДНК. Клонирование генов факторов транскрипции (и их фрагментов), а также выделение соответствующих рекомбинантных белков позволили идентифицировать участки их полипептидных цепей, обеспечивающие специфическое взаимодействие факторов с ДНК. Очищенные фрагменты белков были исследованы на способность взаимодействовать с определенными последовательностями ДНК. Это позволило обнаружить несколько структурных элементов (доменов) полипептидных цепей, общих для факторов транскрипции разных типов, которые легли в основу их современной классификации.
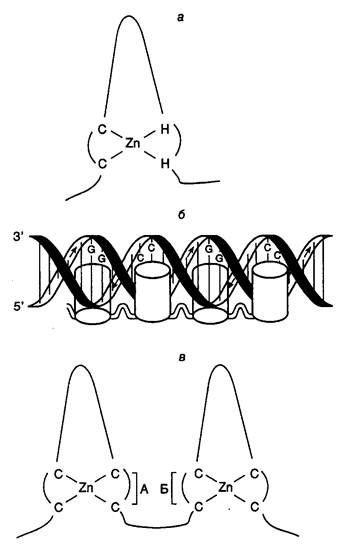
Рис. I.24. Особенности структуры полипептидных доменов типа "цинковые пальцы" и их взаимодействие с ДНК
а – схема строения домена, содержащего Zn-связывающие остатки Cys (C) и Hys (H); б – предполагаемый механизм взаимодействия доменов типа "цинковые пальцы", изображенных в виде цилиндров, с ДНК. Стрелки указывают полярность цепей ДНК 5’®3’; в – схема строения доменов типа "цинковые пальцы", содержащих только Zn-связывающие остатки Cys. Квадратными скобками отмечены участки полипептидных цепей, участвующие в распознавании палиндромных последовательностей ДНК (А и Б)
Домены типа "цинковые пальцы". Одним из первых факторов транскрипции, полученных в виде очищенного рекомбинантного белка, был фактор TFIIIA, который играет ключевую роль в транскрипции генов 5S рРНК РНК-полимеразой III. ДНК-связывающий участок полипептидной цепи этого фактора содержит девять 30-звенных повторов: Tyr/Phe-Xaa-Cys-Xaa-Cys-Xaa2,4-Cys-Xaa3-Phe-Xaa5-Leu-Xaa2-His-Xaa3,4-His-Xaa5, где Xaa – остаток любой аминокислоты. Таким образом, каждый из повторов содержит две строго консервативные пары остатков Cys и His, которые взаимодействуют с одним ионом цинка. Это приводит к образованию в свернутой полипептидной цепи пространственной структуры, сформированной консервативными остатками Phe, Leu и несколькими остатками основных аминокислот. Структура выступает над поверхностью белковой глобулы в виде "пальца" (рис. I.24,а). Вершины пальцев непосредственно контактируют с большой бороздкой ДНК, причем соседние пальцеобразные структуры связываются противоположными сторонами спирали ДНК (см. рис. I.24,б).
Домены типа "цинковые пальцы" обнаружены у многих факторов транскрипции, обеспечивающих функционирование РНК-полимеразы II, в том числе у фактора Sp1, Kruppel-белка Drosophila, белков ADRI и GAL4 дрожжей и белка аденовируса E1A. Интересно, что точковая мутация в гене Kruppel-белка, приводящая к замене лишь одного из остатков Cys на Ser, что, в свою очередь, предотвращает связывание иона Zn2+, фенотипически проявляется как делеция целого гена этого фактора. На данном основании был сделан вывод о том, что способность связывать ионы Zn2+ является критической для проявления ДНК-связывающей активности факторов такого типа.
Аналогичные домены обнаружены в полипептидных цепях семейства рецепторов тиреоидных или стероидных гормонов, которые в комплексе с гормонами после переноса в ядра специфически взаимодействуют с определенными последовательностями ДНК, изменяя уровни транскрипции соответствующих генов-мишеней. Однако в этом случае ДНК-связывающие участки состоят из двух пальцев, каждый из которых содержит четыре остатка Cys, взаимодействующие с ионом Zn2+, вместо двух Cys и двух His (см. рис. I.24,в); у них также отсутствуют консервативные остатки Phe и Leu. Кроме того, элемент из двух цинковых пальцев встречается в полипептидных цепях таких рецепторов только один раз, тогда как в генах, кодирующих цинковые пальцы с Cys–His, подобный элемент может повторяться от 2 до 37 раз.
Исследование мест связывания различных рецепторов стероидных гормонов с ДНК показало, что они взаимодействуют с гомологичными, но не идентичными регуляторными последовательностями нуклеотидов (подчеркнуты):
| Глюкокортикоиды/прогестерон | GGTACANNNTGTTCT |
| Эстрогены | AGGTCANNNTGACCT |
| Тиреоидные гормоны/ретиноевая кислота | TCAGGTCA---TGACCTGA, |
где N – любые нуклеотиды, --- – отсутствие нуклеотидов.
Методами направленного мутагенеза установлено, что специфичность взаимодействия этих рецепторов со своими последовательностями определяется небольшим числом аминокислотных остатков. Так, замена всего лишь двух аминокислотных остатков в N-концевой части цинкового пальца рецептора глюкокортикоидов на аминокислотные остатки, обнаруживаемые в том же самом участке рецептора эстрогенов, приводит к тому, что мутантный рецептор начинает взаимодействовать с регуляторными последовательностями, узнаваемыми рецепторами эстрогенов, и активировать гены, контролируемые этими последовательностями. Аналогичные замены пяти аминокислотных остатков во втором пальце рецептора эстрогенов также приводят к изменению его специфичности: он приобретает способность взаимодействовать с регуляторной последовательностью тиреоидных гормонов. Как уже упоминалось выше, оба рецептора узнают одни и те же последовательности нуклеотидов, различающиеся лишь расстояниями между ними. При этом первый цинковый палец играет ключевую роль в узнавании последовательности как таковой, а второй определяет оптимальное для взаимодействия расстояние между двумя половинками этой последовательности.
Факторы транскрипции, содержащие мотив "спираль–поворот–спираль".Другой тип пептидных доменов, специфически распознающих регуляторные последовательности на ДНК, характерен для белковых продуктов гомеотических (гомеозисных) генов, впервые обнаруженных у дрозофилы. Гомеотические гены позвоночных и растений играют ключевую роль в их морфогенезе. Полипептидные цепи белков, кодируемых этими генами, содержат высококонсервативную последовательность длиной в 60 аминокислотных остатков, называемую гомеобоксом, или гомеодоменом, которая определяет специфичность взаимодействия белков с регуляторными последовательностями ДНК. Анализ третичной структуры гомеодоменов показал, что они образуют структуру типа "спираль–поворот–спираль" (helix–turn–helix), в которой за a-спиральным участком следует b-структура с последующим еще одним a-спиральным участком (рис. I.25,а). Наличие этой пространственной структуры, существование которой было впервые предсказано на основании гомологии с соответствующими аминокислотными последовательностями бактериальных белков-репрессоров, в настоящее время строго доказано методами ЯМР-спектроскопии, в частности для гомеодомена продукта гена Antennapedia дрозофилы.
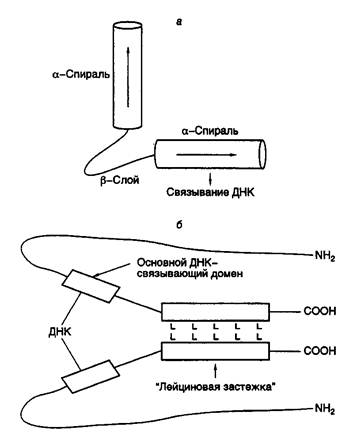
Рис. I.25. Структуры полипептидных доменов типа "спираль–поворот–спираль" (а) и "лейциновая застежка" (б)
L – остатки Leu
Для бактериальных белков-репрессоров было показано, что при образовании специфических комплексов с ДНК первый a-спиральный участок расположен перпендикулярно большой бороздке ДНК, тогда как второй частично находится в ней и обеспечивает специфические контакты репрессора с операторным участком ДНК. Ключевая роль второго a-спирального участка гомеодомена при изучении специфичности взаимодействия этих белков с ДНК была определена с помощью мутаций. Так, замена только одного остатка Ser в положении 9 a-спирали белка Prd на Gln, присутствующий в гомеозисном белке Ftz, приводит к связыванию белка Prd с Ftz-сайтами на ДНК.
Позднее была обнаружена большая группа регуляторных белков, в которых гомеобоксы формируют лишь одну часть более протяженного консервативного домена, названного POU-доменом. Эти белки, к которым относятся, в частности, октамерсвязывающие белки (octamer binding proteins) Oct-1 и Oct-2, белок гипофиза Pit-1 и продукт гена unc-86 нематод, используют POU-домены для специфического взаимодействия с ДНК. Относительный вклад аминокислотной последовательности гомеобокса и негомебоксной POU-последовательности в специфичность связывания белок-ДНК не одинаков для разных белков. Так, в белке Pit-1 специфичность в основном достигается за счет гомеодомена, тогда как в белке Oct-1 основную роль играет другая последовательность POU-домена.
ДНК-связывающий домен типа "лейциновая застежка". Сравнение аминокислотных последовательностей ряда других факторов транскрипции: фактора транскрипции печени C/EBP, дрожжевого фактора GCN4, а также белков-продуктов протоонкогенов Myc, Fos и Jun (протоонкогены – это гены, мутации в которых могут приводить к злокачественному перерождению клеток), позволило выявить еще одну консервативную аминокислотную последовательность, образующую пространственную структуру, названную "лейциновой застежкой" (leucine zipper). В этой структуре остатки Leu, находящиеся в составе a-спирального участка полипептидных цепей факторов, расположены через каждые шесть аминокислотных остатков на равном расстоянии друг от друга и оказываются на одной стороне a-спирали через каждые два витка (см. рис. I.25,б). Такие домены сами по себе не связываются с ДНК, однако обеспечивают димеризацию содержащих их факторов путем взаимопроникновения лейциновых a-спиралей двух молекул факторов. В результате в димере появляются две правильно расположенные друг относительно друга полипептидные цепи, составленные преимущественно из основных аминокислотных остатков, которые и образуют ДНК-связывающий центр фактора транскрипции.
Димеры белков Fos и Jun связываются с Ap-1-последовательностями ДНК, что сопровождается активацией соответствующих генов в ответ на воздействие форболовыми эфирами. Однако если белок Jun связывается с Ap-1-последовательностями нуклеотидов в виде гомодимера (белкового комплекса, состоящего из двух идентичных полипептидных цепей), то белок Fos специфически взаимодействует с ДНК только после образования комплекса (гетеродимера) с белком Jun. Эти свойства двух белков являются следствием различий в структуре их лейциновых доменов, которые не позволяют образовываться гомодимеру из полипептидных цепей Fos. Искусственная замена лейцинового домена Fos на соответствующий домен белка Jun обеспечивает условия для получения гомодимера из таких химерных полипептидных цепей. Необходимость образования димера этих двух регуляторных белков перед взаимодействием с ДНК создает дополнительную возможность воздействия на экспрессию соответствующих генов путем контроля над формированием самого белкового комплекса фактора транскрипции.
Основной ДНК-связывающий домен, впервые обнаруженный у белков, содержащих "лейциновую застежку", позднее был найден и у ряда других белков, регулирующих транскрипцию, в частности у двух белков E12 и E47, которые взаимодействуют с энхансерами иммуноглобулиновых генов, у регуляторного белка мышц MyoD1 и у некоторых белков дрозофилы. Однако в этих случаях основной домен расположен по соседству с участком полипептидной цепи, образующим домен типа "спираль–поворот–спираль", в котором две амфипатические спирали (содержащие все заряженные аминокислотные остатки на одной стороне спирали) разделены неспирализованной петлей. Предполагают, что такой домен играет ту же роль в димеризации полипептидных цепей и формировании ДНК-связывающего центра, что и описанные выше регуляторные полипептиды, содержащие лейциновые домены.
Следует еще раз подчеркнуть, что структуры типа "лейциновая застежка" и "спираль–поворот–спираль" необходимы для димеризации полипептидных цепей транскрипционных факторов, принадлежащих к данной группе, что сопровождается формированием основного ДНК-связывающего участка регуляторных белков. Белок протоонкогена myc содержит как лейциновый домен, так и домен типа "спираль–поворот–спираль" по соседству с основным ДНК-связывающим доменом. В соответствии с этим все данное семейство регуляторных белков можно разделить на подсемейства, в которых полипептидные цепи факторов транскрипции содержат порознь или одновременно домены типа "лейциновая застежка" или "спираль–поворот–спираль".
Таковы особенности структуры некоторых наиболее хорошо изученных доменов факторов транскрипции, обеспечивающих специфичность взаимодействия последних с регуляторными последовательностями ДНК, что необходимо для их регуляторного воздействия на транскрипцию соответствующих генов. Количество известных доменов у факторов транскрипции быстро возрастает с развитием исследований в этой области. Так, новые ДНК-связывающие участки полипептидных цепей недавно обнаружены у фактора транскрипции AP2, факторов, обеспечивающих регуляторное действие сыворотки, белков CTF/NTF, взаимодействующих с CAAT-боксом, факторов транскрипции дрожжей HAP-2 и HAP-3. В белках существует несколько структур, обеспечивающих специфическое распознавание определенных последовательностей ДНК, что позволяет осуществлять передачу регуляторных сигналов к определенным генам-мишеням и служит основой для обеспечения их дифференциальной экспрессии на уровне транскрипции. Данные о некоторых наиболее важных с функциональной точки зрения доменах факторов транскрипции суммированы в табл. I.14.
Несмотря на то что специфическое связывание с ДНК является обязательным этапом для регуляторного воздействия белковых факторов на транскрипцию, реализация активности факторов часто требует их специфического взаимодействия с другими регуляторными белками, а также с самой РНК-полимеразой II. Большинство таких воздействий приводит к активации транскрипции. Однако результатом некоторых из них может быть и репрессия синтеза мРНК. Ниже будут рассмотрены условия, необходимые для осуществления позитивного действия факторов транскрипции.
Для идентификации участков полипептидных цепей факторов транскрипции, непосредственно участвующих в активации синтеза РНК, чаще всего конструируют химерные рекомбинантные белки (некоторые из них кратко описаны выше), объединяющие в одной цепи ДНК-связывающий домен и участки полипептидных цепей других факторов, и изучают влияние таких гибридных факторов на транскрипцию in vitro. В ходе исследований, основанных на подобных подходах, были идентифицированы функциональные домены факторов транскрипции, в том числе домены, участвующие в активации транскрипции, которые, как правило, отличаются от ДНК-связывающих участков их полипептидных цепей. Доменную структуру факторов транскрипции можно проиллюстрировать на примере семейства рецепторов стероидных/тиреоидных гормонов (рис. I.26). В полипептидной цепи таких факторов четко видны три функциональных модуля: ДНК-
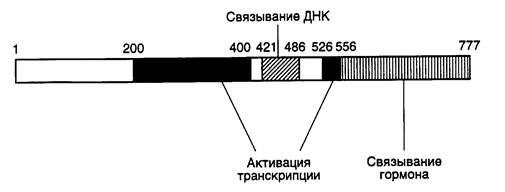
Рис. I.26. Доменная структура полипептидной цепи рецептора глюкокортикоидов
Цифрами указаны номера аминокислотных остатков на границах функциональных доменов, участвующих в активации транскрипции, связывании ДНК и гормона
Таблица I.14
Функциональные домены факторов транскрипции
Таблица I.13 (окончание) Домен Функция Факторы,… связывающий домен, домен, участвующий в связывании гормона, а также домены, необходимые для активации транскрипции. В…Рис. I.27. Роль структуры типа амфипатической a-спирали в составе полипептидной цепи рекомбинантного фактора транскрипции GAL4
Транскрипция активируется за счет полипептидного домена, содержащего амфипатическую a-спираль (а), и не активируется, когда в той же самой аминокислотной последовательности отрицательно заряженные боковые группы распределены случайным образом (б)
Во многих случаях регулируемая экспрессия генов факторов транскрипции достигается путем соответствующего управления транскрипцией генов этих факторов. В частности, в клетках HeLa отсутствует не только белок Oct-2, но и его мРНК. Точно так же транскрипция гена фактора C/EBP происходит только в ядрах клеток печени. Очевидно, что такой способ контроля транскрипции у эукариот не решает полностью проблему регуляции экспрессии генов, поскольку предполагает необходимость наличия регуляторных генов, влияющих на транскрипцию генов факторов транскрипции, регулируемая экспрессия которых, в свою очередь, требует новых факторов, и так далее до бесконечности. В этой связи не является неожиданным, что регуляция экспрессии генов многих факторов транскрипции происходит на посттранскрипционном уровне. Например, возрастание уровня биосинтеза дрожжевого фактора GCN4, активирующего гены биосинтеза аминокислот, является следствием ускорения трансляции его мРНК рибосомами в ответ на недостаток внутриклеточного содержания аминокислот.
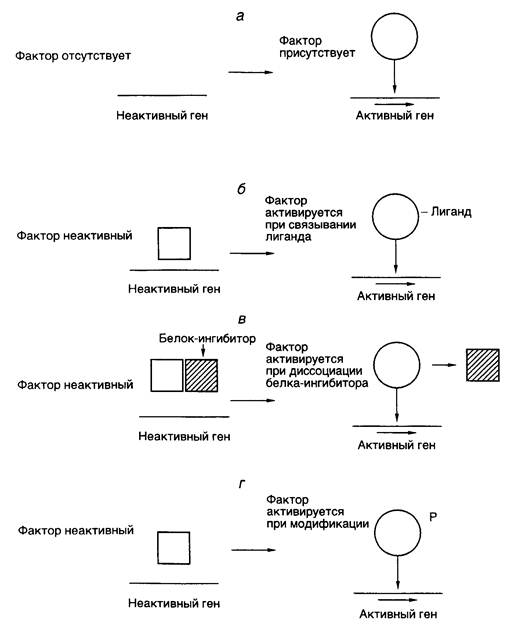
Рис. I.28. Способы регуляции активности факторов транскрипции у эукариот (а–г)
Регуляция экспрессии генов факторов транскрипции может происходить и на уровне сплайсинга соответствующих РНК. В частности, существуют две формы рецептора тиреоидных гормонов, образующиеся в результате альтернативного сплайсинга. У одной из них отсутствует домен, связывающий гормон, и она способна распознавать те же последовательности ДНК, что и гормонсвязывающий рецептор, однако не может активировать транскрипцию в присутствии гормона. Таким образом, эта форма действует как доминантный репрессор соответствующих генов. Подобный механизм описан также и для онкогена v-erbA вируса эритробластоза птиц, кодирующего укороченную форму рецептора тиреоидных гормонов, у которой отсутствует домен, связывающий гормон.
Регуляция активности факторов транскрипции. Белковые продукты генов многих специфически действующих факторов транскрипции часто присутствуют во всех тканях, однако специфический характер их воздействия достигается путем их посттрансляционной активации в строго определенном месте или же в ответ на соответствующий сигнал. Простым примером такого рода является активация дрожжевого фактора транскрипции ACE1, который стимулирует транскрипцию гена металлотионеина в присутствии ионов меди. В этом случае ионы Cu2+, взаимодействуя с фактором, вызывают конформационные изменения в его полипептидной цепи, после чего фактор приобретает способность связываться с регуляторным участком гена металлотионеина и активировать его транскрипцию (см. рис. I.28,б).
Аналогичную зависимость от активирующего лиганда демонстрируют молекулы факторов транскрипции, принадлежащие к семейству рецепторов стероидных/тиреоидных гормонов (см. рис. I.26). Молекулы таких рецепторов для осуществления активирующего действия на гены-мишени должны вначале специфически связать эквимолярные количества соответствующего гормона-эффектора. Как уже упоминалось, эти рецепторы обладают специальным С-концевым доменом, выполняющим данную функцию. Несмотря на то что in vivo такие рецепторы приобретают способность взаимодействовать с регуляторными последовательностями ДНК только в присутствии гормона, in vitro они связываются специфическими последовательностями ДНК как при наличии гормона, так и без него. Оказалось, что в клетках рецепторы находятся в комплексе с белком, предотвращающим их связывание соответствующими регуляторными последовательностями ДНК, и гормоны после взаимодействия с рецепторами в этих комплексах вызывают диссоциацию последних (см. рис. I.28,в).
Следовательно, в рассмотренном выше случае активация факторов транскрипции происходит не в результате конформационного изменения их пространственной структуры под действием лигандов, а путем лигандзависимого разрушения ингибирующего белок–белкового взаимодействия. Подобный механизм активации продемонстрирован для белкового фактора GAL4 в ответ на действие галактозы, а также белка NFkB под воздействием форболовых эфиров в Т-лимфоцитах или клетках HeLa. Более того, аналогичный механизм обеспечивает активацию транскрипции генов в определенных тканях. Так, фактор транскрипции MyoD1 играет ключевую роль в активации экспрессии генов, происходящей в тканях мышц во время дифференцировки миобластов в мышечные волокна (миотубы). Такая активация наблюдается не из-за увеличения содержания MyoD1 в дифференцирующихся клетках, а как следствие уменьшения содержания белка-ингибитора Id, образующего комплекс с MyoD1 и препятствующего его взаимодействию с регуляторными последовательностями ДНК. Интересно, что ингибитор Id, как и сам MyoD1, содержит мотив "спираль–поворот–спираль", который опосредует димеризацию соответствующих белков. Однако в составе Id-белка отсутствует основный ДНК-связывающий домен, функционирование которого обсуждалось выше. Предполагается, что Id димеризуется с MyoD1, подавляя его способность взаимодействовать с ДНК, по аналогии с тем, как это происходит в опытах с укороченными белками MyoD1, не содержащими ДНК-связывающий домен.
Активация факторов транскрипции может осуществляться не только путем изменения белок–белковых взаимодействий, но и под действием ковалентных модификаций самих факторов в ответ на появление специфических сигналов (см. рис. I.28,г). Примером может служить механизм активации фактора транскрипции CREB, который обеспечивает активацию некоторых клеточных генов в ответ на воздействие циклическим АМР. О подобных механизмах речь уже шла в разделе о вторичных мессенджерах. В этом случае сАМР стимулирует протеинкиназу А, которая, в свою очередь, фосфорилирует CREB, что сопровождается активацией домена, расположенного в полипептидной цепи фактора по соседству с сайтом фосфорилирования. Тот же механизм функционирует при активации фактора транскрипции генов теплового шока дрожжей в ответ на повышение температуры, а также при активации фактора NKkB под действием форболовых эфиров. В последнем случае фосфорилирование белка-ингибитора, находящегося в комплексе с белком NKkB, приводит к диссоциации комплекса, что допускает последующее связывание NKkB с регуляторными последовательностями ДНК, сопровождаемое активацией транскрипции соответствующих генов. Фосфорилирование не является единственной модификацией, приводящей к активации факторов транскрипции. Аналогичный эффект достигается и при гликозилировании некоторых белков.
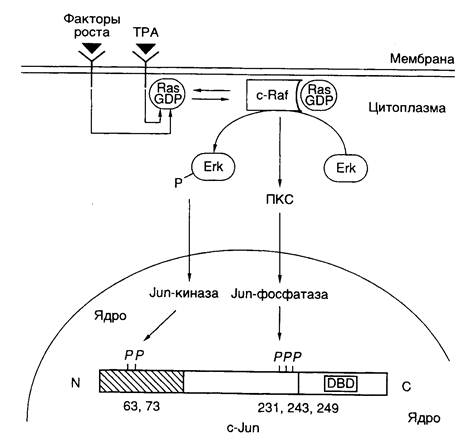
Рис. I.29. Схема регуляции активности фактора транскрипции c-Jun
ПKC – протеинкиназа С, DBD – ДНК-связывающий домен; 12-O-тетрадеканоилфорбол-13-ацетат. Цифрами обозначены номера остатков аминокислот в полипептидной цепи c-Jun, подвергающихся регуляторному фосфорилированию/дефосфорилированию. Заштрихован N-концевой домен, участвующий в активации транскрипции
В заключение рассмотрим несколько подробнее механизм регуляции активности факторов транскрипции класса 1.1 (факторы с доменами типа "лейциновая застежка"), которые, как уже упоминалось, относятся к Bzip-белкам, так как содержат основной домен (B – basic) и домен типа "лейциновая застежка". Данный пример поучителен потому, что приоткрывает завесу над некоторыми молекулярными механизмами канцерогенеза, поскольку многие белковые компоненты этой системы регуляции (Src, Ras, Raf, Jun, Sis, Fos) являются продуктами экспрессии протоонкогенов.
Как уже упоминалось выше, семейство AP-1-подобных факторов транскрипции, предсуществующих в клетках в латентной форме, активируется классическим промотором химического канцерогенеза – 12-О-тетрадеканоилфорбол-13-ацетатом (TPA), а также различными пептидными гормонами, факторами роста, цитокинами и нейромедиаторами. Одновременно происходит индукция транскрипции генов c-fos, уровень экспрессии которых в нестимулированных клетках низок. Латентная форма фактора c-Jun фосфорилирована вблизи C-концевого ДНК-связывающего домена и слабо фосфорилирована в N-концевом активирующем домене. Как следует из упрощенной схемы, представленной на рис. I.29, эта последовательность реакций инициируется после взаимодействия с рецепторами на поверхности клетки соответствующих лигандов – цитокинов или факторов роста. Под действием протеинкиназ Src или PTK гуанозинтрифосфатаза Ras связывает молекулу GTP и переходит в активную конформацию, что позволяет эффекторному участку полипептидной цепи белка взаимодействовать с N-концевым доменом c-Raf. Процесс сопровождается переносом последнего к цитоплазматической мембране, его активацией и запуском каскада реакций, осуществляемых протеинкиназами, активируемыми митогенами (MAP), к которым относятся белки Erk-1 и Erk-2. Активность MAP-киназ зависит от фосфорилирования их полипептидных цепей по остаткам Thr и Ser киназой MAP-киназ (MAPKK), которая сама активизируется в результате фосфорилирования ее полипептидной цепи. Белок c-Raf в этом каскаде реакций выполняет роль такой MAPKK. Активированные Erk-1 и Erk-2 далее транслоцируются в ядро, где инициируют Jun-киназу, которая фосфорилирует фактор транскрипции c-Jun в N-концевом домене. Одновременно с участием протеинкиназы C происходит активация Jun-фосфатазы, которая дефосфорилирует полипептидную цепь c-Jun вблизи ее C-концевого домена. В результате реакций фосфорилирования и дефосфорилирования полипептидной цепи c-Jun этот фактор транскрипции приобретает способность взаимодействовать с регуляторными последовательностями генов, называемых TPA-респонсивными элементами, и далее активирует транскрипцию соответствующих генов.
Рассмотрение механизмов позитивного контроля транскрипции продолжим на примере механизмов функционирования регуляторных последовательностей нуклеотидов высших организмов – энхансеров – специфических регуляторных последовательностей, обеспечивающих высокий уровень транскрипции определенных генов после взаимодействия с регуляторными белками.
Энхансеры. Энхансерами называют определенный класс регуляторных последовательностей нуклеотидов, которые обладают рядом существенных особенностей, резко отличающих их от других регуляторных последовательностей эукариот, регулирующих транскрипцию. Энхансеры представляют собой протяженные последовательности нуклеотидов, которые содержат сайты связывания нескольких факторов транскрипции. Характерными свойствами энхансера являются его способность осуществлять регуляторное действие на промотор на больших расстояниях от него, достигающих 60 т.п.о. и более, независимость его активности от ориентации по отношению к промоторам, а также от расположения относительно регулируемого гена.
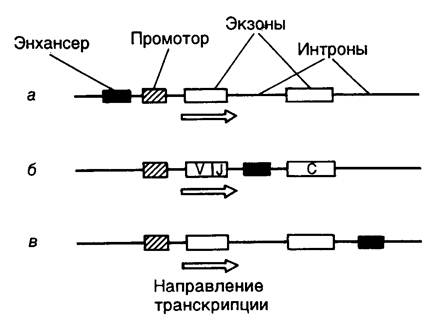
Рис. I.30. Варианты взаимного расположения регуляторных и структурных частей генов эукариот
Регуляторные части генов представлены энхансером и промотором, структурные части – экзонами и интронами. а – ген альбумина, энхансер располагается перед промотором; б – ген иммуноглобулина, энхансер расположен в центре гена между последовательностями, кодирующими константную и вариабельную части белка; в – ген b-глобина, энхансер расположен вслед за кодирующей частью гена
На рис. I.30 приведены схемы строения нескольких эукариотических генов, которые отражают взаимное расположение их структурных и регуляторных частей. Если у гена альбумина (см. рис. I.30,а) энхансер находится перед промотором, а вся регуляторная часть предшествует его структурной части, то в случае генов иммуноглобулинов регуляторные элементы локализованы в интронах самого гена (см. рис. I.30,б). Энхансер может быть расположен и ниже гена на значительном от него расстоянии, как это имеет место у b-глобинового гена (см. рис. I.30,в).
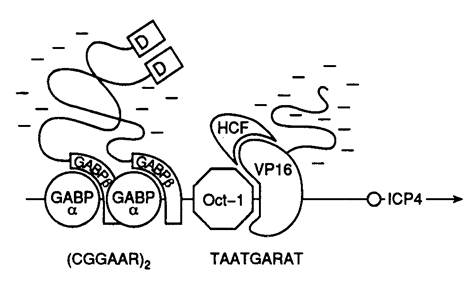
Рис. I.31. Схема белок-белковых и белково-нуклеиновых взаимодействий на энхансерах непосредственно-ранних генов ВПГ
D – домены димеризации соответствующих факторов,
Отмечены отрицательно заряженные "кислые" участки их полипептидных цепей, непосредственно участвующие в активации транскрипции гена ICP4, направление транскрипции которого обозначено стрелкой
Исследование молекулярных взаимодействий факторов транскрипции с энхансерами привело к пониманию того, что такие регуляторные последовательности являются своеобразными матрицами для сборки сложных белковых комплексов, структура которых обеспечивает высокоспецифические белок-белковые связывания и передачу регуляторных сигналов РНК-полимеразе II, находящейся в составе инициационного комплекса. Как и в большинстве других случаев, основной прогресс в изучении молекулярных механизмов регуляции экспрессии генов с помощью энхансеров у эукариот был достигнут с использованием вирусов животных в качестве объектов исследования. У вируса простого герпеса (ВПГ) был обнаружен транскрипционный фактор VP16, участвующий в активации его непосредственно-ранних генов и присутствующий в зрелом вирионе в количестве ~1000 копий. Белок VP16 взаимодействует с энхансерами, расположенными перед каждым из непосредственно-ранних генов вируса, что приводит к активации их транскрипции. Детальное изучение регуляторных участков этих генов показало, что каждый из энхансеров содержит одну или несколько копий цис-регуляторных последовательностей - нонануклеотидную последовательность 5’-TAATGARAT-3’ (так называемая tat-garat) и прямые повторы гексануклеотидной последовательности 5’-CGGAAR-3’ ("cigar"). В очищенном состоянии белок VP16 не взаимодействует ни с одной из них. Однако в присутствии белковых факторов экстрактов ядер клеток-хозяев VP16 входит в состав многокомпонентного белкового комплекса, формирующегося на последовательности "tat-garat" (рис. I.31). Сходство последовательностей нуклеотидов мотива "tat-garat" и сайтов связывания Oct-белков, ранее обнаруженных в регуляторных последовательностях генов гистонов и иммуноглобулинов, заставило проверить эти белки на способность взаимодействовать с ВПГ-энхансерами. Было выяснено, что Oct-1 является вторым белковым компонентом, соединяющимся с "tat-garat"-последовательностью энхансера и облегчающим связывание с ним белка VP16.
Эффективное образование вышеупомянутого белкового комплекса требует участия других компонентов клетки-хозяина, поскольку очищенные белки Oct-1, VP16 и последовательность "tat-garat" формируют стабильный комплекс только в присутствии экстрактов ядер клеток HeLa. Белковый фактор, названный HCF, может непосредственно взаимодействовать с VP16 в отсутствие других компонентов комплекса. С помощью мутационного анализа было установлено, что 5’-концевой сегмент "tat-garat" (последовательность "tat") необходим для связывания белка Oct-1, тогда как ее 3’-концевая последовательность ("garat") требуется для образования полного белкового комплекса Oct-1-VP16-HCF. Таким образом, по крайней мере, четыре молекулярных поверхности (интерфейса) участвуют в формировании функционально активного комплекса на матричной поверхности мотива "tat-garat" энхансеров непосредственно-ранних генов ВПГ. Одна группа контактов образуется между белками Oct-1 и VP16, вторая – между VP16 и HCF, третья – между Oct-1 и последовательностью "tat" и, наконец, четвертая – между VP16 и последовательностью "garat" (см. рис. I.31).
Не менее сложная серия молекулярных интерфейсов участвует и в формировании функционального макромолекулярного комплекса на мотиве "cigar" энхансера непосредственно-ранних генов ВПГ. Белок, взаимодействующий с этим мотивом, выделен из экстрактов ядер печени крыс и получил название GABP (GA-binding protein). Он состоит из двух разных субъединиц – GABPa и GABPb. Белковые комплексы, похожие на GABP, выделены и из культивируемых клеток человека. Часть аминокислотной последовательности GABPa оказалась гомологичной участку ДНК-связывающего домена транскрипционных факторов, принадлежащих к семейству ETS. Все представители этого семейства обладают последовательностью из 85 аминокислотных остатков, которая необходима для их специфического взаимодействия с ДНК. Таким образом, ETS-домен белка GABPa образует первый молекулярный интерфейс, обеспечивающий связывание белка с мотивом "cigar" энхансера.
В смеси с GABPb a-субъединица образует белковый комплекс, который обладает бòльшим сродством к мотиву "cigar" энхансера, чем сама a-субъединица. Анализ особенностей взаимодействия GABP-комплекса с энхансером позволил обнаружить три высокоспецифичных молекулярных интерфейса. Это прежде всего домен полипептида GABPa, необходимый для его взаимодействия с белком GABPb и включающий ETS-домен, а также последовательность из 35 С-концевых аминокислотных остатков GAPBa. У полипептидной цепи GABPb во взаимодействии с GABPa принимают участие четыре тандемных повтора, состоящие из 33 аминокислотных остатков каждый и расположенные в N-концевой части белка. Анализ аминокислотных последовательностей, гомологичных этому повтору у ряда других известных белков, позволил выявить высококонсервативную последовательность TPLH, из-за которой данный мотив и получил свое название. Дополнительные молекулярные взаимодействия между белковым комплексом и последовательностью нуклеотидов "cigar" осуществляются через повторы TPLH после того, как они образуют требуемый комплекс с GABPa. При этом аминокислотные последовательности повторов непосредственно контактируют с ДНК. Наконец, в последнем из известных контактов, имеющих место после сборки белкового комплекса на последовательности нуклеотидов "cigar", участвует так называемый домен димеризации полипептидной цепи GABPb, расположенный вблизи ее С-конца. Очищенные субъединицы GABPb в растворе ассоциируют с образованием гомодимеров, которые в присутствии субъединиц GABPa формируют гетеродимерный комплекс a2b2, хорошо приспособленный для взаимодействия с гексануклеотидным повтором "cigar" (CGGAAR)2 энхансера.
Анализируя все вышеперечисленные компоненты энхансеров непосредственно-ранних генов ВПГ, можно сделать вывод, что в их активации принимают участие не менее пяти белков (VP16, Oct-1, HCF, GABPa и GABPb), которые участвуют, как минимум, в пяти белок-белковых контактах и шести специфических контактах белок–ДНК (см. рис. I.31). Прежде всего, обращает на себя внимание кооперативность взаимодействия компонентов, активирующих энхансеры. Ключевые белки этого комплекса - Oct-1, VP-16 и GABPa сами по себе слабо взаимодействуют со специфическими последовательностями ДНК, но обладают способностью собираться в стабильный функционально активный комплекс, по крайней мере, двумя путями: во-первых, объединяясь с кофакторами, которые самостоятельно не способны взаимодействовать с ДНК (например VP16 с HCF и GABPa с GABPb); во-вторых, контактируя с последовательностью нуклеотидов энхансера, содержащей функциональные участки "tat" и "garat", а также повтор "cigar" и образующей матрицу для геометрически правильной сборки всего активирующего комплекса.
При исследовании механизмов действия многочисленных факторов транскрипции удивляет то, что специфичность взаимодействия с ДНК многих белков этих подсемейств, по крайней мере, определенная in vitro, невысока. В очищенном состоянии факторы часто узнают одни и те же последовательности нуклеотидов. Каким же образом данные белки осуществляют специфические регуляторные воздействия на регулируемые гены? Как уже было видно при обсуждении функционирования энхансеров непосредственно-ранних генов ВПГ, такую специфичность обеспечивают другие, вспомогательные белки, взаимодействующие с основными регуляторными белками. В частности, несмотря на сходство в специфичности распознавания последовательностей нуклеотидов, истинные регуляторные белки обладают бòльшим сродством к последовательностям-мишеням, еще более усиливающимся под влиянием белок-белковых взаимодействий. Недавно было показано, что белок GABPb не связывается с другими белками, обладающими ETS-доменами, и, следовательно, лишь один белок из этого семейства, а именно GABPa, образуя комплекс с GABPb, обеспечивает специфичность взаимодействия последнего с энхансером.
Рассмотренный нами пример регуляции экспрессии непосредственно-ранних генов ВПГ хорошо иллюстрирует те многочисленные белок-белковые и белково-нуклеиновые взаимодействия, которые требуются для функционирования сложной системы дифференциально экспрессирующихся генов высших организмов. Несмотря на то что с развитием молекулярной генетики число известных регуляторных механизмов будет увеличиваться, именно этот принцип, основанный на возможности специфических взаимодействий макромолекул друг с другом, по-видимому, останется доминирующим в регуляторных механизмах эукариот.
Коактиваторы транскрипции. Энхансеры обнаруживают одну из специфических черт регуляции транскрипции у эукариот: влияние на синтез РНК регуляторных последовательностей нуклеотидов, расположенных на больших расстояниях от инициаторной последовательности промоторов. Еще недавно совершенно непонятный механизм этого явления стал проясняться с открытием специфических регуляторных белков – коактиваторов транскрипции. Коактиваторы транскрипции были впервые обнаружены у дрожжей при исследовании одного из основных факторов транскрипции TFIID, который необходим для полноценной инициации транскрипции РНК-полимеразой II. Было установлено, что один из основных компонентов TFIID – TATA-связывающий белок TBP способен обеспечивать базальную, но не индуцированную транскрипцию in vitro. На основании этого было высказано предположение, что он дополнительно должен содержать TBP-ассоциированные факторы (TAF), которые отличаются от основных факторов и активаторов транскрипции. После клонирования генов TAF-факторов и очистки кодируемых этими генами белков выяснилось, что TAF-белки обеспечивают физическое взаимодействие между активаторами транскрипции и основными факторами, поскольку они обладают способностью связывать белки обеих групп. Те же функции присущи и упомянутым выше SRB-белкам дрожжей. Таким образом, коактиваторы транскрипции являются белками-адаптерами, обеспечивающими перенос регуляторного сигнала от тканеспецифических белков-активаторов транскрипции к РНК-полимеразе II.
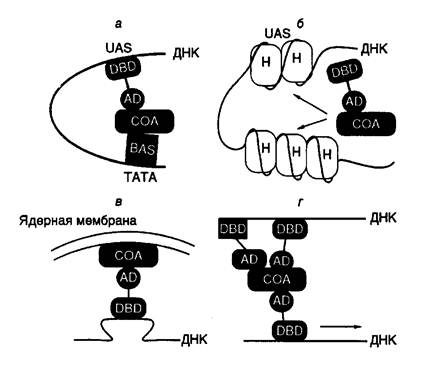
Рис. I.32. Гипотетические модели механизма действия коактиваторов транскрипции
а – передача сигнала от активаторов транскрипции, взаимодействующих с дистальными регуляторными последовательностями нуклеотидов промоторов (UAS); б – разрушение нуклеосомной структуры в регуляторных последовательностях промоторов; в – поддержание определенной пространственной структуры транскрибируемых участков хроматина; г – обеспечение трансвекции
AD и DBD – активирующий и ДНК-связывающий домены активатора транскрипции соответственно; COA – коактиватор транскрипции; BAS – основные факторы транскрипции; H – гистоны
На рис. I.32 суммированы современные представления о механизмах действия коактиваторов транскрипции. Во всех четырех моделях подчеркивается адаптерная (медиаторная) функция этих белков, которые выступают в роли посредников между другими регуляторными белками. Прежде всего, акцентируется их роль в передаче сигнала от белков-активаторов транскрипции, реагирующих с дистальными регуляторными последовательностями промоторов (UAS – upstream activation sites), к основным факторам транскрипции и РНК-полимеразе II (см. рис. I.32,а). В этом случае коактиваторы транскрипции могут усиливать взаимодействие основных факторов транскрипции с инициаторными последовательностями промотора. Имеются экспериментальные данные, указывающие на то, что другая функциональная роль коактиваторов транскрипции заключается в дерепрессии промоторов, доступ к которым для основных факторов транскрипции блокирован гистонами, входящими в состав нуклеосом (см. рис. I.32,б). В этом случае коактиваторы транскрипции могут участвовать в разрушении структуры хроматина в окрестностях промоторов. После удаления гистонов или изменения структуры нуклеосом регуляторные последовательности становятся доступными для основных факторов транскрипции и РНК-полимеразы II. Коактиваторы транскрипции могут играть определенную роль и в создании топологии транскрибируемых участков хроматина в интерфазных ядрах (см. рис. I.32,в). В этом случае коактиваторы удерживают активно транскрибируемые участки хроматина в тех микрокомпартментах интерфазных ядер, которые обеспечивают эффективную экспрессию генов. Такая роль коактиваторов отчетливо проявляется в функционировании инсуляторов и сайленсеров (см. ниже, а также раздел 3.2.3). И, наконец, последняя модель (см. рис. I.32,г) объясняет механизм явлений, аналогичных процессу трансвекции, впервые описанному у дрозофилы. Сущность этого явления заключается в том, что взаимодействие двух различных мутантных аллелей одного гена, присутствующих на разных гомологичных хромосомах, приводит к функциональной компенсации мутаций и усилению экспрессии соответствующего гена, т.е. трансвекция является одной из разновидностей генетической комплементации. Трансвекция происходит, когда, например энхансер гена, структурная часть которого инактивирована мутацией, активирует транскрипцию другого аллеля этого гена с поврежденным мутацией энхансером, находящегося на гомологичной хромосоме. В таком случае трансхромосомная активация транскрипции обеспечивается действием белков-коактиваторов транскрипции, с участием которых происходит передача регуляторного сигнала от активатора транскрипции, ассоциированного с энхансером одной хромосомы, к основным факторам транскрипции гомологичного аллеля этого гена другой хромосомы. Белки-коактиваторы обеспечивают и синапсис (конъюгацию, объединение) гомологичных хромосом на протяженном участке.
Наличие у эукариот регуляторных белков-коактиваторов транскрипции объясняет одну из сторон механизма действия энхансеров, расположенных дистально по отношению к точке инициации транскрипции. В соответствии с этой концепцией дистальные и проксимальные регуляторные элементы промотора, сближенные в результате образования петли, разделяющей их ДНК, удерживаются вместе коактиваторами транскрипции. Однако остается необъясненной еще одна сторона механизма действия энхансеров. Действительно, энхансеры как регуляторные последовательности нуклеотидов обладают рядом уникальных свойств. Их стимулирующее действие на промоторы регулируемых генов не зависит от ориентации, а также положения по отношению к гену и проявляется даже в том случае, если энхансеры удалены от генов-мишеней на значительное (несколько десятков тысяч пар оснований) расстояние. Последнее обстоятельство кажется наиболее загадочным, так как непонятно, каким образом удается избежать активации промоторов гетерологичных генов, которые могут быть расположены в пределах досягаемости действия этих энхансеров. Как оказалось, специфичность действия энхансеров обеспечивается еще одним весьма своеобразным механизмом регуляции экспрессии генов у высших организмов, в котором участвуют специфические регуляторные последовательности нуклеотидов – так называемые пограничные последовательности, или инсуляторы (раздел 3.2.4).
Механизмы негативной регуляции транскрипции
Задержка транспорта факторов транскрипции из цитоплазмы в ядра. Подавление определенных генов может достигаться за счет задержки в цитоплазме… Все IkB-белки содержат один и тот же участок, гомологичный структурному белку… Активация факторов транскрипции из пула неактивных цитоплазматических комплексов обеспечивает быструю индукцию…Структура хроматина как специфический регулятор экспрессии генов
Регуляция тканеспецифической экспрессии генов с использованием энхансеров и сайленсеров, а также некоторых других негативных регуляторных процессов часто происходит по механизмам, принципиально отличающимся от ранее рассмотренных. Речь идет о регуляторных эффектах, реализующихся через изменение структуры хроматина.
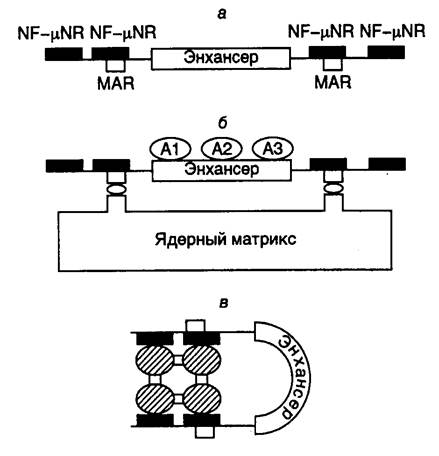
Рис. I.33. Модель негативной регуляции активности интронного энхансера гена тяжелой цепи иммуноглобулина мышей
а – структура фрагмента ДНК в окрестностях энхансера. Обозначены сайты связывания фактора NF-mNR, а также MAR-последовательности; б – активное состояние энхансера, при котором MAR-последовательности ассоциированы с ядерным матриксом, а сам энхансер взаимодействует с активаторами А; в – неактивное состояние энхансера, при котором тетрамер фактора NF-mNR предотвращает взаимодействие MAR-последовательностей с ядерным матриксом и изменяет пространственную структуру энхансера
Интронный энхансер гена тяжелой цепи иммуноглобулина содержит много сайтов связывания для различных тканеспецифических, а также других широко распространенных факторов транскрипции. Максимальная активность энхансера наблюдается в зрелых B-лимфоцитах, где ген претерпевает ряд соматических перестроек. Активность этого энхансера обнаруживается и в некоторых нелимфоидных тканях. Однако в печени или фетальных фибробластах, а также в нескольких других тканях его активность полностью подавлена. Исследования с использованием сайт-специфического мутагенеза показали, что такой энхансер фланкирован негативными регуляторными последовательностями нуклеотидов, которые ингибируют его активность в незрелых B-клетках или клетках других типов, но не обладают аналогичными свойствами в зрелых B-лимфоцитах (рис. I.33,а). Оба этих регуляторных элемента требуются для проявления ингибирующей активности, для которой важно также их положение относительно энхансера. В регуляторных элементах обнаружены сайты связывания транскрипционного фактора NF-mNR, содержание которого особенно велико в клетках, где активность энхансера подавлена. Поскольку фактор NF-mNR способен образовывать тетрамеры, предполагается, что прямое взаимодействие между этими молекулами, ассоциированными с сайтами связывания, фланкирующими энхансер, может приводить к структурной перестройке сегмента ДНК, заключенного между такими сайтами и содержащего энхансер (см. рис. I.33,б,в). Кроме того, регуляторные последовательности, связывающие NF-mNR, содержат MAR-сайты, взаимодействующие с ядерным матриксом, и последовательности, с которыми контактирует ДНК-топоизомераза II, что еще раз указывает на необходимость структурных перестроек ДНК в процессе изменения ее регуляторных функций.
В рассматриваемом случае механизм негативной регуляции активности энхансера можно представить в следующем виде. В клетках, где отсутствует фактор транскрипции NF-mNR (зрелые B-лимфоциты), последовательности MAR, которые фланкируют энхансер, ассоциированы с ядерным матриксом, что сопровождается формированием пространственной структуры энхансера, открытой для взаимодействия с активаторами транскрипции (см. рис. I.33,б). Это приводит к эффективной транскрипции всего гена иммуноглобулина. В клетках же, где фактор NF-mNR присутствует в больших количествах, фрагмент ДНК с энхансером не ассоциирован с ядерным матриксом, так как MAR-сайты блокированы фактором (см. рис. I.33,в). Энхансер приобретает закрытую для позитивных регуляторных факторов конформацию, что сопровождается подавлением транскрипции регулируемого им гена. Рассмотренный пример иллюстрирует один из частных случаев изменения пространственной структуры ДНК и хроматина, а также уровня транскрибируемости ДНК под действием коротких последовательностей нуклеотидов, фланкирующих регулируемый генетический локус. Подобный принцип широко используется для регуляции экспрессии генов у эукариот. Другие примеры этого впечатляющего явления в обобщенном виде будут рассмотрены ниже.
Эффект положения и концепция пограничных последовательностей: инсуляторы. Давно известно, что перенос гена или группы генов в гетерохроматиновые (неактивные в отношении транскрипции) участки хромосом часто сопровождается ослаблением или прекращением его экспрессии (так называемый эффект положения), и, наоборот, некоторые гены после переноса сохраняют свою активность и в гетерохроматиновом окружении. Подавление экспрессии таких транслоцированных генов может быть полным при стабильном эффекте положения и варьировать в зависимости от типа соматических клеток, в которых находится хромосома с транслокациями. Поскольку в последнем случае в организме образуются клоны соматических клеток, с разной эффективностью экспрессирующих транслоцированные гены (вплоть до полного подавления их транскрипции), такой эффект положения называют эффектом положения мозаичного типа (position effect variegation – PEV). Дальнейшее подтверждение существования эффекта положения получено с развитием методов трансгеноза – введения чужеродных рекомбинантных генов в геном клеток зародышевой линии высших организмов.
Исследование этого явления привело к открытию так называемых пограничных последовательностей нуклеотидов (boundaries), фланкирующих функционально активные домены хроматина. Оказалось, что существуют определенные последовательности нуклеотидов длиной в несколько сотен пар оснований, которые обладают способностью подавлять позитивное и негативное влияние эухроматина и гетерохроматина на экспрессию трансгенов, интегрированных в этот хроматин и фланкированных указанными последовательностями в новом сайте интеграции. Фактически такие участки ДНК как бы изолируют ген, находящийся между ними, способствуя сохранению его обычной пространственной структуры, которая может отличаться от структуры окружающего хроматина. Эти последовательности известны кроме того под названием инсуляторов (англ. insulate – изолировать), а также как регуляторные области локусов (locus control regions – LCR). К таким пограничным последовательностям относятся, например A-элементы, фланкирующие ген лизоцима цыплят, scs-элементы (specialized chromatin structure elements), окружающие ген hsp70 Drosophila melanogaster, а также последовательности нуклеотидов, разделяющие регуляторные элементы iab комплекса Bithorax того же объекта. Введение одного из таких элементов между энхансером и промотором регулируемого гена приводит к функциональной изоляции энхансера и подавлению экспрессии гена, а фланкирование гена пограничными последовательностями предохраняет его от инактивирующего действия окружающего конденсированного гетерохроматина, т.е. снимает эффект положения. При подавлении активности энхансеров инсуляторами ярко проявляется еще одно их свойство – полярность действия. Инсуляторы однонаправленно выключают энхансеры, расположенные дистально (на значительном расстоянии) по отношении к регулируемому промотору, но не рядом с ним (подробнее см. ниже). В дополнение к этим функциональным свойствам инсуляторов показано, что они могут разделять два участка хроматина, резко различающиеся по пространственной структуре. В этом случае по одной стороне от пограничной последовательности располагается сильно компактизованный хроматин, ДНК которого недоступна действию нуклеаз, а по другой – хроматин в открытой конформации, характерной для компетентных в отношении транскрипции генов.
Способность последовательностей нуклеотидов ДНК выполнять функции инсуляторов обычно определяют в функциональных генетических тестах по их способности обеспечивать экспрессию генов, искусственно интегрированных в хромосому (трансгенов), независимо от локализации сайта интеграции. В качестве гена-репортера при определении активности инсуляторов часто используют ген white дрозофилы, поскольку изменение уровня его экспрессии сопровождается легко измеряемым изменением окраски глаз у трансгенных мух, которая может меняться от красного, свойственного организмам дикого типа, до желтого и, наконец, белого, встречающегося у так называемых нуль-мутантов, для которых характерно полное подавление экспрессии мутантного гена. В такого рода исследованиях была обнаружена высокая эволюционная консервативность инсуляторов и регуляторных белков, взаимодействующих с ними. В частности, LCR-последовательности b-глобинового гена цыплят эффективно функционируют в этой системе в качестве инсуляторов. Одной из наиболее хорошо изученных последовательностей нуклеотидов, обладающей свойствами инсулятора, является транскрибируемый нетранслируемый участок ДНК ретротранспозона gypsy у дрозофилы, содержащий сайты связывания белка-супрессора Hairy-wing (su(Hw)), свойства которого будут подробнее рассмотрены ниже.
До настоящего времени окончательно не разрешен вопрос о способности MAR/SAR-последовательностей, разделяющих функциональные домены хроматина, выполнять функции пограничных последовательностей. Хотя показано, что некоторые SAR-последовательности не способны подавлять эффект положения, для других аналогичных последовательностей такая способность была продемонстрирована. Например, свойствами инсуляторов обладают соответствующие последовательности уже упомянутого выше гена тяжелой цепи иммуноглобулина, а также генов лизоцима цыплят, b-интерферона и аполипопротеина B человека. В последнем случае сайты прикрепления ДНК к ядерным мембранам расположены за 5 т.п.о перед точкой инициации транскрипции и на 43 т.п.о. ниже этой точки, на границах между конденсированной и открытой формами хроматина. Последовательности, располагающиеся в этих участках хроматина, обладают повышенной чувствительностью к ДНКазе I и обеспечивают правильную экспрессию интегрированного в хромосомы гена-репортера в клетках-трансфектантах гепатомы, вызывая 200-кратную стимуляцию его транскрипции, не зависимую от локализации места интеграции. Все это указывает на то, что данные 3’- и 5’-концевые MAR APOB-локуса человека обладают всеми свойствами пограничных последовательностей. Функционирование SAR-последовательностей в качестве инсуляторов в ряде случаев не является конститутивным, но зависит от типа клеток и стадии развития организма. Например, SAR-последовательности гена b-интерферона человека, фланкирующие мышиный ген теплового шока HSP70.1, функционируют как инсуляторы в клетках эмбрионов мышей на стадии предимплантации, но не в дифференцирующихся тканях новорожденных и взрослых трансгенных мышей. На такого рода наблюдениях основано заключение, что топологические домены хромосом, выделяемые MAR/SAR-последовательностями, не являются статическими образованиями, но могут изменяться в процессе индивидуального развития организма, что, в свою очередь, сопровождается изменением характера экспрессии больших блоков генов в дифференцирующихся клетках.
Структурно-функциональный анализ инсуляторов в вышеупомянутой системе с геном white показал, что последовательности участков инсуляторов, гиперчувствительных к ДНКазе I, необходимы для их функционирования, тогда как центральная А/T-богатая область, устойчивая к действию нуклеазы, для этого не требуется. Удаление части последовательностей из гиперчувствительных сайтов сопровождается понижением активности инсуляторов, тогда как простое увеличение числа копий последовательностей восстанавливает их активность. На этом основании делается вывод, что активность пограничных последовательностей может обеспечиваться определенным критическим количеством молекул связавшихся с ними белков, неспецифичных в отношении типа инсулятора, которые могут действовать на энхансеры либо непосредственно, либо через изменение структуры хроматина.
Природа белкового компонента, взаимодействующего с пограничными последовательностями, была определена в случае типичного инсулятора: scs’-последовательности гена теплового шока дрозофилы. Из ядер культивируемых клеток был выделен белок BEAF-32 (boundary element associated factor) с молекулярной массой 32 кДа, который взаимодействует с палиндромной последовательностью, фланкирующей два гиперчувствительных к ДНКазе участка в scs’. С помощью иммунохимических методов локализовали множественные высокоспецифические места связывания BEAF-32 на политенных хромосомах с одной из сторон пуффов, образующихся на определенных стадиях развития личинок мух, что подчеркивает двухкомпонентный состав последовательностей нуклеотидов инсуляторов. Хотя белки, связывающиеся с противоположной частью этой пограничной последовательности, еще не идентифицированы, предполагают, что белки двух частей инсулятора взаимодействуют друг с другом. Полагают также, что такого рода связывание белков, ассоциированных с различными инсуляторами, может быть одним из необходимых условий формирования большого числа разнообразных функционально активных доменов хромосом, что, в свою очередь, может обеспечивать специфическую экспрессию заключенных в них генов на разных стадиях онтогенетического развития организма.
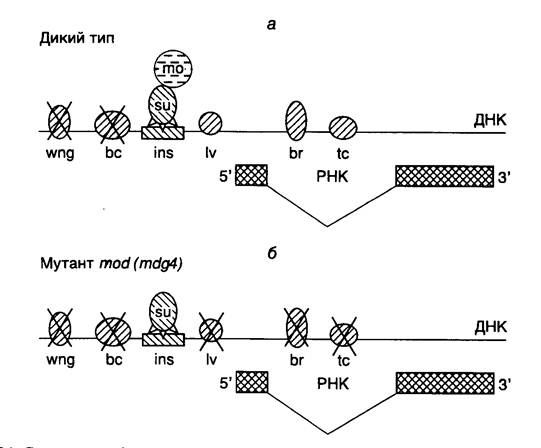
Рис. I.34. Структура и функционирование инсулятора ретротранспозона gypsy дрозофилы
а – последовательность инсулятора (ins), представленная 12 копиями сайта связывания белка su(Hw) (su), взаимодействующего с белком mod(mdg4) (mo). Комплекс этих белков, связанных с инсулятором, однонаправленно подавляет активность энхансеров (перечеркнутые заштрихованные эллипсы) гена yellow в соответствующих тканях; б – инактивация белка mod(mdg4) под действием мутации разрушает белковый комплекс su–mo, и подавление транскрипции под действием инсулятора становится неспецифическим (двунаправленным).
Обозначения тканей дрозофилы: wng – крылья, bc – катикула тела, lv – ткани личинки, tc – тарзальные коготки, br – щетинки
Вышеупомянутый инсулятор ретротранспозона gypsy содержит 12 сайтов связывания белка su(Hw). Коровая последовательность этих сайтов гомологична октамерной последовательности, обнаруженной в различных энхансерах и промоторах позвоночных. Эта последовательность фланкирована AT-богатыми участками, которые способствуют изгибанию молекулы ДНК, требуемому для правильных ДНК-белковых взаимодействий в этом участке генома. Полипептидная цепь белка su(Hw) содержит 12 доменов типа "цинковые пальцы", необходимых для его связывания с ДНК и функционирования инсулятора. Кроме того, белок su(Hw) обладает двумя кислыми доменами, локализованными вблизи его С-конца, которые обеспечивают его взаимодействие с энхансерами и нужны для подавления эффекта положения. Абсолютно необходимым для функционирования инсуляторов является и a-спиральный участок полипептидной цепи этого белка, гомологичный второму спиральному участку (helix-coiled coil) основных факторов транскрипции группы HLH-bzip, содержащему домен типа "лейциновая застежка". Поскольку такой домен обычно требуется для осуществления белок-белковых взаимодействий, полагают, что для функционирования этого инсулятора кроме белка su(Hw) необходимы и другие белки.
С помощью классического генетического анализа был идентифицирован второй компонент инсулятора su(Hw). Мутации в гене modifier of mdg4 (mod(mdg4)) ингибировали полярное действие инсулятора на энхансеры (рис. I.34,а) и усиливали мозаичный эффект положения для генов, транслоцированных в гетерохроматин. У таких мутантов действие инсулятора на подавление активности энхансеров было двунаправленным и не зависело от расстояния между энхансерами и промотором (см. рис. I.34,б). Ген mod(mdg4) кодирует, по крайней мере, три белка, которые возникают в результате альтернативного сплайсинга и содержат BTB-домен, характерный для многих факторов транскрипции, например уже упоминаемого GAGA-фактора, осуществляющего свое действие через изменение структуры хроматина. Полагают, что двунаправленное подавление функций энхансеров инсулятором gypsy в отсутствие функционально активного белка mod(mdg4) являются следствием гетерохроматизации последовательностей, окружающих инсулятор. В этой связи подавление активности энхансеров у мутантов mod(mdg4) может происходить из-за изменений в нуклеосомной структуре данных участков ДНК. Поскольку для развития эффекта требуется наличие нативных доменов типа "лейциновая застежка" и кислых доменов белка su(Hw), предполагают, что процесс гетерохроматизации ДНК в отсутствие функционального белка mod(mdg4) является следствием взаимодействия белка su(Hw) с другими белками. Ингибирующее действие инсулятора ретротранспозона gypsy может распространяться на энхансеры, находящиеся по отношению к нему в транс-положении, т.е. на гомологичной хромосоме.
Дальнейшим указанием на то, что действие пограничных последовательностей на соответствующие гены осуществляется через изменение структуры хроматина, было получено при исследовании их влияния на дозовую компенсацию у дрозофилы. Для экспрессии генов, расположенных на X-хромосоме самцов и самок этого организма, характерен одинаковый уровень, хотя содержание (доза) таких генов у самок в два раза выше, чем у самцов. Это равновесие достигается за счет механизма, повышающего вдвое скорость транскрипции сцепленных с X-хромосомой генов у самцов и получившего название дозовой компенсации. На X-хромосоме самцов происходит сборка мультимерных белковых комплексов (так называемых летальных комплексов), которые изменяют нуклеосомную структуру хромосомы за счет ацетилирования остатков Lys-16 гистона H4. Способность к дозовой компенсации полностью отсутствует у локусов X-хромосомы, перенесенных на аутосомы, т.е. последние подавляют этот эффект. Однако если трансген фланкирован пограничными последовательностями ретротранспозона gypsy, то у 90% трансгенов, интегрированных в аутосомы, происходит правильная дозовая компенсация. Механизм этого явления пока непонятен. Предполагают, что изменение структуры хроматина в трансгене под действием инсуляторов делает возможным сборку на нем летального комплекса или может препятствовать доступу деацетилаз к гистонам нуклеосом.
Результаты исследований белков BEAF-32, su(Hw) и mod(mdg4) указывают на то, что инсуляторы и пограничные последовательности формируют мультибелковые комплексы, регулирующие экспрессию генов через изменение структуры соседнего с ними хроматина. Такие изменения конформации хроматина могут оказывать влияние на взаимодействия между энхансерами и промоторами генов, не изменяя функциональной активности энхансеров как таковых. При этом изменения структуры хроматина, вызываемые инсуляторами, не препятствуют элонгации РНК РНК-полимеразами.
В настоящее время идентифицированы и другие хромосомные белки, обеспечивающие инактивацию генов через конденсацию хроматина, которые, кроме того, необходимы для поддержания хроматина и целых хромосом в конденсированном неактивном состоянии. К таким белкам, в частности, относится белок гетерохроматина 1 (HP-1) дрозофилы, ассоциированный с b-гетерохроматином. Мутации в гене, кодирующем белок HP-1, являются супрессорными, подавляющими мозаичный эффект положения (PEV). В то же время дупликация этого локуса усиливает PEV, что указывает на зависимость упаковки гетерохроматина, инактивирующей гены, от внутриклеточной концентрации белка HP-1. Для такого белка характерна высокая эволюционная консервативность, и его гомологи обнаружены у мышей, человека и растений. Использование переходов конденсации–деконденсации хроматина для регуляции экспрессии как отдельных генов, так и их громадных массивов, по-видимому, является прерогативой эукариот. Еще одним ярким примером такого рода служит инактивация одной из X-хромосом самок млекопитающих в раннем эмбриогенезе.
Инактивация X-хромосом. Поскольку соматические клетки самок млекопитающих содержат две половые X-хромосомы, а самцов – только одну, у самок возникает необходимость в компенсации двойной дозы генов, сцепленных с этими хромосомами. Такая проблема решается путем инактивации одной из X-хромосом, являющейся следствием перевода ее хроматина в высококонденсированное состояние с подавленной транскрипцией. Хотя в большинстве случаев в разных клетках одного и того же животного случайным образом инактивируется или материнская, или отцовская X-хромосома, имеются специальные случаи, когда во всех клетках только отцовская хромосома становится транскрипционно неактивной. Последний случай, получивший название "импринтный тип инактивации X-хромосомы", характерен для сумчатых животных и обнаружен в некоторых клетках эмбрионов мышей. (Более подробно о генетическом импринтинге см. раздел 3.2.5.)
Лучше всего молекулярные механизмы инактивации X-хромосомы изучены у человека, мышей и сумчатых животных. В ранних эмбрионах мышей и человека обе X-хромосомы активны. У мышей инактивация X-хромосомы впервые обнаруживается в ранних эмбрионах на стадии бластоцисты, когда для всех внеэмбриональных клеток характерен импринтный тип инактивации только отцовских X-хромосом. Позднее, через 6 дней эмбрионального развития во всех клетках зародыша материнские и отцовские X-хромосомы инактивируются случайным образом. Неактивное состояние хромосом высокостабильно, и их реактивация (повторная активация) имеет место лишь у самок в клетках зародышевой линии. В клетках зародышевой линии самцов единственная X-хромосома инактивируется в раннем сперматогенезе.
Свойства инактивированных X-хромосом. Все инактивированные X-хромосомы обладают некоторыми общими свойствами. Их ДНК реплицируется в поздней S-фазе клеточного цикла, а в интерфазе они присутствуют в высококонденсированном состоянии в виде так называемых телец полового хроматина (sex chromatin bodies). Все это происходит на фоне низкого уровня ацетилирования гистонов и появления нового гистона macro H2A1, что указывает на возможные изменения структуры нуклеосом. В эмбриональных соматических клетках (но не в клетках зародышевой линии) плацентарных млекопитающих метилированы CpG-островки генов инактивированной X-хромосомы, в отличие от CpG-островков остальной части генома. Неметилированными остаются и CpG-островки инактивированных X-хромосом сумчатых животных. Большая часть вышеперечисленных свойств инактивированных X-хромосом присуща и обычному гетерохроматину. Поэтому процесс инактивации рассматривают как гетерохроматизацию X-хромосом.
У редко встречающихся индивидуумов с ненормальным числом X-хромосом – X0, XX, XXY и т.п. независимо от их числа – по-прежнему инактивированной остается только одна половая хромосома. В отличие от этого, в клетках триплоидных организмов, содержащих по три набора хромосом, инактивируется или одна, или две X-хромосомы, а у тетраплоидов – две. Такого рода данные указывают на существование механизма, поддерживающего в активном состоянии одну X-хромосому на каждые два набора аутосом. Таким образом, перед инактивацией в эмбриональных клетках происходит определение числа наборов аутосом, выбор X-хромосом, остающихся активными, и инициация инактивации остальных X-хромосом.
Инициация инактивации X-хромосом. Процесс инактивации X-хромосом начинается на определенном участке, получившем название центра инактивации X-хромосомы (X-inactivation center). В этом участке был картирован ген Xist (X inactive specific transcript), который впоследствии был клонирован. Сегменты X-хромосомы, у которых центр инактивации удален в результате делеций или транслокаций, не подвергаются инактивации. С помощью генного нокаута Xist было установлено, что для инактивации X-хромосом требуется его транскрипция. Введение гена Xist с помощью трансгеноза в аутосомы было достаточным для инициации инактивации последних.
Ген Xist как основной регулятор инактивации X-хромосом.С помощью генного нокаута удалось показать, что за определение внутриклеточного числа X-хромосом (counting) и инициацию их инактивации отвечают разные участки гена Xist. 5'-Концевая часть гена необходима для инициации инактивации, а его 3'-концевая зона участвует в счете хромосом, в результате которого определяется, какая хромосома остается активной. X-Хромосомы с поврежденной 3'-концевой частью гена Xist всегда инактивируются. В этой серии экспериментов было также установлено, что ген Xist требуется как для случайной инактивации хромосом, так и для инактивации импринтного типа, однако его участие, возможно, не требуется для инактивации X-хромосом в мужских зародышевых клетках. В связи с тем, что на активных X-хромосомах ген Xist сильно метилирован, полагают, что его метилированное состояние сопровождается репрессией гена, препятствующей инактивации X-хромосом.
Удивительным свойством гена Xist является то, что он не кодирует белки. В результате экспрессии гена образуется большая РНК, длина которой составляет 15–17 т.о. После окончания синтеза РНК остается в ядре, а в клетках, где X-хромосома уже инактивирована, эта РНК создает "оболочку" вокруг неактивной хромосомы. В недифференцированных эмбриональных стволовых клетках, где обе X-хромосомы активны, зоны экспрессии гена Xist выявляются с помощью гибридизации in situ в виде отдельной точки на каждой хромосоме на фоне общего низкого содержания Xist-РНК. Во время дифференцировки клеток зона содержания Xist-РНК расширяется вдоль будущей неактивной хромосомы на фоне увеличения ее количества. Одновременно резко уменьшается уровень экспрессии гена Xist на хромосоме, остающейся активной.
Повышение внутриклеточного уровня Xist-РНК происходит не за счет стимуляции транскрипции гена, но вследствие стабилизации самих молекул РНК. При этом стабильная и нестабильная РНК транскрибируются с разных промоторов одного и того же гена. И стабилизация, и хромосомная локализация Xist-РНК являются необходимыми, но не достаточными условиями инактивации X-хромосомы. В ранних эмбрионах мышей на стадии предимплантации отцовские X-хромосомы покрыты оболочкой Xist-РНК, однако остаются в активном состоянии. Это указывает на участие дополнительных факторов в эмбриональной инактивации X-хромосом, которые отсутствуют в клетках ранних эмбрионов.
Установление и поддержание неактивного состояния X-хромосом. Механизм распространения зоны неактивного хроматина вдоль X-хромосом от центра инактивации пока остается непонятным. В аутосомах, содержащих транслоцированный центр инактивации или интегрированный трансген Xist, инактивация распространяется в обе стороны на многие миллионы пар оснований. Однако в этом случае гетерохроматизация хроматина происходит менее эффективно и по-разному на индивидуальных хромосомах. При этом некоторые гены аутосом остаются в активном состоянии. Полагают, что для X-хромосом характерно наличие специфических последовательностей, необходимых для их эффективной гетерохроматизации при инактивации, которые отсутствуют в аутосомах.
Некоторые гены инактивированных X-хромосом продолжают функционировать. Часть из них имеет гомологов на Y-хромосоме и поэтому не требует дозовой компенсации. В ряде случаев их активированное состояние является следствием реактивации предварительно инактивированного хроматина. Однако для большинства таких генов механизм поддержания в активном состоянии на фоне молчащего генетического окружения остается неизвестным.
Ген Xist транскрибируется в клетках всех женских особей в присутствии метилированных CpG-островков генов инактивированных X-хромосом. В культивируемых клетках деметилирующие агенты вызывают частичную реактивацию молчащих генов на этих хромосомах. Не исключено, что кроме этих механизмов инактивированное состояние X-хромосом поддерживает и поздняя репликация их ДНК. У сумчатых животных имеет место поздняя репликация, однако не наблюдается дифференциального метилирования CpG-островков, и у них инактивированное состояние X-хромосом менее стабильно, чем у плацентарных млекопитающих. В последнем случае даже прекращение транскрипции гена Xist не сопровождается реактивацией молчащих X-хромосом, однако на фоне слабого метилирования такая реактивация иногда происходит. Таким образом, поддержание инактивированного состояния X-хромосомы является сложным многоуровневым процессом.
Импринтная инактивация только отцовских X-хромосом рассматривается как эволюционно более примитивная форма дозовой компенсации у животных. Действительно, в этом случае повышается вероятность вредного воздействия на организм мутантных материнских генов, локализованных на X-хромосоме. Такая вероятность должна быть меньше при случайной инактивации в разных клетках отцовских и материнских хромосом. Наличие молекулярных механизмов, регулирующих экспрессию генов через дозовую компенсацию, позволило высказать предположение, что эволюционный обмен генами между аутосомами и половыми хромосомами является вредным для биологического вида, так как может приводить к регуляторному дисбалансу экспрессии транслоцированных генов. Был сформулирован так называемый закон Оно, в соответствии с которым гены, сцепленные с X-хромосомой у одного вида млекопитающих, должны оставаться сцепленными с X-хромосомой и у всех остальных.
Аналогично тому, что было показано на примере X-хромосомы сумчатых млекопитающих, при делении во время митоза дочерние клетки могут наследовать от родительских не только прямую генетическую информацию в виде новой копии всех генов, но и определенный уровень их активности (в данном примере – активное или неактивное состояния). Такой тип наследования генетической информации получил название эпигенетического наследования. Современная эпигенетика изучает наследуемые особенности (паттерны) экспрессии генов, вызываемые потенциально обратимыми изменениями структуры хроматина и(или) метилирования ДНК, не сопровождаемые изменениями ее первичной структуры.
Импринтинг
Метилирование ДНК в регуляции транскрипции
Большинство прокариотических Мтаз способны метилировать ДНК de novo, распознавая неметилированные палиндромные гексануклеотидные последовательности.… "Поддерживающие" Мтазы животных обладают небольшой способностью… Метилирование остатков цитозина оказывает влияние на структурные характеристики ДНК. Это проявляется в облегчении…Факторы транскрипции позвоночных, на активность которых оказывает влияние метилирование остатков цитозина в узнаваемых ими регуляторных последовательностях нуклеотидов
| Фактор транскрипции | Узнаваемая последовательность |
| AP-2 | CCCGCCGGCG |
| AP-2 | CTCCGGGG(C/T)TG |
| Ah-рецептор | TTGCGTG |
| CREB/ATF | TGACGTCA |
| CREB/ATF | CTGCGTCA |
| E2F | TTTTCGCGC |
| EBP-80 | ATCTGCGCATATGCC |
| Ets | CGGAAG |
| MLTF | GGCCACGTGACC |
| MTF-1 | TGCGCCCG |
| c-Myc, c-Min | CACGTG |
| GABP | TTCCGGGC |
| NF-kB | GGGACTTTCCG |
| HiNF-P | CGGTTTTCAATCTGGTCCG |
| MSPF | ATGCGNNNNCGCCT |
В табл. I.15 представлены только консенсусные последовательности, узнаваемые соответствующими факторами транскрипции с подчеркнутыми динуклеотидами CpG, метилирование которых оказывает влияние на взаимодействие факторов с ДНК. Интересно, что фактор Sp1, необходимый для инициации транскрипции на промоторах многих генов домашнего хозяйства, может связываться с метилированными и неметилированными консенсусными последовательностями и, кроме того, предотвращать метилирование соседних последовательностей нуклеотидов. Поскольку Sp1 обнаружен у высших эукариот, ДНК которых содержит 5-mC, предполагают, что данный фактор может играть специфическую роль в регуляции метилирования ДНК у этих организмов.
Известные промоторы, за небольшим исключением (например промотора гена главного комплекса гистосовместимости H-2K), неактивны в метилированном состоянии. Единственная метильная группа, введенная в промотор гена тимидинкиназы вируса простого герпеса или в С-промоторы вируса Эпштейна–Барр, может оказывать большое негативное влияние на транскрипцию. Уровень подавления активности других промоторов, в частности промоторов a- и g-глобиновых генов человека или промотора мышиного гена MyoD1, находится в прямой зависимости от числа введенных в них метильных групп, но не от их положения в промоторах. Ингибирование транскрипции, вызванное частичным метилированием промоторов, может преодолеваться с помощью энхансеров, однако полностью метилированные промоторы не реактивируются энхансерами и сохраняют свое репрессированное состояние, несмотря на присутствие последних. На основании такого рода данных высказывается предположение, что метилирование ДНК регулирует транскрипцию по принципу "все или ничего" и не обеспечивает тонкой регуляции экспрессии генов.
Влияние метилирования ДНК на структуру хроматина. Характер метилирования ДНК может оказывать решающее влияние на структуру хроматина и фазирование (phasing) нуклеосом. Термином "фазирование" обозначают неслучайное расположение нуклеосом относительно конкретной последовательности нуклеотидов ДНК в определенных участках генома. Большинство нуклеосом генома животных располагаются на ДНК случайно. В редких случаях фазирования последовательности нуклеотидов упаковываются в нуклеосомы одним и тем же способом во всех клетках организма, что может оказывать влияние на эффективность транскрипции и репликации ДНК в соответствующих локусах. В настоящее время у млекопитающих описано несколько белков, которые взаимодействуют преимущественно с метилированной ДНК. К ним относятся, например вирусный белок MDBP1 (Major DNA-Binding Protein) и белки человека MeCP1/2 (Methyl-CpG-Binding Protein), а также комплекс белков MDBP2 и гистона H1. Если белок MeCP2 для своего взаимодействия требует присутствия в соответствующем участке ДНК только одного метилированного CpG, то белок MeCP1 связывается с ДНК лишь при наличии нескольких метилированных динуклеотидов. С использованием специфических антител было установлено, что белок MeCP2 локализован преимущественно в G-полосах гетерохроматина метафазных хромосом. Гомозиготные делеции в гене этого белка летальны для мышей, что указывает на важную роль MeCP2 в эмбриогенезе животных. Комплекс MDBP2–гистон H1 может связываться с участком ДНК, содержащим единственный метилированный CpG, и ингибировать транскрипцию. При этом белково-нуклеиновое взаимодействие усиливается после фосфорилирования белков.
Ярким примером подавления экспрессии генов путем формирования хроматина, структурированного специфическим образом, является уже обсуждавшаяся выше инактивация одной из X-хромосом самок млекопитающих. Большинство генов неактивной X-хромосомы прекращает свою экспрессию в раннем эмбриогенезе независимо от наличия в ней CpG-последовательностей. При этом метилирование ДНК и ацетилирование гистона H4 усиливают и стабилизируют репрессированное состояние неактивной X-хромосомы.
Активация генов, входящих в состав неактивного хроматина, требует изменения структуры хроматина и деметилирования ДНК. Обнаружены белковые комплексы, способные реактивировать неактивный хроматин. Деметилирование может происходить пассивно через подавление функционирования поддерживающих Мтаз. В этом случае дочерние цепи ДНК, образующиеся в процессе репликации, остаются неметилированными, что приводит к полному деметилированию ДНК после двух раундов репликации. Активное деметилирование ДНК происходит с участием специфических ферментов – деметилаз.
Гены, входящие в состав неактивного хроматина, в большинстве своем недоступны действию факторов транскрипции. Формирование неактивного хроматина через метилирование специфических последовательностей приводит к уменьшению линейных размеров генома и числа регуляторных последовательностей, доступных факторам транскрипции. Следствием этого является снижение неспецифических взаимодействий регуляторных белков с соответствующими последовательностями генов, что, в свою очередь, уменьшает уровень информационного шума в генетической системе, который может появляться в результате неконтролируемой транскрипции. В этой связи высказывается предположение о важной роли не только генетических, но и видоспецифических эпигенетических изменений в эволюции высших эукариот. Действительно, наследуемый характер паттернов метилирования геномной ДНК способствует стабилизации и распространению в популяциях специфических структур хроматина, а изменение паттернов через эпигенетические мутации может быть одним из путей повышения пластичности генетической информации и ее разнообразия, что может служить материалом для естественного отбора.
CpG-островки. Для генома эукариот характерно наличие изохор (isochores) – протяженных последовательностей, обогащенных GC- или AT-парами. GC-богатые изохоры локализуются в рано реплицирующихся участках хромосом и ассоциированы с R-сегментами (полосами), выявляемыми при их дифференциальной окраске. AT-богатые изохоры реплицируются в поздней S-фазе клеточного цикла и часто обнаруживаются в G-сегментах хромосом. CpG-Островки (CpG islands) представляют собой GC-богатые последовательности (60–70% GC) длиной не менее 200 п.о. с большим числом динуклеотидов CpG. Они локализуются преимущественно в R-сегментах и поддерживаются в неметилированном состоянии в клетках зародышевой линии и нормальных соматических тканей. Исключение составляют островки в генах, подвергнутых импринтингу, в генах инактивированных X-хромосом, а также в повторяющихся элементах генома LINE и SINE (например Alu), где они сильно метилированы. Полагают, что именно неметилированное состояние CpG-островков стабилизирует их структуру в эволюции генома из-за более низкой скорости мутирования по сравнению с 5-mC, который в результате дезаминирования часто превращается в тимин со всеми вытекающими отсюда мутагенными последствиями. В гаплоидном геноме человека обнаруживают ~ 45000 CpG-островков, и считается, что большинство из них ассоциировано с генами. Промоторы многих генов домашнего хозяйства содержат неметилированные CpG-островки.
В настоящее время непонятен механизм поддержания CpG-островков в неметилированном состоянии. Поскольку Мтаза обладает способностью метилировать их in vitro, структурные особенности ДНК сами по себе не способны это обеспечивать. Считается, что в поддержании неметилированного состояния островков участвуют специфические белки хроматина. Хроматин CpG-островков не содержит гистона H1, а гистоны H2A и H2B в этих участках хроматина недоацетилированы. Кроме того, CpG-островки часто содержат сайты связывания фактора транскрипции Sp1, который, взаимодействуя как с метилированными, так и неметилированными сайтами, предотвращает их исходное или дальнейшее метилирование. Полагают, что именно этот фактор может играть ключевую роль в постоянном поддержании генов домашнего хозяйства в неметилированном активном состоянии.
Для соматических клеток, растущих в первичной культуре, характерно быстрое изменение характера метилирования ДНК. Это изменение часто связывают с ограниченным пролиферативным потенциалом культивируемых клеток и их старением как in vivo, так и in vitro. Многие гены культивируемых клеток гиперметилированы, а отдельные CpG-островки аутосом, поддерживаемые in vivo в неметилированном состоянии, переходят в метилированное состояние. Полагают, что гиперметилирование ДНК и инактивация многих генов культивируемых клеток являются следствием отбора, направленного на выключение экспрессии генов, которые не требуются безусловно для выживания клеток в культуре. Кроме того, в культуре происходит отбор клеток на способность к быстрому делению, поскольку быстро делящиеся клетки вытесняют медленно пролиферирующие. Поэтому гены, вызывающие задержку клеточного цикла и терминальную дифференцировку клеток, например p16 или MyoD1, быстро инактивируются у культивируемых клеток под действием мутаций или гиперметилированием.
Роль метилирования ДНК в дифференцировке клеток. Для разных органов и тканей организма характерны специфические наборы (паттерны) метилированных последовательностей ДНК. Такой мозаицизм в метилировании последовательностей генома не является следствием одних только ошибок функционирования системы метилирования, поскольку паттерны метилирования ДНК в гомологичных тканях разных индивидуумов обладают большим сходством. В этой связи можно говорить о тканеспецифическом характере метилирования ДНК, которое обеспечивается координированным функционированием системы метилаз и деметилаз в онтогенезе организма.
В экспериментах на культурах клеток было показано, что изменение паттернов метилирования под действием веществ, вызывающих деметилирование ДНК, например 5-азацитидина, может изменять дифференцированное состояние клеточных линий. В частности, инкубация эмбриональных фибробластов мышей с 5-азацитидином сопровождается их превращением в миобласты, адипоциты и хондроциты. Точно так же дифференцировка клеток эритролейкемии Френд может быть запущена с помощью деметилирующих агентов. Полагают, что в этих случаях в процессе деметилирования ДНК происходит активация генов-регуляторов, детерминирующих дифференцированное состояние клеток, которые, в свою очередь, индуцируют экспрессию всех остальных генов, необходимых для поддержания дифференцированного состояния. Экспрессия конкретных доминантных генов, ответственных за дифференцировку отдельных групп клеток в определенном направлении, должна жестко контролироваться и быть блокированной в клетках других типов. Метилирование ДНК может обеспечивать такое установление неактивного состояния генов дифференцировки и его поддержание в ряду клеточных поколений, т.е. контролировать стабильность дифференцированного состояния соматических клеток организма.
Отцовский импринтинг и аллельное исключение. При отцовском импринтинге, как об этом уже упоминалось выше, экспрессия некоторых генов в дочерних соматических клетках зависит от того, локализованы ли они на отцовских или материнских хромосомах. При этом часто наблюдают различный характер метилирования отцовских и материнских хромосом. У мышей известны ~15 областей хромосом, подвергнутых импринтингу. У многих генов с таким эпигенетическим наследованием обнаружены прямые повторы, которые, как полагают, могут быть задействованы в установлении и поддержании импринтинга. Локализация нескольких генов, в регуляции экспрессии которых задействован импринтинг, в одном и том же участке хромосомы 16 указывает на то, что в установление импринтинга могут быть вовлечены целые домены хромосом.
При аллельном исключении происходит инактивация одного из аллелей, приводящая к функциональной гемизиготности соответствующего гена независимо от его происхождения со стороны родителей. Под гемизиготностью диплоидных организмов или отдельных соматических клеток понимают представленность одного или нескольких генов только одним аллелем, что может быть следствием анеуплоидии (потери одной или нескольких хромосом), делеции или функциональной инактивации второго аллеля. Гемизиготное состояние характерно, в частности для генов X-хромосом самок млекопитающих отдельных соматических клеток, где одна из X-хромосом инактивирована случайным образом. Феномен аллельного исключения описан для генов иммуноглобулинов животных, лишь один из аллелей которых претерпевает продуктивную перестройку под действием V-D-J-рекомбиназы в отдельных лимфоцитах развивающегося организма. Метилирование ДНК оказывает влияние на объединение V-D-J-сегментов генов и, возможно, играет ключевую роль в их аллельном исключении.
Обычно аллельное исключение тонко регулируется в онтогенезе. Однако теоретически аналогичный механизм может реализовываться в результате постепенно накапливаемых случайных ошибок метилирования на протяжении жизни организма. Накопление ошибок метилирования сверх определенного уровня должно сопровождаться выключением соответствующего аллеля на фоне нормального функционирования другого аллеля в конкретной соматической клетке. Происхождение часто обнаруживаемых частично метилированных CpG-сайтов в ДНК различных тканей объясняют такими ошибками метилирования, получившими название эпимутаций. На фоне эпимутаций может легко произойти инактивация единственного оставшегося аллеля дикого типа под действием обычных мутаций или в результате гиперметилирования, что приведет к полному подавлению экспрессии соответствующего гена.
Метилирование как механизм инактивации чужеродной и повторяющейся ДНК у эукариот. Т. Бестором (1990 г.) было высказано предположение о том, что метилирование ДНК у эукариот может выполнять защитную функцию, предохраняя организм от чужеродной ДНК и избытка эндогенных повторяющихся последовательностей. Поскольку у эукариот не описано ферментов рестрикции, специфичных в отношении GpC-последовательностей, предполагается, что такие защитные механизмы осуществляют инактивацию чужеродной ДНК, а не ее деградацию, как это имеет место у бактерий. Экспериментально установлено, что ДНК из внешних источников, например вирусная ДНК или ДНК, введенная в клетки с помощью трансфекции, а также эндогенная ДНК ретротранспозонов и повторяющихся последовательностей (в частности LINE и SINE) могут быть объектом метилирования de novo, приводящего к их генетической инактивации. Например, интеграция ДНК аденовирусов в эукариотический геном сопровождается ее постепенным метилированием. То же характерно и для латентного состояния некоторых других вирусов, которое поддерживается через метилирование остатков цитозина в ДНК их геномов Мтазами клетки-хозяина. Другим примером функционирования этого механизма является гиперметилирование трансгенов, интегрированных в геном организма-реципиента в большом числе копий.
Механизмы, которые позволяют высшим эукариотическим организмам избирательно распознавать и инактивировать чужеродную и повторяющуюся ДНК, не совсем понятны. Полагают, что Мтазы преимущественно распознают молекулы ДНК, формирующие необычные пространственные структуры, например петли или ошибочно спаренные нуклеотиды. В случае повторяющихся последовательностей мишенями Мтаз при метилировании de novo могут быть интермедиаты, образующиеся во время их рекомбинации друг с другом. У гриба Ascobulus immersus повторяющиеся последовательности эффективно распознаются и инактивируются в результате метилирования под действием механизма, получившего название премейотически индуцированного метилирования (methylation induced premeiotically – MIP). Аналогичный механизм у гриба Neurospora crassa назван мутагенезом, индуцированным повторяющимися последовательностями (repeat induced point mutations – RIP). В этом случае остатки цитозина в повторах либо метилируются ферментными системами гриба, либо превращаются в мутантные остатки тимина. Вообще, остатки С, которые являются мишенями для Мтаз, мутируют в геноме эукариот по механизму дезаминирования и превращения в остатки тимина гораздо чаще, чем другие остатки цитозина. Это позволяет рассматривать метилирование как постоянно функционирующий механизм эукариот, инактивирующий чужеродные и повторяющиеся последовательности ДНК с помощью таких мутаций.
Все рассмотренные выше регуляторные механизмы, контролирующие экспрессию генов, функционируют на одном из самых важных этапов реализации генетической информации – на уровне транскрипции. Однако и другие этапы передачи генетической информации являются важными объектами многочисленных регуляторных воздействий.
Посттранскрипционная регуляция экспрессии генов
Регуляция экспрессии генов на уровне уже синтезированной РНК играет исключительно важную роль в онтогенезе многоклеточных и особенно высших организмов. Среди различных способов посттранскрипционной регуляции наибольшее значение имеют механизмы внутриклеточной локализации и депонирования РНК с последующим специфическим вовлечением ее в трансляцию, а также разные формы процессинга предшественников мРНК, избирательной деградации мРНК и ее ковалентных посттранскрипционных модификаций.
Направленный транспорт, внутриклеточная локализация и депонирование мРНК
Структура и образование комплекса ооцит–питающие клетки у дрозофилы. Каждый из двух симметрично расположенных яичников дрозофилы содержит ~16… Выбор клетки, которая становится ооцитом среди 16 цистоцитов, не происходит… Этот краткий экскурс в дифференцировку клеток зародышевой линии насекомого был предпринят, в частности для того, чтобы…Сплайсинг РНК в регуляции экспрессии генов
Убедительные данные о контроле экспрессии генов на уровне процессинга РНК получены в экспериментах с вирусами клеток животных. Вирусы полиомы и SV40…Рис. I.35. Схема формирования активаторов и репрессоров транскрипции, кодируемых геном CREM и образующихся в результате альтернативного сплайсинга
В верхней части рисунка изображена схема гена CREM, включающая альтернативные промоторы Р1 и P2, кодоны альтернативной инициации и терминации трансляции, а также экзоны, кодирующие различные домены факторов. Внизу представлены комбинации последовательностей экзонов, объединяющихся в зрелые мРНК, которые кодируют разных представителей групп репрессоров и активаторов транскрипции, а также ICER-белков
Альтернативный сплайсинг. Одним из примеров посттранскрипционных модификаций РНК, имеющих большое значение в регуляции экспрессии генов эукариот, является альтернативный сплайсинг. Сущность его заключается в том, что в результате посттранскрипционного процессинга предшественника мРНК, из которого в результате сплайсинга вырезаются некодирующие последовательности нуклеотидов, соответствующие интронам транскрибированного гена, образуются зрелые мРНК, различающиеся по своей первичной структуре. В результате в разных клетках и тканях из одного и того же предшественника получаются молекулы зрелых мРНК, которые объединяют в различных комбинациях последовательности экзонов транскрибированного гена.
На рис. I.35 представлена схема экзонной структуры гена модулятора cAMP-респонсивного элемента человека (CREM), кодирующего целое семейство позитивно и негативно действующих изоформ фактора транскрипции, связывающихся с cAMP-респонсивными регуляторными элементами ДНК – CRE. Данное семейство факторов вовлечено в регуляцию экспрессии генов, участвующих в обеспечении эндокринных функций организма и сперматогенезе. Ген построен из функциональных модулей, заключающих в себе информацию двух промоторов, двух альтернативных ДНК-связывающих доменов, а также нескольких транс-действующих доменов этих факторов. Пре-мРНК транскрибируется с неиндуцируемого промотора P1 и подвергается альтернативному сплайсингу, специфичность которого определяется типом ткани, в которой он происходит. Например, во время сперматогенеза происходит переключение с синтеза репрессоров транскрипции CREMa, CREMb и CREMg на образование CREMt, который содержит в своей полипептидной цепи две дополнительные последовательности, обогащенные Gln (Q1 и Q2), необходимые для транс-активации транскрипции. Более короткий транскрипт, синтез которого инициируется на промоторе P2, процессируется с образованием зрелых мРНК, которые кодируют группу небольших молекул репрессоров (ICER). Инициация синтеза РНК на промоторе P2 активируется под действием ритмических гормональных сигналов эпифиза мозга.
Рассмотренный пример показывает важную роль альтернативного сплайсинга в расширении кодирующего потенциала генов эукариот, поскольку в результате использования такого механизма одна и та же последовательность нуклеотидов гена может кодировать несколько разных белков.
Комбинаторика объединения последовательностей нуклеотидов пре-мРНК в процессе альтернативного сплайсинга может быть очень сложной, поскольку в него вовлекаются интроны и экзоны, а их объединение происходит с использованием различных точек сплайсинга, локализованных в этих последовательностях. Распознавание участков ДНК, в которых находятся точки сплайсинга, участвующие в конкретном акте посттранскрипционного процессинга пре-мРНК, происходит с участием специфических белков в результате белково-нуклеинового взаимодействия.
Альтернативный сплайсинг у дрозофилы. Механизм регуляции альтернативного сплайсинга хорошо изучен у дрозофилы, использующей этот процесс, в частности при генетическом определении пола (рис. I.36). Каскад реакций альтернативного сплайсинга в данном случае начинается с альтернативного выбора в пре-мРНК гена sxl последовательности экзона 3, содержащей кодон терминации трансляции. Если в результате альтернативного сплайсинга последовательность нуклеотидов, кодируемая экзоном 3, включается в зрелую мРНК самок, то при ее трансляции рибосомами образуется укороченная полипептидная цепь белка SXL, у которой отсутствует биологическая активность. Напротив, удаление такой последовательности в результате альтернативного сплайсинга приводит к образованию функционально активного белка, который, в свою очередь, участвует в регуляции альтернативного сплайсинга пре-мРНК гена tra, предотвращая взаимодействие мяРНК U2AF65 с одним из 3’-концевых сайтов сплайсинга. Это обеспечивает соединение белка с другим менее эффективным сайтом сплайсинга, расположенным ниже первого, участвующего в определении пола.
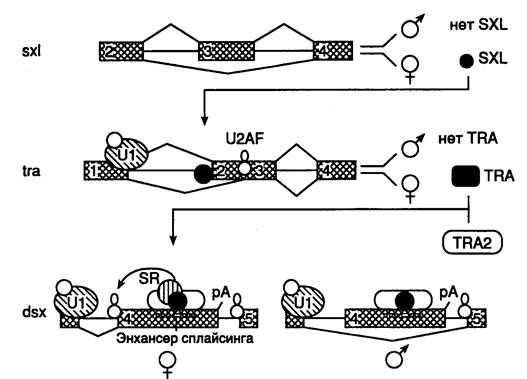
Рис. I.36. Схема каскада реакций альтернативного сплайсинга, приводящих к определению пола у дрозофилы
Белок TRA стабилизирует связывание белка TRA2 с энхансером сплайсинга в tra-пре-мРНК. 1–5 – экзоны
Образующийся в результате белок TRA, содержащий аминокислотную последовательность, кодируемую экзоном 3 гена tra, в комплексе с другими белками TRA2 и SR-белком участвует в образовании мультипротеинового комплекса на специфической последовательности альтернативного экзона в мРНК гена dsx. Подобные регуляторные последовательности обнаружены также в мРНК позвоночных и вирусов животных и получили название энхансеров сплайсинга (они не имеют отношения к энхансерам, регулирующим транскрипцию эукариотических генов). В случае dsx-пре-мРНК образование такого энхансерного комплекса, включающего и белковые факторы, узнающие 3’-концевые сайты сплайсинга, способствует взаимодействию факторов сплайсинга с его низкоэффективным 3’-концевым сайтом, расположенным перед энхансером (и последовательностью экзона 4), а также вырезанию этого интрона. Образующийся в результате трансляции такой мРНК белок DSX блокирует экспрессию генов, обеспечивающих формирование у мух мужского фенотипа. В отсутствие TRA-белка в результате объединения экзонов 3 и 5 получается альтернативный белок DSX, который не препятствует экспрессии этих генов и подавляет дифференцировку самок.
Позитивная и негативная регуляция альтернативного сплайсинга в клетках животных.У животных описано много генов, пре-мРНК которых подвергаются альтернативному сплайсингу. Однако механизмы регуляции этого процесса не так ясны, как в только что рассмотренном примере с генами дрозофилы. Основную роль в выборе альтернативных сайтов сплайсинга у животных, по-видимому, играют общие факторы сплайсинга. В частности, установлено, что простое повышение концентрации SR-белков способствует предпочтительному выбору для сплайсинга проксимально расположенных, т.е. сближенных друг с другом, сайтов сплайсинга во многих пре-мРНК.
Механизм этого явления представлен на рис. I.37 на примере гипотетической пре-мРНК, содержащей два альтернативных одинаково эффективных 5’-концевых сайта сплайсинга. Для простоты показано связывание с РНК только U1-мяРНП и SR-белка. В условиях недостатка U1-мяРНП (см. рис. I.37,а) не все 5’-концевые сайты сплайсинга заполнены мультибелковыми комплексами. Поскольку наиболее эффективно в альтернативном сплайсинге используется внутренний сайт, максимально сближенный со своим 3’-концевым партнером, альтернативный 5’-концевой сайт вовлекается только в том случае, если ниже расположенный сайт не занят. Повышение концентрации U1-мяРНП приводит к тому, что оба 5’-концевых сайта сплайсинга взаимодействуют с белковыми комплексами и сплайсинг происходит преимущественно с участием его максимально сближенных сайтов (см. рис. I.37,б). В этом случае SR-белки усиливают взаимодействие между расположенными по соседству U1-мяРНП-комплексами.
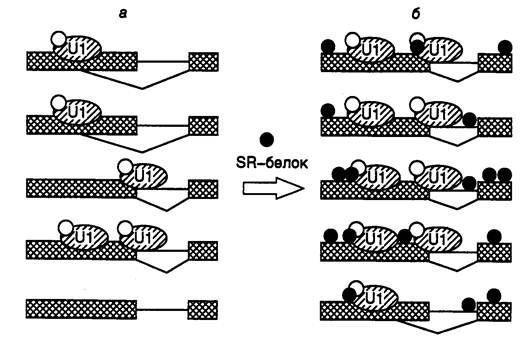
Рис. I.37. Механизм действия белков SR при обеспечении выбора сплайсомой альтернативных сайтов сплайсинга
U1 - U1-мяРНП. Эффективность вырезания интронов: а – 40% проксимальных, 40% дистальных; б – 80% проксимальных, 20% дистальных
У многих генов животных и их вирусов обнаружены последовательности нуклеотидов, блокирующие сплайсинг. Некоторые из этих последовательностей способствуют формированию в пре-мРНК характерной вторичной структуры, которая маскирует сайты сплайсинга. Поскольку многие белковые факторы сплайсинга обладают ДНК-расплетающей активностью и вызывают локальное плавление спирализованных участков РНК, то дифференциальная экспрессия таких факторов оказывает влияние на выбор белками сплайсинга определенных сайтов. Другие негативные регуляторные элементы альтернативного сплайсинга требуют для своего функционирования наличия транс-действующих факторов. Например, белок вируса иммунодефицита человека взаимодействует с последовательностью RRE пре-мРНК и, блокируя ее сплайсинг, обеспечивает экспорт непроцессированной пре-мРНК. Описаны экзоны, также оказывающие негативное влияние на сплайсинг. Кроме того, показано, что белки гетерогенных ядерных РНП A1, A1b, A2 и B1 выступают антагонистами SR-белков при взаимодействии последних с дистальными 5’-концевыми сайтами сплайсинга. Для индивидуальных белков этой группы (A и B) характерна субстратная специфичность, и они оказывают существенное влияние на выбор конкретных сайтов сплайсинга во время процессинга пре-мРНК, что в ряде случаев обеспечивается наличием высокоаффинных сайтов связывания для таких белков между конкурирующими 5’-концевыми сайтами сплайсинга. Например, наличие участка сильного связывания для белка А1, входящего в состав гяРНП, между двумя 5’-концевыми сайтами сплайсинга приводит к преимущественному участию в процессинге дистального сайта сплайсинга (более удаленного от 3’-концевого сайта). Такое взаимодействие не оказывает влияния на связывание обоими 5’-концевыми сайтами сплайсинга U1-мяРНП.
Рассмотренные механизмы позитивной и негативной регуляции альтернативного сплайсинга во многом гипотетичны. Однако существование внутриклеточных механизмов, с высокой точностью регулирующих этот процесс, в настоящее время доказано. Такая специфичность может достигаться за счет контролируемых изменений внутриядерной концентрации индивидуальных SR-белков и белков гетерогенных ядерных РНП-частиц, функционирующих в сочетании с регуляторными последовательностями нуклеотидов (энхансерами сплайсинга) и с сайтами сплайсинга определенной эффективности, локализованными в самих пре-мРНК. В некоторых случаях подобная регуляция требует участия дополнительных специфических факторов.
Переключение классов иммуноглобулинов.В процессе дифференцировки B-лимфоцитов происходит смена классов иммуноглобулинов, синтезируемых этими клетками. В начале дифференцировки образуются иммуноглобулины, обладающие способностью как секретироваться в окружающую среду, так и интегрироваться в плазматическую мембрану B-лимфоцитов. Поверхностные иммуноглобулины выполняют здесь роль рецепторов антигенов и принадлежат к одному из двух классов белков: IgM или IgD. Белки этих двух классов обладают одинаковыми аминокислотными последовательностями в N-концевых частях, взаимодействующих с антигенными детерминантами, и различаются по С-концам. В начале процесса дифференцировки поверхностные иммуноглобулины представлены белками только класса IgM, а после первой стимуляции антигеном появляются белки обоих классов; далее, после завершения дифференцировки B-лимфоцитов, на поверхности клеток остаются иммуноглобулины только класса IgD. Именно они продолжают синтезироваться зрелыми B-лимфоцитами.
В основе феномена переключения классов иммуноглобулинов у B-лимфоцитов лежит механизм альтернативного сплайсинга. На любой стадии дифференцировки B-лимфоцитов синтезируются транскрипты генов иммуноглобулинов, в состав которых входят экзоны вариабельных частей иммуноглобулинов, а также их константных частей, как m, так и d, определяющих класс иммуноглобулинов (IgM или IgD соответственно). В результате альтернативного сплайсинга с последовательностями экзонов вариабельных частей в зрелой мРНК соединяются последовательности экзонов m или d, что и определяет, в конечном счете, класс иммуноглобулинов, образующихся в результате трансляции этих мРНК рибосомами. С помощью альтернативного сплайсинга B-лимфоциты решают вопрос и о том, какая из форм IgM – секретируемая или интегрирующаяся в мембраны – образуется в клетках. Так же как и в случае обсуждавшихся выше классов иммуноглобулинов, секретируемая и ассоциированная с мембранами формы IgM различаются по С-концевым аминокислотным последовательностям. Последовательности, кодирующие эти С-концевые домены иммуноглобулинов, добавляются в зрелые мРНК или удаляются из их предшественников в результате альтернативного сплайсинга.
Исследования последних лет показали, что регуляция экспрессии генов с помощью альтернативного сплайсинга широко распространена в клетках высших организмов. Использование такого изящного механизма позволяет одному и тому же гену кодировать несколько полипептидов, различающихся по своим биологическим функциям, и контролировать их биосинтез во времени (на разных этапах дифференцировки клеток) и в пространстве (в различных органах и тканях). Все это повышает информационную емкость генома высших организмов без существенного увеличения его размеров.
Транс-сплайсинг. Из рассмотренных выше примеров следует, что во время постоянного или альтернативного сплайсинга интроны удаляются из предшественников мРНК в результате нескольких сложных реакций при участии крупного РНП-комплекса, называемого сплайсомой. Обычно 5’- и 3’-концевые сайты сплайсинга, участвующие в таком процессе, расположены на одной молекуле пре-мРНК, т.е. в цис-положении по отношению друг к другу. В отличие от этого в процессе транс-сплайсинга сплайсома выбирает для объединения 5’-сайт и 3’-сайт сплайсинга, которые располагаются на разных молекулах РНК. В настоящее время транс-сплайсинг обнаружен у простейших (трипаносом), евглен, круглых нематод и плоских червей, а также в митохондриях, хлоропластах и безрибосомных пластидах высших растений. Наиболее хорошо изучен механизм транс-сплайсинга у нематоды Caenorhabditis elegans, который подробнее будет рассмотрен ниже. Только у этих групп организмов (за исключением трипаносом, гены которых не содержат интронов) механизмы цис- и транс-сплайсинга функционируют в клетках на одних и тех же молекулах РНК.
Интересной особенностью транскрипции у нематод, сближающих их с трипаносомами, является то, что их РНК синтезируются в виде полицистронных предшественников, которые далее расщепляются до моноцистронных единиц, полиаденилируются и подвергаются транс-сплайсингу. Однако в отличие от трипаносом, у которых транс-сплайсинг ограничивается присоединением к акцепторному 3’-концевому сайту сплайсинга одной и той же лидерной РНК SL1 (spliced leader 1), нематоды обладают еще одним донорным сайтом сплайсинга, ассоциированным с SL2-РНК, молекулы которой присоединяются к внутренним сайтам полицистронных транскриптов. Таким образом, в клетках C. elegans сплайсинг осуществляется по трем механизмам (рис. I.38). Это обычный цис- и транс-сплайсинг, в результате которых SL1-РНК присоединяется вблизи 5’-концов первичных транскриптов-предшественников зрелых мРНК, и, наконец, транс-сплайсинг с участием молекул SL2-РНК, которые объединяются с внутренними последовательностями нуклеотидов полицистронных транскриптов. Все три типа сплайсинга проходят в основном с участием одних и тех же компонентов РНП-комплекса, представляющего собой сплайсому, которая использует одни и те же 3’- и 5’-концевые канонические последовательности сайтов сплайсинга. Подобно высшим организмам в состав сплайсомы нематод входят U1-U6-мяРНК, из которых U2-U6 участвуют в транс-сплайсинге. Молекулы SL-РНК, содержащие донорные сайты сплайсинга, также входят в состав РНП-комплекса.
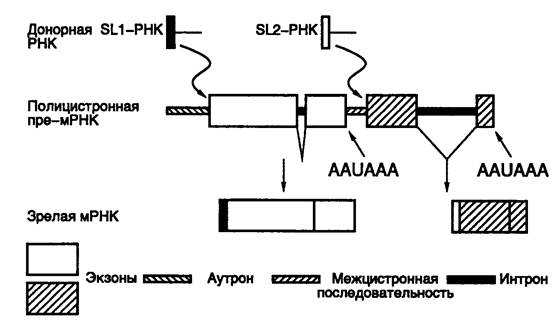
Рис. I.38. Цис- и транс-сплайсинг ядерной полицистронной пре-мРНК у нематоды C. elegans
AAUAAA – сайты полиаденилирования
Последовательности нуклеотидов сайтов транс- и цис-сплайсинга идентичны и взаимозаменяемы в генно-инженерных экспериментах. Интроноподобные последовательности, расположенные на 5’-концах транскриптов, названные аутронами, подвергаются транс-сплайсингу, тогда как внутренние интроны вырезаются по механизму цис-сплайсинга. Единственным отличием гена, транскрипт которого подвергается транс-сплайсингу, является наличие на его 5’-конце последовательности аутрона, а не экзона. При перемещении интрона одного гена из внутреннего положения на 5’-конец другого или того же самого гена он начинает функционировать в качестве аутрона, т.е. подвергается транс-сплайсингу. Если размер такого аутрона превышает 50 п.о., то он нормально функционирует в транс-сплайсинге. При искусственном введении 5’-концевого сайта сплайсинга в аутрон на расстояние более 50 п.о. от его сайта транс-сплайсинга заключенная между этими сайтами последовательность нуклеотидов в РНК подвергается обычному цис-сплайсингу. Таким образом, единственным сигналом, разрешающим транс-сплайсинг, является положение последовательности нуклеотидов вблизи 5’-конца пре-мРНК.
Зрелые, полностью процессированные РНК C. elegans содержат SL1- и SL2-РНК на 5’-концах, причем соблюдаются пропорции в содержании маркированных таким способом РНК внутри клеток. Следовательно, процесс транс-сплайсинга, в результате которого происходит выбор лидерной SL-РНК, каким-то образом регулируется. Предполагается, что белки, взаимодействующие с сайтами полиаденилирования соответствующих РНК, специфически взаимодействуют с белками мяРНП, в состав которых входят SL-РНК, и тем самым осуществляют их выбор.
Функциональная роль транс-сплайсинга в жизненном цикле нематод неизвестна. Экспериментами in vivo продемонстрирована взаимозаменяемость генов, продукты которых подвергаются цис- или транс-сплайсингу. Известно, что сайты транс-сплайсинга часто располагаются непосредственно перед инициирующими AUG-кодонами мРНК. Это позволяет предположить, что SL-последовательности играют определенную роль в инициации трансляции. В частности, с помощью транс-сплайсинга могут удаляться лишние AUG-кодоны, находящиеся не в одной рамке считывания с основной кодирующей последовательностью нуклеотидов мРНК, или создаваться контексты нуклеотидов, которые обеспечивают эффективную инициацию синтеза белка рибосомами. Это, в свою очередь, может допускать определенную эволюционную гибкость в расположении соответствующих промоторов и создавать условия для возникновения новых сайтов инициации транскрипции на ДНК нематод.
Избирательная деградация мРНК
Как было упомянуто, клетки эукариотических организмов способны выводить мРНК из трансляции, не разрушая ее. Это часто достигается регуляцией… Время жизни эукариотических мРНК в цитоплазме чаще всего контролируется их… Различают, по крайней мере, три класса ARE-элементов. Элементы 1-го класса (характерные, в частности для мРНК гена…Рис. I.39. Этапы ARE-зависимой деградации мРНК эукариот
Закрашенные геометрические фигуры – белки и факторы, специфически взаимодействующие с ARE-последовательностью. Их возможное влияние на деаденилирование показано волнистыми стрелками. Толщина стрелок указывает на интенсивность реакции
В соответствии с современной моделью ARE-зависимая деградация мРНК происходит двумя различными путями (рис. I.39). Как уже упоминалось выше, этот процесс начинается с деаденилирования 3’-концевых поли(A)-последовательностей мРНК. Процесс деаденилирования проходит с разной скоростью в зависимости от класса ARE-последовательностей, присутствующих в мРНК. При наличии ARE-элементов 2-го класса (тип GM-CSF) деаденилирование отдельных молекул протекает асинхронно по процессивному механизму и заканчивается образованием молекул мРНК, не содержащих 3’-концевых поли(А)-последовательностей (поли(А)--РНК). В отличие от этого ARE-элементы 1-го и 3-го классов направляют деаденилирование по дистрибутивному механизму. При этом отдельные молекулы деаденилируются синхронно, и на концах мРНК остаются поли(А)-последовательности длиной в 30–60 нуклеотидов. Скорость дальнейшей деградации процессированных мРНК может быть различной и зависит от регулируемой на уровне деградации мРНК экспрессии генов.
Таким образом, наличие в структуре мРНК различных классов специфических ARE-последовательностей, а также множественных белков-регуляторов, взаимодействующих с этими последовательностями, контролирует кинетику деградации мРНК в клетках. Аналогичные механизмы имеют место, в частности в селективной защите или дестабилизации мРНК в ответ на изменение внутриклеточных условий, например при гормональных воздействиях.
Изменение длины поли(А)-последовательностей мРНК. Выше было отмечено, что кэпирование и полиаденилирование процессированных эукариотических мРНК повышают эффективность их трансляции рибосомами. В некоторых случаях эффективность трансляции мРНК, содержащих 3’-концевые поли(A)-последовательности, регулируется путем специфического изменения длины таких гомополимеров. В частности, у слизневиков Dictyostelium этот механизм играет ключевую роль в жизненном цикле. При переходе слизневиков от стадии вегетативного роста (амеба) к образованию плодового тела в клетках синтезируется новый набор мРНК. Одновременно резко укорачивается длина поли(A)-последовательностей мРНК, синтезированных и используемых в вегетативной стадии развития организма. В результате происходит переключение трансляции с мРНК, запасенных в вегетативной фазе роста, на вновь синтезированные мРНК. Аналогичные эффекты наблюдаются в слюнных железах личинок дрозофилы, в процессе развития двустворчатого моллюска Spisula, а также в ооцитах шпорцевой лягушки Xenopus.
Хорошо изученным примером регуляции экспрессии генов на уровне полиаденилирования соответствующих мРНК является также дифференциальное полиаденилирование мРНК белка U1A – компонента U1-мяРНП. Установлено, что 3’-концевые нетранслируемые участки (3’-UTRs) U1A-мРНК различных организмов содержат две копии консервативных последовательностей, которые обладают способностью связывать U1A-белок. В результате синтез избытка U1A-белка ингибирует полиаденилирование мРНК in vivo. При этом происходит подавление полимеризации AMP как следствие прямых контактов белка с поли(А)-полимеразой. После такой дестабилизации U1A-мРНК наблюдается пропорциональное снижение внутриклеточного уровня U1A-белка, т.е. имеет место регулирование его биосинтеза по принципу обратной связи.
Изменения кэп-группы мРНК. Своеобразный механизм контроля трансляции мРНК используется в онтогенезе некоторых бабочек. Например, у табачного бражника Manduca sexta эффективность трансляции определенных мРНК изменяется при ковалентной модификации их 5’-концевых кэп-групп. В ооцитах бражника запасенные мРНК содержат кэп-группу в виде неметилированного остатка гуанозина. Такие мРНК не транслируются рибосомами в бесклеточной белоксинтезирующей системе. Однако после оплодотворения кэп-группы мРНК быстро метилируются с образованием остатка 7-метилгуанозина и становятся активными матрицами при трансляции.
Этим примером мы завершим рассмотрение механизмов регуляции экспрессии генов путем посттранскрипционных модификаций мРНК и их предшественников. Как видно из изложенного материала, все регуляторные модификации структуры РНК оказывают влияние на экспрессию генов, транскриптами которых они являются, через изменение эффективности трансляции этих мРНК рибосомами. Фактически все вышеперечисленные механизмы регуляции экспрессии генов направлены на изменение матричной активности РНК-посредников (мРНК), с помощью которых происходит перенос генетической информации от транскрибируемых генов к белкам. Такие механизмы оказывают регуляторное действие на уровень экспрессии регулируемых генов через изменение эффективности функционирования аппарата трансляции клеток организма. Тем не менее, среди механизмов, регулирующих экспрессию генов на уровне трансляции, многие непосредственно направлены на изменение функциональной активности самих компонентов аппарата трансляции: рибосом и многочисленных факторов трансляции, принимающих прямое участие в биосинтезе белков. Некоторые из этих механизмов будут рассмотрены в следующем разделе.
Регуляция экспрессии генов на уровне трансляции
Регуляция инициации трансляции
Участие фактора инициации трансляции eIF4E в регуляции биосинтеза белка. Фактор eIF4E распознает кэп-структуры мРНК в составе многокомпонентного… Регуляция биосинтеза eIF4E на уровне транскрипции. В ответ на действие… Регулируемое фосфорилирование фактора eIF4E. Фософорилированное состояние полипептидной цепи фактора eIF4E коррелирует…Рис. I.40. Механизмы трансляции полицистронных мРНК у вирусов растений
Черные, серые и светлые прямоугольники изображают различные ОРС в полицистронных РНК, вертикальные линии над ними – AUG-кодоны, горизонтальные стрелки указывают направление перемещения рибосом во время шунта, вертикальная стрелка указывает положение частично супрессируемого стоп-кодона, TAV – гены-активаторы
а, б, в – примеры ослабленного сканирования полицистронных мРНК, содержащих: а – два сайта инициации трансляции на одной ОРС (вирус мозаики вигны (cowpea)), б – перекрывающиеся ОРС (вирус желтой мозаики турнепса), в – две последовательно расположенные ОРС (вирус скрытой мозаики сливы); г – схема шунтирования сайтов инициации (вирус мозаики цветной капусты); д – трансактивация последовательно расположенных ОРС (тот же вирус); е – частичная супрессия стоп-кодона (вирус мозаики табака); ж – сдвиг рамки считывания (вирус желтой карликовости ячменя)
была показана для ОРС IV вируса CaMV и конкретных ОРС многих других вирусов растений. Кодируемый этим геном белок TAV специфически стимулирует трансляцию внутренних ОРС. В искусственных РНК трансактивация оказывается особенно эффективной, если в первой ОРС присутствует ~30 кодонов. Трансактивацию наблюдали для нескольких ОРС, которые были расположены ниже короткой первой рамки считывания. О том, что трансактивация происходит на уровне реинициации трансляции, свидетельствовали полярные эффекты вставок в такие полицистронные РНК последовательностей со вторичной структурой типа шпилек. Поскольку эффективность трансактивации зависела от длины первой ОРС, был сделан вывод, что трансактиватор действует прямо или косвенно на элонгирующие (или терминирующие) рибосомы. Оптимальная длина первой ОРС в 30 кодонов обеспечивает синтез пептида, длины которого достаточно для появления на поверхности транслирующей рибосомы. Предполагают, что на последующем этапе трансляции происходят структурные изменения рибосом, которые приводят к потере способности рибосом к реинициации трансляции и, как следствие, к трансактивации рибосом.
Функция трансактивации связана с центральной частью полипептидной цепи TAV. В процессе трансляции TAV взаимодействует с полисомами, а также с рибосомным белком (молекулярная масса 18 кДа) клеток дрожжей и растений. Трансгенные растения Arabidopsis и табака, экспрессирующие белок TAV, обладают ненормальным фенотипом и пониженной жизнеспособностью. Однако в настоящее время неясно, является ли это следствием способности белка обеспечивать трансактивацию трансляции или сопряжено с его другими, неизвестными активностями.
Регуляция элонгации синтеза полипептидных цепей
Другим фактором, от которого зависит изменение скорости перемещения рибосомы вдоль транслируемой молекулы мРНК, является характерная… Наконец, обнаружен ряд регуляторных белков, которые после взаимодействия с… Запрограммированный сдвиг рамок считывания и неполная супрессия терминирующих кодонов во время элонгации полипептидных…Регуляция терминации трансляции
Аналогичного эффекта система трансляции достигает посредством неполной терминации синтеза полипептидов на некоторых терминирующих кодонах. Из трех… Для образования гибридного белка Gag-Pol ретровирусы типа С используют… Использование вышеописанных механизмов генетически запрограммированного сдвига рамки считывания транслируемой РНК или…Синтез белков, содержащих остатки селеноцистеина
Встраивание этого аминокислотного остатка в полипептидные цепи регулируется весьма тонким механизмом. Перенос остатка селеноцистеина к рибосомам у… Рассмотренный пример показывает, что при необходимости живой организм может… Описано изменение смысла антикодона в тРНК путем посттранскрипционной модификации остатка цитозина с образованием так…Посттрансляционная регуляция экспрессии генов
Кроме того, необходимо иметь в виду, что конечный уровень содержания конкретных белков в клетке зависит не только от скорости их биосинтеза… В этом разделе рассмотрены примеры посттрансляционных модификаций…Последствия фолдинга вновь синтезированных полипептидных цепей
Опасность протеолитической деградации для растущей полипептидной цепи возникает сразу после ее появления на поверхности транслирующей рибосомы.… Растущие полипептидные цепи, у которых отсутствует сигнальная… Различные сигнальные последовательности аминокислотных остатков обеспечивают направленную доставку вновь…Специфические протеиназы в посттрансляционном процессинге белков
Аналогичный механизм посттрансляционной активации используется во время биосинтеза инсулина и других пептидных гормонов. Предшественник инсулина… В системах биосинтеза адренокортикотропного гормона (АКТГ) и эндорфина…Убиквитин-зависимая система протеолиза в регулируемой деградации белков
Как в ядре, так и в цитоплазме эта система отделена пространственно и функционально от протеолитических ферментов, организованных в протеасомы.…Рис. I.41. Этапы функционирования убиквитинзависимой системы протеолиза
Е1–Е3 – ферменты, активирующие убиквитин с функционально-активными SH-группами, PPi – неорганический пирофосфат
Структура и функционирование протеасомы. Белки, меченные цепями убиквитина, после взаимодействия с протеасомами расщепляются до коротких пептидов и свободных аминокислот в результате ATP-зависимой реакции. У эукариот протеасомы присутствуют в цитозоле и ядрах, но не в других клеточных органеллах. Протеасомы выделяют в виде индивидуальных частиц с коэффициентами седиментации 20S и 26S. 20S частица является коровой частью 26S частицы, которая обладает протеолитической активностью. Коровая частица представляет собой белковый комплекс в виде цилиндра, через центральный канал которого "протягивается" молекула гидролизуемого белка. В настоящее время в качестве модельного объекта часто используют протеасомы архебактерии Thermoplasma, которые были закристаллизованы и исследованы с помощью рентгеноструктурного анализа.
Установлено, что протеасома Thermoplasma построена из двух (a и b) субъединиц. Кольцевые структуры на обоих концах цилиндра протеасомы составлены из a-, а центральная часть – из b-субъединиц в отношении a7b7b7a7 (рис. I.42). Протеолитическая активность присуща b-субъединицам, причем их активные центры направлены внутрь полости цилиндра протеасомы. Кроме того, кольца a-субъединицы по обоим концам молекулы образуют узкие отверстия диаметром ~13 Å, через которые может пройти только развернутая цепь полипептида. Это механистически объясняет, каким образом протеасома избирательно расщепляет полипептидные цепи белков, меченные убиквитином. Прежде чем войти в контакт с активными центрами протеиназ, полипептидная цепь деградируемого белка должна быть развернута. Пептиды и аминокислоты, образующиеся в центральной части цилиндра протеасомы, покидают ее через переднее или заднее отверстия, сформированные a-субъединицами. Протеасомы Thermoplasma лишены специфичности в отношении деградируемых белков, и их функционирование требует наличия в N-концевой части b-полипептидов остатка Thr. Интересно, что остатки Thr эукариотических b-субъединиц являются мишенью для антибиотика лактацистина из Streptomyces, который ковалентно связывается с этими остатками, необратимо инактивируя протеасомы.
Рис. I.42. Гипотетическая схема функционирования протеасомы убиквитинзависимой системы протеолиза
Молекулы убиквитина присоединяются к деградируемой полипептидной цепи (1,2) и конъюгат далее взаимодействует с 26S протеасомой (3). Узкий цилиндр изображает кόровую 20S субчастицу протеасомы, обладающую протеолитической активностью. Полипептидная цепь, разворачиваясь, входит в центральную полость 20S субчастицы, где последовательно подвергается протеолизу (4, 5). При этом цепи убиквитина отделяются от деградируемого белка
Локализация активных центров b-субъединиц внутри протеасомы затрудняет неконтролируемую деградацию окружающих белков. Отдельные субъединицы до включения их в состав зрелых протеасом синтезируются в виде неактивных предшественников, что предотвращает их преждевременное протеолитическое действие и является общим принципом биосинтеза протеолитических ферментов. Подобно тому как ферменты лизосом активируются только после их перемещения в соответствующий компартмент клетки, процессинг b-предшественников сопряжен с их включением в состав протеасом. Сборка протеасом начинается с образования гептамерных a-субчастиц (a7), которые стимулируют аутокаталитическое удаление пропоследовательности предшественника b-субъединиц, что приводит к их упорядоченной самосборке с образованием гептамерных b-субчастиц (b7), состыкованных с a-субчастицами. Две предварительно собранные половины протеасомы (a7b7) далее ассоциируют друг с другом с образованием активных 20S протеасом. Очищенные 20S протеасомы эффективно расщепляют небольшие пептиды, но не способны гидролизовать интактные белки. Распознавание конъюгатов убиквитина и разворачивание белковой глобулы происходят с участием ~16 белков, ассоциированных с 20S протеасомой и образующих 26S комплекс. Эти белки способны объединяться в отдельные комплексы, получившие название 19S-кэп-структур. 19S-комплексы ассоциируют друг с другом в присутствии ATP и с 20S протеасомами in vitro, присоединяясь к концам цилиндра.
Протеасомы обеспечивают не только полную деградацию полипептидов, но и участвуют в процессинге предшественников с образованием зрелых, активных белков. В частности, процессинг субъединицы p50 транскрипционного фактора NF-kB животных, сопровождающийся отщеплением и деградацией С-концевой части полипептида, происходит с помощью 26S протеасом.
Процессинг антигенов. В настоящее время сформировалось мнение о том, что протеасомы клеток животных участвуют в процессинге антигенов, представляемых молекулами первого класса главного комплекса гистосовместимости (MHC). Из семи b-субъединиц протеасом человека лишь три обладают протеолитической активностью. Эндогенный антивирусный агент g-интерферон селективно стимулирует синтез неактивных b-субъединиц, одновременно подавляя образование активных. Две из этих стимулируемых субъединиц, названные LMP2 и LMP7, кодируются генами MHC. До конца не ясно, какой биологический смысл имеет замещение почти всех активных субъединиц на неактивные, однако предполагается, что такое явление может иметь отношение к процессингу антигенов, представляемых для распознавания молекулами MHC. Действительно, для мышей с дефектными LMP2 или LMP7 характерно нарушение презентации некоторых антигенов. По-видимому, пептиды, образующиеся в таких реконструированных протеасомах, по размерам или составу аминокислотных последовательностей соответствуют тому стандарту, который требуется для эффективного действия антигенных детерминант во время иммунного ответа.
Сплайсинг белков
Открытие сплайсинга белков было сделано при исследовании экспрессии гена VMA1 дрожжей S. cerevisiae, известного также под названием TFP1, который… Для объяснения механизма белкового сплайсинга предложено несколько моделей.…Рис. I.44. Предполагаемый механизм сплайсинга белков
а, б – альтернативные механизмы инициации сплайсинга, N, C – N- и C-концевые экстеины белков-предшественников
Сплайсинг белков является сложной задачей для исследования in vitro. Процесс вырезания последовательности интеина происходит настолько быстро, что не удается обнаружить промежуточные соединения. Проблему удалось решить методами генной инженерии, вставив последовательность ДНК интеина из гена ДНК-полимеразы термофильной бактерии Pyrococcus в одну рамку считывания между геном белка, связывающего мальтозу, и частью гена парамиозина Dirofilaria immitis. Образующийся химерный белок не претерпевал сплайсинга при 12–20°, но при 37–65° сплайсинг индуцировался. Именно с помощью этого подхода удалось обнаружить разветвленные промежуточные соединения, образующиеся при сплайсинге белков. Кроме того, такой подход может стать продуктивным для биотехнологии, так как он позволяет нарабатывать токсические для клетки белки в виде химерных предшественников при низких температурах, которые затем простым повышением температуры быстро превращаются в полезные белковые продукты.
Другие посттрансляционные модификации белков
Среди ковалентных посттрансляционных модификаций пептидов, синтезируемых рибосомами, занимает особое место эпимеризация L-аминокислотных остатков с…Рис. I.45. Схема строения предшественника дермэнкефалина и дерморфина, а также их посттрансляционных модификаций с предполагаемым механизмом реакций
а – посттрансляционные модификации предшественника. Показано, что вслед за сигнальным пептидом в предшественнике располагаются пять высокогомологичных аминокислотных последовательностей, первая из которых является предшественником дермэнкефалина, а четыре других – дерморфина. Цифры обозначают положение аминокислотных остатков, приведенных ниже в однобуквенном коде; б – предполагаемый механизм реакции эпимеризации L-аминокислот в составе пептидов
Много этапов различных преобразований информационных макромолекул и белков отделяют генетическую информацию, заключенную в конкретных генах, от ее реализации в соответствующих фенотипических признаках клетки и организма, располагающих этой информацией. Такая реализация требует точной координации в функционировании многих генетических систем организма на всех основных уровнях экспрессии генов. Многоступенчатый и сложный характер регуляции функционирования генов, особенно у высших организмов, накладывает большие ограничения на возможности получения полноценной экспрессии рекомбинантных генов в гетерологичных системах. Тем не менее, расширение знаний об этих механизмах приближает момент, когда появится возможность целенаправленно изменять или корректировать работу отдельных генов организма, осуществлять наработку их полноценных белковых продуктов в искусственных генетических системах. О некоторых экспериментальных подходах к решению таких задач методами генной инженерии пойдет речь во второй части книги.
Глава 4. ВОСПРОИЗВЕДЕНИЕ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ
Для того чтобы дочерние клетки по своей структуре и функциям были точной копией родительских клеток-предшественников, они должны получить от родительских клеток полный набор генетической информации в виде геномной ДНК, организованной в хромосомы, и внехромосомных генетических элементов (плазмид, митохондриальной и хлоропластной ДНК и т.п.). В связи с этим перед родительскими клетками встает задача создания точной копии генома и ее правильной передачи дочерним клеткам. Создание такой копии геномной ДНК в родительских клетках становится возможным благодаря наличию в них специальных ферментных систем, осуществляющих удвоение молекул ДНК. В результате реализации последовательности ферментативных реакций на матрице родительских ДНК происходит биосинтез дочерних молекул ДНК, которые являются точной копией исходных молекул. Этот процесс удвоения родительских молекул геномной ДНК во время воспроизводства клеток живого организма получил название репликации, или репликативного синтеза ДНК.
Репликация ДНК
При полимеризации дезоксирибонуклеозидтрифосфатов происходит освобождение молекул пирофосфата, который затем расщепляется неорганической… Как и в случае биосинтеза других макромолекул клетки, процесс репликации… В соответствии с моделью Жакоба и соавторов (1963 г.) репликоном называют молекулу ДНК, способную к автономной…Белки, участвующие в репликации ДНК
Процесс репликации ДНК осуществляется с участием множества белков, которые образуют сложный и эффективно работающий репликативный комплекс. В табл. I.16 представлены основные белки и ферменты, входящие в состав репликативного комплекса прокариотических и эукариотических организмов, и указаны их основные функции.
Таблица I.16
Белки, входящие в состав репликативных комплексов прокариотических и эукариотических организмов
В табл. I.16 включены белки наиболее хорошо изученных систем репликации: E. coli и ее бактериофага Т4, а также вируса SV40, размножающегося в…Репликативная вилка E. coli и бактериофага T4
Рис. I.46. Схема функционирующей репликативной вилки E. coli и эукариот и основных этапов репликации ДНК
а – репликативная вилка с основными белками репликации, в которой димер ДНК-полимеразы синхронно реплицирует обе цепи ДНК; б – этапы репликации (1–8) отстающей цепи ДНК. Этап 7 у эукариот является гипотетическим
Из-за антипараллельности и комплементарности цепей ДНК механизм репликации этих двух цепей существенно различается. Действительно, ДНК-полимераза обладает способностью синтезировать ДНК только в одном направлении: от 5’-конца к 3’-концу, перемещаясь вдоль ДНК-матрицы в направлении 3’®5’. В то же время комплементарные цепи ДНК противоположно направлены (антипараллельны), и в силу своих свойств ДНК-полимераза не может реплицировать молекулу ДНК, просто перемещаясь от одного конца матричного дуплекса к другому. Для разрешения этого противоречия репликативный комплекс использует изящный механизм. На одной цепи ДНК синтез новой цепи происходит непрерывно, и образующаяся цепь называется ведущей, тогда как синтез другой цепи осуществляется прерывисто в виде коротких фрагментов, получивших название фрагментов Оказаки в честь ученого, впервые их открывшего. Эта вновь синтезируемая цепь ДНК называется отстающей. И хотя фрагменты Оказаки также синтезируются в направлении 5’®3’, перемещение работающей ДНК-полимеразы вдоль матричной цепи ДНК при синтезе каждого индивидуального фрагмента Оказаки должно быть противоположным тому, которое имеет место в случае синтеза ведущей цепи. Образующиеся фрагменты Оказаки отстающей цепи далее соединяются друг с другом с помощью ДНК-лигазы.
Репликативный комплекс, который осуществляет синтез ведущей цепи ДНК, включает в себя минимальный (кор-) фермент ДНК-полимеразы III (белок 43 в случае фага Т4), подвижный связывающий b-белок с молекулярной массой 41 кДа ("sliding clamp", белок 45 у фага Т4) и белки g-комплекса, состоящего из пяти полипептидов gdd‘cy (скрепляющие белки – brace proteins). Функциональным аналогом белков g-комплекса у бактериофага Т4 служит комплекс белковых продуктов генов 44/62. При облучении клеток E. coli УФ-светом в них индуцируется синтез укороченного b*-белка (26 кДа), который является продуктом того же гена, что и b-субъединица холофермента ДНК-полимеразы III. По-видимому, функциональная роль b*-белка заключается в обеспечении репликации ДНК на матрице, поврежденной УФ-светом.
При синтезе ведущей цепи ДНК репликативный комплекс E. coli функционирует весьма эффективно с высокой процессивностью. Напомним, что мерой процессивности является длина фрагмента вновь синтезированной макромолекулы, которую комплекс (или индивидуальные ферменты) способен образовывать в одном цикле, не диссоциируя от матрицы. Установлено, что холофермент ДНК-полимеразы III, в состав которого входят минимальный фермент (субъединицы a, q и e), b-белок, белки g-комплекса и t-белок, синтезирует ведущую цепь ДНК длиной в 50000 нуклеотидов со скоростью >500 нуклеотидов в секунду в одном цикле, ни разу не диссоциируя от ДНК-матрицы. Точность репликации ДНК холоферментом ДНК-полимеразы III поражает воображение. Частота ошибочных включений нуклеотидов не превышает 10-9–10-10 на нуклеотид за один раунд репликации. В то же время очищенные каталитические субъединицы реплицируют ДНК с пониженной точностью. В частности, изолированная a-субъединица допускает ошибки в опытах in vitro с частотой ~610-1 на нуклеотид за один раунд репликации. Частота ошибок, возникающих в ДНК, облученной УФ-светом, одна и та же в ведущей и отстающей цепях вновь синтезируемой ДНК in vivo.
Роль g-комплекса заключается в распознавании РНК-затравок (праймеров) на матричной ДНК. g-Комплекс связывается с единственным праймером ведущей цепи ДНК или с каждым из праймеров фрагментов Оказаки отстающей цепи, что, в свою очередь, делает возможным присоединение к промаркированным таким образом праймерам минимального фермента ДНК-полимеразы и b-белка (см. рис. I.46,б).
Две молекулы b-белка входят в состав репликативного комплекса вслед за белками g-комплекса, связываясь с ДНК позади белков g-комплекса и оставляя 3’-конец праймера доступным для ДНК-полимеразы. Димер b-белка образует кольцо вокруг молекулы ДНК и стимулирует АТРазную активность белков g-комплекса. Как уже упоминалось выше, функциональный аналог b-белка – продукт гена 45 бактериофага Т4, образует такую же пространственную структуру, охватывающую молекулу ДНК тремя молекулами. Молекулярная масса белка 45 составляет 2/3 от таковой b-мономера, и их аминокислотные последовательности негомологичны друг другу. Тем не менее, четвертичные структуры этих полипептидов и механизмы их функционирования обладают большим сходством.
b-Белки и белки g-комплекса, будучи связанными с дуплексом праймер–матрица, обеспечивают присоединение к этому комплексу минимального фермента ДНК-полимеразы. Затем ДНК-полимераза при наличии доступных четырех дезоксирибонуклеозидтрифосфатов, используя праймер для инициации синтеза ДНК, с высокой эффективностью синтезирует цепь ДНК, комплементарную ДНК-матрице. Те же самые белки участвуют и в синтезе отстающей цепи ДНК. В этом случае прерывистый синтез ДНК многократно инициируется на большом количестве праймеров, и ДНК синтезируется в виде фрагментов Оказаки длиной ~1000 нт. Синтез затравок, представляющих собой короткие последовательности РНК, обеспечивает продукт гена dnaG (белок 61 фага Т4). ДНК-полимераза начинает элонгацию цепей ДНК, присоединяя первый дезоксирибонуклеозидмонофосфат к 3’-концевому нуклеотиду РНК-затравки. В процессе элонгации участвуют b-белок и белки g-комплекса, которые перемещаются вдоль молекулы ДНК вместе с каталитической субъединицей ДНК-полимеразы.
Ведущая и отстающая цепи ДНК реплицируются координированно, что обеспечивается димеризацией ДНК-полимеразных комплексов. В таком димере, который образуется при участии t-белка, один ДНК-полимеразный комплекс осуществляет непрерывный синтез ведущей цепи ДНК, а другой – фрагментов Оказаки отстающей цепи. Для димеризации ДНК-полимеразы III E. coli необходим t-белок, в то время как продукт гена 43 бактериофага Т4, по-видимому, изначально находится в виде димера. Другое различие репликативных комплексов E. coli и фага Т4 заключается в том, что холофермент ДНК-полимеразы E. coli (субъединицы aeq·gdd‘·cy·t·b) сохраняется в виде стабильного комплекса и в отсутствие ДНК, тогда как холофермент Т4-ДНК-полимеразы существует только в присутствии матрицы.
Необычность ситуации во время синтеза ДНК в репликативной вилке заключается в том, что один и тот же белковый комплекс осуществляет как высоко процессивный непрерывный синтез ведущей цепи ДНК, так и прерывистый синтез фрагментов Оказаки отстающей цепи, претерпевая во втором случае периодическую диссоциацию от матрицы для инициации синтеза ДНК с каждого нового праймера. Для объяснения такого парадокса предположили, что холофермент ДНК-полимеразы способен узнавать 5’-конец каждого РНК-праймера, встречающегося после завершения синтеза очередного фрагмента Оказаки во время образования отстающей цепи ДНК в процессе репликации. Недавно с помощью оригинального экспериментального подхода удалось решить этот вопрос. В участок полипептидной цепи b-белка, контактирующий с минимальным ферментом ДНК-полимеразы III, методами генной инженерии ввели аминокислотную последовательность, узнаваемую и фосфорилируемую протеинкиназой. Измеряя скорость фосфорилирования этих сайтов в условиях избытка протеинкиназы во время синтеза ДНК in vitro, определили кинетику ассоциации и диссоциации комплексов b-белок–ДНК-полимераза по изменению уровня защищенности сайтов фосфорилирования от действия протеинкиназы. Полученные результаты интерпретировали таким образом, что во время связанного с синтезом фрагментов Оказаки перемещения минимального фермента ДНК-полимеразы и g-комплекса вдоль одноцепочечной ДНК-матрицы, покрытой SSB-белком, оба белка прочно связаны с b-белком и матрицей. При встрече репликативного белкового комплекса с дуплексом, образованным матричной ДНК и РНК-затравкой, b-белок остается связанным с вновь синтезированной ДНК, а у отделившихся ДНК-полимеразы и белков g-комплекса появляется возможность вступить в новый цикл синтеза фрагмента Оказаки путем взаимодействия с очередным дуплексом РНК-затравка–матрица. При этом вхождение ДНК-полимеразы в новый репликативный комплекс облегчается наличием в нем b-белка и белков g-комплекса, ассоциированных с очередным РНК-праймером. Таким образом, холофермент ДНК-полимеразы III обладает способностью распознавать молекулярное окружение, создаваемое матричной ДНК, осуществлять терминацию синтеза ДНК при наличии сигнала в виде дуплекса ДНК–затравка и реинициировать синтез ДНК на следующем праймере. В итоге одна и та же молекула ДНК-полимеразы III в составе реплицирующего комплекса способна проводить синтез всех фрагментов Оказаки отстающей цепи реплицируемой ДНК, последовательно осуществляя инициацию, терминацию и реинициацию синтеза каждого из них.
После очередной терминации синтеза ДНК отстающей цепи 3’-конец вновь синтезированной ДНК оказывается вплотную приближенным к 5’-концу праймера следующего фрагмента Оказаки. Для соединения двух фрагментов с помощью ДНК-лигазы необходимы предварительное удаление РНК-праймера и достройка цепи ДНК в образующейся бреши. РНК-затравка удаляется с помощью РНКазы H, нуклеазы, специфически расщепляющей РНК в ДНК–РНК-гибридах, и(или) с участием 5’®3’-экзонуклеазы ДНК-полимеразы I. Во втором случае одновременно с удалением праймера происходит застройка образующейся бреши той же ДНК-полимеразой. В итоге два соседних фрагмента Оказаки вплотную приближаются друг к другу и оказываются отделенными лишь одноцепочечным разрывом, который может репарироваться ДНК-лигазой. В настоящее время остается открытым вопрос о механизмах координации удаления РНК-праймеров из фрагментов Оказаки с самим процессом репликации ДНК.
Кроме вышеупомянутых дуплексов праймеры–ДНК, холоферменты бактериальных и фаговых ДНК-полимераз, по-видимому, способны адекватно реагировать на другие стерические препятствия, возникающие на пути следования вдоль реплицируемой молекулы ДНК. В частности, ДНК-полимераза фага Т4 в процессе репликации может расходиться с транскрибирующими ту же ДНК молекулами РНК-полимеразы, не диссоциируя из репликативного комплекса и не вытесняя РНК-полимеразу с матрицы. Кроме того, репликативный комплекс может распознавать повреждения ДНК, возможно, маркированные специфическими белками, и прекращать репликацию соответствующего участка, останавливаясь или диссоциируя от матрицы. Репликация таких участков ДНК возобновляется после ликвидации повреждений ферментами репаративной системы. Для диссоциировавшей ДНК-полимеразы это становится возможным благодаря тому, что 3’-конец вновь синтезированной цепи ДНК в месте остановки репликации остается связанным с b-белком, который облегчает повторное вхождение диссоциировавшей ДНК-полимеразы в репликативный комплекс.
Особенности функционирования репликативной вилки эукариот
У эукариот обнаружены шесть ДНК-полимераз, три из которых – a, d и e – непосредственно участвуют в репликации хромосомной ДНК (табл. I.17).… Белок PCNA и фактор репликации C (RFС) также образуют стабильный комплекс с… Таблица I.16Эукариотические ДНК-полимеразы и их функциональные гомологи у прокариот
Роль ДНК-полимеразы e в настоящее время не ясна. Возможно, этот фермент непосредственно участвует в репликации или в сопряженной с репликацией… ДНК-полимераза z обнаружена в 1996 г. у дрожжей S. cerevisiae. При… ДНК-полимераза η, так же как и предыдущий фермент, участвует в SOS-ответе дрожжей на генотоксические воздействия.…Регуляция репликации ДНК
Синтез ДНК тесно связан с другими процессами, подготавливающими деление клеток, так как передача необходимой генетической информации родительских… Политенизация хромосом представляет обширный класс генетических явлений,… Характерными примерами возрастания числа генов вследствие их избирательной репликации являются магнификация генов рРНК…Инициация репликации ДНК у E. coli и ее регуляция
Структура области начала репликации oriC. Хромосома E. coli содержит единственную область начала репликации (origin), названную oriC, на которой… В левой части oriC находится AT-богатая область, содержащая три похожих… OriC содержит сайты связывания белков, изгибающих ДНК, IHF (integration host factor) и FIS (factor for inversion…Регуляция репликации плазмиды ColE1
Область начала репликации небольшой плазмиды ColE1, несущей гены устойчивости к колицинам, традиционно используется в генной инженерии при… Инициация репликации плазмиды ColE1. Репликация плазмиды ColE1 происходит в… Все три механизма инициации репликации плазмиды основаны на уникальном свойстве РНК II образовывать стабильный…Рис. I.48. Схема регуляции репликации плазмиды ColE1
а – предполагаемая вторичная структура РНК II, после транскрибирования РНК-полимеразой ~ 500 нуклеотидов ДНК плазмиды; дальнейшее удлинение РНК II сопровождается образованием ДНК–РНК-гибрида (жирная стрелка) между РНК II и транскрибируемой ДНК;
б – возможный механизм контроля репликации плазмиды. В верхней части рисунка изображена генетическая карта участка ДНК, необходимого для инициации репликации плазмидной ДНК и ее контроля. Схематически представлены пространственные структуры двух ингибиторов репликации плазмиды: РНК I и белка Rop. В нижней части изображены две альтернативные конформации РНК II, образующиеся под действием РНК I, I–X – элементы вторичной структуры
Контроль числа копий плазмиды ColE1.Контроль инициации репликации плазмиды ColE1 осуществляется главным образом на уровне изменения пространственной структуры РНК II. Поскольку плазмиды контролируют собственный биосинтез, т.е. их репликация проходит по аутокаталитическому механизму, было постулировано, что инициация репликации ColE1 находится под влиянием ингибитора, кодируемого плазмидой, концентрация которого в клетке тем выше, чем больше число внутриклеточных копий плазмиды. Действительно, анализ механизмов репликации мутантных плазмид, для которых характерна высокая копийность, позволил выявить два транс-действующих фактора, кодируемых плазмидой и оказывающих влияние на репликацию плазмиды in vivo.
Основным ингибитором репликации оказалась небольшая РНК длиной в 108 нуклеотидов, названная РНК I, полностью комплементарная 5’-концевой последовательности предшественника праймера (РНК II). Промотор гена РНК I расположен в области начала репликации плазмиды ColE1 и направлен в противоположную сторону по отношению к промотору РНК II (см. рис. I.48). Комплементарные взаимодействия между РНК I и РНК II оказывают влияние на образование пространственной структуры РНК II таким образом, что предпочтительно возникает конформация βγ, неактивная в отношении инициации репликации (см. рис. I.48,б, внизу справа).
Взаимодействие между РНК I и РНК II происходит продуктивно лишь до тех пор, пока синтезируется короткий транскрипт РНК II длиной не более 80 нуклеотидов. Хотя взаимодействие РНК I с такой короткой последовательностью нуклеотидов происходит медленнее, чем с транскриптом длиной в 360 нуклеотидов, в последнем случае РНК I не оказывает влияния на конформацию 5’-концевой части РНК II и на ее способность функционировать в качестве затравки при репликации плазмиды (конформация αβ, рис. I.48,б, внизу слева). Из этого ясно, что скорость образования гибридов между РНК I и РНК II является определяющей для эффективного функционирования механизма регуляции репликации плазмиды. Процесс взаимодействия РНК I и РНК II в настоящее время детально изучен. Он проходит через образование нескольких промежуточных продуктов и завершается получением стабильного гибрида между полностью комплементарными друг другу РНК I и 5’-концевой областью РНК II.
РНК-организующий белок Rop. Ген второго компонента, негативно регулирующего репликацию плазмиды ColE1, картирован непосредственно за областью начала репликации. Этот ген кодирует 63-звенный белок, названный Rop (repressor of primer), существующий в растворе в виде димера. Как in vivo, так и in vitro Rop усиливает ингибирующую активность РНК I, не оказывая влияния на синтез РНК II. При этом Rop влияет на начальные фазы взаимодействия РНК I и РНК II, облегчая переход очень нестабильного промежуточного продукта С* в более стабильный – Сm*. Белок Rop обладает высоким сродством к С* и лишь слабо взаимодействует с изолированными РНК I и РНК II in vitro. Предполагают, что Rop проявляет незначительную специфичность в отношении последовательностей нуклеотидов и распознает некоторые общие особенности структуры комплекса РНК I–РНК II, возникающего на ранних этапах их взаимодействия. Таким образом, функции белка Rop, по-видимому, заключаются в преобразовании нестабильного комплекса РНК–РНК в более стабильный, что, в свою очередь, сопровождается подавлением формирования праймера, необходимого для инициации репликации плазмиды ColE1.
Использование антисмысловых РНК в контроле репликации бактериальных плазмид является распространенным приемом. В частности, репликация небольшой, низкокопийной плазмиды R1 контролируется белком RepA, который участвует в инициации репликации плазмиды в качестве позитивного регуляторного фактора. Синтез RepA, в свою очередь, регулируется посттранскрипционно с помощью небольшой антисмысловой РНК CopA, которая связывается с RepA-мРНК в результате многоступенчатой реакции, напоминающей образование гибрида между РНК I и РНК II, рассмотренное выше. Такое взаимодействие подавляет экспрессию гена repA, возможно, вследствие расщепления РНК–РНК-дуплекса РНКазой III. Внутриклеточная концентрация антисмысловой CopA-РНК прямо пропорциональна числу копий плазмиды R1. Аналогичный механизм описан и для регуляции инициации репликации плазмиды pT181 Staphylococcus aurеus.
При получении бактериальных векторов для генной инженерии, многие из которых содержат область начала репликации плазмиды ColE1, с целью повышения числа их копий в бактериальных клетках часто используют ингибиторы биосинтеза белка, в частности хлорамфеникол. После обсуждения механизмов регуляции контроля репликации этой плазмиды становятся понятными принципы, на которых основан данный прием. Действительно, внесение в культуральную среду хлорамфеникола блокирует биосинтез бактериальных белков, в том числе, и белка Rop, который необходим для эффективного подавления инициации репликации плазмиды под действием РНК I. В результате нарушается контроль копийности плазмид в бактериальных клетках, и они начинают непрерывно реплицироваться, используя для этой цели предварительно синтезированные бактериальные белки.
Известно, что две фенотипически различающиеся плазмиды, использующие одинаковый механизм контроля репликации, несовместимы в одной бактериальной клетке. Клетки, содержащие две плазмиды из разных групп совместимости, в процессе размножения быстро образуют две популяции, каждая из которых содержит только один тип плазмид. Это происходит вследствие случайного выбора плазмид для репликации внутри бактериальных клеток и случайного распределения исходного пула плазмид по дочерним клеткам. Эволюционное возникновение механизма контроля репликации бактериальных плазмид с использованием антисмысловых РНК расширило возможности появления плазмид, принадлежащих к разным группам совместимости и сосуществующих в одних и тех же бактериальных клетках. Действительно, несмотря на использование одного и того же механизма, антисмысловые РНК, обладающие разными последовательностями нуклеотидов, не смогут узнавать "чужие," гетерологичные РНК-мишени. Это позволяет таким плазмидам сосуществовать в одной бактериальной клетке и создает условия для их более широкого распространения в природных популяциях микроорганизмов.
Особенности репликации линейных геномов
Рис. I.49. Проблема репликации отстающей цепи ДНК линейных хромосом
1 – отстающая цепь реплицирующейся ДНК синтезируется с использованием фрагментов Оказаки, содержащих на 5’-концах РНК-затравки (зачерненные прямоугольники); 2 – по завершении синтеза затравки удаляются и фрагменты лигируются с образованием бреши на 5’-конце вновь синтезированной цепи ДНК, прилегающем к концу хромосомы
Линейные хромосомы бактерий
Линейные хромосомы и плазмиды наиболее хорошо изученных бактерий рода Streptomyces содержат концевые инвертированные повторы (terminal inverted…Рис. I.50. Модель достройки теломерных участков хромосом и плазмид Streptomyces
а – структура теломеры после репликации: верхняя цепь ДНК полностью реплицирована, в нижней имеется одноцепочечная брешь, обозначены четыре палиндромные последовательности нуклеотидов; б – маловероятный механизм с участием концевого белка и ДНК-полимеразы; в–д – альтернативные модели репликации, основанные на других механизмах. 1 – концевой белок, 2 – ДНК-полимераза, 3 – палиндром, 4 – родительская цепь ДНК, 5 – дочерняя цепь, 6 – репаративный синтез
В соответствии с первой моделью одноцепочечный участок теломеры, содержащий TIR-последовательность, образует концевую шпильку путем комплементарных взаимодействий нуклеотидов внутренних участков бреши и 3’-концевых нуклеотидов (см. рис. I.50,в). В этом случае синтез ДНК, репарирующий одноцепочечную брешь, инициируется на двухцепочечном участке, образованном палиндромными последовательностями I-IV, с участием ТР и ДНК-полимеразы и продолжается вдоль 3’-концевого одноцепочечного участка хромосомы. Согласно второй модели ТР инициирует репликацию на полностью двухцепочечной дочерней ДНК, вытесняя 5’-концевую цепь родительской ДНК, с которой связан ТР (см. рис. I.50,г). Вытесняемая цепь далее спаривается с выступающим 3’-концом хромосомы, после чего такая разветвленная структура разрешается с помощью гомологичной рекомбинации. Эта модель предполагает участие в заполнении брешей белка RecA (для переноса цепи ДНК) и продуктов генов ruv (для разрешения структуры Холидея), что подтверждается генетическими данными. В третьей модели одноцепочечный палиндром I образует шпильку, 3’-конец которой служит затравкой для синтеза ДНК, в результате которого заполняется брешь (см. рис. I.50,д). ТР образует одноцепочечный разрыв напротив первоначального 3’-конца, который является затравкой для последующего синтеза ДНК. В результате шпилька разворачивается и восстанавливается структура теломеры. Эта модель аналогична модели "катящейся шпильки", предложенной для объяснения механизма репликации генома парвовирусов. В данной модели роль ТР отличается от его функций в качестве белка-затравки в рассмотренных выше примерах.
Неизвестно, как много форм линейных бактериальных хромосом существует в природе. Не изучены и таксономические проблемы, связанные с топологией хромосом в царстве эубактерий. Если каждый тип хромосом характерен для отдельного таксономического домена, то можно предполагать, что топология хромосом играет важную роль в эволюции бактерий. Альтернативно топологические взаимопревращения хромосом могут быть относительно частыми событиями, а линейные и кольцевые хромосомы присутствуют только у близких видов бактерий. Нестабильность хромосом стрептомицетов (образование протяженных делеций и амплификация последовательностей нуклеотидов) недавно стали связывать с перестройками в их концевых участках, часть из которых сопровождалась образованием кольцевых хромосом. Таким образом, эволюционная роль топологии бактериальных хромосом может быть определена только в результате будущих исследований.
Репликаторы эукариот
Рис. I.51. Структура репликаторов дрожжей S. cerevisiae
Обозначено взаимное расположение различных регуляторных элементов в репликаторах ARS1, ARS307 и ARS305. ACS – каноническая последовательность ARS, DUE – ДНК-расплетающий элемент. Подстрочные индексы указывают на принадлежность регуляторных элементов соответствующим репликаторам
Инициация репликации у эукариот происходит на специфических множественных последовательностях нуклеотидов – репликаторах. Наиболее изученными являются репликаторы дрожжей S. cerevisiae, впервые идентифицированные как автономно реплицирующиеся последовательности (ARS – autonomously replicating sequence), способные поддерживать внехромосомную репликацию плазмид в дрожжевых клетках. Исследование структуры ARS1 показало, что этот хромосомный элемент состоит из нескольких коротких регуляторных последовательностей. Аналогичная организация характерна и для других ARS дрожжей (рис. I.51). В частности, ARS307 в дополнение к канонической последовательности ACS, общей для всех ARS, содержат еще два элемента – B1 и B2, которые необходимы для выполнения репликатором своих функций in vivo. Несмотря на то что эти последовательности в разных репликаторах не строго консервативны, внутри групп (B1, B2 и т.п.) они функционально взаимозаменяемы. Изменение положения по отношению к ACS предотвращает их функционирование.
Первым этапом инициации репликации у дрожжей является взаимодействие регуляторных последовательностей репликатора, по крайней мере, с шестью различными белками, которые образуют комплекс, распознающий область начала репликации ORС (origin-recognition complex). ARS определяет место инициации репликации в клетках дрожжей. Элемент B3 ARS1 взаимодействует с белком Abf1, который стимулирует репликацию доменом, характерным для белков-активаторов транскрипции, тогда как B1 взаимодействует с ORC. Остающиеся регуляторные последовательности области начала репликации дрожжей образуют ранее неизвестный элемент, названный ДНК-расплетающим элементом DUE (DNA-unwinding element), который, как полагают, облегчает раскручивание цепей ДНК при инициации репликации. Точковые мутации в элементе B2 не влияют на функции репликатора, что является общим свойством структурных элементов, тогда как мутации в ACS, B1 и B3 нарушают инициацию репликации, как и следовало ожидать от регуляторных элементов нуклеиновых кислот, взаимодействующих с белками.
Исследования репликаторов у дрожжей S. pombe показали, что область начала репликации ura4 включает в себя три отдельных репликатора, которые располагаются на участке ДНК длиной в 5 т.п.о. У млекопитающих области начала репликации располагаются на расстоянии ~100 т.п.о. друг от друга; часть их уже удалось клонировать и изучить на молекулярном уровне. Установлено, что синтез ДНК в отдельных репликонах происходит по двум направлениям, причем перемещение репликативной вилки осуществляется предпочтительно в одном направлении, которое может изменяться в зависимости от стадии развития организма и уровня экспрессии генов, содержащих репликаторы. Частота использования отдельных репликаторов изменяется в онтогенезе, уменьшаясь в клетках взрослого организма. Сравнение первичных структур шести отдельных репликаторов эукариот показало, что все они содержат DUE-элементы, участки прикрепления к ядерному матриксу (SAR/MAR), канонические ARS-последовательности дрожжей, пиримидиновые тракты, а также ранее неидентифицированную каноническую последовательность WAWTTDDWWWDHWGWHMAWTT, где W = A/T, D = A/C/T, H = A/C/T, a M = A/C. Имеются отдельные сообщения о том, что в репликаторах животных присутствуют пуриновые тракты, канонические последовательности, взаимодействующие с факторами транскрипции и белками репликативного комплекса, энхансерный октамерный мотив, сайты связывания продуктов онкогенов, AT-богатые последовательности и участки перегибов (bent) ДНК. В настоящее время до конца непонятно, какое непосредственное отношение имеют все эти регуляторные последовательности к инициации репликации ДНК. Предполагается, что многие из них участвуют в регуляции транскрипции (а следовательно, и регуляции экспрессии генов) как таковой, поскольку большинство из известных в настоящее время репликаторов локализованы в 5’-концевых последовательностях функционирующих генов.
Репликация теломерных участков эукариотических хромосом
Рис. I.52. Механизм функционирования теломеразы
Изображено комплементарное взаимодействие внутренней матричной молекулы РНК теломеразы с ДНК теломерного участка хромосомы
Синтез теломерных последовательностей ДНК осуществляется специальными ферментами – теломеразами, для которых нет аналогов среди других известных нуклеотидилтрансфераз. Особенностью этих ферментов является присутствие у них в качестве составной части короткого фрагмента РНК – компонента, абсолютно необходимого для их функционирования и служащего матрицей при синтезе теломерных последовательностей хромосом (рис. I.52). Комплементарное взаимодействие внутренней РНК теломеразы с 3’-концевым выступающим одноцепочечным сегментом ДНК хромосомы инициирует синтез теломерных последовательностей. При этом 3’-концевой фрагмент ДНК служит затравкой для удлинения этой ДНК на РНК-матрице. После удлинения (элонгации) выступающей цепи ДНК до конца матрицы происходит транслокация фермента на один теломерный повтор вперед относительно матрицы с освобождением последовательности матричных нуклеотидов, после чего он готов для вступления в следующий цикл элонгации только что добавленной 3'-концевой последовательности хромосомы. После завершения удлинения одноцепочечной 3'-концевой теломерной последовательности вторая цепь ДНК достраивается обычным способом. Таким образом происходит решение "проблемы отстающей цепи ДНК" при репликации ДНК у эукариот.
Наличие у животных тканеспецифичности в распределении теломер по размерам, а также изменение размеров этих последовательностей в онтогенезе предполагают существование механизмов, регулирующих данный процесс. Создается впечатление, что для активной пролиферации клеток теломерные последовательности не должны становиться короче определенного порогового размера. Недавние исследования обнаружили резкое повышение активности теломераз, характерное для опухолевых клеток, что служит в настоящее время чувствительным физиологическим маркером их злокачественного перерождения. В этой связи сегодня в качестве одного из подходов к терапии опухолей рассматривают подавление активности теломераз, функционирование которых, как полагают, необходимо для иммортализации клеток и роста опухолей. Именно благодаря таким свойствам теломеразы в последнее время вызывают особый интерес, что сопровождается расширением исследований в данной области молекулярной генетики.
Пространственная организация синтеза ДНК у эукариот
Роль ядерных пространственных структур в обеспечении функциональных свойств ДНК можно рассмотреть на примере репликации хромосом в ооцитах Xenopus… В нормальных соматических клетках не все центры репликации одновременно…Глава 5. ЗАЩИТА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ
Существование биологических видов, а следовательно, и феномена жизни как такового целиком зависит от точности передачи генетической информации как по вертикали – от организмов-родителей потомкам, так и по горизонтали – от одной соматической клетки к другой в процессе онтогенетического развития многоклеточных организмов. В предыдущей главе были рассмотрены основные механизмы функционирования главной генетической системы, обеспечивающей воспроизведение генетической информации путем удвоения молекул ДНК, – системы репликации, точность функционирования которой поражает воображение. Для правильной передачи генетической информации исключительно важны и молекулярные механизмы, обеспечивающие расхождение удвоившихся хромосом между дочерними клетками у про- и эукариот, в последнем случае при митозе и мейозе. Однако ни одна из существующих генетических систем не работает безошибочно. Поэтому не менее важную роль в жизнедеятельности организма играет его система репарации (исправления) ошибок, случайно возникающих при репликации ДНК и после ее завершения.
У проблемы точности передачи генетической информации в ряду поколений клеток и организмов имеется и другая сторона. Чрезмерная консервация генетической информации, заключенной в отдельных генетических локусах, может быть вредной для организма и вида в целом. В частности, одним из механизмов, лежащих в основе возникновения разнообразия антител, являются запрограммированные изменения генов иммуноглобулинов, которые закрепляются в геноме лимфоцитов в результате их отбора в онтогенезе. Высокий темп изменений некоторых генетических локусов у паразитических организмов, например у трипаносом, в результате которых меняется структура антигенных детерминант на поверхности их клеток, необходим для их выживания, так как помогает этим организмам избежать нейтрализующего действия иммунной системы организма-хозяина. Другим хорошо известным примером такого рода является генетическая изменчивость вируса гриппа. Наконец, абсолютный консерватизм в передаче генетической информации по вертикали сделал бы невозможным филогенетическое развитие организмов, их эволюционные преобразования, приведшие, в конечном счете, к тому разнообразию биологических видов, которое сегодня наблюдается в природе. Эволюционно сложившиеся отношения между точностью функционирования вышеупомянутых генетических систем и частотой ошибок, возникающих при воспроизведении генетической информации отдельных генетических локусов, четко сбалансированы между собой, и уже установлено, что в ряде случаев являются регулируемыми. Запрограммированные и случайные наследуемые изменения генома, называемые мутациями, могут сопровождаться колоссальными количественными и качественными изменениями в экспрессии генов.
Мутации
Индуцированными мутациями называют наследуемые изменения генома, возникающие в результате тех или иных мутагенных воздействий в искусственных… В классификации, основанной на размерах сегментов генома, подвергающихся… При хромосомных мутациях происходят как изменение числа отдельных хромосом в геноме (анеуплоидия), так и крупные…Основные источники мутаций и методы определения мутагенной активности
Ошибки репликации. Как уже обсуждалось в разделе 4.1, синтез ДНК происходит в результате последовательного ферментативного присоединения… Генетические методы определения частоты ошибок репликации, возникающих в… При другом подходе к определению точности синтеза ДНК in vitro измеряют частоту обратных мутаций, восстанавливающих…Основные классы алкилирующих агентов
| Класс | Представитель | Структурная формула |
| Иприты сернистые | Иприт | S(CH2CH2Cl)2 |
| азотистые | Азотистый иприт | HN(CH2CH2Cl)2 |
| Эпоксиды | Этиленоксид | 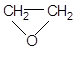
|
| Этиленимины | Этиленимин Триэтиленмеламин | 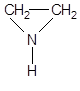 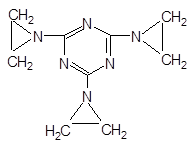
|
| Алкилалкансульфонаты | Этилметансульфонат | C2H5OSO2CH3 |
| Метилметансульфонат | CH3OSO2CH3 | |
| b-Лактоны | b-Пропиолактон | 
|
| Диазосоединения | Диазометан | CH2N ═ N |
| Нитрозосоединения | N-Нитрозо-N-метилуретан Диэтилнитрозамин N-Метил-N-нитро-N-нитрозогуанидин | 
 CH3N(NO)C(=NH)NHNO2
CH3N(NO)C(=NH)NHNO2
|
Алкилирование является одной из возможных химических модификаций нуклеотидов ДНК in vivo под действием экзогенных мутагенов. Число известных химических веществ, способных вызывать модификации нуклеотидов ДНК по другим механизмам, быстро возрастает с расширением исследований в этой области. Среди таких мутагенов следует упомянуть азотистую кислоту, которая образуется из нитритов (NaNO2 и KNO2) в водных растворах при низких значениях pH. Азотистая кислота дезаминирует гуанин до ксантина, аденин до гипоксантина, а цитозин до урацила. В ДНК спаривание урацила с аденином приводит к транзициям GC®AT, гипоксантин вызывает обратную транзицию AT®GC, ксантин же не спаривается ни с одним из пиримидинов ДНК, и его включение оказывается летальным для клетки. Мутагенным действием обладают различные органические перекиси. Сама перекись водорода не оказывает мутагенного эффекта, но становится сильным мутагеном в сочетании с формальдегидом или ацетоном, у которых индуцирует образование свободных радикалов. Азид натрия – мощный ингибитор дыхания, также в ряде случаев обладает мутагенным действием, что связывают с накоплением в процессе метаболизма мутагенных перекисей. Перекиси индуцируют мутации и разрывы хромосом, имитируя мутагенное действие рентгеновских лучей, которые индуцируют образование различных реакционноспособных радикалов. И, наконец, среди химических мутагенов необходимо упомянуть аналоги нуклеозидов и оснований: 5-бромдезоксиуридин и 2-аминопурин, являющиеся сильными мутагенами. Спаривание с аденином 5-бромдезоксиуридина, обычно включающегося в ДНК вместо цитозина, приводит к образованию транзиций GC®AT. Обратные транзиции AT®GC возникают под действием 2-аминопурина.
Красители, обладающие способностью интеркалировать между основаниями ДНК, вызывают мутации со сдвигом рамки считывания. К таким красителям, в частности относятся хорошо известные бромистый этидий и производные акридина.
Промутагены, проканцерогены и их метаболическая активация. Рассмотренные выше химические соединения изначально обладают мутагенной активностью и для ее проявления не требуют каких-либо дополнительных модификаций. Однако существует множество химических соединений, которые сами по себе не проявляют мутагенную активность, но приобретают ее после серии биохимических превращений внутри организма под действием его ферментных систем. Такие химические соединения получили название промутагенов, а процесс их ферментативного превращения в мутагены – метаболической активации.
Любой организм в течение жизни подвергается непрерывной атаке экзогенными чужеродными химическими соединениями – ксенобиотиками, для защиты от накопления которых у него имеются эффективные ферментативные механизмы. Процесс метаболизма ксенобиотиков в организме традиционно разделяют на две фазы. Поскольку многие опасные для здоровья ксенобиотики гидрофобны и имеют тенденцию к накоплению в липидах клеточных мембран, обе фазы их внутриклеточного метаболизма связаны, прежде всего, с введением в их молекулы гидрофильных химических групп. Последующее повышение растворимости этих соединений в биологических жидкостях облегчает их выведение из организма. Таким образом, во время первой фазы метаболизма ксенобиотиков происходит ферментативное введение в их молекулы небольших полярных групп (например гидроксильных), что делает молекулы ксенобиотиков более водорастворимыми. С другой стороны, такие реакции подготавливают молекулы ксенобиотиков для вступления во вторую фазу метаболизма, во время которой происходит конъюгация преобразованных в первой фазе молекул ксенобиотиков с еще более полярными химическими группировками, в частности с остатками глюкуроновой кислоты, сульфатов или глицина.
Среди ферментов, принимающих участие в первой фазе метаболизма ксенобиотиков, наиболее хорошо изученными являются цитохромы группы Р-450. Эти ферменты в организме представлены большим числом (>20) изоформ, каждая из которых, как правило, обладает широкой субстратной специфичностью, а все вместе они способны метаболизировать множество экзогенных и эндогенных химических соединений. Обобщенное уравнение химической реакции, осуществляемой цитохромами Р-450, представлено ниже:
S + NAD(P)H + O2 ® SO +NAD(P)+ + H2O,
где S – молекула субстрата, а SO – ее окисленная форма. Таким образом, для окисления субстрата цитохром Р-450 чаще всего использует электроны свободного кислорода, поступление которых к ферменту опосредовано NAD(P)H и флавопротеиновой редуктазой. Молекулы цитохрома Р-450 интегрированы в мембраны и при гомогенизации клеток ассоциированы с фракцией микросом. На рис. I.53 представлен механизм метаболической активации 1,2-бензпирена (БП) – одного из наиболее сильных проканцерогенов. БП широко распространен в окружающей среде и в больших количествах образуется при горении нефтепродуктов, табака, а также при других термических воздействиях на органические соединения. Метаболические превращения БП по эпоксид-диольному пути начинаются с его эпоксидирования в положении 7,8 определенной изоформой цитохрома Р-450, ассоциированной с мембранами микросом. Полученный эпоксид гидролизуется эпоксидгидролазой в соответствующий диол БП. Далее под действием другой изоформы цитохрома Р-450 происходит образование предпочтительно двух диастереомеров эпоксида в положении 9,10 и других минорных производных (соединения в фигурных скобках, см. рис. I.53). Оказалось, что изомер (+)-анти-БПДЭ как in vitro, так и in vivo нестабилен и ковалентно связывается преимущественно с N2-атомом дезоксигуанозина ДНК своим С10-атомом с образованием аддуктов БПДЭ-ДНК.
Рис. I.53. Механизм метаболической активации 1,2-бензопирена (БП) микросомами животных
БПДЭ – 9,10-эпоксид-1,2-бензопирен-7,8-дигидродиола, Р-450 – цитохром Р-450, ЭГ – эпоксидгидролаза
Механизм метаболической активации БП подробно рассмотрен здесь для иллюстрации общих принципов химического мутагенеза. Метаболическая активация ксенобиотиков с образованием реакционноспособных метаболитов является одной из основных причин генотоксичности множества химических соединений окружающей среды, с которыми организм контактирует на протяжении всей жизни. Список химических мутагенов экзогенного происхождения далеко не исчерпывается перечисленными химическими соединениями. По мере углубления исследований число известных мутагенов непрерывно растет благодаря созданию высокочувствительных методов оценки мутагенной активности. Известно, что почти все мутагены одновременно являются канцерогенами – веществами, вызывающими возникновение злокачественных опухолей, хотя обратное утверждение не всегда верно. Все это объясняет необходимость сохранения чистоты среды обитания человека, животных и растений.
Эндогенные мутагены. Выше уже упоминалось, что молекулы ДНК часто претерпевают in vivo тепловую депуринизацию, которая может быть спонтанным внутренним источником измененных нуклеотидов. Другим источником эндогенных мутаций служит самопроизвольное дезаминирование цитозина в составе ДНК с образованием урацила. 5-Метилцитозин – одно из модифицированных оснований ДНК, представляет собой "горячую точку" возникновения мутаций путем спонтанного дезаминирования, так как в результате удаления его аминогруппы образуется нормальное основание T, не распознаваемое системами репарации как мутантное.
К сожалению, не только окружающая среда может быть источником генотоксических химических соединений, отравляющих жизнь организма и нарушающих функционирование его генома. Свободные радикалы, которые образуются в организме во время нормального метаболизма, могут быть дополнительной и существенной причиной спонтанных мутаций. В частности, частота повреждений нуклеотидов ДНК, появляющихся под действием свободных радикалов кислорода, приближается к частоте мутаций, возникающих при депуринизации ДНК. В клетках свободные радикалы кислорода возникают в реакциях восстановления, в результате которых появляются чрезвычайно реакционноспособные промежуточные соединения. Наибольшую опасность для ДНК представляют радикалы гидроксила, супероксид и синглетный кислород, которые образуются в процессе дыхания, фагоцитоза и при повреждении клеток. Путем измерения содержания в моче человека 8-гидроксидезоксигуанозина и тимингликоля – основных модифицированных нуклеозидов и оснований, образующихся под действием радикалов кислорода, было установлено, что ежедневно в каждой клетке человека возникает ~10000 таких модифицированных нуклеотидов, мутагенный эффект которых в настоящее время доказан.
Другим источником эндогенных мутагенов в организме является метаболизм нормальной микрофлоры. Некоторые промежуточные соединения, возникающие при метаболизме аминокислот, желчных кислот и холестерина под действием бактерий организма человека и обладающие мутагенной и канцерогенной активностью, представлены в табл. I.19. Промоторами в канцерогенезе называют вещества, не имеющие канцерогенной активности, но ускоряющие процесс канцерогенеза под действием химических веществ – истинных канцерогенов. Как видно из таблицы, достаточно широк список веществ, обладающих всеми вышеупомянутыми активностями и образующихся под действием нормальной микрофлоры человека, обитающей, в частности в его кишечнике и на слизистых оболочках. Помимо этого в результате метаболизма в бактериальных клетках происходит активация нитратов с образованием мутагенных и канцерогенных N-нитрозаминов в кишечнике, желудке и ротовой полости человека. Описан также гидролиз обезвреженных ферментами детоксикации конъюгатов истинных канцерогенов.
Таким образом, многочисленные мутагены экзогенного и эндогенного происхождения создают вокруг и внутри любого многоклеточного организма тот мутагенный фон, к которому он вынужден приспосабливаться в процессе эволюции. Мутагенный фон "среды обитания" информационных макромолекул и, прежде всего, ДНК уникален для каждого вида живых организмов в силу особенностей их метаболизма и условий жизни. В соответствии с этим каждый биологический вид для того чтобы выжить, т.е. понизить частоту мутаций в конкретных генах до приемлемого уровня, обладает системами защиты от мутаций определенной эффективности. О механизмах функционирования таких систем защиты генетической информации речь пойдет ниже. А пока рассмотрим некоторые методы определения мутагенной активности химических соединений, применяемые для мониторинга окружающей среды.
Таблица I.19
Метаболиты нормальной микрофлоры человека, обладающие мутагенной и канцерогенной активностями
Тест Эймса. Благодаря своей простоте и высокой эффективности он применяется наиболее широко. Принцип метода основан на том, что мутантные… Сестринские хроматидные обмены (СХО). Генотоксическое действие химических…SOS-мутагенез у бактерий
У E. coli мутагенез под действием УФ-света и многих химических веществ происходит в результате координированной экспрессии большого числа генов,… Исследование мутантов E. coli, неспособных к SOS-ответу при УФ-повреждениях,… Белок RecA, кроме двух вышеупомянутых функций в индукции аутокаталитического расщепления LexA и UmuD, выполняет и…Мутаторный фенотип
Исследование молекулярно-генетических механизмов, приводящих к формированию мутаторного фенотипа, позволило обнаружить отдельные гены, ответственные… Мутаторный фенотип у микроорганизмов проявляется в повышенной частоте…Экспансия ДНК
В наследовании предрасположенности к экспансии ДНК имеет место импринтинг (см. раздел 3.2.5). Процесс экспансии происходит во время митотической…Рис. I.55. Модели механизма экспансии ДНК во время репликации
а – с проскальзыванием ДНК-полимеразы; б – с участием отстающей цепи ДНК; в – с привлечением механизма конверсии генов
Среди возможных ди- и тринуклеотидных последовательностей лишь для CAG/CTG, CGG/CCG и AT продемонстрирована экспансия in vivo, приводящая к патологиям. Предполагают, что возможность экспансии именно этих, а не других повторов определяется их способностью образовывать стабильные шпильки. Предложены три модели, объясняющие механизм экспансии ДНК, в которых участвуют шпильки, образованные соответствующими повторами (рис. I.55). Первая модель предполагает проскальзывание реплицирующей молекулы ДНК-полимеразы на повторе в обратном направлении, сопровождаемое образованием шпильки в строящейся цепи ДНК (см. рис. I.55,а). В этом случае в следующем раунде репликации или по завершении репаративного синтеза ДНК длина кластера повторяющихся последовательностей увеличится на размер сегмента ДНК, образовавшего шпильку. Согласно второй модели при репликации отстающей цепи ДНК на соответствующем повторе матричная ДНК некоторое время находится в одноцепочечной форме (см. рис. I.55,б). В это время одноцепочечная последовательность отстающей цепи, содержащая повтор, может образовать шпильку, которая блокирует синтез ДНК в данном месте. Предполагается, что белок, связывающийся с одноцепочечной ДНК (SSB-белок), не может эффективно взаимодействовать с двухцепочечной шпилькой, однако сохраняет способность связываться с одноцепочечной петлей на вершине шпильки, обеспечивая инициацию репликации ДНК с этого места. После того как ДНК-полимераза прореплицирует одну половину шпильки, ее структура разрушится, что приведет к снятию блока репликации перед шпилькой и ее нормальному продолжению. Однако синтезированный перед этим фрагмент ДНК, соответствующий одной половине шпильки, оказывается лигированным с уже имевшимся фрагментом Оказаки. Он не может отделиться от матрицы, которая своими нуклеотидами, расположенными по концам, образует водородные связи с повторами матрицы. Далее избыточная последовательность включается в растущую цепь ДНК и после ошибочной репаративной коррекции шпильки приводит к увеличению размера этого кластера повторяющихся последовательностей, т.е. их экспансии. В соответствии с третьей моделью шпильки, образующиеся в местах соответствующих кластеров повторяющихся последовательностей на разных молекулах ДНК, могут взаимодействовать друг с другом, что будет сопровождаться возникновением сложно структурированной матрицы для репликации. В процессе синтеза ДНК на такой сложной матрице весьма вероятно включение избыточной последовательности в виде повтора во вновь синтезируемую ДНК (см. рис. I.55,в). Аналогичный эффект может быть достигнут и в результате сложной последовательности событий рекомбинации с участием этих шпилек.
Заканчивая обсуждение недавно обнаруженных "необычных" мутационных изменений геномной ДНК, связанных с увеличением числа копий (экспансией) коротких повторяющихся последовательностей, следует подчеркнуть, что они не изменяют традиционных представлений о мутагенезе. Хотя такие мутации ассоциированы с конкретными генетическими локусами, содержащими повторы определенной структуры, процесс экспансии этих последовательностей носит случайный характер и, возможно, запускается первичным мутационным изменением в кластере повторов, которое делает более вероятным формирование шпилечной или иной пространственной структуры подобных кластеров. Однако не так давно была описана еще одна группа мутаций, само существование которых идет в разрез с общепринятым неодарвиновским представлением о механизмах возникновения мутаций. В следующем разделе речь пойдет об адаптивных мутациях; их возникновение в геноме носит не случайный, а направленный характер.
Адаптивные мутации
Взгляды неодарвинистов на мутационный процесс прямо противоположны. В соответствии с их доктриной, доминирующей в системе взглядов современных… Считается, что спор между неоламаркистами и неодарвинистами окончательно решен… Потрясение твердо устоявшихся основ молекулярной генетики с неоламаркистских позиций началось в 1988 г. после…Механизмы защиты генома от мутаций
К сожалению, обе системы защиты не обладают 100%-й эффективностью. То же можно сказать и о точности функционирования ферментных систем,…Репарация ДНК
Основные механизмы репарации поврежденной ДНК
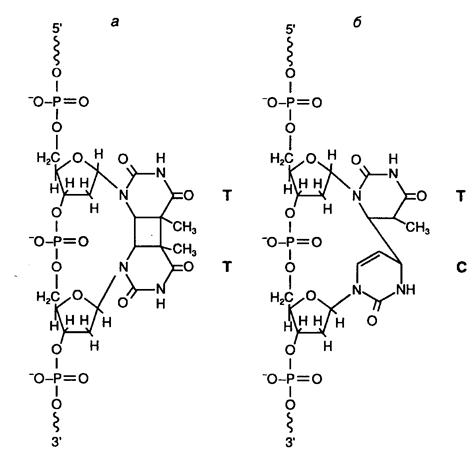
Рис. I.56. Участок ДНК с основными повреждениями, вызываемыми УФ-светом
а – тиминовый димер циклобутанового типа; б – пиримидиновый димер, соединенный 6–4 связью.
С – цитозин; Т – тимин
Как уже упоминалось выше, имеются два типа нарушений структуры ДНК, которые в конечном итоге приводят к мутациям. Это, во-первых, включение нормальных нуклеотидов в аномальное окружение из последовательностей нуклеотидов, приводящих к образованию неправильно спаренных оснований и петель разных размеров. Во-вторых, появление повреждений ДНК в виде аномальных нуклеотидов в правильных последовательностях ДНК. В этом случае речь идет о различных химических модификациях нуклеотидов, включая их разрушение и образование поперечных сшивок. Помимо того, что повреждения ДНК часто являются причиной мутаций, они еще могут приводить к задержке и полному блокированию репликации и транскрипции.
При исследовании механизмов репарации ДНК первые важные результаты были получены на клетках, облученных УФ-светом с длинами волн 240–280 нм. УФ-облучение клеток часто сопровождается их гибелью, образованием мутаций и злокачественной трансформацией, что вызвано в первую очередь повреждениями их ДНК. Среди первичных повреждений такого рода наиболее часто встречаются биспиримидиновые фотопродукты: пиримидиновые димеры циклобутанового типа, соединенные связью 6–4 (рис. I.56). Как про-, так и эукариоты имеют несколько ферментных систем, которые разделяют пиримидиновые димеры или восстанавливают исходную структуру азотистых оснований. К таким репаративным системам относится, прежде всего, система эксцизионной репарации ДНК, осуществляющая вырезание поврежденных нуклеотидов (nucleotide excision repair – NER) или азотистых оснований (base excision repair – BER). Система ферментативной фотореактивации ДНК (photoreactivation – PHR), основным компонентом которой является ДНК-фотолиаза, разделяет пиримидиновые димеры, превращая их в нормальные пиримидиновые основания. Кроме того, поврежденные УФ-светом молекулы ДНК могут репарироваться с участием систем рекомбинации и в процессе пострепликативного синтеза ДНК. Действие многих вышеперечисленных систем репарации поврежденной ДНК распространяется не только на фотопродукты, но и на другие модифицированные основания, образующиеся под действием химических мутагенов. Отдельно следует упомянуть систему, распознающую неправильно спаренные основания в двойной спирали ДНК, возникающие в результате ошибок репликации.
Большинство исследованных организмов обладают системами репарации ДНК в различных комбинациях. Так, клетки E. coli для удаления фотопродуктов используют системы NER и PHR, тогда как у человека пиримидиновые димеры циклобутанового типа удаляются исключительно системой NER. Системы эксцизионной репарации NER и BER благодаря своей универсальной полифункциональности занимают центральное место среди систем репарации ДНК.
Эксцизионная репарация в клетках животных
Таблица I.20ДНК-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в BER
Рис. I.57. Модифицированные азотистые основания ДНК, удаляемые ДНК–гликозилазами при функционировании BER а – урацил; б – гипоксантин; в – 5–гидроксицитозин; г –…Рис. I.58. Основные пути и этапы эксцизионной репарации у животных
Цифрами обозначены последовательные этапы функционирования BER и NER
В последнее время начаты исследования механизмов сопряжения BER с другими генетическими процессами, протекающими внутри клеток: транскрипцией, репликацией ДНК и регуляцией клеточного цикла. Для соматических клеток менее опасно иметь повреждения ДНК, связанные с появлением некодирующих (AP-) участков, чем ошибочно кодирующих оснований, поскольку последние приводят к образованию мутаций, тогда как первые допускают осуществление полноценной пострепликативной репарации повреждений. ДНК-гликозилазы, участвующие в BER, способны переводить сайты, содержащие модифицированные основания (например урацил), в некодирующие сегменты одной из цепей ДНК. Урацилгликозилазы, ассоциированные с белковыми комплексами репликативных вилок, действуют очень эффективно на одноцепочечные ДНК, и их активность регулируется во время клеточного цикла.
Эксцизионная репарация ДНК путем удаления нуклеотидов (NER). Если в системе BER происходит удаление отдельных поврежденных азотистых оснований ДНК путем разрыва соответствующих N-гликозидных связей между азотистыми основаниями и остатками дезоксирибозы, то в системе NER поврежденные азотистые основания вырезаются в составе олигонуклеотидов. NER может осуществляться двумя путями. В первом случае происходит гидролиз фосфодиэфирной связи по 3’- или 5’-концу на некотором расстоянии от ошибочно спаренного (поврежденного) нуклеотида, который далее целиком удаляется под действием 5’®3’- (или 3’®5’-) экзонуклеазы, гидролизующей цепь ДНК нуклеотид за нуклеотидом в соответствующем направлении от первоначального одноцепочечного разрыва в репарируемой ДНК. Образующаяся брешь далее заполняется ДНК-полимеразой. Такой механизм репарации реализуется у E. coli и человека для вырезания неповрежденных (немодифицированных) ошибочно спаренных нуклеотидов. Механизм последовательного эндо- и экзонуклеазного расщепления ДНК не используется для удаления поврежденных (измененных) нуклеотидов. Это связано, по-видимому, с тем, что такие нуклеотиды (например возникшие в результате образования аддуктов с мутагенами) часто являются ингибиторами экзонуклеаз.
Одним из решений данной проблемы представляется использование ферментной системы, которая вносила бы одноцепочечные разрывы по обе стороны от поврежденного нуклеотида на некотором расстоянии от него с последующим удалением одноцепочечного фрагмента ДНК, содержащего измененный нуклеотид. Действительно, такой второй механизм эксцизионной репарации функционирует у всех исследованных видов живых организмов и будет рассмотрен ниже более подробно.
В универсальном механизме эксцизионной репарации как прокариоты, так и эукариоты гидролизуют 3–5-ю фосфодиэфирную связь с 3'-конца от повреждения (см. рис. I.56). При этом прокариоты гидролизуют также 8-ю связь от 5’-конца измененного нуклеотида, тогда как у эукариотических организмов происходит одноцепочечный разрыв на расстоянии 21–25 нуклеотидов от повреждения со стороны его 5’-конца. Таким образом, прокариоты удаляют измененный нуклеотид в составе 12–13-членных олигомеров, тогда как эукариоты – в составе одноцепочечных фрагментов ДНК длиной в 27–29 нуклеотидов. Ферментная система, вносящая такие двойные одноцепочечные разрывы, получила название эксцизионной нуклеазы (эксцинуклеазы). Образующаяся в молекуле репарируемой ДНК одноцепочечная брешь далее заполняется с помощью ДНК-полимеразы, а фосфодиэфирная связь в остающемся одноцепочечном разрыве восстанавливается ДНК-лигазой.
Генетика NER. Гены NER E. coli uvrA, uvrB и uvrC не обнаруживают гомологии с соответствующими генами человека. В отличие от них гены NER дрожжей и человека высокогомологичны, и энзимология эксцизионной репарации в этих двух системах также обладает большим сходством. По крайней мере, три заболевания у человека вызываются генетическими нарушениями системы эксцизионной репарации: пигментная ксеродерма, синдром Кокейна и трихотиодистрофия.
Кожа больных пигментной ксеродермой обладает повышенной чувствительностью к дневному свету, что проявляется в виде фотодерматозов, включая рак кожи. В ряде случаев отмечены аномалии нервной системы, причиной которых являются мутации в одном из семи генов: XPA, XPB, ...XPG. Однако описаны больные с классическими симптомами пигментной ксеродермы, но с ненарушенной системой NER. Для клеток этих больных характерны изменения в так называемой пострепликативной репарации. Больным с синдромом Кокейна присущи нарушения роста, умственная отсталость, катаракты, повышенная чувствительность к свету с сопутствующими дерматозами. Обнаружены мутации в двух группах генов, приводящие к этому заболеванию. У больных с мутантными генами CS-A или CS-B клетки способны нормально репарировать УФ-повреждения ДНК. У другой группы больных обнаружены мутации в генах XPB, XPD или XPG. У больных трихотиодистрофией со смешанными симптомами выявлены мутации в генах XPB или XPD. Классические симптомы этого заболевания, по-видимому, являются следствием мутации в гене транскрипционного фактора TFIIH.
Получение мутантов с измененной NER у грызунов позволило разбить такие гены на 11 групп комплементации, большинство из которых соответствует группам комплементации XP и CS человека. Часть соответствующих генов человека удалось клонировать, используя их способность исправлять (комплементировать) генетические дефекты в культивируемых мутантных клетках грызунов. Эти гены получили название кросс-комплементирующих генов эксцизионной репарации (ERCC – excision repair cross complementing). Среди них гены XPE и ERCC6–ERCC11 не требовались для прохождения основных реакций эксцизионной репарации, и их функция неизвестна.
Структура и функции белков NER. В табл. I.21 суммированы некоторые свойства белков животных, участвующих в NER. Большинство таких белков существует in vivo в виде комплексов, поэтому необходимо иметь в виду, что ферментативные активности, обнаруживаемые у отдельных
Таблица I.21
Белки животных, участвующие в NER
белков в очищенном состоянии, могут не иметь прямого отношения к их функциям в системе NER. XPA – белок с молекулярной массой 31 кДа, обладает доменом типа "цинковые… RPA (HSSB) – тример, состоящий из белковых субъединиц р70, р34 и р11, необходим для репликации ДНК и репаративного…Рис. I.59. Модель эксцизионной репарации (NER) у млекопитающих
Обозначены белок-белковые и белково-нуклеиновые взаимодействия, возникающие при функционировании NER. A–F – продукты генов XPA–XPF
Репаративный синтез ДНК у человека является PCNA-зависимым (см. раздел 4.1.3), т.е. может осуществляться с участием ДНК-полимераз Pold и Pole. PCNA связывается с системой праймер–матрица под действием фактора репликации RFC, откуда следует, что последний также участвует в репаративном синтезе ДНК. В опытах с бесклеточными системами моноклональные антитела к Pold специфически подавляют репаративный синтез. Однако оказалось, что в тех же высокоочищенных бесклеточных системах вместо Pold с аналогичным эффектом могут быть использованы Pole и даже фрагмент Кленова ДНК-полимеразы I E. coli. Это означает, что реконструированные из очищенных компонентов бесклеточные системы лишь в ограниченной степени имитируют биохимические процессы, происходящие в живых клетках. В настоящее время считается, что обе ДНК-полимеразы – Pold и Pole участвуют в репаративном синтезе ДНК у человека.
Сопряжение NER с транскрипцией. Транскрибируемые последовательности нуклеотидов ДНК, особенно в матричной цепи, репарируются с большей скоростью, чем нетранскрибируемые последовательности. Интересно, что в клетках больных с синдромом Кокайна не наблюдается такой асимметрии в репарации.
В клетках E. coli белковый фактор, кодируемый геном mfd и сопрягающий транскрипцию и репарацию, замещает остановившиеся перед повреждением молекулы РНК-полимеразы, что приводит к диссоциации транскрипционного комплекса. При этом он одновременно привлекает экзонуклеазный репаративный комплекс к поврежденному участку ДНК. В клетках животных ген CSB кодирует белок с молекулярной массой 160 кДа, который содержит так называемый хеликазный домен (мотив) и, возможно, выполняет те же функции, что и белок Mfd у E. coli. На основе поведения клеток с мутантными генами белков CSA и CSB разработана простая модель механизма, с помощью которого обеспечивается асимметричная репарация цепей ДНК. В соответствии с этой моделью РНК-полимераза II, остановившаяся в процессе транскрипции перед поврежденным участком ДНК, распознается комплексом CSA–CSB и перемещается в сторону от повреждения без разрушения четвертичной структуры транскрипционного комплекса. Одновременно комплекс CSA–CSB привлекает компоненты репаративной системы XPA и TFIIH к месту повреждения ДНК и помогает сборке эксцинуклеазного комплекса. Нуклеотиды поврежденной цепи вырезаются, и брешь репарируется. После этого РНК-полимераза в составе транскрипционного комплекса продолжает транскрипцию.
Регуляция NER. Для клеток животных не характерен так называемый SOS-ответ, свойственный клеткам E. coli и представляющий собой суммарную реакцию бактериальной клетки на повреждение ДНК различными агентами, что проявляется, в частности, в усилении транскрипции генов NER. Точно так же посттрансляционные модификации белков репарации, происходящие в ответ на повреждение ДНК, не влияют на активность эксцинуклеазы человека. Было обнаружено, что повреждения ДНК стабилизируют белок р53 – белок-супрессор опухолевого роста, который является регулятором транскрипции. Имеются данные о том, что белок р53 может взаимодействовать с белками XPB и RPA, необходимыми для NER. Однако клетки с инактивированными генами р53 (p53(-/-)), как и клетки дикого типа, эффективно удаляют из поврежденной ДНК два основных фотопродукта, возникающих под действием УФ-света, и обладают такой же устойчивостью к УФ. Поэтому в настоящее время считается, что белок р53 не оказывает прямого влияния на NER. Белки Cdk7 и циклин H, которые образуют Cdk-активирующую киназу, входят в состав комплекса TFIIH, что позволяет предполагать наличие связи репарации ДНК с фазами клеточного цикла.
Гомологичная рекомбинация в репарации ДНК
Рис. I.60. Схема репарации двухцепочечных разрывов ДНК с участием гомологичной рекомбинации
Обозначены продукты генов E. coli и S. cerevisiae, необходимые для прохождения соответствующих этапов репарации повреждений ДНК. Разделены пресинаптическая (а), синаптическая (б) и постсинаптическая (в) фазы репарации
Существует несколько моделей, объясняющих механизм репарации повреждений ДНК с участием системы гомологичной рекомбинации. Схема одного из таких механизмов репарации двухцепочечных разрывов ДНК у E. coli изображена на рис. I.60. В соответствии с этой моделью процесс репарации условно разделяют на три этапа. В первой, пресинаптической, фазе репарации происходит внесение двухцепочечного разрыва в ДНК или, при его наличии, сразу осуществляется нуклеазное расщепление концов разрыва. В создании одноцепочечных 3’-OH-выступающих концов ДНК в месте разрыва принимает участие белок RecBCD, который обладает как хеликазной, так и экзонуклеазной активностями. RecBCD расплетает двухцепочечную молекулу ДНК в месте разрыва и гидролизует одну из цепей в направлении 5’®3’, оставляя выступающий одноцепочечный участок. Во второй фазе наблюдается синапсис гомологичных участков двух молекул ДНК с вхождением комплементарного одноцепочечного участка в ДНК-дуплекс и последующим репаративным синтезом ДНК. Поиск гомологичных участков и обмен цепями, необходимые для рекомбинации, происходят с участием белка RecA. В третьей, постсинаптической, фазе репарации образовавшиеся структуры Холидея разделяются с помощью белков RuvA, -B и -C, RecG, а также белков SOS-системы репарации (RecN, UvrD, RecF и RecJ). Похожие механизмы используются клетками для рекомбинационной репарации одноцепочечных брешей, остающихся в молекулах ДНК из-за блокировки репликативного синтеза ДНК модифицированными нуклеотидами.
Многие продукты генов E. coli и дрожжей, участвующие в рекомбинационной репарации повреждений ДНК, имеют гомологи у животных и человека. Отличительной особенностью эукариотической рекомбинации и репарации является вхождение соответствующих белков в многочисленные белковые комплексы, в частности транскриптосомы и реплисомы, что указывает на их важную роль в матричном биосинтезе нуклеиновых кислот эукариотических клеток.
Репарация ошибочно спаренных нуклеотидов
Обычно у E. coli ДНК метилирована Dam-метилазой по сайтам GATC. Однако после завершения репликации дочерняя цепь ДНК некоторое время остается… Следует подчеркнуть, что использование белка MutH и Dam-метилазы для… У E. coli существуют, по крайней мере, еще два специфических пути репарации ошибочно спаренных нуклеотидов. Система…Полимераза поли(ADP-рибозы) в репарации ДНК у эукариот
In vivo поли(ADP-рибоза) характеризуется очень малым временем полужизни. Цепи полимера, синтезированные в ядрах в ответ на мутагенное воздействие, в… Ген PARP, картированный на участке 1q41–1q42 хромосомы человека, кодирует…Рис. I.61. Схематическое изображение молекулы поли(ADP-рибозы), присоединенной к полипептидной цепи полимеразы поли(ADP-рибозы) и продуктов ее деградации
Синтез поли(ADP-рибозы) можно рассматривать как один из редких случаев посттрансляционной модификации белков, при которой PARP использует свою собственную полипептидную цепь в качестве субстрата (рис. I.61). Такая массированная аутомодификация резко изменяет физические свойства фермента. Остатки Glu (25–30), расположенные в полипептидной цепи PARP между двумя вышеупомянутыми доменами, служат точками инициации синтеза поли(ADP-рибозы). В процессе синтеза происходит разветвление полимера, и длина боковых цепей может достигать нескольких сотен остатков. В настоящее время до конца неизвестно, модифицирует ли молекула PARP сама себя или же это осуществляют другие молекулы PARP. На основании имеющихся кинетических данных наиболее вероятной считается модель, в соответствии с которой молекула PARP, ассоциированная с одноцепочечным разрывом, образует комплекс с другой молекулой и уже вторая молекула PARP служит акцептором полимеризуемой ADP-рибозы.
Гликогидролаза поли(ADP-рибозы) расщепляет цепи полимера с их концов, освобождая мономеры и олигомеры ADP-рибозы. Таким образом, в результате синтеза и деградации поли(ADP-рибозы) в ядрах образуются не только остатки никотинамида и ADP-рибозы, но и более сложные разветвленные продукты, состоящие из трех–четырех молекул мономера.
В присутствии ингибиторов PARP клетки животных становятся чрезвычайно чувствительными к действию алкилирующих агентов и ионизирующей радиации. Кроме того, в этом случае наблюдается повышенный уровень сестринских хроматидных обменов (СХО). Однако до сих пор нет доказательств прямого участия поли(ADP-рибозы) в репарации ДНК. Сверхэкспрессия рекомбинантного N-концевого домена PARP в клетках животных сопровождается теми же эффектами, что и действие ингибиторов PARP, в частности 3-аминобензамида. В неповрежденных клетках происходят дестабилизация генома и рост числа СХО. Опыты с трансгенными мышами, у которых ген PARP инактивирован в результате генного нокаута (см. раздел 10.3.4), показывают, что PARP-дефицитные мыши, тем не менее, здоровы и фертильны. Следовательно, PARP не играет существенной роли в пролиферации клеток, их дифференцировке и онтогенезе мыши. Клетки таких животных обладают нормальной способностью к эксцизионной репарации ДНК системами BER и NER. PARP-дефицитным мышам свойственны не совсем понятные физиологические дефекты, проявляющиеся в гиперплазии эпидермиса, вызванной повышенной пролиферацией кератиноцитов у старых особей, а также пониженной способностью тимоцитов к пролиферации после g-облучения. Клетки панкреатических островков у PARP-дефицитных мышей обладают повышенной устойчивостью к цитотоксическому действию NO. Это может указывать на недостаток NAD, вызываемый повышенным синтезом поли(ADP-рибозы), как одну из причин цитотоксичности NO у нормальных животных.
В настоящее время предложено несколько моделей, объясняющих физиологическую роль PARP в клетках животных. Все они подчеркивают, что PARP не участвует прямо в эксцизионной репарации ДНК, но необходима для быстрой мобилизации ресурсов клеток при исправлении повреждений их генома. Способность ингибиторов PARP вызывать гиперчувствительность клеток к алкилирующим агентам и ионизирующей радиации позволяет рассматривать этот фермент в качестве удобной мишени в химиотерапии опухолей.
Рассмотренные в данной главе механизмы образования мутаций указывают на большое разнообразие путей повреждения генетической информации, заключенной в экспрессирующихся и временно молчащих генах. Эволюционное развитие животного и растительного мира противопоставило мутагенным воздействиям мощное противоядие в виде эффективных систем репарации ДНК. Тем не менее, из-за ошибок систем репарации и повреждения самих этих систем происходит необратимое накопление мутаций, приводящих к нарушениям метаболизма и развитию различных патологических состояний организма. В этой связи еще более эффективным средством защиты генетической информации является блокирование (инактивация) химических мутагенов на подступах к жизненно важным генетическим локусам. Именно такую нагрузку несут рассмотренные выше ферментные системы детоксикации ксенобиотиков. На мой взгляд, одной из функций поли(ADP)-рибозы в клетках, подвергнутых мутагенному воздействию, может быть очистка ядер от мутагенов, ковалентно взаимодействующих с нуклеиновыми кислотами, в том числе свободных радикалов, возникающих под действием ионизирующего излучения. Это соединение может играть роль чистильщика (scavenger) ядер от химических мутагенов и понижать их внутриядерную концентрацию через образование соответствующих аддуктов. Синтез поли(ADP)-рибозы является быстрым адаптивным ответом клеток в ответ на массированное мутагенное воздействие. Однако в естественных условиях существования организмов такие ситуации встречаются редко. В природных условиях, свободных от присутствия антропогенных экологических факторов, скорее имеется слабый мутагенный фон, постоянно окружающий информационные макромолекулы на протяжении всей жизни организма. В недавно разработанной модели альтруистичной ДНК (Л.И. Патрушев, 1997 г.) избыточные последовательности нуклеотидов эукариотической ДНК рассматриваются в качестве еще одной специфической системы защиты генетической информации, характерной для многоклеточных организмов. Далее будут представлены основные положения этой модели.
Альтруистичная ДНК
Анализ структуры генома эукариот показывает, что для соматических клеток многоклеточного организма остается еще один путь защиты своего генома от… Вовлечение систем репарации повреждений ДНК в поддержание генетической…Парадокс возможности существования многоклеточных организмов
Рис. I.62. Происхождение генетического груза в геноме соматических клеток многоклеточных организмов
Развитие многоклеточного организма начинается с дробления зиготы, образующейся в процессе оплодотворения яйцеклетки и содержащей диплоидный набор хромосом (две параллельные линии вверху рисунка). А–М – наборы мутаций
Принимая, что суммарная ДНК гаплоидного генома человека насчитывает ~3·109 п.о., а частота спонтанных мутаций в среднем составляет 10-8 на нуклеотид за генерацию, можно предположить, что, начиная с первого деления оплодотворенной яйцеклетки в процессе онтогенетического развития организма человека, каждое следующее деление должно сопровождаться появлением в их геномной ДНК, по крайней мере, 30 независимых мутаций (рис. I.62). Организм человека состоит из ~1015 клеток. Для образования стольких клеток из оплодотворенной яйцеклетки требуется ~50 клеточных генераций. Следовательно, гаплоидный геном каждой из соматических клеток человека 50-й генерации должен содержать в разных частях, по крайней мере, 1500 мутаций. Если предположить далее, что набор из 30 мутаций возникает и закрепляется в каждом последующем клеточном делении независимо от мутаций, полученных во время предыдущих делений клеток, то получается, что любая дочерняя соматическая клетка наследует от клетки-предшественницы все имеющиеся в ее геноме мутации и приобретает блок новых 30 мутаций. При этом набор соматических мутаций в потомстве каждой из делящихся клеток одного поколения будет отличаться один от другого, в том числе и в парах аллельных локусов ДНК отдельных клеток, поскольку они редуплицируются независимо. При таком развитии событий мутации, возникающие в геноме соматических клеток каждой последующей генерации, случайным образом сканируют шаг за шагом всю реплицирующуюся геномную ДНК, а результаты сканирования не повторяются в каждом новом поколении клеток. Так, блок из 30 спонтанных мутаций, возникающих после гипотетической 50-й генерации соматических клеток в онтогенезе многоклеточного организма, должен присутствовать в ~1015 (250) вариантах.
Проблема становится еще более очевидной, если иметь в виду, что многие клетки организма, например эпителиальные или стволовые клетки крови, пролиферируют на протяжении всей жизни многоклеточного организма, совершая громадное число клеточных делений. По некоторым оценкам, общее число клеточных циклов, в которых участвуют клетки человека на протяжении его жизни, приближается к 1016. Кроме того, соматические мутации возникают в многоклеточном организме не только в активно пролиферирующих, но и покоящихся клетках. Частоты возникновения спонтанных мутаций в пролиферирующих и в покоящихся клетках млекопитающих в ряде случаев различаются лишь незначительно.
Парадоксальность эволюционно сложившейся генетической ситуации заключается в том, что если бы большая часть последовательностей нуклеотидов геномной ДНК заключала в себе жизненно важную генетическую информацию, существование многоклеточных организмов было бы невозможно. Их гибель происходила бы из-за неизбежного накопления в делящихся соматических клетках вредных или летальных мутаций, приводящих к обрыву линий дифференцирующихся в онтогенезе соматических клеток. Это особенно относится к мутациям в жизненно важных генах половых хромосом, которые в соматических клетках находятся в гемизиготном состоянии. Альтернативно основные генетические локусы многоклеточных организмов могут находиться под дополнительной защитой от мутационных изменений.2
На основании приведенных выше аргументов можно сделать вывод о том, что большая часть некодирующих избыточных последовательностей нуклеотидов геномной ДНК эукариот не заключает в себе жизненно важной генетической информации и/или у эукариотических клеток имеются механизмы, обеспечивающие дополнительную защиту геномной ДНК от мутаций. Не соглашаясь с основными положениями концепции "эгоистической" и "паразитической" ДНК, можно предположить, что именно такая организация генома эукариотических организмов, в корне отличающаяся от структуры генома прокариот, имеет отношение к разрешению проблемы генетической парадоксальности существования многоклеточных организмов, которую можно назвать парадоксом М (Metazoa, Metaphyta). Создается впечатление, что именно избыточная ДНК генома эукариот может иметь отношение к повышению его информационной стабильности до уровня, необходимого для реализации многоклеточности в природе.
Повышение информационной стабильности генома избыточными последовательностями
Рис. I.63. Гипотетическое эволюционное преобразование генома-предшественника путем включения в него некодирующих избыточных последовательностей нуклеотидов
Влияние избыточных последовательностей нуклеотидов на число мутаций, возникающих в результате ошибок репликации в кодирующих последовательностях генома. Предположим, что длина исходного генома, не содержащего избыточных последовательностей нуклеотидов, составляет N п.о. (см. рис. I.63). При этом в результате ошибок репликации в нем, в среднем, возникает a мутаций независимо одна от другой и случайным образом. Допустим, что в ходе эволюционных преобразований в него включаются избыточные последовательности нуклеотидов, суммарная длина которых составляет nN п.о. и, соответственно, общая длина преобразованного генома становится равной (n+1)N п.о. Поскольку число мутаций, возникающих в результате ошибок репликации, прямо пропорционально длине реплицирующейся ДНК, общее количество мутаций, в среднем, возникающих в преобразованном геноме при участии этого механизма, должно возрасти в n+1 раз и составить a(n+1). Вероятность возникновения одной независимой и случайной мутации в некодирующей части генома P(1) будет пропорциональна его длине:
P(1) = 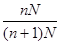 =
= 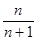 . (1)
. (1)
В то же время вероятность возникновения в избыточных частях генома всех a(n+1) мутаций будет равна:
P[a(n+1)] = 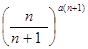 (2),
(2),
поскольку вероятность одновременного наступления a(n+1) независимых событий равна произведению вероятностей наступления каждого из них в отдельности. При a = 1 (т.е. в том случае, если в процессе репликации исходного генома в нем, в среднем, возникала одна мутация) и достаточно больших значениях n это выражение стремится к e-1, т.е. к ~0,36. Таким образом, в данном случае при n = 100 (что, приблизительно, соответствует соотношению некодирующих и кодирующих последовательностей нуклеотидов в геноме человека и других млекопитающих) вероятность того, что ни одна из мутаций, возникающих в гипотетическом преобразованном геноме в результате ошибок репликации, не произойдет в его кодирующих частях, будет довольно высокой и составит ~ 0,37. Это означает, что, в среднем, каждая третья дочерняя соматическая или половая клетка, возникшая в результате редупликации гипотетического генома с достаточным количеством некодирующих избыточных последовательностей нуклеотидов, будет полностью свободна от мутаций, образующихся по такому механизму в кодирующих частях своего генома.
С увеличением числа мутаций в исходном геноме-предшественнике (a >> 1) вероятность возникновения всех мутаций в некодирующих частях генома быстро уменьшается. Однако поскольку эти мутации будут распределяться между кодирующими и некодирующими частями генома пропорционально длине каждой из этих частей, общее их количество в кодирующих частях генома останется неизменным. Следовательно, эволюционное включение в геном-предшественник большого количества некодирующих последовательностей нуклеотидов не увеличивает число мутаций, возникающих в кодирующих частях генома в результате ошибок репликации. Более того, в ряде случаев такое эволюционное преобразование генома может заметно стабилизировать его генетическую информацию.
Влияние избыточных последовательностей нуклеотидов на число мутаций, возникающих в кодирующих частях генома под действием мутагенов. Ситуация, связанная с возникновением мутаций в гипотетическом геноме под действием мутагенов экзогенного и эндогенного происхождения, принципиально отличается от только что рассмотренной (см. рис. I.63). Если предположить, что эволюционное преобразование генома, приведшее к включению в него n некодирующих последовательностей нуклеотидов, не сопровождается увеличением числа внутриядерных мутагенов, то генетические последствия такого преобразования будут гораздо более значительными.
Так же как и в предыдущем случае, вероятность попадания одного мутагена Mk в некодирующую область гипотетического генома равна 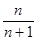 . Вероятность же того, что все k мутагенов попадут в некодирующие области нового генома P(k), равна:
. Вероятность же того, что все k мутагенов попадут в некодирующие области нового генома P(k), равна:
P(k) = 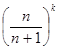 (3).
(3).
При больших значениях n и малых k величина P(k) стремится к 1,0, т.е. имеет место событие, близкое к достоверному. Иными словами, чем больше доля некодирующих последовательностей нуклеотидов в геномной ДНК, тем вероятнее, что все внутриядерные мутагены попадут в некодирующие последовательности. В случае гипотетического генома с n = 100 вероятность попадания одного мутагена в кодирующую область становится равной 0,01, т.е. весьма малой. При этом общее число мутагенов, которые будут взаимодействовать с кодирующими последовательностями нуклеотидов, уменьшится в 100 раз и будет иметь место 100-кратная защита кодирующих функционально значимых участков эволюционно преобразованного генома от мутаций, вызываемых внутриядерными мутагенами, по сравнению с исходным геномом-предшественником. При k = n+1 с ростом n уравнение (3) будет стремиться к e-1, т.е. к ~0,36, и быстро уменьшаться при дальнейшем увеличении k. Но это относится к вероятности полной защиты кодирующих последовательностей нуклеотидов. Относительная же защита, равная доле химических мутагенов из всего их пула, взаимодействующих с кодирующими последовательностями нуклеотидов, будет обратно пропорциональна общей длине избыточных последовательностей в преобразованном геноме, т.е. обратно пропорциональна n. Относительная защита генома от химических мутагенов может быть особенно актуальной в условиях экологического стресса.
Насколько соответствует действительности предположение о том, что эволюционное преобразование генома-предшественника путем включения в него большого количества избыточных последовательностей нуклеотидов не будет сопровождаться пропорциональным возрастанием количества внутриядерных мутагенов? Очевидно, что такое предположение является упрощением. Увеличение внутриядерного содержания ДНК, например в результате эндорепликации при политении, по-видимому, всегда приводит к пропорциональному увеличению объема соответствующих ядер, следствием чего, казалось бы, должно быть пропорциональное возрастание количества молекул внутриядерных мутагенов. Однако это не совсем так. Данный вывод относится лишь к мутагенам, непосредственно образующимся в ядре, например в результате взаимодействия ионизирующего излучения с веществом ядер. Большая же часть мутагенов, по-видимому, должна поступать в ядра из цитоплазмы путем радиальной диффузии через ядерные мембраны. При этом одним из факторов, ограничивающих попадание мутагенов из цитоплазмы в ядра, является их поверхность, поскольку вероятность контакта мутагенов цитоплазмы с ядром прямо пропорциональна площади его поверхности. При увеличении объема поверхность ядра-шара возрастает пропорционально квадрату его радиуса, тогда как объем – пропорционально кубу радиуса ядра. Следовательно, объем ядер будет увеличиваться быстрее площади их поверхности и количество молекул внутриядерных химических мутагенов, приходящихся на нуклеотид ядерной ДНК, должен уменьшаться при возрастании ядерного объема за счет увеличения содержания ядерной ДНК. Такое эволюционное преобразование генома в целом будет сопровождаться повышением его информационной стабильности.
Включение в геномную ДНК некодирующих последовательностей может приводить и к более специфической защите жизненно важных локусов генома от химических мутагенов. В частности, глобальная защита кодирующих последовательностей от химических мутагенов, поступающих из цитоплазмы в ядро путем радиальной диффузии, могла бы происходить в том случае, если бы некодирующие последовательности были преимущественно локализованы вблизи поверхности ядер и экранировали последовательности, расположенные ближе к их центральной части. В настоящее время имеются многочисленные экспериментальные данные, указывающие на высокоупорядоченное расположение последовательностей нуклеотидов ДНК в интерфазных ядрах. Значение пространственного расположения отдельных последовательностей ДНК интерфазных хромосом для избирательной, специфической защиты кодирующих последовательностей будет подробнее рассмотрено ниже.
Селективная защита генов от мутаций
В этом отношении наиболее изучена и показательна хромомерная организация гигантских политенных хромосом, образующихся в клетках некоторых типов… Следует подчеркнуть, что компактизация ДНК вдоль хроматид в интерфазных…Высокоупорядоченное расположение летальных генов на хромосомах
Используя эти рассуждения в качестве рабочей гипотезы, мы исследовали расположение жизненно важных генов на всех 16 хромосомах дрожжей Saccharomyces… Хромосома 2 является одной из пяти наиболее крупных хромосом дрожжей, длина… Летальные гены расположены на хромосоме неравномерно. Имеются места их скопления, особенно ярко выраженные в…Возможный смысл парадокса С
Развивая концепцию о стабилизирующем влиянии избыточных последовательностей нуклеотидов ДНК на генетическую информацию, заключенную в геноме… Таким образом, повышение точности функционирования систем репликации и… Эволюционное увеличение размера генома понижает требования таких видов к точности функционирования систем репарации…Глава 6. СОВРЕМЕННАЯ КОНЦЕПЦИЯ ГЕНА
Подводя итоги рассмотрению основных достижений в исследованиях структуры и механизмов функционирования генов, представляется целесообразным более подробно обсудить вопрос о том, что же такое ген в свете современных экспериментальных данных.
Классическое представление о гене как цистроне, а также модель Ф. Жакоба и Ж. Моно регуляции активности полицистронных оперонов бактерий явились вершиной развития молекулярной генетики 1960-х годов. Работы С. Бензера по изучению тонкой структуры гена rII-области бактериофага Т4 продемонстрировали предел (а точнее – беспредельность) разрешающей способности генетического анализа в применении к бактериофагам и одновременно невозможность получения таких же точных результатов при его использовании для исследования сложноустроенных организмов с более продолжительным жизненным циклом. К началу 1970-х гг. в отношении структуры и функционирования гена, по крайней мере прокариотического, складывалось вполне определенное и логичное мнение о том, что ген представляет собой непрерывную последовательность нуклеотидов ДНК, состоящую из двух частей – регуляторной и структурной. В модели гена 1960-х годов регуляторная часть всегда предшествует структурной и определяет уровень его экспрессии через взаимодействие с регуляторными белками. Структурная часть гена кодирует единственную полипептидную цепь белка или молекулу РНК и колинеарна белковому продукту, т.е. последовательность нуклеотидов гена однозначно определяет и соответствует последовательности аминокислот в кодируемом этим геном белке. Модель гена 1960-х годов предусматривает его четкие границы и постоянную локализацию на хромосоме. Изменения в первичной структуре гена и его перемещения в геноме могли быть только следствием непредсказуемых мутаций и должны были приводить к нарушению его функционирования. Таковы общие представления о гене, которые складывались в молекулярной генетике на основании экспериментальных данных до разработки методов генной инженерии. Последние 20 лет интенсивного развития молекулярной биологии и генетики с широким использованием методов рекомбинантных ДНК изменили эти представления. Сегодня совершенно ясно, что ген не всегда колинеарен РНК или белку, которые закодированы в последовательности его нуклеотидов – одна и та же последовательность нуклеотидов ДНК может кодировать разные полипептидные цепи, а нестабильность генов может быть генетически запрограммированной. Прежде чем сделать попытку сформулировать современное определение термина "ген", обобщим основные свойства генов, подробно рассмотренные в первых пяти главах книги.
Ген не всегда колинеарен своим РНК или белкам.Большинство генов эукариот обладает мозаичной структурой кодирующих и некодирующих последовательностей нуклеотидов – экзонов и интронов. Лишь в результате сплайсинга предшественников мРНК заключенные в них интроны вырезаются и восстанавливается колинеарность гена, мРНК и белкового продукта (см. раздел 2.2.3). Удаление избыточных последовательностей в результате сплайсинга происходит не только на уровне РНК, но и на уровне полипептидных цепей. Недавно обнаруженный сплайсинг белков у дрожжей S. cerevisiae и других микроорганизмов (см. раздел 3.6.4) по-новому осветил возможности механизмов, контролирующих реализацию генетической информации.
Не менее удивительными, с привычной точки зрения, являются и механизмы редактирования кодирующего потенциала РНК на посттранскрипционном уровне. Расширение исследований в этой области показывает, что такое редактирование РНК широко распространено у животных, растений и микроорганизмов. Факты корректировки генетической информации на посттранскрипционном уровне оказались неожиданными. Почему организму выгоднее не сохранять всю необходимую генетическую информацию в самом исходном гене, а корректировать ее уже в процессе реализации? К сожалению, пока на этот вопрос нет однозначного ответа. Однако можно полагать, что такая корректировка кодирующего потенциала РНК имеет непосредственное отношение к дополнительной стабилизации генетической информации в наиболее уязвимых для мутагенеза генетических локусах (см. раздел 2.2.2). Если мое объяснение верно, то существование механизма редактирования первичной структуры РНК на посттранскрипционном уровне не изменяет классических представлений о функционировании генов.
Одна и та же последовательность нуклеотидов ДНК может кодировать разные полипептидные цепи. Генетический материал многих вирусов и бактериофагов организован компактно. Например, на определенных участках генома колифага f2 или бактериофага fX174 для кодирования белка используются две возможные рамки считывания. Уникальное сверхкомпактное кодирование генетической информации характерно для мобильного генетического элемента бактерий IS5, у которого одна из цепей ДНК содержит два перекрывающихся гена, а комплементарный им участок другой цепи заключает в себе третий ген. В таких случаях можно, по-видимому, говорить о наличии в одной и той же последовательности нуклеотидов нескольких генов в классическом смысле этого слова.
Кодирование разных полипептидов одной и той же последовательностью нуклеотидов ДНК имеет место и у эукариот, а также их вирусов. Так, из одного предшественника мРНК в результате альтернативного сплайсинга образуется несколько зрелых мРНК, кодирующих разные белки (см. раздел 3.3.2). Следовательно, один и тот же ген может кодировать не один белок, а целое их семейство. Ярким примером является альтернативный сплайсинг РНК гена модулятора cAMP-респонсивного элемента человека CREM, кодирующего большое семейство позитивно и негативно действующих изоформ фактора транскрипции (см. раздел 3.3.2). К аналогичным результатам приводит альтернативный процессинг полипротеинов, кодируемых некоторыми вирусными геномами. Число подобных примеров увеличивает интересный регуляторный механизм, использующий антисмысловые РНК, синтезируемые in vivo, в качестве регуляторных макромолекул. Антисмысловые РНК в этой роли были рассмотрены в разделе 4.2.2 в связи с регуляцией репликации плазмиды ColE1, а также как природные регуляторы трансляции мРНК у бактерий. В таких случаях обе цепи ДНК данного генетического локуса оказываются кодирующими. Следовательно, кодирование одной последовательностью нуклеотидов (одним геном в классическом понимании этого термина) множественных белков и РНК – широко распространенное явление.
Перечисленные механизмы расширяют информационную емкость генома и позволяют более компактно хранить генетическую информацию. Если в случае прокариот и, особенно, вирусов тенденция к максимальной компактизации генома понятна и логично объясняется малыми допустимыми размерами самого генома, то этого нельзя сказать о геноме высших организмов. Действительно, неясным остается смысл эволюционного возникновения перекрывающихся генов эукариот при перенасыщении их генома некодирующими последовательностями нуклеотидов. По-видимому, это может отражать механизм образования таких генов в процессе эволюции, когда возникновение новой регуляторной последовательности (промотора, терминатора или сайта сплайсинга) внутри гена приводит к синтезу измененного, но функционально значимого полипептида. Образование новых генов по такому механизму могло бы происходить с использованием уже готовых нуклеотидных блоков существующих генов, а не из бессмысленных некодирующих последовательностей.
Запрограммированная нестабильность генов в геноме. Стабильность гена in vivo является одним из его жизненно важных свойств. Именно стабильность генетической информации живых организмов, проявляющаяся в сохранении фенотипических признаков в ряду поколений, делает возможным существование и самой жизни. Конечно, значение изменчивости генетического материала для эволюции в биосфере прекрасно понимали уже в самом начале развития молекулярной биологии и молекулярной генетики. Однако тогда, как и во времена де Фриза, изменение генетической информации в организме считалось редким событием, происходящим в результате генной мутации и которое чаще всего сопровождается вредными для организма последствиями, ставящими под угрозу возможность его существования.
Данные, полученные в результате работы с индивидуальными генами, обнаружили в живом организме парадоксальную ситуацию. Оказалось, что само существование большинства позвоночных животных полностью зависит не только от высокой стабильности их генома, но и от запрограммированной нестабильности ряда генетических локусов. В частности, функционирование всей иммунной системы основано на происходящих в онтогенезе животных крупномасштабных перестройках генетического материала в локусах, заключающих в себе последовательности генов иммуноглобулинов. В процессе дифференцировки B- и T-лимфоцитов на уровне их геномной ДНК имеет место перенос последовательностей нуклеотидов (V), кодирующих вариабельные участки полипептидных цепей иммуноглобулинов, а также других небольших сегментов ДНК (J и D), к последовательностям, кодирующим константные части этих белков. Объединение последовательностей нуклеотидов генов иммуноглобулинов случайным образом в разных сочетаниях, происходящее в каждой индивидуальной B- или T-клетке по-новому, приводит к образованию огромного числа разных генов иммуноглобулинов, способных направлять биосинтез антител практически любой специфичности при распознавании антигенов. Более того, в процессе возникновения генов иммуноглобулинов in vivo происходят не только перестройки генома, которые сами по себе еще не обеспечивают всего разнообразия антител. При дифференцировке лимфоцитов функционирует система, осуществляющая направленное введение случайных соматических мутаций в определенные сегменты последовательностей ДНК, которые кодируют вариабельные участки полипептидных цепей иммуноглобулинов.
Геном клеток зародышевой линии не содержит генов, появляющихся в дифференцированных клетках иммунной системы. В онтогенезе на уровне соматических клеток происходят как бы эволюционные преобразования части генетического материала, из которой возникают новые гены и соответственно новые белки с различающимися субстратными специфичностями. Какую же часть генома в данном случае можно считать геном иммуноглобулина? Классические представления о гене не позволяют ответить на этот вопрос. Дестабилизируя соответствующие генетические локусы, организм решает задачу одновременного создания большого числа разнообразных белков с использованием потенциала генома, ограниченного в своих размерах. При таком решении организму нет необходимости из поколения в поколение осуществлять передачу громадного количества генетической информации, связанной с этими белками, биологический потенциал многих из которых не будет востребован на протяжении жизни особи следующей генерации. Потомству передается лишь генетическая программа, по которой, в принципе, могут быть синтезированы все эти белки. Таким образом, у животных в клетках зародышевого пути и в большинстве соматических клеток вообще отсутствуют гены иммуноглобулинов в классическом понимании этого термина. Они возникают de novo во время онтогенеза, и невозможно предсказать, какой в точности набор генов и иммуноглобулинов будет создан при реализации такой генетической программы. С помощью непредсказуемого репертуара антител организм решает задачу защиты от не менее непредсказуемого разнообразия антигенов, которые постоянно возникают в биосфере, в том числе и вследствие природной нестабильности генов, кодирующих эти антигены. Например, запрограммированная высокая частота перестроек генов поверхностного антигена малярийного плазмодия позволяет паразиту избегать нейтрализующего влияния иммунной системы, т.е. дает возможность выжить.
В последнее время появляются данные о том, что гены, кодирующие рецепторы пахучих веществ системы обоняния позвоночных животных и человека, претерпевают перестройки, подобные таковым генов иммуноглобулинов, с теми же биохимическими последствиями. Все это указывает на то, что сейчас мы еще не осознаем до конца истинной роли индетерминизма генетической информации в жизни многоклеточных организмов как одного из основных принципов функционирования генетических систем.
В качестве еще одного примера естественной генетической нестабильности, которая приводит к созданию новых генов, не существующих у исходных организмов, рассмотрим механизм образования гена фактора sk (или s27) РНК-полимеразы Bacillus subtilis. В результате этого процесса происходит объединение в одной рамке считывания гена spoIVCB, кодирующего N-концевую часть sk, с геном spoIIIC, в котором закодирована недостающая С-концевая часть белка. Фактор sk в составе молекулы РНК-полимеразы функционирует только в процессе споруляции B. subtilis, обеспечивая избирательную транскрипцию бактериальных генов. При этом вновь созданный ген не передается потомству B. subtilis, так как материнские клетки перестают существовать после образования спор, а вместе с ними элиминируется и бактериальная хромосома. Такой способ регуляции экспрессии генов путем продуктивного объединения их участков на уровне геномной ДНК, по-видимому, распространен у клеток, претерпевающих терминальную дифференцировку. Более подробную информацию о функциональном непостоянстве генома можно найти в монографии Р.Б. Хесина.
Таким образом, генетически запрограммированное непостоянство определенных локусов во многих случаях жизненно необходимо. Только учитывая этот факт, следует рассматривать стабильность гена как важнейшее его свойство. Кроме того, еще одним механизмом, контролирующим темп мутационных изменений отдельных генетических локусов у про- и эукариот, может быть дифференциальная защита индивидуальных генов от химического мутагенеза как следствие их специфической пространственной организации (см. раздел 5.3.3). Генетически детерминированный уровень мутагенеза отдельных локусов может определять и предпочтительное изменение генов в филогенезе. Этот же механизм мог бы контролировать мутабильность индивидуальных генов или их частей в онтогенезе, а также объяснять возможность возникновения адаптивных мутаций (см. раздел 5.1.5).
Нуклеиновые кислоты как ферменты. До появления генной инженерии РНК отводили роль промежуточных переносчиков генетической информации (мРНК, тРНК) или приписывали структурные функции (рРНК). Современная молекулярная генетика развеяла миф о том, что биологический катализ является прерогативой белковых молекул, включив в число ферментов и нуклеиновые кислоты – рибозимы и дезоксирибозимы (см. главу 9). Выясняется все большая функциональная роль в биосинтезе белка самих рибосомных РНК как катализаторов. Несмотря на это белки среди энзимов сохраняют лидирующую позицию, так как их каталитический потенциал, скрытый в гигантском разнообразии сочетаний 20 аминокислот, несопоставим с таковым ДНК, РНК и других более просто устроенных макромолекул клетки.
Современное определение гена.Несомненно, что за время активного применения методов генной инженерии представления о гене существенно изменились. Однако можно ли сказать, что понятия гена в прежнем классическом смысле этого слова больше не существует? Несмотря на соблазн согласиться с этим, приходится ответить на вопрос отрицательно. В самом деле, незыблемым остается основной принцип, заложенный в понятие гена как фрагмента нуклеиновой кислоты, в последовательности нуклеотидов которой закодирована информация о последовательности нуклеотидов в другой нуклеиновой кислоте или аминокислотной последовательности в белке. Изменение фенотипа организма однозначно связано с мутационными изменениями генотипа, т.е. изменениями последовательности нуклеотидов во фрагменте нуклеиновой кислоты (ДНК или РНК), именуемом геном. Генотипические различия, как и считалось ранее, всегда передаются от родителей потомству, т.е. носят наследуемый характер. Таким образом, на сегодняшний день ген можно было бы определить как наследуемую часть генома, оказывающую влияние на какой-либо фенотипический признак. Эта формулировка по смыслу близка к классическому определению "один ген – один признак".
ЧАСТЬ II
ОСНОВНЫЕ НАПРАВЛЕНИЯ РАЗВИТИЯ ПРИКЛАДНОЙ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
Введение
В первой части книги были кратко рассмотрены основные результаты экспериментальных и теоретических исследований по молекулярной биологии и генетике, направленные на познание молекулярных механизмов функционирования генов. Получение этих результатов стало возможным лишь благодаря разработке современных методов манипулирования генами in vivo и in vitro и, прежде всего, методов генной инженерии. Использование таких подходов, основные принципы которых будут подробнее рассмотрены ниже, привело к созданию новых фундаментальных и прикладных направлений исследований по молекулярной генетике. Реализация ряда научных программ позволила в последнее время определить полную первичную структуру генома нескольких бактерий, включая "королеву" генетики E. coli, B. subtilis, а также дрожжей S. cerevisiae. Полным ходом идут работы по секвенированию всего генома человека и картированию его основных известных генов. Открытие каталитической активности РНК и ДНК явилось основой нового направления в молекулярной генетике, связанного с изучением и практическим использованием рибозимов и дезоксирибозимов. Наряду с этими работами бурно развивается другой комплекс исследований, связанных с антисмысловыми РНК – мощными природными и искусственными регуляторами генной активности. Разработка многочисленных и эффективных методов направленного мутагенеза сделала возможным тонкое изучение функциональной значимости конкретных последовательностей нуклеотидов в генах и аминокислотных последовательностей в белках. Это, в свою очередь, позволило перейти к искусственному конструированию новых белков с заранее заданными свойствами, в том числе с новой ферментативной активностью. Такое направление исследований получило название белковой инженерии. Введение чужеродных генов в многоклеточные организмы и осуществление их эффективной экспрессии в новом генетическом окружении привело к созданию трансгенных животных и растений. В результате был заложен прочный фундамент для генотерапии, а также клонирования целых многоклеточных организмов из отдельных соматических клеток. Современные методы молекулярной генетики революционизировали диагностику различных наследственных и приобретенных заболеваний, поскольку только они дали возможность с высокой достоверностью связать причинно-следственными отношениями конкретный генотип с конкретными патологическими состояниями организма. Такая глубина понимания молекулярных механизмов патологии недостижима другими методами и, по-видимому, лишь на этом пути возможно приближение к физиологической гармонии, т.е. к истинному здоровью человека. С учетом всего этого во второй части книги кратко рассматриваются основные достижения вышеперечисленных и некоторых других направлений молекулярной генетики, а также сделана попытка прогноза их дальнейшего развития. Изложение материала начинается с обсуждения принципов генной инженерии, так как во многом именно благодаря ей биологическая наука приобрела современный облик.
ЧАСТЬ II. ИСКУССТВЕННЫЕ ГЕНЕТИЧЕСКИЕ СИСТЕМЫ
Глава 7. ПРИНЦИПЫ ГЕННОЙ ИНЖЕНЕРИИ
Само название раздела молекулярной генетики, именуемого генной инженерией, указывает на то, что в результате такого рода исследований создаются искусственные генетические конструкции, в которых отдельные части генов или гены целиком объединяются в требуемой последовательности руками экспериментатора – генного инженера. Это позволяет определять их взаимное влияние и функциональное значение, а также проводить экспрессию генов в новом генетическом окружении. Таким образом, в экспериментальных условиях имеет место обмен генетической информацией как между отдельными генами организмов одного и того же вида, так и между организмами разных таксономических групп, что не происходит в природе из-за непреодолимых барьеров репродуктивной изоляции. Тем не менее, практически во всех методах современной генной инженерии фрагментарно (в адаптированном виде) используются элементы природных молекулярно-генетических механизмов.
Обмен генетической информацией между носителями этой информации – живыми организмами, а также составляющими их соматическими и половыми клетками является фундаментальным принципом существования всего живого. Половой процесс освобождает организмы от груза необратимых изменений в виде соматических мутаций и других многочисленных модификаций макромолекул, которые нарушают его нормальное функционирование в старости. Кроме того, в результате такого процесса геном нового организма воссоздается в новом сочетании аллелей, что, как правило, сопровождается расширением его адаптивных возможностей. Этот широко распространенный способ обмена генами между организмами с их передачей по вертикали, т.е. от поколения к поколению, не исчерпывает всего феномена обмена генами, непрерывно происходящего в биосфере.
Известна обширная группа генетических явлений, связанная с горизонтальной передачей генов в пределах одного поколения организмов, а также между клетками одного и того же многоклеточного организма. Характерными примерами такого рода являются специфическая и неспецифическая трансдукции, осуществляемые бактериофагами, в результате чего происходит перенос небольших частей генома микроорганизмов. Большое значение в эволюции бактерий играет и обмен генами с помощью конъюгативных плазмид и транспозонов, в частности распространение генов устойчивости к различным химическим веществам как в популяциях родственных бактерий, так и между представителями таксономически удаленных друг от друга групп. Ретровирусы, по-видимому, и в природных условиях способны осуществлять горизонтальный перенос генов у млекопитающих, а с помощью Ti-плазмид происходит горизонтальный обмен генами и у растений. Перемещение генетической информации и изменение характера ее экспрессии возможны и в пределах самих одноклеточных и многоклеточных организмов под действием разнообразных мобильных генетических элементов, а также при воздействии мутагенных факторов окружающей среды.
Приведенные примеры показывают, что в природе обмен блоками генов, отдельными генами и их фрагментами как в пределах геномов, так и между различными геномами и организмами – обычное явление. В результате этих событий переносимые гены не только сохраняют свою способность к экспрессии в новом генетическом окружении, но и могут значительно менять ее уровень, что часто сопровождается характерным изменением фенотипа организмов.
Образование новых сочетаний генов и их частей в природных условиях, по-видимому, не носит целенаправленного характера, и лишь жесткая проверка естественным отбором может оценить жизненную значимость таких преобразований геномов. Однако сознательное использование в лабораторных условиях основных генетических принципов, лежащих в основе природных перемещений генов, позволило разработать более эффективные системы передачи генетической информации между организмами и приступить к беспрецедентным по информативности исследованиям генетических явлений на молекулярном уровне. У нас на глазах произошло рождение нового направления в молекулярной биологии – генной инженерии, значение которого не ограничивается результатами тех или иных фундаментальных и прикладных исследований. Несомненно, именно с этого момента начался новый этап эволюции биосферы Земли, все последствия которого мы в настоящее время не в состоянии предвидеть.
Необходимость манипулирования генами диктуется конкретными задачами фундаментальных и прикладных исследований. Для понимания молекулярных механизмов функционирования отдельных генов и взаимосвязанных генетических систем большое значение имеет работа с изолированными генами. Такие исследования позволяют определить границы генов, выделить их в чистом виде и идентифицировать элементы структуры, существенные для функционирования. Доказательством функциональной значимости выделенного участка генома может быть только его нормальная экспрессия в модельной генетической системе. Поэтому следующим этапом исследования выделенного гена всегда является перемещение его в такую генетическую систему, где экспрессия гена легко обнаруживается. Результаты экспрессии оценивают либо по появлению белкового продукта, кодируемого исследуемым геном, либо по изменению функций биологической системы вследствие появления в ней новой ферментативной или другой активности, например по компенсации присутствующей в этой системе мутации. Таким образом, в результате исследования структуры конкретного гена и моделирования его экспрессии в искусственной генетической системе можно понять особенности его функционирования в живом организме. Подобный подход может быть успешно применен как к известным генам, которые выделяются целенаправленно, так и к неидентифицированным ранее последовательностям нуклеотидов, функциональную значимость которых определяют лишь после выделения их в чистом виде. Последний подход реализуется в так называемой обратной генетике.
В настоящее время с помощью методов генной инженерии получены данные о структуре и функционировании генов разнообразных организмов, что дало возможность перейти на качественно новый уровень генетических исследований. Это, во-первых, возможность переноса гена в новое для него генетическое окружение с дальнейшей его экспрессией, что ведет к изменению свойств организма, в геном которого вводится ген (например создание продуцентов биологически активных веществ или трансгенных животных), а также осуществление генотерапии наследственных и приобретенных заболеваний путем искусственного замещения мутантных аллелей. Во-вторых, стало реальным конструирование новых генов путем объединения in vitro как известных, так и новых, искусственно синтезированных последовательностей нуклеотидов. Этот подход используется в белковой инженерии для исследования функциональной значимости отдельных аминокислот и доменов в полипептидных цепях ферментов, а также для создания новых белков. В-третьих, в современной биотехнологии появилась возможность применять изолированные гены в составе генно-инженерных конструкций для получения пищевых продуктов и биологически активных веществ белковой природы.
Поскольку в экспериментальных условиях невозможно работать с одной копией гена, получение необходимого числа идентичных копий гена или его частей является первой и одной из основных задач генной инженерии. Для ее решения используют метод молекулярного клонирования. Сущность метода заключается в том, что нуклеотидная последовательность, которую необходимо выделить или размножить, ковалентно встраивается в самореплицирующиеся молекулы нуклеиновой кислоты, называемые векторами. Далее такая последовательность нуклеотидов в составе вектора вводится в клетки про- или эукариотического организма, и эти гибридные клетки в селективных условиях, обеспечивающих сохранение вектора внутри клеток, выращивают на питательной среде. В результате образуется клон клеток, теоретически содержащих идентичные векторные молекулы с одной и той же вставкой чужеродной последовательности нуклеотидов. Поскольку объединение молекул клонируемой последовательности нуклеотидов и вектора является не чем иным, как рекомбинацией in vitro, такие гибридные молекулы называют рекомбинантными молекулами. В настоящее время разработаны многочисленные методы, позволяющие выделять определенные последовательности нуклеотидов из сложной смеси фрагментов хромосомной ДНК, а также осуществлять обмен между строго определенными фрагментами генов и другими последовательностями нуклеиновых кислот. Во всех этих реакциях, как правило, используются высокоочищенные препараты нуклеиновых кислот и ферментов нуклеинового обмена, особенности использования которых будут кратко рассмотрены ниже.
Большинство ферментов, применяемых для молекулярного клонирования нуклеиновых кислот, участвует в метаболизме нуклеиновых кислот in vivo. Это означает, что генная инженерия в своем развитии опирается на достижения исследований ферментных систем метаболизма нуклеиновых кислот и существует благодаря возможности получения таких ферментов в высокоочищенном состоянии. В то же время сам процесс клонирования и исследования клонированных последовательностей нуклеотидов сводится в основном к последовательному проведению in vitro определенных ферментативных реакций с использованием очищенных ферментов и их субстратов – нуклеиновых кислот.
При очистке ДНК и РНК в основном используются одни и те же приемы. Различия в методах их фракционирования определяются значительно большей чувствительностью молекул РНК к гидролитическому расщеплению из-за присутствия у рибонуклеотидов, входящих в состав РНК, свободных 2'-ОН групп, их более низкой молекулярной массой и наличием у одноцепочечных молекул характерной (компактной) пространственной структуры. Для выделения нуклеиновых кислот в нативном состоянии необходимо соблюдать, по крайней мере, две предосторожности: следует использовать мягкие условия разрушения тканей биологического объекта, содержащего изучаемые нуклеиновые кислоты, и инактивировать гидролитические ферменты (ДНКазы или РНКазы) до того, как они успеют гидролизовать молекулы нуклеиновых кислот. С учетом этого ингибиторы нуклеаз вводятся в буферные растворы до разрушения клеток или тканей. В качестве ингибиторов нуклеаз используют как неспецифические денатурирующие агенты (ионные детергенты, гидроокись ртути, гуанидинхлорид, гуанидинизотиоцианат, фенол, хлороформ и т.п.), так и специфические ингибиторы, например ингибитор РНКазы из плаценты человека или ванадиевые комплексы рибонуклеозидов.
Работу двухцепочечной геномной ДНК (особенно ДНК эукариотических клеток) сильно усложняют значительная молекулярная масса и высокая жесткость выделяемых молекул. Следствием этого являются большая вязкость растворов высокомолекулярной ДНК и легкость ее фрагментации в растворах. В связи с этим при выделении высокомолекулярной ДНК допускается лишь мягкое перемешивание ее раствора в процессе депротеинизации (освобождения от белков). Для этого на первых этапах очистки обычно применяют протеолитические ферменты (протеиназу К из Trirachium album или проназу из Streptomyces griseus), фенол и хлороформ. Поскольку при освобождении от белков происходит одновременная очистка ДНК и РНК, для освобождения от примесей РНК применяют высокоочищенные препараты РНКаз без примесей ДНКаз (чаще всего панкреатическую РНКазу), а в случае выделения РНК – ДНКаз, не загрязненных РНКазами.
Разделение ДНК и РНК центрифугированием в градиенте плотности CsCI и сахарозы. Высокоэффективным методом разделения нуклеиновых кислот, широко используемым при их очистке, является центрифугирование в градиенте плотности хлористого цезия. В этом случае высокая ионная сила буферного раствора в центрифужных пробирках способствует диссоциации комплексов белков и нуклеиновых кислот, и разделение макромолекул происходит на основании их различий в плавучей плотности. Перемещение макромолекул во время центрифугирования происходит до тех пор, пока они не достигнут зоны раствора CsCl с плотностью, равной их плавучей плотности. В этой зоне происходит их концентрирование. Метод центрифугирования в градиенте плотности CsCI в присутствии бромистого этидия используется в генной инженерии для получения векторных плазмид в препаративных количествах. Он позволяет отделять суперскрученные молекулы ДНК от релаксированных и линейных, так как их плавучие плотности заметно различаются из-за разного количества молекул бромистого этидия, интеркалированного в эти топологические изомеры плазмидной ДНК. В практической генной инженерии для очистки векторных плазмид центрифугирование в градиенте плотности CsCI в настоящее время используется редко. В целях обычного применения рекомбинантных ДНК, в том числе для молекулярного клонирования, построения рестрикционных карт и определения последовательности нуклеотидов (секвенирования), разработаны методы минипрепаративного выделения. В одном из них суперскрученные молекулы рекомбинантных плазмидных ДНК легко отделяются от линейных молекул хромосомной и плазмидной ДНК в процессе щелочной денатурации с последующей быстрой нейтрализацией раствора. При этом в основном успевают ренатурировать только суперскрученные молекулы ДНК, так как две их цепи остаются физически связанными друг с другом в процессе денатурации. Образовавшийся комплекс денатурированной ДНК и белков отделяется от плазмидной ДНК центрифугированием, а от основной массы РНК освобождаются переосаждением в присутствии высокой концентрации LiCl.
Широко распространенным методом фракционирования нуклеиновых кислот по размерам молекул является центрифугирование в градиенте концентрации глицерина.
Электрофоретическое и хроматографическое разделение нуклеиновых кислот. Для дополнительной очистки плазмидной ДНК иногда применяют гель-фильтрацию на Сефакриле S1000 (крупнопористый синтетический аналог сефадекса), а также электрофорез в агарозном геле. Следует отметить, что электрофорез в агарозном, полиакриламидном или смешанном агарозно-полиакриламидном гелях используют для определения размеров и выделения небольших фрагментов двухцепочечной ДНК, образующихся под действием эндонуклеаз рестрикции или во время секвенирования ДНК. Проявление фрагментов в этом случае проводят с помощью бромистого этидия, интеркалирующего между основаниями ДНК и флуоресцирующего в ультрафиолетовом свете. Более чувствительными методами обнаружения фрагментов ДНК в гелях являются окраска серебром, авторадиография и введение флуоресцентной метки.
Отдельно следует упомянуть метод аффинной хроматографии на олиго(dТ)-целлюлозе, используемый для специфической очистки эукариотических мРНК, большинство из которых содержит на 3'-конце поли(А)-последовательность. В олиго(dТ)-целлюлозе последовательности олиго(dТ)12-18 ковалентно присоединены к молекулам целлюлозы своими 5'-концевыми фосфатными группами. При использовании этого метода фракцию суммарной РНК наносят на колонку с олиго(dT)-целлюлозой в условиях, при которых происходит гибридизация поли(А)-последовательностей мРНК с комплементарными им последовательностями олиго(dТ)-целлюлозы. После отмывания несвязавшихся со смолой молекул РНК, большинство из которых являются рРНК и тРНК, фракцию поли(А)-РНК элюируют, прогревая колонку до температуры плавления поли(А)•олиго(dТ)-гибридов или разрушая гибриды понижением ионной силы элюирующего раствора.
Все перечисленные выше способы очистки и фракционирования нуклеиновых кислот позволяют получать лишь относительно короткие последовательности нуклеотидов. Однако в настоящее время в арсенале молекулярной биологии имеются методы, которые дают возможность выделять в гомогенном состоянии последовательности нуклеотидов, эквивалентные целым хромосомам. Одним из таких методов является электрофорез в импульсном электрическом поле (pulsed field gel electrophoresis – PFGE), с помощью которого удается препаративно разделять ДНК целых хромосом дрожжей. Другой эффективный метод, с помощью которого можно фракционировать метафазные хромосомы млекопитающих, – это сортировка хромосом с помощью проточной цитофлуориметрии. Метод позволяет получать индивидуальные метафазные хромосомы в количестве, достаточном для конструирования клонотек генов индивидуальных хромосом.
Все упомянутые выше методы очистки нуклеиновых кислот при использовании в качестве исходного материала клеток бактерий, животных или растений дают в руки исследователей сложную смесь генов и некодирующих последовательностей нуклеотидов. Для выделения конкретных последовательностей нуклеотидов и работы с ними необходимо использовать многочисленные ферменты. Свойства некоторых ферментов, широко используемых в генной инженерии, кратко рассмотрены ниже.
Основные ферменты, используемые в генной инженерии
Рестриктазы и ДНК-метилазы
Классификация рестриктаз. По механизму действия и молекулярной структуре различают три типа рестриктаз. Ферменты рестрикции типа I представляют…Рис. II.1. Формы разрывов двухцепочечных ДНК, образующихся под действием рестриктаз
а – 5’-выступающие (1), 3’-выступающие "липкие" (2) и "тупые" (3) концы ДНК, образующиеся под действием рестриктаз BamHI, KpnI и PvuII соответственно. Стрелками обозначены места разрывов цепей ДНК, пунктирной линией – ось симметрии сайтов рестрикции;
б – лигирование с потерей сайта рестрикции
Названия рестриктаз складываются из первых букв видовых названий бактерий, в которых они обнаружены, например Eco – E. coli. В том случае, когда различные по специфичности действия рестриктазы присутствуют в клетках разных штаммов одного вида бактерий, в название рестриктазы вводят дополнительную букву, например рестриктазы Hinc и Hind выделены из бактериальных клеток Haemophilus influenzae, штаммы с и d. Цифры, следующие за буквенными обозначениями, отражают последовательность открытия соответствующих рестриктаз в клетках бактерий одного вида, например HaeI, HaeII и HaeIII из H. aegipticus.
Рестриктазы типа II – основной инструмент генной инженерии. Большинство рестриктаз типа II специфически узнают на ДНК тетра- и гексануклеотидные последовательности, а по крайней мере три из них – октануклеотиды. Чем короче олигонуклеотидная последовательность сайта рестрикции, узнаваемого рестриктазой, тем чаще он встречается в случайной последовательности нуклеотидов, в которой каждый из четырех нуклеотидов представлен с одинаковой частотой (50% А–Т-пар и 50% G–С-пар). Так, случайная тетрануклеотидная последовательность встречается в среднем через каждые 256 п.о. (44), а гексануклеотидная – через каждые 4096 п.о. (46). Однако в природных ДНК распределение нуклеотидов может заметно отличаться от случайного. Например, для эукариотических ДНК характерна низкая частота встречаемости динуклеотида CpG и соответственно сайтов рестрикции, содержащих эти динуклеотиды (рестриктазы HhaI, HpaII, TaqI, ThaI, AvaI, HaeII, HindII, SalI, SmaI, XhoI, XmaI). Существенное отклонение частоты встречаемости сайтов рестрикции от ожидаемого при случайном их распределении вдоль ДНК свойственно и хромосомам термофильных бактерий, которым, напротив, свойственно (хотя и не во всех случаях) обогащение по G–С-парам. Для большинства сайтов, узнаваемых рестриктазами типа II, характерно наличие в них симметрии второго порядка, т.е. узнаваемые ими последовательности представляют собой палиндромы, например у рестриктазы EcoRI – 5’-GAATTC-3’. Это означает, что нуклеотиды, расположенные в каждой из цепей на равном расстоянии от оси симметрии, комплементарны друг другу. Если точки расщепления противоположных цепей ДНК смещены друг относительно друга в сайте рестрикции, то образующиеся в результате рестрикции концы ДНК содержат выступающие одноцепочечные участки. Поскольку такие участки комплементарны сами себе и друг другу и могут между собой взаимодействовать, их часто называют "липкими" концами. В "липких" концах выступающим одноцепочечным участком может быть как 5’-, так и 3’-конец (рис. II.1,а). Формальным признаком образования 5’- или 3’-выступающих "липких" концов в сайтах рестрикции является расположение точки расщепления цепей ДНК в последовательности, используемой для обозначения сайта рестрикции, слева или справа от оси симметрии соответственно. У некоторых рестриктаз точки расщепления обеих цепей ДНК расположены непосредственно друг под другом в сайте рестрикции. В этом случае после расщепления ДНК "липких" концов не образуется, а получаются так называемые "тупые" концы, в которых нет выступающих одноцепочечных участков ДНК (см. рис. II.1,а). Имеется одно принципиальное функциональное различие между 5’- и 3’-выступающими "липкими" концами – последние невозможно пометить путем их достройки ДНК-полимеразой. Эту особенность следует иметь в виду при выборе рестриктаз для получения рестрикционных фрагментов ДНК, которые предполагается использовать в качестве зондов.
При конструировании рекомбинантных молекул полезно помнить, что, хотя рестриктазы BamHI, BclI, BglII и XhoII узнают разные сайты рестрикции, они образуют одни и те же "липкие" концы, GATC. То же характерно и для группы рестриктаз SalGI, XhoI и AvaI (NCGA). При лигировании (см. ниже) фрагментов ДНК, образованных рестриктазами одной из таких групп, происходит их объединение, но при этом исходные сайты рестрикции теряются, так как в результате образуется новая непрерывная последовательность нуклеотидов (см. рис. II.1,б). Сайты рестрикции для некоторых рестриктаз II типа не являются симметричными. Например, рестриктаза HgaI узнает асимметричную последовательность 5’-GACGC-3’, а одноцепочечные разрывы вносит в противоположные цепи ДНК, отступя вправо на 5 и 10 нуклеотидов соответственно:
5’-GACGC(N)5¯
3’-CTGCG(N)5(N)5¯
Последовательности нуклеотидов образующихся "липких" концов являются уникальными для каждого такого сайта рестрикции. Вследствие этого рестрикционные фрагменты ДНК, образовавшиеся под действием данной рестриктазы, в смеси соединяются друг с другом лишь в строго определенной исходной последовательности, которая задается уникальными последовательностями нуклеотидов в "липких" концах рестрикционных фрагментов ДНК. Например, при расщеплении этой рестриктазой репликативной формы ДНК фага fX174 образуется 14 фрагментов, которые in vitro объединяются в правильную последовательность с образованием инфекционной fX174-ДНК.
Универсальные рестриктазы для одноцепочечных ДНК. На основе рестриктаз, узнающих асимметричные последовательности нуклеотидов, разработана система, позволяющая расщеплять молекулы одноцепочечной ДНК в любой заданной точке. С этой целью синтезируется олигонуклеотид, 5’-концевая часть которого содержит сайт, узнаваемый такой рестриктазой, а последовательность нуклеотидов 3’-концевой части комплементарна участку ДНК, в который необходимо внести эндонуклеазный разрыв. В результате гибридизации олигонуклеотида с одноцепочечной ДНК образуется структура, изображенная на рис. II.2. При этом фермент взаимодействует с сайтом узнавания (участок I), а разрывы вносятся по местам, обозначенным стрелками. Таким образом, положение места эндонуклеазного расщепления будет целиком зависеть от последовательности нуклеотидов участка II синтетического олигонуклеотида, комплементарного ДНК-субстрату.
Рис. II.2. Расщепление одноцепочечной ДНК универсальной рестриктазой
а – синтетический олигонуклеотид; б – одноцепочечная ДНК.
После образования шпильки и гибридизации с одноцепочечной ДНК-мишенью олигонуклеотид образует сайт связывания рестриктазы (участок I) и сайт расщепления ДНК-ДНК-гибрида (участок II). Стрелки указывают места эндонуклеазного расщепления ДНК и олигонуклеотида
Изошизомеры. В клетках разных видов бактерий могут содержаться рестриктазы, узнающие одни и те же сайты рестрикции. Такие рестриктазы называют изошизомерами. Изошизомеры некоторых рестриктаз с успехом используются для обнаружения метилированных участков ДНК в геноме. Так, рестриктазы HhaI и HpaII расщепляют неметилированные последовательности GCGC и CCGG соответственно и утрачивают способность к расщеплению, если хотя бы один из остатков цитозина в этих сайтах метилирован. В то же время фермент MspI (изошизомер HpaII) расщепляет последовательность CCGG независимо от того, метилированы или неметилированы остатки цитозина в таком сайте. N-Метилирование остатков аденозина в ДНК можно обнаружить с помощью изошизомеров Sau3A (расщепляет как метилированные, так и неметилированные последовательности GATC), DpnI (расщепляет только метилированные последовательности GMeATC) и MboI (расщепляет только неметилированные последовательности).
Изменение специфичности действия рестриктаз в неоптимальных условиях. Рестриктазы являются высокоспецифическими ферментами. Однако для поддержания этой специфичности in vitro необходимо соблюдать в реакционной смеси оптимальные условия для действия ферментов. При нарушении таких условий у некоторых рестриктаз начинает проявляться вторичная (так называемая штриховая) активность. Так, рестриктаза EcoRI расщепляет последовательность GAATTC при pH 7,3, 100 мМ NaCl в присутствии 5 мМ MgСl2, однако при изменении значений pH, понижении концентрации NaCl или замене ионов Mg2+ на Mn2+, а также в присутствии органических растворителей у фермента появляется тенденция к расщеплению более короткой последовательности AATT (так называемая активность EcoRI). К рестриктазам, обладающим подобными свойствами, относятся также BamHI, BstI, BsuI, DdeI, HhaI, PstI, SalI, SstI, XbaI.
Действие рестриктаз на необычные субстраты. Помимо двухцепочечных ДНК многие рестриктазы способны использовать ДНК-РНК-гибриды в качестве субстрата. Это относится, в частности, к рестриктазам EcoRI, HindII, SalI, MspI, HhaI, AluI, TaqI и HaeIII. Некоторые рестриктазы, например HaeIII, HhaI и SfaI, способны расщеплять одноцепочечную ДНК фага fX174, хотя и со значительно меньшей скоростью, чем соответствующую двухцепочечную RF-форму. Такая способность была продемонстрирована для некоторых других рестриктаз, а также ДНК-субстратов. Остается неясным, узнают ли эти рестриктазы истинные одноцепочечные сайты или же последовательности нуклеотидов, заключенные в элементы вторичной структуры.
С развитием метода полимеразной цепной реакции (ПЦР) (см. ниже) часто возникает необходимость расщепления рестриктазами амплифицированных олигонуклеотидов недалеко от их концов, т.е. в условиях, когда сайт рестрикции фланкирован с одного из своих концов одним или несколькими нуклеотидами. В этом случае установлена четкая зависимость способности определенных рестриктаз расщеплять сайты рестрикции от количества фланкирующих сайт нуклеотидов. Данное свойство рестриктаз объясняют, в частности тем, что на самих концах двухцепочечной молекулы ДНК происходит локальное плавление двойной спирали ДНК с образованием коротких одноцепочечных участков, захватывающих сайт узнавания рестриктазами. Частично избежать локальное плавление можно понижением температуры реакционной смеси во время проведения рестрикции таких олигонуклеотидов. Поскольку эти данные имеют большое значение для практической генной инженерии, они суммированы в табл. II.1.
Таблица II.1
Эффективность расщепления коротких последовательностей ДНК некоторыми распространенными рестриктазами
Рестриктаза Последовательность олигонуклеотидов в окрестностях сайта рестрикции Длина цепи, нт Процент… ДНК-метилазы. Большинство штаммов E. coli содержит два типа ферментов, метилирующих ДНК: dam- и dcm-метилазы. Первая…ДНК- и РНК-лигазы
Рис. II.3. Механизм лигирования ДНК Т4-ДНК-лигазой
1 – образование промежуточного комплекса фермент Е–AMP; 2 – образование фосфодиэфирной связи
Ферменты матричного синтеза ДНК и РНК
ДНК-зависимые ДНК-полимеразы. Среди ДНК-зависимых ДНК-полимераз наибольшее применение в генной инженерии находят ДНК-полимераза I E. coli и ее… Полимеразная цепная реакция (ПЦР). Термостабильная Taq-полимераза в настоящее… С помощью ПЦР можно амплифицировать in vitro сегменты ДНК длиной от 0,1 до 5–7 т.п.о. и более, а для получения…Рис. II.4. Полимеразная цепная реакция (ПЦР)
Поскольку специфичность ПЦР зависит главным образом от соответствия последовательности нуклеотидов праймеров первичной структуре амплифицируемых фрагментов ДНК, эта специфичность приближается к абсолютной при повышении длины праймеров до 17–20 нуклеотидов. Такая высокая специфичность и чувствительность позволяют использовать ПЦР для ДНК-диагностики инфекционных и наследственных заболеваний человека, а также вирусоносительства в тех случаях, когда вирусом в латентной форме заражены лишь отдельные соматические клетки, например в случае вируса иммунодефицита человека (ВИЧ) (см. главу 11). Разработка метода ПЦР во многом расширила методические возможности молекулярной генетики, и в частности генной инженерии, причем настолько, что это кардинально изменило и усилило исследовательский потенциал многих ее направлений.
Точность амплификации ДНК термостабильными ДНК-полимеразами является особенно критическим параметром в том случае, если продукты ПЦР используются далее для конструирования экспрессирующихся генов. Необходимость в уменьшении частоты мутаций стимулирует поиски новых термостабильных ДНК-полимераз, амплифицирующих ДНК с большей точностью. В табл. II.2 приведены результаты испытаний точности синтеза ДНК различными коммерческими ДНК-полимеразами.
Относительно высокая точность синтеза ДНК in vitro ДНК-полимеразами Pfu и Vent обусловлена наличием у них 3’-5’-экзонуклеазной корректирующей активности. Частота ошибочно включенных нуклеотидов в результате одновременного функционирования двух разных ДНК-полимераз в смесях, применяемых для амплификации длинных сегментов ДНК (long PCR), оказывается ниже, чем при использовании Taq-полимеразы, но выше, чем для очищенной ДНК-полимеразы Pfu.
При проведении аллель-специфической ПЦР (см. раздел 11.1) необходимо учитывать способность Taq-полимеразы инициировать синтез ДНК на праймерах, 3’-концевой нуклеотид которых некомплементарен матричной ДНК. При исследовании этого вопроса оказалось, что не все пары
Таблица II.2
Частота ошибок при синтезе ДНК, осуществляемом термостабильными ДНК-полимеразами in vitro при проведении ПЦР в оптимальных условиях
РНК-зависимые ДНК-полимеразы (обратные транскриптазы, ревертазы). Обратные транскриптазы способны осуществлять синтез ДНК на матрице РНК,… Недавно способность синтезировать ДНК на матрице РНК в определенных условиях…Другие ферменты
Терминальная трансфераза из тимуса теленка (терминальная дезоксирибонуклеотидилтрансфераза), осуществляющая последовательное присоединение… Щелочные фосфатазыбактерий (BAP) и кишечника теленка (CIAP) катализируют… В заключение следует рассмотреть некоторые нуклеазы, часто используемые в генной инженерии. Нуклеазы – это…Векторы
Основная идея, позволяющая решать эту задачу, заключается в том, чтобы присоединить исследуемые фрагменты ДНК к молекуле-переносчику, которая могла… Идеальная векторная молекула должна обладать несколькими обязательными…Плазмидные векторы
Рис. II.5. Различные векторы для клонирования ДНК и их рестрикционные карты
Обозначены положения уникальных сайтов рестрикции, а также функционально значимых генов
а – векторная плазмида pBR322; б – экспрессирующая векторная плазмида pUC18; в – векторная плазмида pAN7, предназначенная для отбора рекомбинантных клонов с использованием гомологичной рекомбинации; г – многофункциональная векторная плазмида Bluescript
Первые эффективные векторы для клонирования фрагментов чужеродной ДНК, не утратившие своего значения и поныне, были получены с использованием бактериальных плазмид. Большая серия векторных плазмид, обозначенных символом pBR, создана на основе репликона природной плазмиды ColEI, придающей клеткам E. coli устойчивость к колицину путем его объединения с генами устойчивости к антибиотикам. Таким образом, бактериальные клетки, несущие подобные комбинированные плазмиды, приобретали устойчивость к соответствующим антибиотикам, и их было легко отличить от бесплазмидных клеток путем простого посева на питательную среду с антибиотиками. Генетическая карта одного широко распространенного вектора этой серии – pBR322 изображена на рис. II.5,а. Такая плазмида представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной 4363 п.о. Последовательность нуклеотидов pBR322 полностью известна. Плазмида содержит гены устойчивости к тетрациклину (Tc) и ампициллину (Ap), которые были перенесены в плазмиду pBR322 из плазмиды pSC101 и транспозона Tn3 соответственно. Оба этих гена являются селектируемыми генетическими маркерами плазмиды, т.е. позволяют проводить отбор бактериальных клеток с плазмидой pBR322 по их способности к росту на питательных средах в присутствии тетрациклина и(или) ампициллина. Плазмида pBR322 содержит также обеспечивающий ее стабильную репликацию в клетках E. coli участок ДНК, который включает область начала репликации (ori). Характерной чертой плазмиды pBR322, как и любого современного вектора, является наличие в ней нескольких уникальных сайтов рестрикции, обозначенных на генетической карте. Следует иметь в виду, что встраивание в плазмиду клонируемых чужеродных фрагментов ДНК по сайтам рестрикции, расположенным в генах Ар или Tc (например PstI или BamHI), будет нарушать целостность этих генов и их функциональную активность. В результате происходит утрата бактериальными клетками, содержащими рекомбинантные плазмиды, устойчивости к соответствующим антибиотикам. По такому признаку легко различить бактериальные клетки, не содержащие плазмиды (не растут в присутствии ампициллина и тетрациклина), клетки с плазмидой, не содержащей вставки клонируемой ДНК (растут в присутствии обоих антибиотиков), и клетки с рекомбинантными плазмидами (в зависимости от локализации вставки могут расти на среде только с одним из двух вышеупомянутых антибиотиков). Следовательно, наличие в векторных молекулах селектируемых маркеров резко повышает эффективность клонирования из-за возможности проведения быстрого отбора рекомбинантных плазмид на селективных питательных средах.
Помимо генов устойчивости к антибиотикам в качестве селектируемых маркеров используют и другие гены или их фрагменты. В частности, для этих целей часто применяются гены различных ферментов, присутствие которых в клетках в составе плазмиды обнаруживают по появлению соответствующей ферментативной активности. В часто используемых векторах серии pUC таким селектируемым маркером является 5’-концевая часть гена b‑галактозидазы E. coli – lacZ’ (см. рис. II.5,б). Эта часть гена, находящаяся под контролем lac-промотора, кодирует N-концевую часть b-галактозидазы (так называемый a-пептид), которая путем объединения с недостающей С-концевой частью полипептида без образования пептидной связи восстанавливает ферментативную активность b-галактозидазы. b‑Галактозидаза обладает способностью расщеплять искусственный субстрат Xgal (5-бром-4-хлор-3-индолил-b-D-галактопиранозид) с образованием окрашенного в голубой цвет продукта реакции. В том случае, когда в бактериальных клетках, которые содержат в хромосоме недостающую экспрессирующуюся 3’-концевую часть гена lacZ и выращиваются на среде с Xgal, в результате комплементации a-пептидом вектора появляется активность b-галактозидазы, образованные этими клетками бактериальные колонии окрашиваются в голубой цвет. Уникальные сайты рестрикции для клонирования ДНК локализованы в начале гена b-галактозидазы в составе полилинкера (синтетической последовательности нуклеотидов, содержащей несколько перекрывающихся уникальных сайтов рестрикции), который не нарушает функциональной целостности последовательности нуклеотидов a-пептида. Вставка рекомбинантной ДНК в эти векторы разрывает структурную часть гена b-галактозидазы и инактивирует его, в связи с чем колонии бактерий с подобными рекомбинантными плазмидами, выросшие на питательной среде с Xgal, не окрашены. Поскольку векторы серии pUC одновременно содержат и ген устойчивости к ампициллину, отбор бактерий, несущих рекомбинантные плазмиды, можно проводить одновременно по этим двум маркерам. На питательной среде с ампициллином и Xgal вырастают только бактерии, устойчивые к антибиотику, т.е. содержащие плазмиду pUC, а среди выросших колоний лишь неокрашенные содержат вставку чужеродной ДНК. В качестве селектируемых маркеров в векторных молекулах часто используются гены, присутствие которых может быть обнаружено косвенно по комплементации генетических дефектов бактериальных клеток-хозяев, что делает их жизнеспособными в определенных селективных условиях. Подробнее об одной из таких систем см. в разделе 7.3.3.
За короткий период развития генной инженерии было сконструировано труднообозримое количество векторных плазмид, обеспечивающих конкретные потребности исследователей. Одной из вершин генно-инженерного искусства, прекрасно иллюстрирующей возможности генной инженерии, в настоящее время являются полифункциональные векторы серии Bluescript, полученные фирмой "Stratagene" (США) (см. рис. II.5,г). Вектор Bluescript M13+ представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной около 3 т.п.о. Он включает в себя ген устойчивости к ампициллину Ampr, ген b-галактозидазы lacZ, в N-концевую часть которого встроен полилинкер, содержащий уникальные сайты рестрикции для 21 рестриктазы, промоторно-операторную область lacZ, а также ген lac-репрессора lacI. В результате встраивания клонируемого фрагмента ДНК в полилинкер происходят разрыв кодирующей части гена lacZ и инактивация b-галактозидазы, что, как и в случае вектора pUC18, можно обнаружить по исчезновению окраски колоний бактерий, содержащих этот вектор со вставкой клонированной ДНК. Кроме того, встроенный в полилинкер фрагмент ДНК попадает под контроль промоторно-операторной регуляторной последовательности гена lacZ и в присутствии индуктора IPTG может быть экспрессирован в клетках E. coli. В дополнение к этому полилинкер в векторной плазмиде содержит на одном конце промотор для Т7-, а на другом – для Т3-РНК-полимераз, которые ориентированы навстречу друг другу. Это позволяет транскрибировать любую из цепей клонированного фрагмента ДНК in vitro с помощью той или другой РНК-полимеразы и получать препаративные количества мРНК или же комплементарной ей антисмысловой РНК. Кроме того, вектор Bluescript M13+ обладает межгенной областью (IG) фага f1, родственного фагу M13. Эта область детерминирует все цис-действующие функциональные последовательности нуклеотидов фага, необходимые для репликации его хромосомы и упаковки ее в фаговые частицы. В присутствии фага-помощника M13 происходит преимущественная упаковка образовавшейся в результате репликации одноцепочечной плазмиды в фаговые частицы M13. Одноцепочечная ДНК Bluescript M13+ после очистки может быть использована непосредственно для секвенирования клонированной ДНК или проведения сайт-специфического мутагенеза. Векторы типа Bluescript M13+, способные существовать либо в виде плазмиды, либо в составе фаговых частиц нитевидных бактериофагов, называют фагмидами.
Векторы на основе фага l
Рис. II.6. Упаковка рекомбинантной фаговой ДНК в фаговые частицы in vitro
Емкость клонирующих векторов была значительно повышена с появлением векторов, сконструированных на основе хромосомы бактериофага l. Получившие широкое распространение векторы серий Charon, lgt11 и EMBL обладают, по крайней мере, двумя существенными преимуществами перед плазмидными векторами. Во-первых, векторы на основе ДНК фага l обладают значительно большей емкостью, в них можно клонировать фрагменты ДНК длиной от 5 до 25 т.п.о. Во-вторых, фаговые частицы, содержащие упакованную ДНК, способны проходить литический цикл развития внутри бактериальных клеток и, следовательно, образовывать стерильные пятна (бляшки) на газоне бактерий. Такие бляшки содержат в концентрированном виде как сами фаговые частицы с упакованными в них рекомбинантными молекулами ДНК, так и все продукты метаболизма зараженных бактериальных клеток, включая белки и ферменты, которые появляются в результате экспрессии клонированных бактериальных генов. Каждая бляшка возникает вследствие развития индивидуальной фаговой частицы, содержащей рекомбинантную ДНК только одного типа, а, следовательно, все фаговые частицы одной бляшки (~1010) представляют собой, как правило, клон идентичных фаговых частиц (они могут различаться в редких случаях за счет мутационных изменений их генома, произошедших в процессе жизненного цикла фага, либо в том случае, если одна бактериальная клетка заражается несколькими фаговыми частицами одновременно). Все это позволяет легко обнаруживать в фаговых бляшках искомые ферментативные активности или последовательности нуклеотидов и идентифицировать клонированные последовательности ДНК. В основе конструирования фаговых векторов лежит несколько простых принципов (рис.II.6). В середине молекулы l-ДНК длиной ~45 т.п.о. расположен участок хромосомы (~15 т.п.о.), который не является необходимым для литического развития бактериофага. Поэтому, в принципе, его можно заменить на любой фрагмент ДНК аналогичного размера и осуществить клонирование фрагмента путем размножения рекомбинантного бактериофага. Поскольку механизм упаковки хромосомной ДНК в фаговые частицы основан на включении ДНК строго определенного размера, рекомбинантные ДНК, содержащие фрагменты клонируемой ДНК, которые не соответствуют оптимальному размеру, не упаковываются и не клонируются. Это позволяет легко освобождаться от фаговых частиц, не содержащих вставки клонируемой ДНК, и оптимизировать процесс клонирования путем снижения в упаковочных экстрактах доли нежизнеспособных фаговых частиц. Процесс упаковки фаговой ДНК в зрелые фаговые частицы осуществляется в смеси бесклеточных экстрактов двух штаммов E. coli, лизогенных по дефектным бактериофагам l. В одном штамме амбер-мутацией инактивирован один из белков фагового капсида (продукт гена E), а в другом – ген A, продукт которого необходим для включения фаговой ДНК в головку бактериофага. Имеются и другие пары лизогенных штаммов E. coli, позволяющие производить упаковку ДНК в фаговые частицы с использованием тех же общих принципов. Объединение бесклеточных лизатов обоих штаммов E. coli приводит к взаимной комплементации недостающих функций с помощью соответствующих белков дикого типа. Таким образом, в объединенных экстрактах имеются все компоненты, необходимые для сборки зрелых инфекционных фаговых частиц, в них происходит упаковка рекомбинантной ДНК с эффективностью образования 104–105 фаговых частиц на 1 мкг упаковываемой ДНК. Помимо вышеупомянутых мутаций ДНК l-лизогенов содержат температурно-чувствительную мутацию в репрессоре cI, который инактивируется после переноса лизогенных клеток E. coli на непермиссивную температуру (42o), что сопровождается индукцией профага l и накоплением внутри бактериальных клеток белковых продуктов, необходимых для упаковки ДНК. ДНК профагов также содержит делецию b2, элиминирующую сайт att, необходимый для интеграции фаговой ДНК в бактериальную хромосому. Это предотвращает выход ДНК профага из бактериальной хромосомы, а следовательно, и ее упаковку in vitro. Кроме того, в хромосоме профага имеется мутация, инактивирующая ген S, кодирующий лизоцим, что препятствует преждевременному лизису бактериальных клеток после индукции профага и позволяет сконцентрировать бактериальные клетки перед получением упаковочных экстрактов. И, наконец, бактериальные лизогенные клетки содержат мутацию recA, которая предотвращает гомологичную рекомбинацию между ДНК профага и рекомбинантными ДНК, упаковываемыми в фаговые частицы.
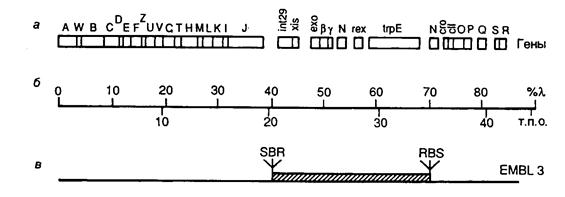
Рис. II.7. Генетическая карта хромосомы бактериофага l-EMBL3
а – расположение генов на хромосоме; б – шкала длины хромосомной ДНК в процентах от длины l-ДНК и т.п.о.; в – участок генома, замещаемый на клонируемый фрагмент ДНК соответствующего размера. S, B и R – сайты рестрикции SalGI, BamHI и EcoRI соответственно
В качестве примера рассмотрим генетическую карту векторной ДНК бактериофага l-EMBL и кратко обсудим возможности этого вектора (рис. II.7). Векторы серии EMBL являются производными ДНК бактериофага l1059. Их хромосомная ДНК длиной в 42364 п.о. содержит центральный сегмент ДНК длиной ~15 т.п.о., который замещается на клонируемый фрагмент ДНК соответствующего размера. При этом в фаговые частицы может быть упакована рекомбинантная ДНК общей длиной в 9–23 т.п.о. Замещаемый фрагмент фаговой хромосомы фланкирован с обоих концов последовательностями полилинкера, содержащего рестриктазные сайты EcoRI, BamHI и SalGI, по которым встраивают клонируемые фрагменты ДНК. При этом во время подготовки вектора к работе нет необходимости отделять "плечи" вектора от центрального фрагмента. Сначала центральный фрагмент ДНК выщепляется рестриктазой по одному из сайтов полилинкера, а затем смесь образовавшихся фрагментов обрабатывается другой рестриктазой, сайт для которой находится в полилинкере. Образующиеся олигонуклеотидные фрагменты полилинкера удаляются при переосаждении ДНК спиртом, а "липкие" концы "плеч" вектора и центральной последовательности получаются некомплементарными друг другу и не могут объединяться в процессе лигирования с образованием исходной формы ДНК вектора.
Космиды и фазмиды
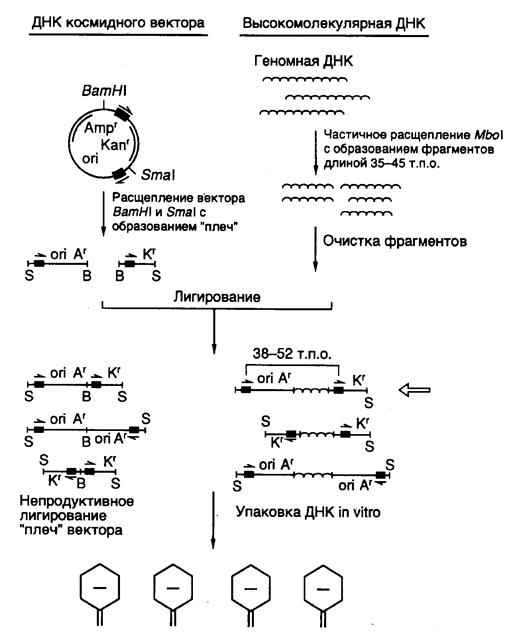
Рис. II.8. Космидный вектор и конструирование клонотеки геномной ДНК на его основе
Как уже упоминалось выше, фаговые векторы позволяют клонировать фрагменты ДНК длиной 15–25 т.п.о. Однако этого явно недостаточно, чтобы клонировать целиком многие гены животных и растений, длина которых зачастую превышает 35–40 т.п.о. Требуемой емкостью обладают векторные молекулы, называемые космидами (рис. II.8). Космиды представляют собой небольшие плазмиды, в которые in vitro введены cos-сайты ДНК фага l. Отсюда происходит название всего типа данных векторов (cosmid). В ДНК нормальных фаговых частиц cos-сайты расположены на концах молекул, они разделяют мономеры фаговой ДНК в конкатемерах, объединяющих несколько соединенных "голова к хвосту" мономеров, которые являются предшественниками зрелых фаговых ДНК перед упаковкой в фаговые частицы. В таких конкатемерах соседние cos-сайты располагаются на расстоянии 35–45 т.п.о. друг от друга и заключают между собой весь фаговый геном. В процессе упаковки cos-сайты узнаются компонентами ферментативной системы и по ним происходит последовательное отделение (отрезание) упакованной в фаговую частицу l-ДНК от остальной неупакованной ДНК конкатемера. Таким образом, наличие cos-сайтов в ДНК является, по существу, единственным необходимым условием упаковываемости ДНК в фаговые частицы. Это означает, что последовательность нуклеотидов l-ДНК, расположенная между двумя cos-сайтами, которая заключает в себе весь фаговый геном (35–45 т.п.о.), может быть замещена in vitro на аналогичный по длине (38–52 т.п.о.) фрагмент чужеродной ДНК и эффективно упакована в фаговые частицы (такова максимальная емкость головки фага). Естественно, что такая искусственная фаговая частица оказывается нежизнеспособной.
Однако после адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30–40 т.п.о. Поскольку такая плазмида (космида) содержит в своем составе селектируемые маркеры в виде генов устойчивости к антибиотикам, ее поддерживают в бактериальных клетках путем выращивания бактерий на среде с соответствующими антибиотиками. Несмотря на то что емкость космидных векторов значительно выше фаговых, эффективность клонирования в космидах ниже, хотя и достигает в ряде случаев 105–106 колоний на 1 мкг клонируемой ДНК. При такой эффективности упаковки требуется всего лишь 2–4 мкг клонируемой ДНК для получения полной клонотеки большинства эукариотических геномов.
Стадия упаковки ДНК космид в фаговые частицы используется лишь для облегчения процесса введения рекомбинантных ДНК большого размера внутрь бактериальных клеток. Такой процесс имитирует проникновение фаговой хромосомы в бактерии во время фаговой инфекции. В случае космид сходство между их проникновением в бактериальные клетки и фаговой инфекцией на этом заканчивается. Однако сходство является более глубоким в случае векторов, называемых фазмидами. Фазмиды представляют собой векторные молекулы ДНК, которые содержат в себе генетические элементы плазмид и хромосом бактериофагов. Они могут обладать емкостью в отношении клонируемой ДНК, характерной для l-векторов, и существовать в определенных условиях в бактериальных клетках в виде плазмиды или же упаковываться в фаговые частицы in vivo при изменении этих условий.
Сверхъемкие векторы YAC, BAC и PAC
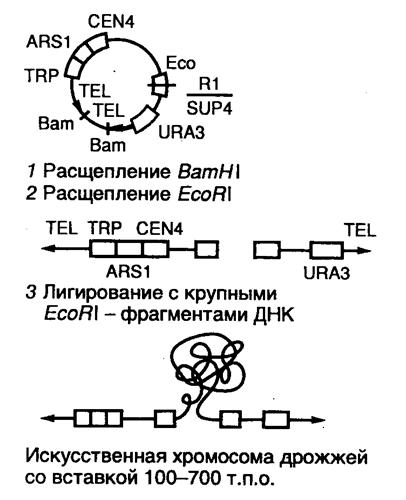
Рис. II.9. Схема клонирования сверхдлинных молекул ДНК с использованием вектора YAC
1 – линеаризация ДНК вектора рестриктазой BamHI;
2 – расщепление линеаризованной ДНК вектора рестриктазой EcoRI с образованием "плечей"; 3 – введение в вектор клонируемого EcoRI-фрагмента ДНК
Хромосомы высших организмов содержат в своем составе протяженные молекулы ДНК. Например, длина ДНК одной из типичных хромосом человека составляет 100–200 миллионов пар оснований (м.п.о.). Исследование генов в хромосомах высших растений, животных и человека потребовало создания векторов для клонирования фрагментов ДНК длиной в несколько сотен тысяч пар оснований. Этим задачам отвечает недавно созданная система для клонирования сверхдлинных молекул ДНК на основе искусственно полученной мини-хромосомы дрожжей YAC (yeast artificial chromosome). YAC-вектор представляет собой кольцевую молекулу ДНК, содержащую ряд генетических элементов, которые позволяют ей существовать во внехромосомном состоянии в клетках дрожжей (рис. II.9).
Вектор заключает в себе две теломерные последовательности нуклеотидов TEL, необходимые для репликации концов мини-хромосомы, и область начала репликации ARS1, соединенную с последовательностью центромеры. Все эти функциональные элементы требуются для репликации YAC-вектора и его правильной передачи в дочерние ядра во время митоза. Кроме того, вектор содержит два селектируемых маркера TRP, восстанавливающих способность к росту ауксотрофных по триптофану клеток дрожжей в отсутствие экзогенного триптофана, а также маркер URA3, компенсирующий генетический дефект клеток дрожжей, который нарушает биосинтез урацила. В векторе имеется также ген супрессорной тРНК sup4, являющийся селектируемым маркером для поддержания вектора в мутантных бактериальных клетках, содержащих амбер-мутации в жизненно важных генах. Помимо этого, он обладает последовательностями нуклеотидов, необходимыми для его репликации в бактериальных клетках.
При подготовке к клонированию YAC-вектор, выделенный в виде плазмиды, расщепляют рестриктазой BamHI и отделяют от образовавшегося короткого фрагмента ДНК, который не требуется для репликации YAC-вектора в дрожжах (этап 1). После этого проводят второе расщепление вектора рестриктазой EcoRI, сопровождающееся образованием двух его "плеч", каждое из которых на одном из концов содержит теломерные последовательности хромосомы дрожжей (этап 2). На заключительном этапе (3) полученные "плечи" лигируют с крупными EcoRI-фрагментами клонируемой ДНК, которые получают путем частичного расщепления высокомолекулярной хромосомной ДНК, предназначенной для клонирования. Полученными таким образом рекомбинантными ДНК трансформируют протопласты клеток дрожжей, и образовавшиеся трансформанты отбирают на селективной твердой питательной среде. В таком векторе удавалось осуществлять клонирование фрагментов ДНК длиной до 700 т.п.о.
При всех своих достоинствах системы клонирования, основанные на векторах семейства YAC, обладают рядом существенных недостатков. В рекомбинантных ДНК, поддерживаемых в таких системах, часто возникают внутренние делеции. Кроме того, при введении рекомбинантных ДНК в клетки дрожжей иногда имеет место проникновение в одну клетку нескольких молекул вектора со вставками. В итоге отдельные клоны дрожжевых клеток могут содержать несколько несцепленных друг с другом молекул рекомбинантных ДНК, а рекомбинация между ними вообще может приводить к образованию химерных молекул. Все это очень затрудняет физическое картирование генов в хромосомах исследуемых объектов. Для преодоления такого рода трудностей были сконструированы альтернативные векторные системы, среди которых наиболее популярными в настоящее время являются системы, основанные на искусственных хромосомах бактерий – BAC (bacterial artificial chromosome).
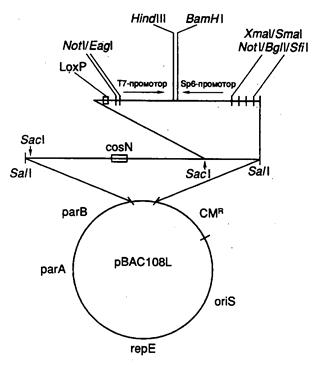
Рис. II.10. Вектор pBAC108L – представитель семейства BAC-векторов
В векторных системах BAC используется ДНК хорошо изученного полового фактора (F-фактора) E. coli – гигантской плазмиды мужских бактериальных клеток, которые являются донорами бактериальной ДНК при конъюгации с женскими клетками (рис. II.10). Типичный F-фактор содержит гены oriS, repE, parA и parB, регулирующие его собственную репликацию и контролирующие число его копий в бактериальных клетках. В частности, гены oriS и repE обеспечивают однонаправленную репликацию F-фактора, а гены parA и parB поддерживают число его копий на уровне одной-двух на бактериальную клетку. Классический вектор BAC (pBAC108L) включает в себя все эти гены, а также ген устойчивости к хлорамфениколу, используемый в качестве селектируемого маркера. Вектор содержит также сегмент ДНК, по которому производится клонирование. В этом сегменте имеется типичный полилинкер, а также два уникальных сайта рестрикции HindIII и BamHI, фланкированные промоторами T7- и Sp6-РНК-полимераз. Эти промоторы могут быть использованы для получения РНК-зондов, необходимых для осуществления "прогулок по хромосомам" (раздел 7.6.2), а также прямого секвенирования клонированной ДНК в месте стыковки с вектором. Кроме того, во фрагменте имеется сайт cosN, обеспечивающий расщепление вектора со вставкой в уникальном месте с помощью терминазы фага l без применения ферментов рестрикции. Этот фермент используется бактериофагом для специфического разрезания конкатемеров своей хромосомы при упаковке в фаговые частицы. Для той же цели может быть применен и сайт loxP бактериофага Р1, который является мишенью для фаговой эндонуклеазы Cre. Эти сайты используются для получения специфических концов клонированной ДНК с целью ее дальнейшего рестрикционного картирования путем введения концевой метки с последующим неполным расщеплением с помощью рестриктаз и электрофоретическим разделением образовавшихся фрагментов (см. раздел 7.6.1).
Современные BAC-векторы позволяют клонировать фрагменты ДНК длиной до 300 т.п.о. и выше. Рекомбинантные молекулы вводятся в клетки E. coli с помощью электропорации (см. раздел 7.3.2), причем эффективность образования трансформантов в 10–100 раз выше, чем при обычной трансформации сферопластов дрожжей векторами семейства YAC. Это позволяет уменьшить исходное количество ДНК, необходимое для конструирования репрезентативных клонотек генов (см. раздел 7.3). При скрининге таких клонотек используются традиционные методы работы с бактериальными колониями (раздел 7.3.3). В отличие от YAC-ДНК, которая находится в клетках дрожжей в линейной форме, BAC-векторы со вставками, как и традиционные F’-факторы, существуют в бактериальных клетках в виде кольцевых суперскрученных молекул. Это облегчает их выделение и последующую работу с рекомбинантными молекулами ДНК в растворе, а кроме того, допускает простое повторное введение в бактериальные клетки этих ДНК, выделенных минипрепаративными методами. Поскольку рекомбинантные BAC-векторы существуют в бактериальных клетках в виде одной копии, исключаются совместное клонирование в одной клетке разных фрагментов ДНК и образование химерных молекул, что весьма существенно для физического картирования больших геномов методами "снизу вверх" (см. раздел 12.1.4). Весьма существенным свойством системы клонирования, основанной на векторах семейства BAC, является ее генетическая стабильность. Исходная структура клонированных фрагментов ДНК в пределах точности использованных методов сохраняется в таких векторах даже после 100 серийных пересевов бактериальных клеток, содержащих рекомбинантные молекулы ДНК. Все вышеперечисленные свойства переводят векторы BAC в разряд сверхъемких векторов нового поколения.
В заключение следует упомянуть о семействе векторов PAC (P1-derived artificial chromosome), также часто используемых в современных исследованиях. Векторы этой серии содержат гены бактериофага Р1, обеспечивающие репликацию фаговой хромосомы в зараженных бактериальных клетках. Рекомбинантные ДНК на их основе (размер вставки 150–200 т.п.о.) также вводятся в бактериальные клетки с помощью электропорации.
Интегрирующие и челночные (бинарные) векторы
Интегрирующие векторы грамположительной бактерии Bacillus subtilis. B. subtilis, как и E. coli, является излюбленным объектом генной инженерии. Это… Рис. II.11. Челночный вектор pFH7 (а) и экспрессирующий вектор pPR-TGATG-1 (б)Конструирование экспрессирующих векторов и их функционирование
Напомним, что экспрессия генетической информации, заключенной в генах живых организмов, в соответствии с основным постулатом молекулярной биологии… Регуляторная часть генов распознается соответствующими ферментными системами… Факторы, оказывающие влияние на эффективность экспрессии рекомбинантных генов: транскрипция. Для того чтобы в клетках…Векторы для переноса ДНК в клетки животных и растений
В отличие от бактерий в клетках эукариот внехромосомные, автономно реплицирующиеся генетические элементы типа бактериальных плазмид встречаются… Экспрессирующий вектор pKSV-10. Структура теоретически возможного…Рис. II.12. Эукариотический вектор pKSV-10
Часть бактериальной плазмиды, содержащей область начала репликации ori, соединена с транскрипционной единицей вируса SV40, 5’-концевая часть которой включает ранние промотор и репликатор вируса SV40, а 3’-конец содержит сайт полиаденилирования и интрон большого T-антигена. Последовательности чужеродной ДНК, которые необходимо экспрессировать в клетках животных, клонируют по BglII-сайту рестрикции. Кроме того, в векторе имеются уникальные сайты для рестриктаз KpnI, BamHI, SalI и EcoRI. Вектор может реплицироваться в клетках E. coli и в клетках обезьян линии COS
В ряде случаев гены, необходимые для репликации эукариотического вектора, вводят непосредственно в вектор. Так же как и бактериальный, эукариотический вектор должен содержать один или несколько уникальных сайтов рестрикции для клонирования требуемой последовательности нуклеотидов. В экспрессирующем векторе полилинкер располагают непосредственно за генетическими элементами, регулирующими транскрипцию (наибольшее значение из них имеют промотор и энхансер), перед сайтом полиаденилирования и терминатором транскрипции. Структура других кассет генов, обеспечивающих экспрессию рекомбинантных генов в клетках животных, будет рассмотрена в разделе 7.4.6.
Векторы растений. Специфика векторов для экспрессии рекомбинантных генов в клетках растений обусловлена главным образом регуляторными последовательностями нуклеотидов, которые обеспечивают эффективную транскрипцию генов в растительных тканях. Например, в известном векторе pCaMVCAT используются промотор и сайт полиаденилирования генов вируса мозаики цветной капусты, под контролем которых находится ген бактериальной хлорамфениколацетилтрансферазы (cat). Этот ген-репортер применяется для оптимизации условий введения векторной ДНК в клетки растений и может быть заменен на любой другой ген. Вектор pCaMVCAT является челночным, т.е. может реплицироваться как в клетках E. coli, так и растений. В первом случае селектируемым маркером служит, как обычно, ген устойчивости к ампициллину.
Вектор pCaMVCAT принадлежит к большой группе так называемых DMGT-векторов (DNA-mediated gene transfer), осуществляющих опосредованный ДНК перенос генов в клетки растений. Это означает, что в данном случае перенос генов в клетки растений опосредован ДНК вектора, так как они находятся в составе векторной молекулы. Для получения стабильных линий растительных клеток, которые бы содержали рекомбинантные ДНК в интегрированном в хромосомы состоянии и активно экспрессировали его, часто в состав DMGT-векторов вводят дополнительные селектируемые маркеры, которые придают клеткам, включившим экзогенную ДНК, определенный, легко обнаруживаемый фенотип. Такими маркерами могут быть, например гены неомицинфосфотрансферазы II (NPT II), гигромицинфосфотрансферазы (HPT), дигидрофолатредуктазы, в результате экспрессии которых клетки приобретают устойчивость к канамицину, гигромицину B или метотрексату соответственно.
Клонотеки генов
Получение клонотек генов
На рис. II.8 представлена схема конструирования клонотеки геномной ДНК с использованием космидного вектора. Следует иметь в виду, что общие принципы… Геномную ДНК подвергают частичному гидролизу мелкощепящей рестриктазой MboI… Полученную после лигирования сложную смесь молекул рекомбинантных ДНК упаковывают в фаговые частицы стандартным…Введение рекомбинантных ДНК в клетки
После завершения лигирования векторных молекул с клонируемыми фрагментами ДНК реакционную смесь с продуктами реакции уже можно рассматривать как библиотеку генов. Полученные таким образом рекомбинантные молекулы ДНК хранятся длительное время в замороженном состоянии, и по мере необходимости из них отбирают аликвоты реакционной смеси, содержащие требуемое количество рекомбинантных молекул, и вводят в клетки микроорганизмов для клонирования и дальнейшей работы.
Процесс поглощения экзогенной ДНК бактериальными клетками, сопровождающийся приобретением ими новых генетических маркеров, называют генетической трансформацией. В том случае, если бактериальные клетки поглощают ДНК бактериофагов и в результате происходит образование зрелых фаговых частиц, говорят о трансфекции фаговой ДНК. Поглощение экзогенной ДНК в процессе трансформации и трансфекции может осуществляться лишь компетентными клетками. Под компетентностью понимается такое состояние бактериальных клеток, при котором они способны сорбировать экзогенную ДНК на своей поверхности и поглощать ее, после чего экзогенная ДНК может быть интегрирована в бактериальную хромосому или существовать в виде внехромосомного элемента (эписомы, плазмиды).
Для многих грамположительных бактерий компетентность является естественным свойством, которое становится максимально выраженным на определенных этапах роста культуры. В то же время у наиболее важных для генной инженерии грамотрицательных клеток E. coli естественная компетентность вообще отсутствует и клетки приобретают ее лишь в искусственных условиях. В настоящее время установлено, что при низких температурах и в присутствии двухвалентных катионов клетки E. coli и экзогенная ДНК продуктивно взаимодействуют друг с другом и экзогенная ДНК может с высокой эффективностью проникать внутрь бактериальных клеток. Частоту трансформации и трансфекции клеток E. coli можно повысить разными способами. Среди них наиболее популярными являются тепловой шок, введение в инкубационную смесь одновалентных катионов (Rb+), хлорида гексаминкобальта(III) или выращивание бактериальных клеток на среде с повышенным содержанием ионов Mg2+ (10–20 мМ).
Современные методики трансформации бактериальных клеток позволяют получать до 107–108 трансформантов или трансфектантов на 1 мкг суперскрученной плазмидной ДНК. Поскольку трансформация и трансфекция проводятся при низких концентрациях экзогенной ДНК, а для появления у трансформированной бактерии устойчивости к антибиотикам или развития фаговой бляшки достаточно проникновения внутрь бактериальной клетки одной молекулы рекомбинантной ДНК, образовавшиеся колонии или бляшки трансформантов и трансфектантов содержат, как правило, только один тип рекомбинантных молекул ДНК с идентичными вставками клонируемых последовательностей нуклеотидов.
Еще более высокой эффективности трансформации (до 109–1010 трансформантов на 1 мкг ДНК) достигают при использовании электропорации. В этом случае клетки вместе с плазмидной или фаговой ДНК помещают в небольшую ячейку между двумя электродами и подвергают кратковременному (10–100 мкс) воздействию электрического поля высокой напряженности. Быстрая поляризация клеточных мембран приводит к их обратимому повреждению (образованию пор), сопровождаемому повышением их проводимости и проницаемости для макромолекул. В это время происходит эффективный перенос экзогенных молекул ДНК внутрь клеток, подвергнутых электрическому шоку. После того как рекомбинантные молекулы ДНК введены в бактериальные клетки и получены бактериальные колонии или фаговые бляшки, каждая из которых содержит рекомбинантные ДНК только одного типа, возникает важная задача отбора тех колоний или бляшек, которые заключают в себе искомые последовательности нуклеотидов рекомбинантных ДНК.
Методы скрининга клонотек генов
Для выявления конкретных последовательностей нуклеотидов в клонотеках генов рекомбинантные бактерии или фаги рассевают на чашках Петри и… После отмывки фильтров от несвязавшегося радиоактивного зонда их высушивают и… Часто бывает, что первичная структура искомого гена неизвестна. Тогда применяют один из следующих способов. Во-первых,…Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток
Однако эффективный синтез рекомбинантных белков зависит не только от используемых клеточных линий. Основное влияние на этот процесс оказывают… Для получения рекомбинантных белков кроме вышеупомянутого метода стабильно… Недавно швейцарскими исследователями (С. Гайссе с соавт., 1996 г.) было проведено сравнительное изучение эффективности…Клетки яичников китайских хомячков (линия CHO)
Для биотехнологических целей в системе амплификации рекомбинантных генов в качестве селектируемого маркера часто используют ген…Рис. II.13. Кассеты генов в экспрессирующих векторах, использованные для получения фактора, ингибирующего лейкозы, в культурах клеток
а – кДНК huLIF (черные стрелки), включающая лидерные последовательности (незаштрихованные прямоугольники), была интегрирована в экспрессирующий вектор pXMT3 под контроль гибридного промотора, расположенного между точкой начала репликации вируса SV40 и основным поздним промотором аденовируса (SV40/AdMLP), ДГФР, amp, neo – гены дигидрофолатредуктазы и устойчивости к ампициллину и неомицину соответственно, VA – трансляционный энхансер; pA – сайт полиаденилирования;
б – вектор pSV2neo-Ig-huLIF, сконструированный на основе транскрипционных и трансляционных регуляторных элементов генов тяжелой (IgH) и легкой (IgL) цепей иммуноглобулинов. Транскрипция кассеты контролируется мышиным промотором гена IgL k и энхансером гена IgH. Транскрипт, содержащий последовательность huLIF, в результате сплайсинга объединяется с экзоном 2 гена IgL, кодирующего лидерную последовательность, которая обеспечивает секрецию зрелого huLIF клетками;
в – вектор pGES-LIF, прямоугольники 1–4 – регуляторная область кластера глобиновых генов, короткая черная стрелка – промотор b-глобинового гена, ломаной линией отмечены последовательности, удаляемые сплайсингом. Во всех случаях стрелки указывают направление транскрипции
Размер амплифицированного геномного локуса значительно больше размера селектируемого гена и может составлять несколько сотен тысяч пар оснований. Трансфекция клеток геном ДГФР и исследуемым рекомбинантным геном, заключенными в один экспрессирующий вектор, сопровождаемая их интеграцией в геном, будет приводить к их совместной амплификации на фоне метотрексата и усилению синтеза требуемого рекомбинантного белка, как следствие увеличения дозы его гена. Данные о возможности сохранения высокого уровня экспрессии гена в отсутствие селектирующего агента, т.е. генетической стабильности продуцентов, противоречивы. Результат зависит от генотипа конкретных клонов клеток, в том числе и локализации сайта интеграции экспрессирующего вектора в геном клеток CHO. Эффективным экспрессирующим вектором, используемым в описываемой системе, является двухцистронная молекула ДНК, в которой исследуемый рекомбинантный ген находится под контролем сильного промотора перед геном ДГФР, что обеспечивает высокое сопряжение синтеза рекомбинантного белка с уровнем устойчивости клеток к метотрексату (рис. II.13,а).
7.4.2. Клетки мышиной миеломы (линия Sp2/0)
Клетки миеломы находят широкое применение для получения гибридом – линий клеток, производящих моноклональные антитела определенной специфичности. Поскольку эти клетки осуществляют эффективную секрецию рекомбинантных белков, они хорошо изучены в отношении экспрессии в них соответствующих рекомбинантных генов, введенных с помощью трансфекции. Кроме того, такие клетки способны расти в суспензионной культуре (без прикрепления к поверхности субстрата), что облегчает их культивирование при необходимости крупномасштабной наработки.
Линия клеток мышиной миеломы Sp2/0 Ag14, утративших способность синтезировать или секретировать иммуноглобулины, часто используется для производства рекомбинантных белков. Клетки этой линии легко трансфецируемы рекомбинантными ДНК и могут выращиваться в больших количествах на питательной среде без дорогостоящей сыворотки. Клетки Sp2/0 экспрессируют эндогенный ген ДГФР, что делает невозможным их прямое применение для амплификации рекомбинантных ДНК с использованием метотрексата. Это затруднение обычно преодолевают путем введения в экспрессирующий вектор мутантного гена ДГФР, в котором точковая мутация, сопровождаемая заменой T®G, приводит к замещению Leu®Arg в положении 22 полипептидной цепи ДГФР, следствием чего является понижение сродства фермента к метотрексату в 270 раз. Благодаря этому после трансфекции может быть проведен отбор клеток, содержащих мутантный ген ДГФР вместо нормального, путем постепенного увеличения концентрации метотрексата в среде. При умеренных концентрациях ингибитора эндогенный ген ДГФР полностью инактивируется, тогда как мутантный ген остается активным и может быть амплифицирован в результате описанного выше механизма после повышения концентрации метотрексата в среде. Однако уровень амплификации гена ДГФР и ассоциированного с ним рекомбинантного гена в такой системе как правило ниже, чем в обычной, так как меньшее число внутриклеточных копий мутантного гена требуется для обеспечения необходимого уровня устойчивости клеток к ингибитору. Кроме того, было показано, что высокий уровень внутриклеточной экспрессии рекомбинантных генов, введенных в клетки Sp2/0 с помощью трансфекции, может обеспечиваться после инкубации с метотрексатом за счет увеличения скорости их транскрипции, а не в результате их амплификации. Такой результат может быть получен в результате введения множественных копий гена ДГФР при трансфекции. Структура одного из векторов, пригодного для использования с миеломными клетками Sp2/0, представлена на рис. II.13,б). Транскрипция трансгенов в этом векторе обеспечивается промоторно–энхансерными элементами гена иммуноглобулина с участием эндогенных регуляторных факторов клеток миеломы.
Клетки селезенки мышей (линия MEL)
Для биотехнологических целей в настоящее время часто используется линия клеток MEL-E9, которая является производной линии клеток MEL-NP5, полученных… На рис. II.13,в изображена схема экспрессирующего вектора, применяемого с этой…Клетки африканской зеленой мартышки (линия COS)
Число копий плазмид, введенных в клетки COS, достигает максимума через ~48 ч после трансфекции. Далее внутриклеточный уровень плазмидной ДНК… Эффективность системы экспрессии, основанной на клетках COS, зависит, в первую…Клетки насекомых, зараженные бакуловирусами
Интерес к бакуловирусам как потенциальным переносчикам рекомбинантных генов и системам, обеспечивающим их экспрессию, стал возникать после того, как… Первоначально использование бакуловирусов с культурами клеток вызывало большие… Для проявления в полной мере биологической активности многих рекомбинантных белков требуются посттрансляционные…Сравнение эффективности рассмотренных систем экспрессии
Стабильные клетки-продуценты, созданные на основе амплификации рекомбинантных генов, позволяют получать рекомбинантные продукты в более высоких…Бесклеточные белоксинтезирующие системы
Большим преимуществом бесклеточных систем перед целыми клетками является доступность их отдельных компонентов для экспериментальных воздействий.… Бесклеточные белоксинтезирующие системы представляют собой одни из самых… По природе компонентов, которые определяют способность бесклеточных систем осуществлять трансляцию определенных мРНК,…Прокариотические системы
Одним из наиболее важных условий функционирования бесклеточных систем биосинтеза белка является нативное состояние рибосом и факторов трансляции. В… В том случае, если разрушение бактериальных клеток проводят жесткими методами… Экстракты бактериальных клеток S30 и S1OO, кроме всех необходимых факторов трансляции, содержат и основные компоненты…Эукариотические системы
В настоящее время наиболее часто применяемыми системами такого рода являются белоксинтезирующие системы из ретикулоцитов кроликов, зародышей пшеницы… Ретикулоциты – безъядерные предшественники эритроцитов человека и животных,… Все основные компоненты, необходимые для функционирования бактериальных бесклеточных систем биосинтеза белка, должны…Проточные системы
Значительный прогресс в этой области исследований был достигнут в лаборатории А.С. Спирина в 1988 г. Здесь с помощью простых усовершенствований… Такое простое усовершенствование бесклеточной системы сильно изменило характер… С разработкой проточной бесклеточной белоксинтезирующей системы стало возможным проводить биосинтез рекомбинантных…Другие современные методы исследования генов
Рестрикционное картирование генов
Для построения рестрикционной карты используют гибридизацию по методу Е. Саузерна. Клонированный фрагмент ДНК отдельно или в составе вектора… Размеры рестрикционных фрагментов оценивают путем сравнения их… 7.6.2. "Прогулки и прыжки по хромосомам"S1-картирование РНК и ДНК
Использование S1-нуклеазы позволяет с точностью до одного–двух нуклеотидов картировать положение точек инициации и терминации транскрипции внутри…Футпринтинг
Стратегия выделения нового гена
Определив последовательность нескольких N-концевых аминокислот белка, можно в соответствии с генетическим кодом синтезировать ряд олигонуклеотидных… По-прежнему уникальной задачей, которая по плечу лишь большим международным… Примерно такой путь исследований в генной инженерии привел за последние 20 лет к клонированию множества генов, в том…Глава 8. НАПРАВЛЕННЫЙ МУТАГЕНЕЗ И БЕЛКОВАЯ ИНЖЕНЕРИЯ
Многие мутации сопровождаются изменениями фенотипа мутантного организма на морфологическом или биохимическом уровне, хорошо различимыми визуально или с помощью биохимических методов. Такие мутационные изменения называют генетическими маркерами мутантного организма, так как они позволяют отличать мутанты от нормальных особей и прослеживать передачу мутантных генов в ряду поколений. Именно эта возможность следить за судьбой мутантных генов в потомстве, получаемом от скрещиваний родительских мутантных организмов, позволила в свое время создать мощное научное направление, называемое формальной генетикой, основанное на генетическом анализе наследования мутантных признаков.
До развития генной инженерии гены исследовали преимущественно методами генетического анализа с использованием мутантных признаков организмов в качестве генетических маркеров. Это давало возможность определения границ генов и построения их подробных генетических карт. Именно потребности генетического анализа привели к быстрому развитию классических методов получения мутаций: чем больше имеется мутаций в определенном гене, тем более подробную генетическую карту такого гена можно построить. Классические методы получения мутаций в конкретных генах основаны на отборе мутантных организмов в селектируемых условиях (например по устойчивости к антибиотикам) из большого числа организмов дикого типа и мутантных организмов, несущих мутации в других генах. После получения искомого мутантного организма можно локализовать мутацию на генетической карте и биохимическими методами исследовать ее проявление на молекулярном уровне. Например, с использованием очищенного мутантного фермента можно определить молекулярные изменения, приводящие к формированию мутантного фенотипа. Этот традиционный подход, не забытый окончательно и сегодня, дал очень много для развития классической и молекулярной генетики. Однако из-за низкой эффективности и большой трудоемкости метода его было трудно использовать для исследования высших организмов.
Методы направленного получения мутаций
Получение делеций и вставок
Рис. II.16. Получение делеций с помощью нуклеазы Bal31
Ген, клонированный в плазмиде, расщепляют по уникальному сайту рестрикции и образовавшиеся линейные молекулы ДНК инкубируют в присутствии экзонуклеазы Bal31. При этом экзонуклеаза последовательно удаляет нуклеотиды с обоих концов ДНК, причем количество удаляемых нуклеотидов прямо пропорционально времени инкубации ДНК с нуклеазой, а также зависит от температуры инкубации и концентрации фермента. В результате подобного действия образуется набор фрагментов ДНК разной длины, содержащих делеции различных размеров по обе стороны выбранного сайта рестрикции. К "тупым" концам таких молекул ДНК с помощью ДНК-лигазы присоединяют двухцепочечные олигонуклеотидные линкеры, содержащие уникальный (часто исходный) сайт рестрикции, обрабатывают соответствующей рестриктазой, замыкают молекулы в кольцо посредством лигирования и затем вводят их в бактериальные клетки. Точное картирование концов делеций осуществляют секвенированием соответствующих участков ДНК мутантных плазмид. В результате получают набор делеций разного размера, положение которых в исследуемом фрагменте ДНК строго локализовано.
Небольшие делеции в окрестностях сайтов рестрикции можно получать быстрее удалением "липких" концов линеаризованной плазмидной ДНК после рестрикции с последующим замыканием линейной ДНК в кольцо лигированием по образовавшимся "тупым" концам. В этом случае размер делеции соответствует размеру одноцепочечных "липких" концов в сайтах рестрикции. Кроме того, такой метод допускает простую проверку наличия мутаций в требуемом участке ДНК, так как в результате мутации происходит потеря уникального сайта рестрикции.
Для получения вставок коротких или протяженных последовательностей нуклеотидов в исследуемые участки клонируемых генов также разработаны эффективные и надежные методы. В простейшем случае такая задача решается путем расщепления исследуемого гена рестриктазой по уникальному сайту рестрикции и встраивания по этому сайту фрагмента природной ДНК или синтетического двухцепочечного олигонуклеотида, который фланкирован соответствующими "липкими" концами. Лигирование может проводиться и по "тупым" концам. В таком случае последовательности нуклеотидов на концах вставки уже не имеют существенного значения для встраивания этого фрагмента по сайту рестрикции.
Для создания множественных вставок коротких или протяженных последовательностей нуклеотидов в исследуемых участках ДНК в основном используют два подхода. В первом случае с помощью панкреатической ДНКазы в низких концентрациях в присутствии ионов Mn2+ вносят случайным образом один двухцепочечный разрыв в каждую векторную плазмиду, содержащую клонированный ген. К концам образовавшихся линейных молекул ДНК присоединяют с помощью ДНК-лигазы синтетические олигонуклеотидные линкеры, содержащие сайт рестрикции, который отсутствует в исследуемой плазмиде. Образовавшиеся линейные молекулы ДНК с линкерами обрабатывают рестриктазой, узнающей сайт рестрикции линкера, что приводит к образованию "липких" концов, и замыкают в кольцо с помощью ДНК-лигазы. В итоге кольцевые молекулы ДНК содержат исследуемый клонированный ген, в котором имеется по одной вставке локализованных случайным образом (в соответствии с расположением исходных двухцепочечных разрывов) олигонуклеотидных линкеров. Во втором случае статистические разрывы в двухцепочечной ДНК получают путем частичного (неполного) гидролиза мелкощепящими рестриктазами, которые узнают сайт рестрикции длиной в 4 нуклеотида. Метод получения вставок с использованием синтетических олигонуклеотидных линкеров получил название сканирования линкером.
Химический мутагенез
Распространенным методом введения большого числа точковых мутаций разной локализации в исследуемые части генов in vitro является химический… Одноцепочечные мутагенизированные участки ДНК удобно получать путем… Несмотря на удобство введения такого рода мутаций в ДНК in vitro, химический мутагенез накладывает ограничения на…Сайт-специфический мутагенез с использованием олигонуклеотидов
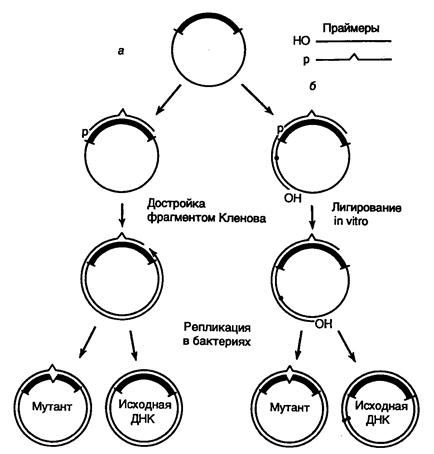
Рис. II.17. Направленный мутагенез с использованием олигонуклеотидов
а – система с одним мутагенизирующим праймером;
б – система с двумя праймерами и селектируемым маркером
В простейшем случае для проведения желаемой замены нуклеотидов синтезируют 15–20-членный олигодезоксирибонуклеотид, комплементарный одной из цепей ДНК исследуемого гена (рис. II.17,а). При этом в данный нуклеотид в процессе синтеза вносят требуемые замены нуклеотидов. Мутагенизируемый ген клонируют в фазмидном векторе, который переводят в одноцепочечную форму. После выделения такой одноцепочечной ДНК с клонированным геном дикого типа с ней гибридизуют синтетический олигонуклеотид и, используя его в качестве затравки, синтезируют с помощью фрагмента Кленова in vitro комплементарную цепь ДНК. Образующаяся в итоге двухцепочечная кольцевая молекула ДНК представляет собой гетеродуплекс, дочерняя цепь которого комплементарна исходной родительской цепи на всем протяжении, кроме участка, занимаемого олигонуклеотидом, где мутантный нуклеотид (нуклеотиды) некомплементарен соответствующему нуклеотиду матрицы.
Остающийся после завершения синтеза дочерней цепи ДНК одноцепочечный разрыв ликвидируют с помощью ДНК-лигазы, а образовавшуюся двухцепочечную ковалентно замкнутую ДНК вводят в бактериальные клетки, где она проходит несколько раундов репликации. После первого раунда репликации происходит сегрегация в разные молекулы ДНК мутантного аллеля и аллеля дикого типа исследуемого гена, и далее эти молекулы продолжают реплицироваться независимо друг от друга, что приводит к образованию двух популяций рекомбинантных ДНК, содержащих изучаемый ген в мутантной и исходной формах. Таким образом, теоретически каждая вторая молекула, выделенная из подобных бактериальных клеток, должна содержать в клонированном гене требуемую мутацию, локализованную в строго определенном сайте.
Для того чтобы отличить мутантные ДНК от нормальных, проводят либо прямое секвенирование мутагенизируемого участка гена, либо гибридизацию рекомбинантных молекул с олигонуклеотидом, ранее использованным в качестве затравки, предварительно меченным радиоактивными изотопами (например 32P). Связь этого олигонуклеотида, содержащего замены нуклеотидов, в гибриде будет более прочной с мутантной ДНК, чем с ДНК дикого типа, так как в первом случае олигонуклеотид и ДНК будут полностью комплементарны друг другу. Плавление гибрида и отделение олигонуклеотида от ДНК произойдут при более низких температурах, если гибрид был образован с ДНК дикого типа, а не с мутантной ДНК. Освободившиеся в результате плавления гибридов олигонуклеотиды отделяют от ДНК промыванием комплекса на фильтрах, что проявляется в отсутствие сигнала при авторадиографии, тогда как в случае гибридов олигонуклеотида и мутантной ДНК будет появляться четкий сигнал.
На практике, однако, частота возникновения мутантных ДНК в общей популяции рекомбинантных мутагенизируемых молекул бывает значительно > 50%. Это обусловлено рядом причин, основными из которых in vitro являются 3'®5'-экзонуклеазная активность фрагмента Кленова и его способность вытеснять цепь ДНК в направлении 5’®3’. Для преодоления первого затруднения мутантные нуклеотиды в олигонуклеотидном праймере располагают не ближе, чем за четыре нуклеотида от его 3’-конца (обычно за семь–десять нуклеотидов). Чтобы избежать последствий второго источника артефактов, для синтеза комплементарной цепи в мутагенизируемой одноцепочечной молекуле ДНК используют систему из двух праймеров (см. рис. II.17,б). В этой системе второй праймер выбирается таким образом, чтобы его 3’-конец после гибридизации с мутагенизируемой одноцепочечной молекулой ДНК располагался на расстоянии 1–3 т.п.о. от фосфорилированного 5’-конца мутагенизирующего нуклеотида. В этом случае после заполнения бреши между двумя олигонуклеотидами вновь синтезированной ДНК, синтез которой начался с дополнительного праймера, произойдет лигирование одноцепочечного разрыва ДНК-лигазой, которая присутствует в реакционной смеси вместе с фрагментом Кленова, поскольку 5’-конец мутагенизирующего нуклеотида фосфорилирован. Однако здесь не образуется кольцевой ковалентно замкнутой молекулы ДНК, так как на 5’-конце дополнительного праймера отсутствует фосфатная группа. После завершения реакции образовавшимися молекулами ДНК трансформируют клетки E. coli и производят отбор мутантных молекул ДНК в клонах бактерий по гибридизации с мутагенизирующим олигонуклеотидом, меченным радиоактивным изотопом.
Эффективность системы направленного мутагенеза с использованием двух олигонуклеотидов приближается к максимально теоретически возможной – 50%. С помощью этого метода можно получать все виды мутаций, как точковые с заменами одного–трех оснований, так и протяженные делеции длиной в 0,5–1,0 т.п.о., а также вставки, например для создания новых сайтов рестрикции. Если для получения точковых мутаций достаточно мутагенизирующего праймера длиной в 17–20 нуклеотидов, то в случае получения делеций праймеры должны быть длиннее (30–40 нуклеотидов), поскольку они удерживают последовательности матричной ДНК, фланкирующие выпетливаемый участок. Дальнейшее развитие системы направленного мутагенеза с использованием двух олигонуклеотидов, получившей название системы сопряженного праймирования, позволило значительно упростить процедуру отбора мутантных ДНК. В таких усовершенствованных системах в дополнительный олигонуклеотид вводится мутация, инактивирующая или восстанавливающая в дочерней мутантной ДНК какой-либо селектируемый маркер. В одной из таких систем, где в качестве вектора используется ДНК фага M13mp18amIV, селектируемым маркером служит амбер-мутация в гене IV. Матричную ДНК получали, выращивая мутантные фаги M13mp18amIV в бактериальных клетках E. coli TG1, содержащих ген-супрессор амбер-мутаций Su2+. При этом данный фаг не развивается в клетках несупрессорных штаммов E. coli Su2-.
Для проведения мутагенеза одноцепочечную ДНК фага M13mp18am1Y гибридизуют с двумя праймерами, один из которых мутагенизирующий, а другой, комплементарный гену IV, содержит точковую мутацию в амбер-кодоне, восстанавливающую последовательность нуклеотидов дикого типа. После достройки комплементарной цепи ДНК фага M13mp18am1Y с использованием вышеупомянутых праймеров двухцепочечные ДНК вводят в бактериальные клетки Su2-, которые, кроме того, дефектны по системе репарации. Поскольку бактериальные клетки, дефектные по системе репарации, сами по себе обладают мутаторным фенотипом (т.е. для них характерна повышенная частота возникновения спонтанных мутаций), то для того чтобы в мутируемые ДНК не вносить дополнительные мутации, трансформированные бактериальные клетки высевают на газон клеток E. coli Su2- с нормальной системой репарации. При таком подходе фаговые частицы проходят лишь первый цикл развития в клетках с двумя мутациями, а все последующие – в клетках Su2- с одной мутацией. В результате в таких клетках образуются только те фаговые частицы, ДНК которых содержат сайт-специфическую мутацию и восстановленный ген IV.
Аналогичный подход был использован в системе с геном b-галактозидазы, находящимся в составе векторов серии M13mp. В такой системе фаговый ген кодирует a-пептид b-галактозидазы E. coli и комплементирует (восстанавливает) дефектную b-галактозидазу бактериальных клеток-хозяев. Введение амбер-мутации в фаговый ген b-галактозидазы с помощью праймера, используемого в паре с олигонуклеотидом-мутатором, сопровождается потерей дочерними фаговыми частицами способности комплементировать мутантную b-галактозидазу бактериальных клеток. В результате в образующихся фаговых бляшках отсутствует активность b-галактозидазы, которая бы расщепляла искусственный субстрат BCIG с образованием продукта, окрашенного в голубой цвет. Вследствие этого бляшки, образованные фаговыми частицами, содержащими ДНК с сайт-специфическими мутациями, не окрашены и их легко отбирать визуально.
Хорошо себя зарекомендовали и системы циклического отбора мутантных ДНК, содержащие сайт-специфические мутации, в которых используются свойства систем рестрикции–модификации EcoK и EcoB E. coli. Используемые для трансформации штаммы E. coli могут содержать системы рестрикции–модификации EcoK- или EcoB-типа. В том случае, если родительскую цепь ДНК для мутагенеза выделяют из клеток, дефектных по метилазам системы модификации, то после достройки комплементарной цепи с мутантного олигонуклеотида такая неметилированная ДНК будет расщепляться системой рестрикции после введения в соответствующий бактериальный штамм. Если одновременно с олигонуклеотидом-мутатором использовать второй олигонуклеотид, изменяющий сайт рестрикции, то лишь ДНК с мутировавшим сайтом рестрикции в результате ошибочного функционирования системы репарации сохранится в бактериальных клетках. Такие ДНК с высокой вероятностью будут содержать и требуемую мутацию.
Недавно была описана система, в которой в родительскую цепь ДНК фазмиды вводили вместо остатков тимидина остатки уридина. В этом случае после синтеза дочерней комплементарной ДНК in vitro с использованием мутантного олигонуклеотида в качестве затравки родительская цепь ДНК инактивируется в трансформированных бактериальных клетках с помощью эндогенной урацил-N-гликозилазы, удаляющей из ДНК остатки урацила, что сопровождается частичным гидролизом этой цепи с последующей репарацией брешей по мутантной цепи в качестве матрицы и закреплением введенной мутации.
Наконец, следует упомянуть систему олигонуклеотид-зависимого сайт-специфического мутагенеза, в которой для отбора мутантных цепей ДНК используется попеременно то один, то другой селектируемый маркер, в качестве которых выступают гены устойчивости к антибиотикам. Это позволяет вводить с высокой эффективностью в один и тот же ген несколько сайт-специфических мутаций в последовательных циклах направленного мутагенеза. В таких системах в первом цикле вместе с мутагенизирующим праймером в качестве селектируемого используют праймер, вносящий мутацию, которая придает бактериальным клеткам устойчивость к одному антибиотику, а во втором цикле – к другому (с восстановлением чувствительности к первому антибиотику). Далее такие циклы могут быть повторены необходимое число раз, которое определяется количеством требуемых мутаций.
Разработка систем сопряженного праймирования позволила значительно увеличить эффективность направленного мутагенеза и довести выход ДНК, содержащих сайт-специфические мутации, до 70% от общего числа образующихся молекул ДНК.
Рассмотренные подходы к получению сайт-специфических мутаций с помощью олигонуклеотидов позволяют с высокой точностью и эффективностью производить замены отдельных нуклеотидов в строго определенных локусах. Однако чаще всего невозможно предсказать фенотипические последствия мутационных замен отдельных аминокислот в полипептидных цепях белков, и для получения необходимых фенотипических изменений требуется введение множественных мутаций в определенные участки гена с последующим отбором мутантов требуемого фенотипа. Для решения подобных задач был разработан и эффективно используется метод кассетного мутагенеза.
При реализации такого подхода из гена, клонированного в составе векторной плазмиды, по двум близко расположенным уникальным сайтам рестрикции вырезается фрагмент ДНК, в который необходимо внести мутации, и на его место встраивается синтетический двухцепочечный олигонуклеотид, содержащий необходимые замены нуклеотидов (кассету мутаций). В этом случае, если в окрестностях мутагенизируемого локуса гена отсутствуют подходящие природные сайты рестрикции, их вводят с помощью направленного мутагенеза. Разработка автоматических синтезаторов ДНК сделала синтез олигодезоксирибонуклеотидов простой и даже рутинной процедурой. Более того, использование на определенных этапах синтеза вместо одного нуклеотида смеси из двух, трех или даже всех четырех дезоксирибонуклеозидтрифосфатов позволяет получать за один прием сложную смесь олигонуклеотидов, которые могут содержать в определенных сайтах наборы кодонов для многих или даже для всех 20 природных аминокислот. Это дает возможность осуществлять одновременный скрининг по искомому мутантному фенотипу большого числа разных мутантных клонов, полученных в одном цикле клонирования. С помощью кассетного мутагенеза можно легко исследовать функциональную роль отдельных сайтов и целых доменов в полипептидных цепях конкретных белков и создавать рекомбинантные белки с новыми, подчас неожиданными свойствами.
Внесение множественных мутаций в разные участки полипептидных цепей исследуемых белков позволяет при наличии соответствующих эффективных методов отбора получать белки с требуемыми свойствами и уже после этого определять, какие именно аминокислоты придают такие свойства белку. Альтернативным методом исследования функциональной значимости отдельных аминокислот в белках является их целенаправленная замена на нейтральную аминокислоту, например аланин. Такая последовательная замена аминокислот в полипептидных цепях изучаемых белков на остатки аланина получила название сканирование аланином. Введение аланина в полипептидные цепи не изменяет их общей конформации, как это имеет место, например в случае замен на глицин или пролин, и не сопровождается ярко выраженными электростатическими или стерическими эффектами. Кроме того, аланин часто встречается в полипептидных цепях и с одинаковой частотой представлен как на внутренних, так и на внешних участках полипептидных цепей белковых глобул. С помощью сканирования аланином можно локализовать аминокислоты, образующие активный центр ферментов, исследовать участки полипептидных цепей, существенные для взаимодействия белков с другими макромолекулами и низкомолекулярными лигандами, изучать структуру эпитопов полипептидных цепей, а также ряд других структурных и функциональных особенностей белков.
Еще одним универсальным методом замены определенных аминокислот в полипептидных цепях белков in vivo является использование аминоацилированных различными аминокислотами супрессорных тРНК, которые узнают нонсенс-триплеты в мутантных мРНК в процессе трансляции. В результате в соответствующее место полипептидной цепи взамен аминокислоты, присутствующей в белке дикого типа, встраивается аминокислота, которую несет аминоацилированная супрессорная тРНК. В настоящее время в дополнение к природным супрессорным тРНК E. coli синтезированы in vitro гены, кодирующие супрессорные РНК новой специфичности. В итоге до 13 аминокислотных замен может быть произведено в синтезирующейся in vivo полипептидной цепи в результате супрессии кодона UAG (amber). С использованием такого подхода, в частности, удалось произвести >1600 замен аминокислот Lac-репрессора E. coli и локализовать участки полипептидной цепи, существенные для связывания индуктора, прочного связывания оператора и термостабильности белка.
Важным преимуществом метода амбер-супрессии перед другими методами направленного мутагенеза у бактерий и бактериофагов является то, что он не требует синтеза большого числа мутантных генов и их последующего отбора, так как введение одного мутантного гена в составе экспрессирующего вектора в клетки разных супрессорных штаммов E. coli позволяет получать разные замены аминокислот с одновременной сверхпродукцией мутантного белка в бактериальных клетках. Это облегчает его последующую очистку и изучение биохимических свойств.
Полимеразная цепная реакция в направленном мутагенезе
Вырожденные праймеры, которые представляют собой сложную смесь олигонуклеотидов, содержащих многие точковые мутации, также используют для… Для получения точковых мутаций используют пару праймеров, в которых изменен…Рис. II.18. Использование ПЦР для получения мутаций
Получение точковых мутаций (1), делеций (2) и вставок (3): a и d – внешние праймеры, b и c – внутренние праймеры. AB и CD – фрагменты ДНК, образовавшиеся в результате ПЦР с использованием праймеров a и b, а также c и d соответственно. После гибридизации друг с другом объединяемых фрагментов ДНК сформировавшимися комплементарными последовательностями нуклеотидов одноцепочечные участки достраиваются ДНК-полимеразой в процессе ПЦР
В первых ПЦР в отдельных пробирках амплифицируют правую и левую части мутагенизируемого сегмента ДНК с использованием пар праймеров a + b и с + d, что приводит к образованию двух фрагментов ДНК, перекрывающихся на участках, которые содержат включенные праймеры (этапы 1 и 2). Фрагменты очищают от праймеров, смешивают друг с другом в эквимолярном соотношении и после цикла тепловой денатурации и ренатурации используют в качестве матрицы в другой ПЦР с внешними праймерами a и d (этап 3). На этом этапе в первом цикле ПЦР происходит достройка цепей перекрывающихся фрагментов ДНК (пунктирные линии на рис. II.12,1), и образовавшийся фрагмент двухцепочечной ДНК, содержащий требуемую мутацию, далее служит матрицей для амплификации и по завершении ПЦР присутствует в реакционной смеси в препаративном количестве.
Тот же принцип объединения двух фрагментов ДНК, перекрывающихся за счет праймеров, используется при получении делеций и вставок. Для создания делеции (на рис. II.18,2 обозначена прямоугольниками на цепях ДНК) берут внутренние праймеры b и с, 5’-концы которых комплементарны матрице по одну сторону делетируемой последовательности нуклеотидов, а 3’-концы – последовательности нуклеотидов, фланкирующей другой ее конец. Образующиеся при этом продукты ПЦР AB и СD перекрываются в точке делеции и далее используются, как и в предыдущем случае. При получении вставок (см. рис. II.18,3) применяют внутренние праймеры b и с, комплементарные друг другу своими 5’-концевыми частями, которые соответствуют образуемой олигонуклеотидной вставке во фрагмент матричной ДНК. 3’-Концы этих праймеров комплементарны участкам ДНК-матрицы, непосредственно примыкающим к сайту, в который производится вставка олигонуклеотида.
С помощью метода ПЦР удается легко получать и множественные мутации в конкретных участках ДНК. В этом случае амплификацию мутагенизируемого сегмента ДНК производят в присутствии трех (вместо четырех) дезоксирибонуклеозидтрифосфатов, причем один из них вводят в реакционную смесь в высокой концентрации. Именно этот нуклеотид преимущественно включается в амплифицируемый фрагмент ДНК вместо недостающего нуклеотида, что сопровождается накоплением в ДНК-продукте множественных случайных мутаций в виде соответствующих замен нуклеотидов. В таких искусственных условиях мутации возникают за счет снижения точности функционирования ДНК-полимеразы.
Белковая инженерия
Другое перспективное направление белковой инженерии – это конструирование биологически активных пептидов, обладающих фармакологической активностью.Библиотеки пептидов и эпитопов
До появления библиотек пептидов улучшение их биологических свойств осуществляли путем последовательного синтеза большого числа аналогов и проверкой… По способам получения библиотеки пептидов разделяются на три группы. К первой… Библиотеки пептидов, иммобилизованных на микроносителях, обладают существенным недостатком: они требуют при скрининге…Рис. II.19. Схема экспрессии пептидных эпитопов на поверхности оболочки нитевидных колифагов
Пептидные эпитопы находятся в составе гибридных полипептидных цепей минорного белка pIII (а) или основного белка pVIII вирусной оболочки (б). Стрелки указывают положение кодирующих эпитопы олигонуклеотидных фрагментов в геноме бактериофага, а также положение самих эпитопов. В составе полипептида pIII (а) показана только одна копия эпитопа (на самом деле их число достигает 4–5)
Библиотека пептидов, полученная в результате реализации третьего подхода, в современном виде представляет собой набор десятков или даже сотен миллионов коротких различающихся последовательностей аминокислот, которые экспрессированы на поверхности вирионов бактериофагов в составе их собственных структурных белков. Это становится возможным благодаря введению методами генной инженерии в геном бактериофагов гибридных рекомбинантных генов, кодирующих измененные структурные белки его вирионов. (Данный метод известен под названием фагового дисплея.) В результате экспрессии таких генов образуются гибридные белки, на N- или С-концах которых (см. ниже) присутствуют дополнительные последовательности аминокислот. В наиболее хорошо разработанной системе, позволяющей конструировать библиотеки пептидов генно-инженерными методами, используют небольшой нитевидный колифаг f1 и два его белка: основной и минорный белки оболочки pVIII и pIII. In vivo оба белка синтезируются в виде полипептидных цепей с короткими N-концевыми сигнальными последовательностями, которые отщепляются сигнальной пептидазой во время их созревания после переноса к внутренней части бактериальной мембраны. Зрелые белки встраиваются в оболочку бактериофага в процессе ее сборки. При этом белок pVIII образует основную оболочку бактериофага, тогда как четыре или пять молекул pIII ассоциированы с концевой частью вириона и обеспечивают взаимодействие вирусных частиц с половыми ворсинками клеток E. coli (рис. II.19). Генно-инженерными методами пептиды соединяют с белками – непосредственно с их N-концевыми последовательностями или на небольшом от них расстоянии. Концевые последовательности большинства белков являются более гибкими и, как правило, экспонируются на поверхности глобулы, что позволяет получать гибридные рекомбинантные белки без существенного нарушения их основных свойств, а также делает интегрируемые пептиды доступными для распознавания извне. Кроме того, в таком положении и пространственная структура самих пептидов испытывает меньшее влияние белка-носителя. В ходе экспериментов было установлено, что введение чужеродных пептидов в N-концевую часть белка pIII не оказывает существенного влияния на жизнеспособность и инфекционность фаговых частиц, тогда как соединение пептидов длиной >5 аминокислотных остатков с N-концевой частью белка pVIII нарушает сборку вирионов. Последнее затруднение можно преодолеть доставкой к месту сборки вирионов молекул белка pVIII дикого типа, синтез которых направляется соответствующим геном вируса-помощника. В этом случае оболочка бактериофага будет содержать как измененные белки pVIII, так и полипептиды дикого типа от вируса-помощника.
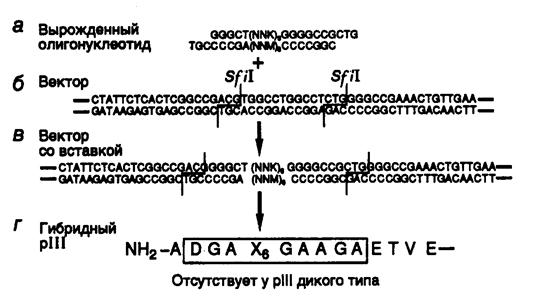
Рис. II.20. Схема конструирования рекомбинантного вирусного генома, содержащего вставки вырожденных олигонуклеотидов, для получения библиотеки эпитопов
Двухцепочечный олигонуклеотид (а), содержащий вырожденные кодоны NNK и те же самые сайты рестрикции в составе линкеров, лигируют с ДНК вектора Fuse5 (б), расщепленного рестриктазой SfiI, с образованием рекомбинантного генома (в), который направляет синтез гибридного рекомбинантного белка (г), содержащего на N-конце указанную аминокислотную последовательность
При конструировании библиотеки пептидов прежде всего синтезируют два комплементарных друг другу олигонуклеотида, которые после отжига образуют двухцепочечную молекулу, центральная часть которой кодирует собственно пептиды (рис. II.20,а), а выступающие по концам одноцепочечные участки комплементарны "липким" концам вектора, получающимся под действием соответствующей рестриктазы (см. рис. II.20,б).
Для кодирования аминокислот пептидов используют вырожденные кодоны вида NNK или NNS, которые включают все четыре нуклеотида (N) в первом и втором положениях, G или T (K), а также G или С (S) в третьем положении. При таком подходе информация о всех 20 аминокислотах и одном стоп-кодоне заключена в 32 различных кодонах NNK и NNS, а не в 64, как это имеет место в случае природного генетического кода.
В процессе синтеза вырожденных олигонуклеотидов, кодирующих исследуемые пептиды, на каждой стадии используют индивидуальные нуклеотиды для кодонов инвариантных аминокислот, фланкирующих вариабельный участок пептида, а также эквимолярные смеси нуклеотидов для участков, кодирующих случайные последовательности. Образовавшийся в итоге набор вырожденных олигонуклеотидов далее клонируют в виде одноцепочечных фрагментов в соответствующих сайтах гена белка оболочки бактериофага в составе фагового вектора или фазмиды. Альтернативно для такого набора олигонуклеотидов (химически или с помощью ПЦР) синтезируют комплементарные цепи с включением инозина в вариабельные участки, поскольку его остатки, как известно, спариваются с основаниями С и T матрицы, что облегчает образование правильных дуплексов между соответствующими олигонуклеотидами. Образующиеся двухцепочечные олигонуклеотиды в случае необходимости обрабатывают соответствующими рестриктазами и клонируют в фаговом векторе. Итоговые рекомбинантные молекулы (см. рис. II.20,в) ДНК вводят в бактериальные клетки, получая ~109 трансформантов на 1 мг рекомбинантной ДНК, образовавшиеся фаговые частицы размножают в бактериях и после очистки исследуют на присутствие рекомбинантных пептидов (см. рис. II.20,г), способных взаимодействовать с исследуемыми рецепторами в белках их вирионов.
Число индивидуальных фаговых клонов в библиотеке является определяющим для ее использования. К примеру, библиотека, заключающая в себе все возможные гексапептиды, должна содержать 64 млн (206) разных шестичленных аминокислотных последовательностей, кодируемых ~1 млрд (326) различных гексакодонов (32 – число кодонов, с помощью которых можно закодировать любую из 20 аминокислот предложенным выше способом, а именно с использованием кодонов NNK или NNS). Для решения такой задачи должны быть получены очень большие библиотеки, содержащие, по крайней мере, 2·108 – 3·108 индивидуальных, независимых клонов, а величина 109 в настоящее время является верхним пределом для числа индивидуальных клонов библиотеки, которую еще можно практически использовать.
Исходя из этого, можно заключить, что максимальная длина пептидов, включающих в себя все возможные сочетания 20 аминокислот, с которыми возможно работать с помощью библиотек пептидов, составляет 6 аминокислотных остатков. Тем не менее, следует иметь в виду, что библиотека 15-членных пептидов того же размера (2–3·108 клонов) будет содержать больше разнообразных гексапептидов, чем рассмотренная выше библиотека 6-членных пептидов. Кроме того, поскольку лишь ограниченное число аминокислотных остатков в пептиде действительно определяет его биологическую активность, библиотека 15-членных пептидов может оказаться представительнее библиотеки более коротких пептидов с тем же числом клонов.
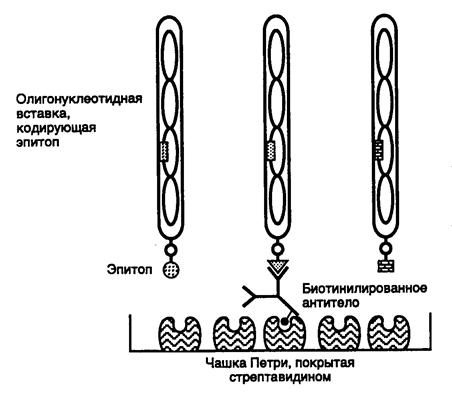
Рис. II.21. Схема отбора фаговых частиц, обладающих требуемыми эпитопами
Показаны три рекомбинантных фаговых частицы, экспрессирующие разные эпитопы в составе pIII. Только эпитоп центральной фаговой частицы распознается молекулой биотинилированного антитела, иммобилизованного на чашке Петри с помощью стрептавидина и использованного для скрининга библиотеки
Для того чтобы выделить из библиотеки пептиды с искомой биологической активностью, применяют различные методы скрининга. В частности, для выделения пептидов, имитирующих определенные эпитопы, используют биотинилированные моноклональные антитела соответствующей специфичности, которые иммобилизуют на твердой подложке с помощью стрептавидина (рис. II.21). Фаговые частицы, экспрессирующие на своей поверхности соответствующие эпитопы, взаимодействуют с антителами и задерживаются подложкой, тогда как другие рекомбинантные фаговые частицы удаляются в процессе промывания. Задержанные на подложке фаговые частицы далее элюируют кислотой, индивидуальные клоны дополнительно размножают в бактериальных клетках и экспрессированные на них эпитопы исследуют по различным критериям. Наличие идентичных или сходных последовательностей нуклеотидов среди клонированных последовательностей свидетельствует о специфичности процесса очистки. Индивидуальные клоны затем охарактеризовывают другими, в частности иммуноферментными методами. На заключительной стадии исследования осуществляют синтез выделенных пептидов и их всестороннее изучение в очищенном состоянии.
В настоящее время имеются данные о некоторых работах, проведенных с использованием пептидных библиотек. В одном из таких исследований из библиотеки были выделены пептиды, последовательность аминокислот в которых резко отличалась от последовательности аминокислот истинного эпитопа исследуемого антигена. Тем не менее, такой пептид прочно связывался со специфическими антителами и конкурировал за связывание с природным антигеном. Это позволило сделать вывод о возможности существования мимотопов – коротких пептидов, имитирующих природные эпитопы, последовательности аминокислот которых существенно различаются между собой. Удалось установить канонические последовательности аминокислот пептидов, имитирующих эпитопы природных белков, а среди них идентифицировать аминокислотные остатки, играющие ключевую роль во взаимодействии антиген–антитело.
Одним из многообещающих приложений библиотек пептидов является идентификация пептидных лигандов, имитирующих "структурные" эпитопы, образующиеся на поверхности белковых глобул в результате сворачивания их полипептидных цепей, что сопровождается пространственным сближением аминокислотных остатков, расположенных в полипептидной цепи на значительном расстоянии друг от друга. С помощью пептидных библиотек возможна идентификация пептидных аналогов различных эпитопов небелковой природы. По-видимому, в ближайшем будущем возможно использование пептидных библиотек для получения новых лекарственных препаратов, создания диагностических средств и производства эффективных вакцин. В области конструирования новых лекарственных препаратов усилия исследователей могли бы быть направлены на создание пептидных лигандов, специфически взаимодействующих с рецепторами, представляющими медико-биологический интерес. Знание структуры таких лигандов позволило бы упростить получение на этой основе лекарственных препаратов небелковой природы.
Библиотеки пептидов и эпитопов найдут свое применение и в исследованиях механизмов гуморального иммунного ответа, а также заболеваний иммунной системы. В частности, большинство аутоиммунных заболеваний сопровождается образованием аутоантител против антигенов собственного организма. Эти антитела во многих случаях служат специфическими маркерами того или иного аутоиммунного заболевания. С использованием библиотеки эпитопов, в принципе, можно получить пептидные маркеры, с помощью которых было бы возможно следить за специфичностью аутоантител во время развития патологического процесса как в индивидуальном организме, так и в группе пациентов и, кроме того, определять специфичность аутоантител при заболеваниях неизвестной этиологии.
Библиотеки пептидов и эпитопов потенциально могут быть использованы также для скрининга иммунных сывороток с целью выявления пептидов, специфически взаимодействующих с защитными антителами. Такие пептиды будут имитировать антигенные детерминанты патогенных организмов и служить мишенями для защитных антител организма. Это позволит использовать подобные пептиды для вакцинации пациентов, у которых отсутствуют антитела против соответствующих патогенов. Изучение эпитопов с помощью библиотек пептидов является частным случаем одного из многочисленных направлений их использования в прикладных и фундаментальных исследованиях взаимодействия лигандов и рецепторов. Дальнейшее усовершенствование этого подхода должно способствовать созданию новых лекарственных препаратов на основе коротких пептидов и быть полезным в фундаментальных исследованиях механизмов белок-белковых взаимодействий.
Белки-репортеры в гибридных белках
В другом случае гибридные белки применяют для получения высокого уровня экспрессии коротких пептидов в бактериальных клетках благодаря стабилизации… С помощью гибридных белков решают и обратную задачу клонирования неизвестного…Гибридные токсины
Серия работ И. Пастана с сотрудниками по конструированию гибридных токсинов направленного действия прекрасно иллюстрирует возможности белковой инженерии в части комбинирования различных функциональных доменов белков для достижения конкретных биологических эффектов.
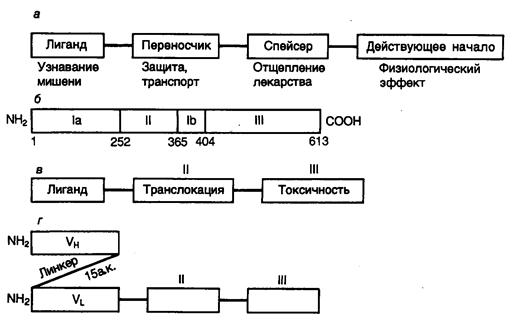
Рис. II.22. Лекарственные препараты направленного действия на основе гибридных токсинов
а – обобщенная схема структуры лекарственного препарата направленного действия; б – строение псевдомонадного токсина (цифрами обозначено положение аминокислотных остатков); в – строение гибридного токсина; г – гибридный токсин на основе моноклональных антител
Идеальное лекарственное средство строго специфического избирательного действия должно обладать, по крайней мере, следующими структурно-функциональными особенностями (рис. II.22,а). Такой лекарственный препарат должен заключать в себе действующее начало для достижения физиологического эффекта и лиганд, распознающий рецептор на поверхности клеток-мишеней. Кроме того, в нем должны быть структурные элементы, распознаваемые системой транспорта организма, для доставки лекарства к клеткам-мишеням, а также спейсерный участок, необходимый для отделения действующего начала от остальных функциональных частей препарата после его доставки по адресу. Именно такая идеальная схема реализуется в природном экзотоксине Pseudomonas aeruginosa. Экзотоксин А P. aeruginosa представляет собой белок, состоящий из одной полипептидной цепи длиной в 613 аминокислот, которая организована в три функциональных домена (см. рис. II.22,б). N-Концевой домен Ia (аминокислотные остатки 1–252) необходим для взаимодействия с поверхностью клеток-мишеней (прототип лиганда идеального лекарства направленного действия). Функции домена Ib (аминокислотные остатки 365–404) в настоящее время неизвестны. Домен II (аминокислотные остатки 253–364) обеспечивает эффективный перенос токсина в цитозоль клеток (система транспорта лекарства), а домен III (аминокислотные остатки 405–613) осуществляет ADP-рибозилирование фактора элонгации трансляции EF2, что приводит к подавлению трансляции и гибели клеток-мишеней. Таким образом, для оказания цитотоксического действия экзотоксину A необходимо с помощью домена Iа распознать рецепторы на поверхности клеток, проникнуть в клетку с помощью эндоцитоза, опосредованного рецепторами, и быть транслоцированным через внутреннюю мембрану в цитозоль, где локализуется фактор EF2. Основная идея в создании токсинов направленного действия заключалась в том, чтобы заменить домен Iа на какой-либо иной пептидный лиганд, взаимодействующий с другой группой рецепторов на поверхности клеток, и тем самым изменить специфичность действия токсина в отношении самих клеток (см. рис. II.22,в).
Было установлено, что удаление домена Iа генно-инженерными методами резко (в сотни и тысячи раз) снижает токсичность такого укороченного белка как в отношении клеток различных линий, так и in vivo. Присоединение к С-концевой части укороченного полипептида молекулы интерлейкина 2 человека осуществляли путем объединения структурных частей соответствующих генов в экспрессирующем векторе. Очищенный гибридный токсин оказался чрезвычайно токсичным в отношении клеток, несущих на своей поверхности рецепторы интерлейкина 2, и не действовал на клетки, у которых эти рецепторы отсутствовали и которые погибали под действием природного токсина. Интернализация (транслокация внутрь клеток) гибридного токсина была опосредована субъединицами р55 и р70 рецептора интерлейкина 2. Таким образом, в результате действия гибридного токсина на популяцию клеток, часть из которых экспрессирует на своей поверхности рецепторы интерлейкина 2, происходит избирательная гибель именно этих клеток.
В организме большинство покоящихся T-клеток и T-клеток памяти не экспрессируют на своей поверхности высокоаффинных рецепторов интерлейкина 2, тогда как T-клетки, стимулированные аллоантигенами, содержат такие рецепторы. Поэтому внутрибрюшинное введение гибридного токсина крысам с экспериментальным артритом – заболеванием, обусловленным патологической активацией T-клеток, снижало симптомы заболевания. Гибридный токсин существенно уменьшал у мышей и реакции отторжения трансплантата.
Вслед за этими пионерскими работами последовала целая серия исследований, направленных на создание аналогичных систем адресной доставки различных цитотоксических полипептидов. В процессе дальнейшего усовершенствования системы адресной доставки псевдомонадного токсина с использованием интерлейкина 2 в качестве лиганда отказались от полного удаления адресного домена токсина и ограничились его инактивацией путем введения в ген токсина четырех сайт-специфических мутаций. Молекулы такого гибридного токсина оказались в 10–100 раз более эффективными цитотоксическими агентами против клеток человека и обезьян, экспрессирующих на своей поверхности рецепторы для интерлейкина 2, а также обладали значительно большим временем полужизни в крови мышей in vivo по сравнению с ранее полученной конструкцией.
На основе псевдомонадного токсина были созданы гибридные токсины, содержащие в качестве лигандов полипептидные цепи интерлейкина 4, интерлейкина 6, трансформирующего фактора роста типа a и инсулиноподобного фактора роста I. Для всех этих гибридных белков была показана высокоспецифическая цитотоксичность в отношении опухолевых клеток (включая клетки миеломы человека), обладающих соответствующими рецепторами. Использование в гибридном токсине в качестве лиганда части полипептидной цепи CD4 – гликопротеина поверхности T-клеток, который является рецептором вируса ВИЧ и взаимодействует с его гликопротеином gp120, позволило избирательно поражать T-клетки, зараженные вирусом ВИЧ и экспрессирующие на своей поверхности вирусный белок gp120.
Тот же принцип подавления инфекции, вызванной вирусами ВИЧ, растворимыми рецепторами CD4 был использован при конструировании гибридных белков, объединяющих части полипептидных цепей CD4 с константными частями тяжелых или легких цепей иммуноглобулинов человека. При этом в процессе объединения генов были удалены последовательности нуклеотидов, кодирующие трансмембранный и цитоплазматический домены CD4, а также вариабельную часть полипептидных цепей иммуноглобулинов. Образующиеся гибридные молекулы, названные иммуноадгезинами, за счет константной части молекулы иммуноглобулина приобретали повышенную стабильность в организме и, кроме того, сохраняли специфические свойства, опосредуемые константными частями иммуноглобулинов: связывание Fс-рецептора и белка A, способность к фиксации комплемента и перенос через плацентарный барьер. Совокупность всех этих свойств давала возможность иммуноадгезинам эффективно прерывать инфекцию T-клеток вирусом ВИЧ-I, блокируя как сам вирус, так и зараженные им клетки, экспрессирующие на своей поверхности вирусный антиген gp120.
Дальнейшее усовершенствование генно-инженерных конструкций на основе псевдомонадного экзотоксина А произошло после того, как в качестве адресной части гибридного токсина стали использовать вариабельные домены моноклональных антител к компоненту p55 рецептора интерлейкина 2 человека. В этом рекомбинантном белке с помощью 15-звенного пептидного линкера аминокислот соединяли вариабельный домен тяжелой цепи этого иммуноглобулина с вариабельным доменом его легкой цепи, а С-конец легкой цепи – с N-концом укороченного псевдомонадного токсина (см. рис. II.22,г). Такие молекулы гибридного токсина также оказались высокоспецифичными цитотоксическими агентами по отношению к лейкозным клеткам человека, экспрессирующим на своей поверхности рецепторы интерлейкина 2.
Разработанный подход продемонстрировал возможность использования специфических антител в качестве адресных частей гибридных токсинов. Это дает в руки исследователей универсальный способ адресной доставки токсинов, который в будущем позволит оказывать цитотоксическое действие на любые группы клеток, экспрессирующих на своей поверхности специфические антигены, т.е. значительно расширить количество мишеней для химиотерапевтических воздействий с использованием рекомбинантных белков.
Помимо псевдомонадного экзотоксина A в качестве действующего начала в гибридных токсинах успешно применяли дифтерийный токсин, фактор некроза опухолей и A-цепь рицина. Поскольку A-белок избирательно взаимодействует с константными (Fс) частями иммуноглобулинов класса G многих млекопитающих, такой гибридный токсин в паре с иммуноглобулином, полученным против какого-либо антигена на поверхности клеток, избирательно связывается с этими клетками и убивает их. Такие иммунотоксины являются еще одним потенциальным противоопухолевым агентом и могут быть использованы против клеток, экспрессирующих на своей поверхности специфические антигены.
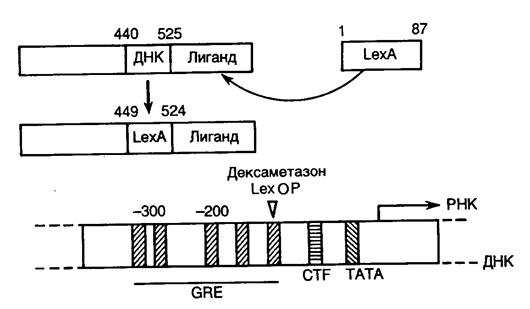
Рис. II.23. Использование гибридного белка для регуляции экспрессии гена
Методы генной инженерии открывают безграничные возможности конструирования новых белков путем объединения в разных комбинациях различных функциональных доменов полипептидных цепей. Получение гибридных токсинов направленного действия иллюстрирует возможности такого подхода в белковой инженерии. В качестве последней иллюстрации возможностей этой группы методов рассмотрим гибридный белок как новый регулятор активности генов. При конструировании такого белка методами генной инженерии был заменен ДНК-связывающий домен в рецепторе глюкокортикоидных гормонов на соответствующий домен LexA-репрессора E. coli (рис. II.23).
Введение операторной последовательности гена lexA в область промотора глобинового гена (или других генов) приводило к активации промотора под действием гибридного белка в присутствии дексаметазона – синтетического гормона, взаимодействующего с рецептором глюкокортикоидов. Таким образом, в новом генетическом окружении последовательность нуклеотидов оператора гена lexA E. coli функционировала в качестве энхансера транскрипции в присутствии гибридного белка-активатора, узнающего эту последовательность. Результаты работы демонстрируют возможность создания новых белков – регуляторов активности генов путем комбинирования известных функциональных доменов.
Развитие белковой инженерии во многом сдерживается недостатком знания о структурно-функциональных взаимоотношениях в белках, что обусловлено сложностью объекта исследования. Многочисленные работы, направленные на изучение таких связей, как правило, носят эмпирический характер и завершаются локализацией аминокислот, существенных для функционирования активных центров ферментов. Поэтому основная задача белковой инженерии – по известной последовательности аминокислотных остатков получить белок с заданными свойствами – в настоящее время еще далека от своего разрешения. Тем не менее, уже сейчас иногда удается целенаправленно изменять некоторые свойства существующих ферментов путем замен небольшого числа аминокислотных остатков их полипептидных цепей с помощью направленного мутагенеза.
Подходы к созданию новых ферментов
Серия работ была проведена на субтилизине – протеолитическом ферменте бактерий рода Bacillus. В активном центре субтилизина B. lentus в положении… Эти работы иллюстрируют возможности данного направления исследований в… Такой же подход с целенаправленными заменами отдельных аминокислотных остатков был использован для изменения…Субтилигаза в лигировании пептидов
Недавно был разработан альтернативный подход к химическому синтезу длинных пептидов, заключающийся в ферментативном лигировании предварительно… Д. Джексоном с соавторами (1994 г.) разработана стратегия синтеза крупных…Концепция ксенобиоза
Вероятно, на самом деле последствия таких мутационных замен аминокислот могут быть более значительными. Начнем с того, что внимание исследователей,… Еще более яркий пример такого рода демонстрируют абзимы (антитела, обладающие… Исходя из этого можно ожидать появления в организме человека и животных антител, обладающих самыми неожиданными…Рис. II.24. Гипотетическая схема ксенобиоза и его последствий
В верхней части рисунка изображены соматическая клетка и происходящие в ней процессы, приводящие к образованию эндогенных ксенобиотиков
При этом можно говорить о возможности нарушения толерантности системы цитохрома Р-450 в результате каких-либо патологических процессов, как это имеет место в случае иммунной системы при развитии аутоиммунных заболеваний. С учетом приведенных фактов можно предполагать, что под действием соматических мутаций может произойти изменение активного центра цитохрома P-450 таким образом, что он начнет распознавать в качестве субстрата эндогенный метаболит организма, например ароматическую аминокислоту или стероидный гормон, и метаболизировать его по эпоксид-диольному пути с образованием промежуточного эпоксида, обладающего мутагенной активностью (рис. II.24). Образовавшийся эндогенный ксенобиотик в том случае, если он не окажется особенно токсичным, будет непрерывно мутагенизировать геном как своей собственной клетки, так и соседних клеток до тех пор, пока не произойдут мутации, нарушающие контроль клеточной пролиферации (например в онкогенах или генах-супрессорах опухолей), что будет сопровождаться малигнизацией клеток, в том числе их неконтролируемым ростом, т.е. развитием злокачественного новообразования.
В том случае, если будет малигнизироваться клетка, содержащая мутантный ген цитохрома P-450, то все клетки образующейся опухоли будут синтезировать эндогенный ксенобиотик и опухоль будет оказывать сильный токсический эффект на целый организм. Этого не произойдет, если будут малигнизироваться клетки, расположенные по соседству с мутантной. В настоящее время уже описаны эксперименты, в которых с помощью направленного введения точковых мутаций удалось изменить специфичность цитохрома P-450. Кроме того, как было упомянуто выше, изменение субстратной специфичности под действием точковых мутаций описано и для других ферментов. Все это указывает на возможность развития событий по предлагаемому гипотетическому сценарию.
Появление мутаторного фенотипа у клеток злокачественных новообразований описано в настоящее время для многих форм рака. Основной причиной мутаторного фенотипа раковых клеток считают мутационные нарушения ферментных систем репарации, что имитирует внутриклеточное возрастание концентрации мутагенов. Предлагаемый механизм указывает на еще один возможный путь малигнизации нормальных клеток через образование эндогенных ксенобиотиков – эндогенных мутагенов. При развитии такой цепи событий повреждение систем репарации будет вторичным по отношению к первичному синтезу эндогенного мутагена.
Помимо онкологических заболеваний эндогенные ксенобиотики могли бы вызывать некоторые аутоиммунные заболевания в ответ на образование аддуктов с макромолекулами организма, что придавало бы модифицированным макромолекулам иммуногенность и нарушало иммунологическую толерантность организма. Эндогенные ксенобиотики могли бы быть также одной из постоянно действующих причин старения организма вследствие его постепенного отравления эндогенными ксенобиотиками по мере накопления в клетках с возрастом мутантных ферментов, обладающих измененной субстратной специфичностью.
Процесс спонтанного и индуцированного соматического мутагенеза происходит непрерывно на протяжении всей жизни многоклеточного организма. Следовательно, в организме постоянно образуются новые мутантные белки, которые исходно не были закодированы его геномом. Мутантные белки могут контактировать в клетках с большим количеством эндогенных метаболитов и при наличии структурного соответствия между метаболитом и новым активным центром мутантного белка метаболизировать его с образованием эндогенного ксенобиотика, например продуктов расщепления упомянутого выше пептидного гормона VIP, наличие которых в организме больных доказано. Многоклеточный организм является своеобразным полигоном, на котором ежеминутно на протяжении всей жизни происходят испытания вновь образующихся белков на способность метаболизировать эндогенные химические соединения, с которыми они находятся в контакте. Таким образом, ксенобиоз в том случае, если он распространен так широко, как я думаю, должен быть обычным феноменом, присущим всем многоклеточным организмам.
Если предположение о ксенобиозе верно, то организм должен обладать эффективными системами защиты от этого неизбежного явления. Помимо высокоэффективных репаративных систем, понижающих частоту спонтанного мутагенеза в соматических клетках, защиту от эндогенных ксенобиотиков отчасти могла бы осуществлять сама иммунная система. В таких случаях с участием иммунной системы элиминировались бы те мутантные соматические клетки, которые экспонируют мутантные белки на своей поверхности и которые в этом случае распознавались бы как чужеродные антигены. Однако в большинстве случаев, по-видимому, этого не должно происходить, так как мутантные белки будут локализованы внутри клеток.
Другим средством защиты от образующихся ферментов с новой субстратной специфичностью (и ксенобиоза) у многоклеточных организмов могут быть убиквитин- и ATP-зависимые системы внутриклеточного протеолиза аномальных белков. Однако эти системы должны срабатывать в первую очередь в отношении мутантных белков, у которых резко нарушена пространственная структура, что при одиночных заменах аминокислот, по-видимому, происходит редко. В пользу такого предположения свидетельствуют все те многочисленные мутантные соматические клетки, которые описаны в литературе и из которых можно выделять мутантные белки.
Вероятно, основную защиту от эндогенных ксенобиотиков могла бы обеспечивать обсуждавшаяся выше система цитохрома P-450. Действительно, широкая совокупная субстратная специфичность системы цитохрома P-450 позволяет ей метаболизировать и в конечном счете обезвреживать химические соединения. По аналогии с иммунной системой, которая помимо защиты организма от экзогенных инфекционных агентов выполняет функции иммунного надзора за антигенным состоянием соматических клеток, основной функцией системы цитохрома P-450 может быть освобождение организма от эндогенных ксенобиотиков. В соответствии с этим система цитохрома P-450 эволюционно могла возникнуть для поддержания, прежде всего, метаболического гомеостаза многоклеточных организмов в условиях непрерывно образующихся эндогенных ксенобиотиков, а уже затем ее функции распространились и на экзогенные химические соединения, вредные для организма.
Глава 9. АНТИСМЫСЛОВЫЕ РНК, РИБОЗИМЫ И ДЕЗОКСИРИБОЗИМЫ
Антисмысловые РНК как ключевые компоненты одной из систем негативной регуляции экспрессии генов были впервые описаны у бактерий. Вскоре тот же тип регуляции был обнаружен и у эукариот. Уже в первых опытах было установлено, что короткие РНК, комплементарные мРНК, образуют с ними гибриды и блокируют трансляцию. Поскольку действие таких РНК направлено против функционирования кодирующих (осмысленных) РНК, они получили название антисмысловых (antisense RNA), или micРНК (mRNA interfering complementary RNA). Это открытие вскоре легло в основу целого направления исследований искусственной регуляции экспрессии генов, неразрывно связанного с методами генной инженерии.
Антисмысловые РНК и олигонуклеотиды
В середине 1970-х годов синтетические олигонуклеотиды, комплементарные мРНК, были впервые использованы в бесклеточных системах биосинтеза белка для…Механизм действия антисмысловых РНК
Механизм транспорта олигонуклеотидов в клетки обладает чертами сходства с эндоцитозом, опосредованным рецепторами. Эффект подавления трансляции мРНК… Использование аналогов олигодезоксирибонуклеотидов повышает результативность… Механизмы ингибирующего действия антисмысловых РНК. В первых опытах с антисмысловыми РНК, которые с помощью…Использование антисмысловых РНК
Получение трансгенных мышей, экспрессирующих антисмысловые РНК гена ОБМ, который содержался в количестве десяти копий на геном, сопровождалось… Антисмысловые РНК могут быть использованы и для получения мутантных фенотипов,… Таблица II.3Влияние экспрессии антисмысловых РНК на фенотип трансгенных мышей
Использование антисмысловых РНК для исследования онтогенеза животных выявило высокую чувствительность определенных его стадий к изменению уровня… Исследование клеточного цикла.Антисмысловые РНК оказались полезными в… Противовирусная терапия.Внутриклеточная экспрессия антисмысловых РНК, направленных против мРНК некоторых ключевых…Природные антисмысловые РНК
Экспрессия гена sulA E. coli, кодирующего SOS-индуцируемый ингибитор деления бактериальных клеток, регулируется нетранслируемой РНК, комплементарной… Антисмысловые РНК участвуют и в регуляции жизненного цикла бактериофагов.… Антисмысловые РНК, по-видимому, играют важную роль и в экспрессии ранних генов вируса полиомы. Геном вируса полиомы…Рибозимы и дезоксирибозимы
Типы рибозимов
Рис. II.25. Особенности вторичной структуры рибозимов разных типов
а – "головка молотка", б – шпилька, в – рибозим вируса гепатита d, г – рибозим Neurospora VS. Стрелки обозначают точки расщепления РНК; нуклеозид N может быть A, U, G или C, H – A, U или C, Y – любой пиримидин; приведены общепринятые обозначения элементов вторичных структур рибозимов
Другими примерами рибозимов являются РНК, образующие структуры типа шпилек, а также РНК вируса гепатита δ (ВГД) и сателлитная РНК Варкуда (Varcud satellite – VS) нейроспоры (см. рис. II.25,б,в,г соответственно). (Структура и механизм действия рибозимов в составе интронов групп I, II и III были подобно рассмотрены в разделе 2.2.3.) Рибозимы со структурами типа шпилек были впервые обнаружены у вироидов и вирусоидов растений, рибозимы ВГД были идентифицированы среди сателлитных РНК вируса гепатита В человека, а рибозимы VS – среди сателлитных РНК природных изолятов Neurospora. В связи с рибозимами следует вспомнить и о РНКазе Р E. coli, состоящей из небольшого полипептида и РНК длиной в 375 нуклеотидов, о которой уже упоминалось в разделе 2.2.1. Именно РНК обеспечивает этому ферменту эндонуклеазную активность, необходимую для процессинга предшественников тРНК.
Хотя у природных РНК сайт расщепления и последовательность нуклеотидов рибозима расположены на одной молекуле (in cis по отношению друг к другу), HH-рибозимы могут действовать и на сайты расщепления, расположенные in trans, т.е. на других молекулах РНК. Именно это свойство рибозимов данного класса позволило использовать их для создания высокоспецифичных эндорибонуклеаз на основе антисмысловых РНК, которые обладают способностью расщеплять in trans молекулы РНК, содержащие тринуклеотидные сайты расщепления. Для создания высокоспецифического рибозима, функционирующего по этому принципу, последовательность рибозима заключают в последовательность антисмысловой РНК таким образом, чтобы при образовании гибрида с РНК-мишенью в контакте с активным центром рибозима оказывалась тринуклеотидная последовательность сайта расщепления.
Свойства рибозимов
Адресная доставка искусственных рибозимов. Существуют два основных подхода к адресной доставке олигонуклеотидов. При одном из них синтезированные… В ходе исследований по оптимизации адресной доставки рибозимов были изучены… Для создания альтернативных гидрофобных комплексов молекул рибозимов с носителем иногда используют катионные липиды.…Рибозимы как лекарственные средства
Лечение вирусных заболеваний. Большие усилия предпринимаются для использования рибозимов в лечении СПИДа, вызываемого вирусами иммунодефицита… Еще одним подходом к преодолению ВИЧ-инфекции является отщепление 5’-концевой… Основной сложностью, которую приходится преодолевать при конструировании рибозимов, расщепляющих геномную ВИЧ-РНК,…Рис. II.26. Использование сайтов рестрикции для конструирования рибозима, интегрированного в антисмысловую РНК
Недавно была получена кассета из девяти идентичных генов рибозимов, расположенных друг за другом в одном экспрессирующем векторе. Рибозимы такой "полицистронной" РНК, направленные против разных частей ВИЧ-генома, сохраняли внутри клетки свою специфичность, но были более эффективными в пересчете на одну копию РНК полирибозима и не утрачивали своей активности даже в частично деградировавших молекулах РНК.
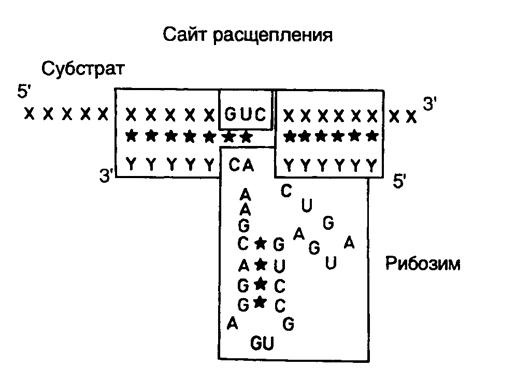
Рис. II.27. Взаимодействие рибозима с РНК-субстратом
В заключение этого раздела рассмотрим пример использования рибозимов против вирусов растений в сельском хозяйстве. Как упоминалось выше, рибозимы, образующие структуру типа "головки молотка", распознают в сайте расщепления РНК-мишени последовательности из трех нуклеотидов, рядом с которой происходит гидролиз цепи РНК. Подобными тринуклеотидами могут быть последовательности AUC, CUA, CUC, GUA, GUC, GUU и UUC. В предложенном подходе РНК-связывающий домен рибозима конструируют таким образом, что распознаваемый тринуклеотид входит в состав последовательности нуклеотидов, которая в двухцепочечной ДНК образует сайт рестрикции. Подобный подход дает возможность встраивать последовательность каталитического домена рибозима по этому сайту рестрикции в кДНК, полученную путем обратной транскрипции РНК-мишени. Следовательно, каталитический домен рибозима оказывается фланкированным последовательностями антисмысловой РНК, комплементарной РНК-мишени, которые автоматически выполняют роль РНК-связывающего домена. При таком подходе отпадает необходимость в синтезе большого числа олигонуклеотидов, и в любом необходимом случае рибозим собирается из готовых блоков. В качестве конкретного примера рассмотрим создание рекомбинантного рибозима, специфически расщепляющего РНК, содержащую последовательность сайта рестрикции SalI (рис. II.26). После расщепления кДНК рестриктазой SalI (этап 1) образовавшиеся "липкие" концы гидролизуют нуклеазой S1 (этап 2) и по образовавшимся "тупым" концам встраивают каталитический домен рибозима, заключенный в двухцепочечном фрагменте ДНК (этап 3). В результате транскрибирования такой конструкции синтезируется антисмысловая РНК, в состав которой включен каталитический домен рибозима. После гибридизации с РНК-мишенью образуется двухцепочечная молекула РНК, на одной из цепей которой формируется структура рибозима типа "головки молотка" (рис. II.27), расщепляющего РНК-мишень в строго определенном месте. Описанный подход был реализован при конструировании рибозима, направленного против геномной РНК одного из вирусов сливы. При этом были получены последовательности нуклеотидов рибозима, пригодные для использования с другими 25 сайтами рестрикции.
Подавление функционирования онкогенов. Одними из основных различий, обнаруживаемых между нормальными и раковыми клетками, являются генетические различия ряда генов, контролирующих пролиферацию. В геноме опухолевых клеток часто обнаруживают мутации в генах двух типов: онкогенах и генах-супрессорах опухолевого роста, или антионкогенах. Онкогены эволюционно консервативны и вызывают неопластическую трансформацию клеток как при ретровирусной инфекции в природных условиях (поскольку они часто бывают включены в состав генома ретровирусов), так и после введения ДНК онкогенов в культивируемые клетки с помощью трансфекции. Большинство онкогенов вначале было обнаружено именно в составе генома онкогенных вирусов, и они являются мутантными производными протоонкогенов, присутствующих в здоровых клетках многоклеточных организмов и активирующихся во время эмбриогенеза, роста клеток или регенерации тканей. Поскольку активированные онкогены в опухолевых клетках, как правило, сверхэкспрессируются и кодируемая ими РНК по своей первичной структуре отличается от РНК протоонкогенов, РНК онкогенов являются хорошей потенциальной мишенью для рибозимов.
Онкоген H-ras. Мутация в кодоне 12 гена H-ras, приводящая к замене GGC®GUC, создает консенсусный сайт, по которому HH-рибозим может расщеплять мутантную мРНК. In vitro было продемонстрировано пятикратное различие в эффективности действия рибозима на мутантную H-ras-РНК и соответствующую РНК дикого типа. Получены H-ras-зависимые линии клеток, стабильно трансформированные экспрессирующим вектором, который направлял синтез HH-рибозима под контролем промотора b-актинового гена. Для таких клеток характерна пониженная скорость пролиферации, сопряженная с уменьшением внутриклеточных уровней H-ras-РНК и белка р21, кодируемого этим геном. Далее рибозим экспрессировали в клетках линии EJ карциномы мочевого пузыря человека. Введение исходных клеток мышам сопровождалось их быстрой гибелью на фоне развития высокоинвазивных опухолей. В отличие от этого клоны EJ-клеток, экспрессирующих рибозим, в организме мышей обладали резко сниженным опухолевым фенотипом. Образующиеся опухоли были малоинвазивны, и наблюдалось приблизительно двукратное повышение уровня выживаемости мышей с трансплантатами. Гистологические исследования подтверждали слабую способность опухолей к метастазированию. Рибозимы в опухолях обнаруживались методом ПЦР на протяжении 86–90 дней. Таким образом, эти и ряд других экспериментов показали способность рибозимов нормализовать экспрессию активированного H-ras как in vitro, так и in vivo.
Онкоген c-fos. Как уже упоминалось в первой части книги, белковый продукт гена c-fos участвует в передаче сигнала эукариотическими клетками, вовлечен в синтез ДНК и может придавать клеткам устойчивость к противоопухолевым препаратам. Последние два свойства этого белка находят подтверждение, в частности в том факте, что при проведении лечения часто используемым противоопухолевым лекарством цисплатином (цис-диаминодихлорплатина) происходит индукция гена c-fos вслед за генами dTMP-синтазы и ДНК-полимеразы. Рибозим, разрушающий c-fos-мРНК, снижал конечный уровень экспрессии гена c-fos, приводил к повышению чувствительности опухолевых клеток к химиотерапевтическим агентам (включая цис-платину) и значительно подавлял экспрессию генов dTMP-синтазы, ДНК-полимеразы b и гена металлотионеина человека hMTII-A.
Онкогены bcr/abl. Аберрантная филадельфийская хромосома образуется в результате транслокации (9;22)(q34;q11) в стволовых клетках костного мозга, что сопровождается слиянием генов bcr и abl с образованием химерного онкогена bcr/abl и развитием хронических миелоидных лейкозов (ХМЛ). Транскрипт химерного гена кодирует белок р210bcr/abl, который обладает повышенной активностью тирозинкиназы. Такие РНК и белок обнаруживаются почти у всех больных с синдромом ХМЛ, а также у 50% пациентов с острым лимфобластоидным лейкозом, у которых имеется филадельфийская хромосома. С помощью рибозимов, специфически расщепляющих последовательность химерной мРНК в месте стыковки последовательностей двух генов, удалось подавить экспрессию химерного гена bcr/abl в культивируемых клетках. Экспрессия рибозимов в культивируемых клетках вызывала снижение уровня bcr/abl-мРНК, полностью блокировала образование химерного белка р210bcr/abl и ингибировала рост клеток на 84%. Эти результаты были значительно лучше эффектов, вызываемых антисмысловыми олигонуклеотидами.
В работах других исследователей был получен рибозим, расщепляющий вышеупомянутую химерную РНК по кодону GUU, расположенному по соседству с местом стыковки последовательностей двух генов. Этот рибозим разрушал соответствующую РНК in vitro и in vivo, а также подавлял тирозинкиназную активность белка р210.
9.2.4. Репарация мутантных РНК с помощью рибозимов, осуществляющих транс-сплайсинг
Просто устроенные HH- и HP-рибозимы принято рассматривать как рибозимы первого поколения. Во всех примерах, рассмотренных выше, в прикладных целях использовалась их способность осуществлять специфическое эндонуклеазное расщепление молекул РНК. Недавно (Дж. Т. Джонс и др., 1996 г.) удалось приспособить рибозимы для восстановления генетической информации на уровне молекул РНК, структура которых нарушена мутациями. Рибозим интрона группы I Tetrahymena после незначительных генно-инженерных модификаций оказался способным выполнять такие репарирующие функции.
Как уже обсуждалось в первой части книги (см. раздел 2.2.3), аутосплайсинг транскриптов, содержащих интроны группы I, начинается с расщепления фосфодиэфирной связи между 5’-концевым экзоном и прилегающим к нему интроном, сопровождаемого полным удалением интрона и лигированием фланкирующих его экзонов, приводящим к восстановлению непрерывной структуры РНК. Идея, лежащая в основе использования рибозимов для репарации РНК, проста. Достаточно лишь с помощью генно-инженерных методов к 3’-концу рибозима присоединить вместо 3’-концевого экзона любую другую последовательность, чтобы она соединялась с последовательностью 5’-концевого экзона в строго определенной точке с образованием гибридной молекулы РНК. Поскольку сайт взаимодействия рибозима с РНК во время транс-сплайсинга и положение точки разрыва РНК целиком определяются внутренней направляющей последовательностью рибозима (internal guide sequence – IGS), присоединение новой 3’-концевой последовательности можно осуществлять практически в любом месте РНК-мишени (рис. II.28). Таким образом, для репарации мутационного повреждения в экзоне 2 на уровне РНК IGS делают комплементарной участку РНК-мишени, локализованному выше точки повреждения (в рассматриваемом примере – А) на стыке экзонов 1 и 2. Экзон 2 дикого типа соединяют с рибозимом, который после взаимодействия с РНК-мишенью вырезает из нее мутантную последовательность экзона 2 и заменяет на эквивалентную последовательность дикого типа. В результате комплекс рибозима и репарированной РНК распадается и обновленная РНК вовлекается в трансляцию.
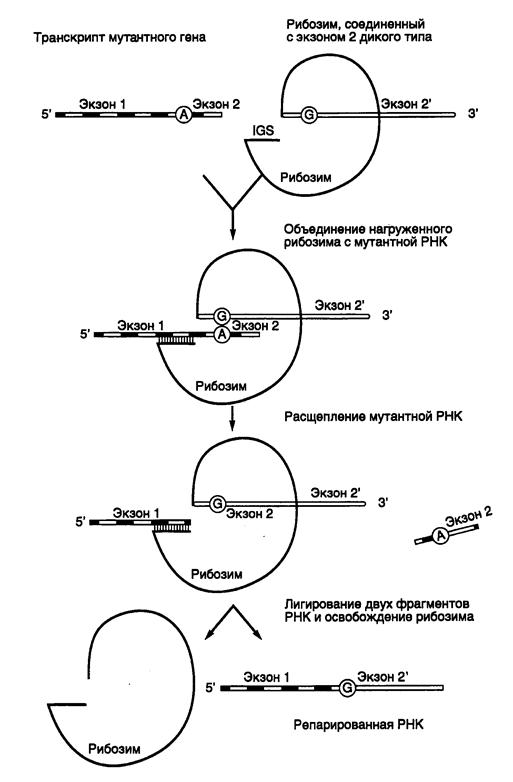
Рис. II.28. Схема репарации мутантной мРНК рибозимом, осуществляющим транс-сплайсинг
Молекула рибозима, соединенная 3’-концом с последовательностью экзона 2 дикого типа, взаимодействует с мутантной РНК выше мутантного нуклеотида и замещает мутантную часть репарируемой РНК в реакции аутосплайсинга
Такой подход был успешно использован для репарации мРНК гена lacZ как в клетках E. coli, так и в культивируемых клетках животных. Точность транс-сплайсинга, направляемого рибозимом, оказалась абсолютной – в образующихся восстановленных молекулах РНК не наблюдали сдвига рамки считывания. Однако в этих опытах на первый план вышла другая проблема. Длина IGS-последовательности, определяющей специфичность взаимодействия рибозима с РНК, составляет всего шесть нуклеотидов. Такая последовательность из шести нуклеотидов в молекулах РНК встречается достаточно часто (каждые 4096 оснований). Следствием этого было объединение репарирующего фрагмента РНК не только с РНК-мишенью, но и другими РНК, не имеющими отношения к первой. Выход из сложившейся ситуации ищут в увеличении специфичности действия рибозима путем удлинения IGS. Однако с увеличением длины области комплементарного взаимодействия между рибозимом и РНК будут возрастать прочность этого взаимодействия и, как следствие, затруднение последующего распада каталитического комплекса, что должно сопровождаться ингибированием реакции.
Применение рибозимов в реакциях транс-сплайсинга для корректировки экспрессии мутантных генов на посттранскрипционном уровне рассматривается как весьма перспективное направление в генотерапии. И хотя более логичной все-таки кажется необходимость репарации мутаций на уровне самих генов, такой подход, возможно, получит право на жизнь и в клиниках. По сути дела он является прототипом реакции редактирования РНК (см. раздел 2.2.2), который эффективно используется клетками при экспрессии ряда генов в природных условиях.
Благодаря генной инженерии введение в молекулярную генетику антисмысловых РНК и рибозимов привело к появлению высокоспецифичного инструмента для изучения функциональной роли и регуляции экспрессии индивидуальных генов in vivo. Использование этих методов представляется особенно перспективным в исследованиях по биологии и генетике развития, так как именно здесь инактивация отдельных генов соматических клеток представляется особенно сложной задачей. Плодотворным подходом является объединение последовательностей антисмысловых РНК с рибозимами, поскольку в результате получаются каталитически действующие, высокоспецифические супрессоры генов, а также конструкции, корректирующие экспрессию генов на посттранскрипционном уровне. Полагают, что дальнейшее развитие техники адресной доставки генов антисмысловых РНК, направленных против патогенных вирусов, в клетки зародышевой линии животных и растений может привести к созданию сортов растений и пород животных, устойчивых к действию патогенных вирусов, и дать большой экономический эффект в сельском хозяйстве. Однако хорошо известно, что на любое лекарство у возбудителя заболевания всегда находится адекватный защитный ответ. Поэтому до тех пор, пока генотерапия не будет опираться на самонастраивающиеся генетические системы, что имеет место, например в случае иммунной системы, победа, в конечном счете, будет оставаться за возбудителем. Нельзя не учитывать и возможное использование антисмысловых РНК в будущем для генотерапии как инструмента воздействия на онкогены и другие генные локусы, повышенный уровень экспрессии которых вредно сказывается на жизнедеятельности соматических клеток многоклеточных организмов. Первые результаты, полученные при разработке некоторых из этих направлений молекулярной генетики, кратко изложены в главе 11.
Дезоксирибозимы
Несмотря на прогноз о большой каталитической инертности ДНК, в течение последних пяти лет ферментативная активность была обнаружена и у ее молекул,… Поиск молекул ДНК, обладающих определенными ферментативными активностями, как… На основании такого рода данных были сделаны выводы, что молекулы ДНК, как и РНК, способны формировать различные…Аптамеры
Аптамеры, взаимодействующие с красителями.Недавно была реализована идея использования аптамеров для введения флуоресцентной метки в молекулы РНК,… В другой серии исследований были идентифицированы аптамеры, взаимодействующие… Аптамеры, взаимодействующие с небольшими молекулами биологического происхождения. В качестве первого этапа серии…Молекулы РНК у истоков жизни
Теории происхождения жизни, основанные на первоначальном участии молекул РНК в создании самореплицирующихся и самоусложняющихся систем, нашли…Молекулы РНК в качестве РНК-репликаз
Для того чтобы репликация РНК самими молекулами РНК имела место, необходимо одновременное присутствие в одном микрообъеме, по крайней мере, двух… Выше уже были рассмотрены механизмы реакций аутосплайсинга и транс-сплайсинга,… Альтернативой реакции удлинения праймера на один нуклеотид за цикл может быть зависимая от матрицы реакция элонгации…Возможность синтеза полипептидных цепей молекулами РНК
Функциональная связь между рРНК и интронами группы I недавно открылась с неожиданной стороны, когда установили, что аминогликозидные антибиотики,… При наличии активированных аминокислот синтез пептидов не представляется… Молекулы РНК могут распознавать аминокислоты. По крайней мере, у двух природных РНК (как и у обсуждавшихся выше…Глава 10. ТРАНСГЕННЫЕ ЖИВОТНЫЕ И РАСТЕНИЯ
Методические достижения генной инженерии микроорганизмов, разрушившие межвидовые барьеры в передаче генов, подготовили благоприятную почву для введения рекомбинантных ДНК в многоклеточные организмы. Действительно, идея введения чужеродных генов в геном многоклеточного организма ничем существенно не отличается от блестяще реализованных идей генетической трансформации бактериальных клеток гетерологичными последовательностями нуклеиновых кислот. Поэтому неудивительно, что с развитием генной инженерии появление трансгенных животных и растений не заставило себя долго ждать.
Способы получения трансгенных многоклеточных организмов
Почти все гены зигот имеют хорошие шансы быть представленными в большинстве соматических клеток организма и принять участие в формировании их… Такой молекулярно-генетический подход к изменению генотипа и фенотипа… Для получения трансгенных животных в настоящее время применяют три основных метода. Во всех методах рекомбинантные…Экспрессия трансгенов
Обнаружена слабая корреляция между числом копий трансгенов, тандемно интегрированных в геном животного, и суммарным уровнем их экспрессии. Это… Таким образом, данные, полученные к настоящему времени, указывают на то, что…Использование трансгенов у животных
Исследование механизмов экспрессии генов
Использование таких эффективных, хотя и трудоемких методов иногда является единственным путем идентификации тканеспецифических регуляторных… Экспрессия трансгенов обнаруживается по появлению соответствующего им…Токсигены в исследовании дифференцировки соматических клеток в онтогенезе
После интеграции таких токсигенов в геном развивающегося эмбриона они передаются от клетки к клетке в рядах клеточных поколений без экспрессии до… С помощью такой стратегии были получены впечатляющие результаты при изучении… Из-за большой токсичности вышеупомянутых белковых токсинов (чтобы убить клетку, достаточно одной молекулы)…Изменение физиологического статуса лабораторных и сельскохозяйственных животных
Увеличение уровня экспрессии GH у трансгенных мышей обусловливает и ряд других физиологических реакций организма. Например, под действием трансгена… Результаты таких опытов легли в основу целого направления прикладных… Другое направление биотехнологии, в котором используется трансгеноз, – изучение возможности биосинтеза чужеродных…Моделирование наследственных и приобретенных заболеваний человека
Основой для решения послужили две работы, выполненные М. Хупером и М. Куэном с соавторами и опубликованные в 1987 г. Авторам удалось разработать… Рис. II.29. Схема адресной доставки генов в геном эмбриональных стволовых клеток с использованием гомологичной…Трансгенные растения
Процесс получения трансгенных растений в этом случае начинается с введения требуемых генов в недифференцированные клетки таким образом, чтобы они… Основным направлением применения трансгеноза для генетической модификации… Другой метод защиты растений от вирусов с помощью трансгенов, предложенный В. Шибальским в 1988 г., успешно…Генотерапия наследственных и приобретенных заболеваний
Теоретически возможны два типа генно-инженерных воздействий на геном человека с целью генотерапии. Во-первых, это вмешательство на уровне… В настоящее время генотерапия рассматривается как многообещающее направление в…Способы доставки новых генов в геном человека
Наиболее пристальное внимание как к средству доставки трансгенов при генотерапии уделяется вирусу лейкоза мышей Молони (MoMLV). Вирусы группы… Модификации гена белка оболочки. Последовательности нуклеотидов гена env,… Соединение белка оболочки с новыми лигандами. Первые успехи на этом пути были достигнуты путем создания конъюгатов…Управление экспрессией трансгенов в клетках-мишенях
Тканеспецифические промоторы. Обеспечение тканеспецифической экспрессии трансгена может достигаться путем использования в генно-инженерных… Промоторы, активируемые в клетках опухолей. Описано несколько случаев, когда… Направленная интеграция трансгенов в определенные генетические локусы. Альтернативным, хотя и более трудоемким,…Современные достижения генотерапии онкологических заболеваний
Многие формы онкологических заболеваний протекают на фоне нарушения регулируемой экспрессии онкогенов или антионкогенов. Причиной такого… Другую группу экспериментов, направленных на генотерапию рака, которые… Векторы, переносящие трансгены HLA-B7 и/или IL-2, уже прошли многочисленные клинические испытания. Ранее на…Ближайшие перспективы использования генотерапии
Хорошо изучена также этиология болезни Тэя–Сакса. Для пациентов характерно полное отсутствие активности b-гексозаминидазы, что сопровождается… Метахроматическая лейкодистрофия характеризуется дефицитом арилсульфатазы A и… В отличие от генотерапии на уровне клеток зародышевой линии генотерапия с использованием соматических клеток сопряжена…Успехи генотерапии в модельных экспериментах
На мышах моделировали также синдром мукополисахаридоза типа VII, для которого характерно нарушение ступенчатой деградации глюкозаминогликанов в…Проблемы, возникающие в связи с практическим применением генотерапии
Ни одна из вышеперечисленных технических проблем, возникающих при практическом использовании генотерапии, не является неразрешимой, однако…Глава 11. ДНК-ДИАГНОСТИКА И ДНК-ТИПИРОВАНИЕ
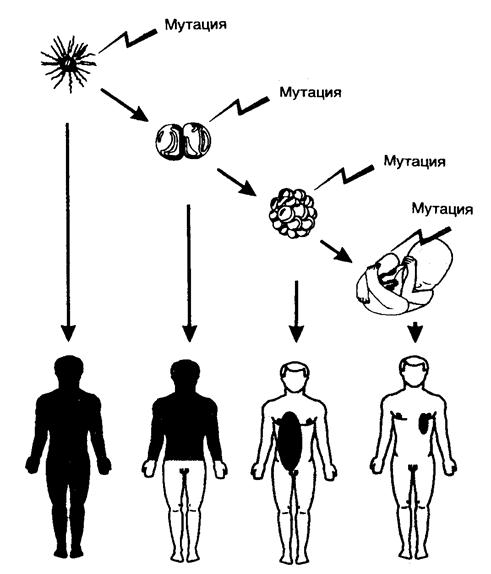
Рис. II.30. Генетические последствия мутаций, происходящих в геноме соматических клеток человека на разных стадиях эмбриогенеза
Черным цветом закрашены места локализации клонов мутантных клеток разных размеров в организме человека
Исследования показывают, что большинство заболеваний человека, а возможно, и все его болезни связаны с мутациями, приводящими к изменению уровней экспрессии конкретных генов. Мутации в определенных генах нарушают функционирование биохимических систем, что в конце концов приводит к развитию соответствующих патологических состояний организма (рис. II.30). В том случае, если мутации происходят в геноме клеток зародышевой линии человека, все соматические клетки организма-потомка, который развивается из мутантной зиготы, образовавшейся от слияния мутантных гамет в процессе оплодотворения, будут содержать указанную мутацию. Чем позже в онтогенезе человека возникает соматическая мутация, тем меньше размер клона мутантных клеток во взрослом организме. Если же мутация доминантна, т.е. патологический мутантный признак, определяемый мутантным геном, проявляется даже при наличии в соматических клетках копии нормального гена, полученного от другого родителя, то возникает наследственное заболевание.
В случаях, когда мутация, определяющая мутантный фенотип, рецессивна (ее действие проявляется лишь в гомозиготном состоянии, при котором один и тот же мутантный ген получен от каждого из родителей), можно говорить о предрасположенности организма-гетерозиготы к соответствующему заболеванию и носительстве мутантного гена. Действительно, организм, у которого действие рецессивной мутации маскируется функционированием другого, полноценного аллеля, внешне (фенотипически) выглядит нормальным. Однако у такого организма гораздо больше шансов дать больное потомство в браке с носителем такого же мутантного гена, что является одной из причин запрета на близкородственные браки. С другой стороны, у носителей мутантных генов в гетерозиготном состоянии может произойти соматическая мутация в соответствующем аллельном гене соматических клеток, что также станет причиной развития приобретенного генетического заболевания. В качестве одного из примеров такого заболевания мы уже рассматривали ранее ретинобластому – онкологическое заболевание, поражающее сетчатку глаз, чаще всего, в детском возрасте. Это заболевание развивается в два этапа: вначале организм ребенка получает от одного из родителей мутантный ген RB1, являющийся рецессивным онкогеном (антионкогеном), а затем в онтогенезе в одной из соматических клеток в результате мутации происходит инактивация второй его копии, что вызывает малигнизацию клетки и развитие опухоли. Такой же механизм лежит в основе возникновения некоторых форм диабета, а также ряда онкологических и аутоиммунных заболеваний.
Традиционная диагностика наследственных и инфекционных заболеваний строится на детальном изучении симптомов и проведении многочисленных биохимических анализов, включая культивирование патогенных микроорганизмов на сложных питательных средах. При этом выявление бессимптомного носительства вредных аллелей и микроорганизмов-возбудителей превращается в чрезвычайно трудоемкую задачу. В частности, традиционными цитогенетическими методами можно выявить в геноме человека лишь некоторые крупные хромосомные перестройки: протяженные делеции и транслокации генетического материала, потерю или приобретение целых хромосом. При этом мелкие делеции, транслокации и вставки, а также точковые мутации, которые являются наиболее часто встречающимися изменениями генетического материала, остаются не обнаруженными. То же имеет место и при диагностике бессимптомного носительства возбудителей инфекционных заболеваний бактериальной и вирусной природы, например вируса иммунодефицита человека, которые в латентной стадии инфекции могут присутствовать в организме человека лишь в небольшом числе копий.
Разработанные недавно новые методы молекулярной биологии, и особенно метод ПЦР, значительно облегчили проведение диагностики наследственных и инфекционных заболеваний. При этом мутации выявляются в ДНК клинических образцов, а бессимптомное присутствие возбудителей обнаруживают по наличию геномных ДНК или РНК соответствующих вирусов или бактерий.
В основе всех методов ДНК-диагностики лежат три фундаментальных принципа молекулярной биологии (рис. II.31). Это прежде всего существование комплементарных взаимодействий между двухцепочечными молекулами нуклеиновых кислот (первый принцип), которые после денатурации с последующей ренатурацией (второй принцип) позволяют им безошибочно находить друг друга и восстанавливать первоначальную вторичную структуру. Если же в процессе ренатурации нуклеиновых кислот добавить в пробы короткие олигонуклеотиды (зонды или праймеры), ковалентно соединенные с каким-либо меченым соединением, то они благодаря комплементарным взаимодействиям соединяются с тем участком нуклеиновой кислоты, который содержит последовательность нуклеотидов, строго соответствующую последовательности нуклеотидов зонда или праймера (третий принцип). Следовательно, наличие связавшейся с нуклеиновой кислотой метки с высокой точностью свидетельствует о присутствии в анализируемом образце искомых последовательностей нуклеотидов.
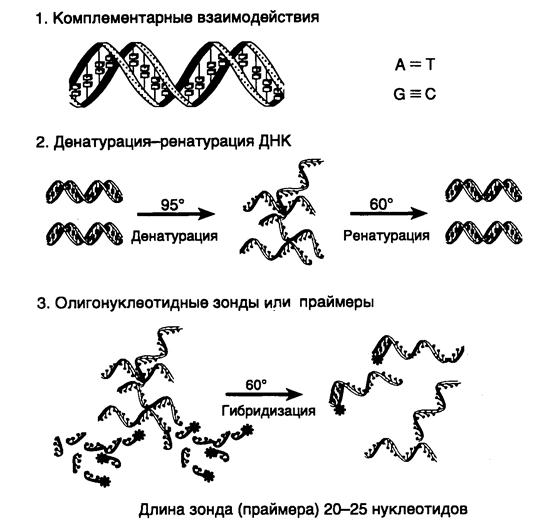
Рис. II.31. Три молекулярно-генетических принципа, лежащих в основе ДНК-диагностики
Звездочками отмечено наличие радиоактивной, флуоресцентной или другой метки в олигонуклеотидных зондах или праймерах на одном из их концов
Современные методы ДНК-диагностики находят широкое применение в медицине для обнаружения мутаций при наследственных (или приобретенных) заболеваниях и ДНК-типирования организмов (рис. II.32). ДНК-диагностика наследственных и приобретенных заболеваний может заключаться как в обнаружении известных, уже описанных мутаций, так и в поиске новых мутаций, приводящих к тому же патологическому состоянию организма. ДНК-типированием называют поиск генотипических особенностей у микро- или макроорганизма, которые позволяют его идентифицировать и(или) отнести к той или иной систематической группе.
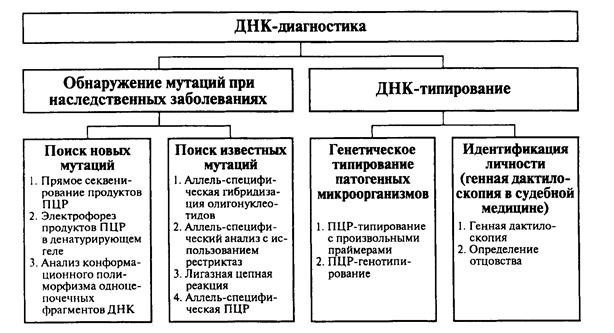
Рис. II.32. Применение методов ДНК-диагностики в медицине
ДНК-диагностика наследственных и приобретенных заболеваний
Для проведения ДНК-диагностики наследственных и приобретенных заболеваний необходимо подготовить нуклеиновые кислоты, содержащиеся в клинических образцах, и проанализировать их адекватными методами. При этом целью анализа является обнаружение в геноме больного известных или новых мутаций, ассоциированных с развитием мутантного фенотипа в виде симптомов конкретного заболевания.
Получение клинического генетического материала
Слюнупациентов (до 5 мл) обычно собирают в пластиковые пробирки. Допускается сбор слюны на фильтровальную бумагу с последующим ее высушиванием с… Корни волос содержат несколько сотен соматических клеток, а следовательно, и… Срезы для микроскопии и парафинированные ткани используют для проведения семейного генетического анализа, когда другие…Диагностика заболеваний
Методы обнаружения новых неизвестных мутаций. Если раньше точковые мутации, а также микроделеции и вставки обнаруживали преимущественно прямым… Прямое секвенирование продуктов ПЦР является очень эффективным и… Электрофорез продуктов ПЦР в денатурирующем градиентном геле (denaturing gradient gel electrophoresis – DGGE).…Рис. II.33. Схема обнаружения точковых мутаций гибридизацией с аллель-специфическими зондами
М и Д – зонды, соответствующие мутантному аллелю и аллелю дикого типа. Звездочкой отмечены радиоактивные метки
Аллель-специфическая гибридизация олигонуклеотидов (allele-specific oligonucleotide hybridization – ASO). Фрагменты ДНК, амплифицированные с помощью ПЦР с использованием в качестве матрицы ДНК обследуемых индивидуумов и ДНК дикого типа, денатурируют и иммобилизуют на нитроцеллюлозных или нейлоновых мембранах. Мембрану со специфически связанными с ней нуклеиновыми кислотами обычно называют блотом. В том случае, если ДНК наносят на мембрану в виде круглых пятен с помощью микропипетки, речь идет о дот-блотах. Одни из дот-блотов гибридизуют с олигонуклеотидом (обычно меченным 32Р или флуоресцентной меткой), первичная структура которого соответствует исследуемому аллелю дикого типа (дот-блот-гибридизация). Другой идентичный дот-блот гибридизуют с меченым олигонуклеотидом, соответствующим мутантному аллелю (рис. II.33). Температуры плавления образовавшихся гетеродуплексов и правильных гибридов различаются. Поскольку в гетеродуплексах имеется ошибочно спаренный нуклеотид, температура их плавления (денатурации) будет ниже, чем у соответствующих правильных гибридов. Подобрав температуру, при которой происходит плавление гетеродуплексов, но не правильных гибридов, можно путем промывки буфером соответствующей температуры избирательно убрать с дот-блотов меченые олигонуклеотиды гетеродуплексов, сохранив олигонуклеотиды правильных гибридов в связанном с ДНК дот-блотов состоянии.
После авторадиографии дот-блот-гибридов, промытых буфером соответствующей температуры, получается следующая картина. В случае гибридизации ДНК дот-блотов с олигонуклеотидным зондом, соответствующим последовательности нуклеотидов нормального аллеля, гибрид сохраняется, если в доте присутствует ДНК дикого типа здорового индивидуума. Гибрид разрушается, если в доте присутствует ДНК индивидуума с мутантным геном в гомозиготном состоянии (оба аллеля исследуемого гена, полученные от каждого из родителей, мутантны). В этом случае в результате гибридизации зонда с ДНК обоих аллелей образуются гетеродуплексы, содержащие ошибочно спаренный нуклеотид и обладающие пониженной температурой плавления. В том случае, если обследуемый индивидуум гетерозиготен по исследуемому гену и его ДНК заключает в себе как мутантный аллель, так и аллель дикого типа, в результате промывки разрушается гибрид мутантного аллеля, но не аллеля дикого типа, и половина образованных гибридов сохраняется.
При использовании в дот-блот-гибридизации олигонуклеотидного зонда, соответствующего мутантному аллелю исследуемого гена, по тем же самым причинам после промывки в жестких температурных условиях гибриды сохранятся в случае ДНК гомозиготных и гетерозиготных по мутантному аллелю индивидуумов, но будут разрушены в пробах с ДНК, содержащей только нормальные аллели.
Аллель-специфический анализ с использованием рестриктаз применяют в том случае, когда исследуемая мутация изменяет сайт рестрикции. Принцип этого метода полностью совпадает с таковым метода ПДРФ, рассмотренного выше. Рестриктаза может расщеплять двухцепочечную ДНК только в том случае, если ДНК содержит соответствующий сайт рестрикции. Наличие или отсутствие сайта рестрикции в продукте ПЦР указывает на особенности первичной структуры амплифицируемого участка ДНК: наличие или отсутствие мутации, изменяющей последовательность нуклеотидов этого участка. В результате мутаций могут не только элиминироваться известные сайты рестрикций, но и возникать новые, что выявляется по изменению электрофоретической подвижности продуктов ПЦР после их инкубации с рестриктазами.
Аллель-специфическая ПЦР. Известно, что для эффективного осуществления ПЦР 3'-концевой нуклеотид праймера должен быть комплементарен соответствующему нуклеотиду матричной ДНК. В противном случае эффективность удлинения праймера во время ПЦР резко снижается и при определенных сочетаниях ошибочно спаренных нуклеотидов может отсутствовать вообще. Именно эта особенность ПЦР и лежит в основе метода обнаружения мутаций с помощью аллель-специфической ПЦР, иначе иногда называемой аллель-специфической элонгацией праймера (allele specific primer extension).
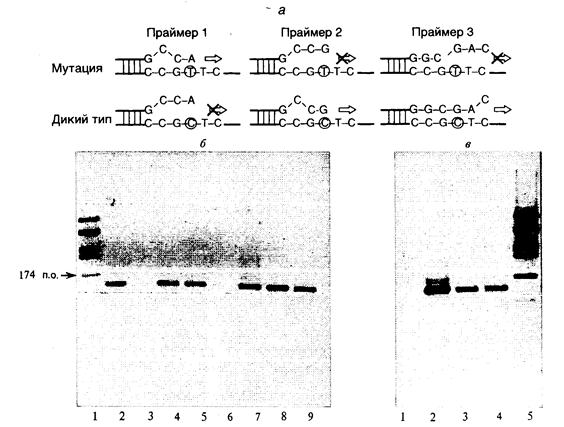
Рис. II.34. Схема одной из современных модификаций аллель-специфической ПЦР (а), использованной для идентификации точковой мутации Leiden в геноме человека (б и в)
Со всеми аллель-специфическими праймерами использован один и тот же встречный праймер. 3’-Концевые нуклеотиды аллель-специфических праймеров комплементарны мутантному нуклеотиду T (4), нуклеотиду дикого типа C (6), праймер 7 комплементарен нуклеотиду дикого типа своей внутренней частью, а его 3’-концевой нуклеотид не комплементарен матричной ДНК. Для усиления специфичности в праймеры 4 и 6 вблизи 3’-концов введены дополнительные нуклеотиды, некомплементарные матрице. Праймер 4 элонгируется ДНК-полимеразой в присутствии гомозиготной мутантной ДНК, но не ДНК дикого типа (б – дорожки 2 и 3 соответственно), в случае праймеров 6 и 7 наблюдается обратная картина (б и в – дорожки 6,8 и 1,3 соответственно). При наличии мутации в гетерозиготном состоянии все праймеры эффективно элонгируются (б – дорожки 5, 9, в – дорожка 4). Увеличение циклов ПЦР сверх оптимального приводит к образованию продуктов ПЦР в тех пробах, где при меньшем числе циклов они не образовывались (б – дорожки 4,7 и в – дорожка 2), что может служить внутренним контролем. Праймер 7 является универсальным, так как позволяет обнаруживать почти любую гомозиготную точковую мутацию, попадающую в его внутреннюю часть. Использование пар праймеров 4 и 6 или 4 и 7 позволяет легко дифференцировать гомозиготные и гетерозиготные мутации
На рис. II.34 представлены схема высокоэффективного варианта аллель-специфической ПЦР, недавно разработанного нами и использованного для диагностики мутации Leiden при тромбофилиях, а также полученные с помощью данного метода результаты. Эта мутация локализована в экзоне 10 гена фактора V системы свертывания крови человека и часто ассоциирована с синдромом повышенной ее свертываемости. В соответствии с последовательностью нуклеотидов анализируемого участка генома синтезируют два праймера, 3'-концевой нуклеотид одного из которых комплементарен мутантному нуклеотиду матричной ДНК, а у другого – нуклеотиду дикого типа (см. рис. II.34,а,б). Для усиления специфичности действия праймеров вблизи их 3’-концов были введены некомплементарные матрице нуклеотиды. Для исключения ложноотрицательных результатов в пробах, где продукт ПЦР отсутствует, повышали число циклов ПЦР сверх оптимального, после чего, если система работает нормально, продукт ПЦР появляется и в этих пробах, что может служить дополнительным внутренним контролем. Другой тип разработанных нами универсальных аллель-специфических праймеров содержит 3’-концевой нуклеотид, всегда некомплементарный матрице, а мутантный нуклеотид матрицы попадает в его внутреннюю часть (см. рис. II.34,а,в). В этом случае продукты ПЦР отсутствуют, если в гибриде во внутреннюю часть праймера попадает любой некомплементарный мутантный нуклеотид матричной ДНК вне зависимости от его точной локализации. Такие праймеры позволяют обнаруживать любые точковые мутации в гомозиготном состоянии и у гаплоидных микроорганизмов.
Для выявления гетерозиготного состояния анализируемого гена иногда используют мутантный и нормальный праймеры разных размеров, которые различаются по длине их 5'-концевых последовательностей, полностью комплементарных анализируемой ДНК. В этом случае в процессе ПЦР в реакционную смесь можно одновременно добавлять оба аллель-специфических праймера: мутантный и нормальный вместе с общим для обоих праймеров – встречным. Образовавшиеся продукты реакции, соответствующие мутантному аллелю и аллелю дикого типа, далее разделяют электрофоретически в гелях, используемых для секвенирования нуклеиновых кислот.
При использовании аллель-специфических праймеров для обнаружения мутаций необходимо иметь в виду, что не все сочетания ошибочно спаренных с матрицей 3'-концевых нуклеотидов одинаково эффективны в блокировании ПЦР. Наименьшей способностью к элонгации праймеров с ошибочно спаренными 3'-концевыми нуклеотидами обладает так называемый фрагмент Шоффлера Taq-полимеразы, который представляет собой молекулу ДНК-полимеразы T. aquaticus, укороченную с N-конца на несколько десятков аминокислотных остатков. В то же время в этом методе не применимы термостабильные ДНК-полимеразы, обладающие 3'®5'-корректирующей активностью, например Vent-полимераза.
ПЦР с аллель-специфическими праймерами является простым и эффективным методом обнаружения мутаций в геномной ДНК обследуемых индивидуумов. В отличие от всех рассмотренных выше методов аллель-специфическая ПЦР в такой постановке позволяет находить небольшое количество мутантных ДНК на фоне большого числа молекул ДНК дикого типа. Аналогичная генетическая ситуация может иметь место в том случае, если соматические мутации возникают в процессе онтогенетического развития организмов, и лишь небольшая часть соматических клеток (клон соматических клеток) таких организмов-мозаиков содержит анализируемые мутации. В этом случае, например при онкологических заболеваниях, мутантные ДНК в препаратах суммарной ДНК сильно разбавлены соответствующими последовательностями дикого типа и их трудно обнаружить другими методами. Аллель-специфические праймеры, полностью комплементарные лишь мутантным последовательностям анализируемой ДНК, вовлекаются в амплификацию таких мутантных последовательностей, а последовательности нуклеотидов ДНК дикого типа не амплифицируются. Подобный подход позволяет обнаруживать несколько десятков или сотен молекул мутантной ДНК на фоне десятков тысяч молекул ДНК дикого типа.
Лигазная цепная реакция – ЛЦР (ligase chain reaction – LCR). Способность ДНК-лигаз восстанавливать фосфодиэфирные связи в одноцепочечных разрывах двухцепочечных молекул ДНК используется при проведении ЛЦР. Для реализации этого подхода синтезируют два олигонуклеотида, комплементарные непрерывной последовательности нуклеотидов ДНК, которые после гибридизации с такой последовательностью примыкают друг к другу и разделены лишь одноцепочечным разрывом. При этом 3'-конец предшествующего нуклеотида должен содержать свободную 3'-ОН-группу, а в 5'-положении 5'-конца олигонуклеотида, следующего за ним, должна находиться фосфатная группа.
В первом цикле ЛЦР два вышеупомянутых олигонуклеотида отжигаются с исследуемой денатурированной ДНК (как и при ПЦР) в присутствии термостабильной ДНК-лигазы, а также всех остальных необходимых кофакторов и ионов. Реакционную смесь прогревают до температуры, оптимальной для лигирования, после чего между отожженными олигонуклеотидами образуется фосфодиэфирная связь, соединяющая оба олигонуклеотида друг с другом. Затем температуру реакционной смеси повышают до температуры плавления гибрида, образованного анализируемой ДНК и лигированными олигонуклеотидами, которые освобождаются в реакционную смесь в составе единого фрагмента. Во время второго цикла температуру реакционной смеси вновь понижают до температуры отжига олигонуклеотидов, которые, находясь в молярном избытке по отношению к освободившимся продуктам реакции, преимущественно гибридизуются с анализируемой ДНК. Далее связавшиеся олигонуклеотиды снова лигируют, и образовавшийся продукт реакции освобождают из гибрида повышением температуры. При этом содержание продукта в реакционной смеси удваивается. После проведения n циклов ЛЦР в реакционной смеси теоретически может оказаться nx молекул продукта реакции, где х – число пар олигонуклеотидов, вступающих в реакцию в каждом цикле, теоретически равное числу копий анализируемой последовательности нуклеотидов в реакционной смеси.
ЛЦР не происходит в том случае, если 3'-концевой нуклеотид первого олигонуклеотида или 5'-концевой нуклеотид второго некомплементарны соответствующим нуклеотидам анализируемой ДНК. Поэтому при наличии мутации в тех сайтах ДНК, где олигонуклеотиды стыкуются друг с другом, в реакцию со своим партнером вступает только измененный олигонуклеотид, полностью комплементарный анализируемой мутантной ДНК, т.е. продукт реакции образуется лишь при наличии в реакционной смеси "мутантного" олигонуклеотида, но не олигонуклеотида дикого типа. Таким образом, принципы, лежащие в основе метода определения мутаций с помощью ЛЦР, в ряде существенных моментов идентичны принципам аллель-специфической ПЦР.
Для количественной оценки ЛЦР один из олигонуклеотидов обычно метят биотином, а другой (соответствующий мутантному аллелю) – с помощью радиоактивной или флуоресцентной метки. По завершении ЛЦР олигонуклеотиды, меченные биотином, связывают с мембранными фильтрами с иммобилизованным стрептавидином, а количество лигированных олигонуклеотидов определяют по количеству связавшейся с фильтрами радиоактивной или флуоресцентной метки после отмывки непрореагировавших олигонуклеотидов.
Количественная ПЦР. Результаты большинства из обсуждавшихся выше методов с использованием ПЦР имеют качественный характер. С помощью этих методов легко обнаруживают качественные изменения в генах: точковые мутации, делеции и вставки. Однако при некоторых наследственных заболеваниях соответствующие симптомы возникают в ответ на изменение дозы (числа копий) определенных генов. Типичным примером наследственного заболевания, обусловленного изменением числа копий определенного участка хромосомы 21 в геноме клеток человека, является синдром Дауна. Цитогенетически это заболевание может быть диагностировано по трисомии хромосомы 21 или по наличию крупных транслокаций части этой хромосомы на другие хромосомы на фоне присутствия двух других нормальных хромосом 21. Тем не менее описаны клинические случаи синдрома Дауна, при которых не происходит видимых изменений кариотипа человека. Это обусловлено дупликацией с последующей транслокацией или без нее небольшого участка хромосомы 21. Выявление таких мутаций невозможно традиционными цитогенетическими методами. Однако с помощью количественной ПЦР определение полуторакратного возрастания дозы соответствующего участка хромосомы 21 становится совершенно реальным.
Проведение количественной ПЦР характеризуется, по крайней мере, двумя особенностями. Во-первых, ПЦР проводят в присутствии дезоксирибонуклеозидтрифосфатов или праймеров, меченных с помощью радиоактивной или флуоресцентной метки, с тем чтобы точно определять количество образовавшегося продукта ПЦР. Во-вторых, во время ПЦР необходимо завершать реакцию достаточно рано, пока не образовалось слишком много ПЦР-продуктов. Это связано с тем, что в конечной фазе насыщения, когда продуктов ПЦР становится слишком много, лимитирующими звеньями реакции становятся как субстраты (дезоксирибонуклеозидтрифосфаты), так и сам фермент, для молекул которого становится слишком много матричной ДНК в виде ПЦР-продуктов. В таких условиях завершение очередного цикла ПЦР уже не сопровождается удвоением количества ПЦР-продуктов и происходит нивелирование небольших количественных различий между разными пробами, которые достаточно четко выявляются на ранних стадиях ПЦР после прохождения нескольких циклов реакции.
При проведении количественной ПЦР в реакционную смесь необходимо вводить внутренние контроли в виде дополнительной пары праймеров, с помощью которых происходит амплификация генетического локуса, для которого точно известна его доза (число копий на молекулу геномной ДНК) в исследуемом геноме. Таким образом, сравнение количества продукта ПЦР, образующегося при амплификации исследуемого локуса, с количеством продукта ПЦР контрольного локуса позволяет определять их количественные соотношения в геноме.
ДНК-типирование
Недавно были обнаружены генетические маркеры в виде специфических последовательностей ДНК, которые дают возможность выявлять родственные отношения… Генетическим, или ДНК-типированием, называют определение особенностей генотипа… Таким образом, у каждого вида организмов имеется большое число внутривидовых различий в первичной структуре ДНК…ДНК-типирование микроорганизмов
Рис. II.35. Схема ДНК-типирования микроорганизмов с использованием ПЦР и праймеров произвольной структуры
а – штаммоспецифические различия, обусловленные разной локализацией участков ДНК, взаимодействующих с праймерами. В ДНК штаммов 2 и 3 отсутствует участок, который имеется в ДНК штамма 1, что приводит к исчезновению соответствующей полосы продукта ПЦР на электрофореграмме; б – результаты амплификации ДНК, содержащей сайты связывания праймеров постоянной локализации. ДНК штаммов 2 и 3 содержат делеции разной длины между сайтами связывания праймеров. Альтернативно, ДНК штаммов 1 и 2 могут содержать вставки, отсутствующие у ДНК штамма 3. Это находит отражение в длинах продуктов ПЦР, разделяемых электрофорезом. А, Б – сайты связывания праймеров на ДНК
Генетическое типирование микроорганизмов с использованием праймеров произвольной первичной структуры. Использование коротких олигонуклеотидных праймеров произвольной структуры основано на том, что в больших геномах для них имеются множественные сайты посадки, а следовательно, и инициации ПЦР. Чем короче такие праймеры, тем большее количество сайтов посадки для них должно существовать. Одним из ограничений дальнейшего участия таких праймеров в ПЦР будет расстояние между двумя сайтами посадки для противоположно направленных праймеров. Чем длиннее ПЦР-продукт, который должен образовываться в результате функционирования таких праймеров, тем менее надежно работает вся система типирования. На практике длина образующихся с произвольными праймерами продуктов ПЦР находится в пределах 0,2–2,0 т.п.о.
В зависимости от локализации на ДНК мест посадки для пары коротких праймеров могут образовываться два типа продуктов ПЦР. В первом случае различия в длинах продуктов ПЦР обусловлены присутствием на ДНК типируемых микроорганизмов разного числа сайтов связывания для одного или обоих праймеров (рис. II.35,а). Во втором случае такие различия определяются длинами сегментов ДНК (ампликонов), заключенных между парами мест посадки праймеров при неизменном их числе в конкретных генетических локусах (см. рис. II.35,б). На практике могут одновременно реализовываться обе эти возможности. Во время генетического типирования эукариот указанными методами иногда сразу функционируют до 100 ампликонов, тогда как у бактерий это число достигает лишь 20.
Несмотря на то что при обсуждаемом подходе последовательности праймеров выбираются произвольно, получаемая картина амплификации, как правило, является видо- и штаммоспецифичной. При этом количество сайтов связывания на одной и той же ДНК для праймеров одинаковой длины, но с разной первичной структурой может существенно варьировать. На рис. II.35 показаны такие свойства двадцати 10-нуклеотидных праймеров, испытанных на ДНК человека, бобов и S. aureus. Видно, что использование праймера AGGGGTCTTG, например, приводит к амплификации 8 ампликонов в ДНК человека, 3 ампликонов в ДНК соевых бобов и не выявляет ни одного ампликона в ДНК S. aureus, тогда как при использовании праймера AATCGGGCTG удается обнаруживать до 40 ампликонов в ДНК человека и соевых бобов и до 20 ампликонов в бактериальной ДНК. Таким образом, при использовании обсуждаемого метода в ДНК-типировании самым важным этапом является подбор праймеров или их комбинаций для наиболее эффективного определения принадлежности организма к тому или иному виду, штамму или линии.
Генетическое типирование микроорганизмов с использованием геномных фингерпринтов. При другом подходе к генетическому типированию с использованием ПЦР исследуют полиморфизм конкретных локусов, для которых хотя бы частично известна первичная структура. Синтезируют специфические олигонуклеотидные праймеры, сайты связывания которых фланкируют исследуемую последовательность ДНК с длиной 1,5–2,5 т.п.о. После проведения ПЦР особенности первичной структуры продуктов ПЦР определяют с помощью рестрикционного анализа. Положение сайтов рестрикции в анализируемой последовательности нуклеотидов может иметь видо- или штаммоспецифический характер и служить точным генетическим маркером того или иного микроорганизма.
С помощью этого метода, который по своей сути является разновидностью рассмотренного выше способа определения ПДРФ, идентифицируют близкородственные, сходные по фенотипу штаммы возбудителей заболеваний, исследуют генетическую структуру популяций микроорганизмов и механизмы их адаптивной изменчивости.
11.2.2. Идентификация личности на основе минисателлитной ДНК: определение отцовства
Определение отцовства представляет собой серьезную социальную, юридическую и медицинскую проблему. Решение этой задачи часто требуется в судах, при разрешении частных споров, для пренатальной (внутриутробной) диагностики, генетических консультаций и при пересадках органов. Например, только в США в 1990 г. было проведено более 120000 тестов на определение отцовства, и это число быстро возрастает. Мировой рынок таких диагностических тест-систем оценивался в 1994 г. более чем в 1 млрд долларов и сейчас является крупнейшим рынком среди молекулярно-генетических диагностикумов.
С использованием диагностических тест-систем на основе минисателлитных ДНК определение отцовства получило прочную научную основу. С этой целью в настоящее время используют два подхода. При одном из них применяют олигонуклеотидные зонды, специфичные в отношении многих минисателлитных локусов, при другом – наборы зондов (или праймеров), специфичных в отношении отдельных полиморфных локусов VNTR (подробнее о VNTR см. раздел 1.3.1).
Теоретические аспекты возможности определения отцовства.Возможность определения отцовства, так же как и отнесение биологических образцов, содержащих ДНК, к тому или иному человеку, основано на наличии в геноме человека четких генетических маркеров в виде определенных последовательностей ДНК, набор которых уникален для конкретного индивидуума. Теоретически такими маркерами могли бы быть любые последовательности нуклеотидов ДНК, для которых характерна большая изменчивость в популяциях человека. Как было уже отмечено выше, тандемно повторяющиеся последовательности минисателлитов (VNTR) являются одними из наиболее полиморфных последовательностей нуклеотидов в геноме человека. Поэтому неудивительно, что именно они были использованы для идентификации личности. Наличие сочетания генетических маркеров среди VNTR, общих для мужчины, женщины и спорного ребенка, в ряде случаев может однозначно указывать на родственные связи между ними.
Отсутствие общих генетических маркеров у обследуемых ребенка и мужчины однозначно исключает последнего как отца ребенка. Однако обнаружение у них общих маркеров еще не может быть доказательством того, что подозреваемый мужчина является отцом. Доказательства отцовства основываются на простых статистических расчетах, в которых учитываются частоты встречаемости в популяции общих аллелей исследуемых VNTR-локусов. Рассчитывается отношение (X/Y) вероятности (X) получения наблюдаемого набора маркеров возможного настоящего отца к вероятности (Y) обнаружения этого набора маркеров у любого, выбранного наугад человека, принадлежащего этой популяции. Такое отношение вероятностей получило название индекса отцовства (paternity index – PI).
При расчетах PI возникает еще одна проблема, связанная с определением вероятности (X) того, что обследуемый мужчина является отцом. Значение такой вероятности необходимо иметь до проведения каких-либо диагностических тестов. Обычно используемое значение 0,5 нельзя считать достаточно обоснованным во всех конкретных случаях. К счастью, при очень больших значениях PI (>104), которые обычно получаются при таких исследованиях ДНК, выбор этой исходной вероятности оказывается практически несущественным. Как правило, это получается вследствие низких значений вероятности Y.
Определение отцовства с использованием олигонуклеотидных зондов, специфичных в отношении нескольких VNTR-локусов.В 1985 г. И.О. Джеффрисом и соавторами впервые было показано, что олигонуклеотидные зонды, комплементарные последовательностям миоглобинового гена человека, одновременно обладают способностью гибридизоваться по Саузерну с множественными локусами минисателлитной ДНК. Профили гибридизации оказались специфичными для отдельных индивидуумов. Совокупность электрофоретически разделяющихся рестрикционных фрагментов анализируемой ДНК, выявляемых после проведения гибридизации с мечеными зондами, которые специфичны в отношении полиморфных минисателлитных локусов, получила название ДНК-фингерпринтов, или генетических отпечатков пальцев. С помощью таких и других аналогичных олигонуклеотидных зондов удается выявлять на одной электрофореграмме до 15–20 различных фрагментов ДНК одного индивидуума, молекулярная масса которых превышает 3,5 т.п.о., а также много более мелких фрагментов, которые не учитываются при определении отцовства этим методом.

Рис. II.36. Примеры исключения и доказательства отцовства с помощью ДНК-типирования
Результаты гибридизации по Саузерну с зондом F10 показывают полную идентичность фрагментов ДНК у ребенка и отца (дорожки 2 и 3), что рассматривается как доказательство отцовства, либо выявляют, по крайней мере, 6 дополнительных фрагментов ДНК у ребенка, обозначенных стрелками, которые отсутствуют у отца (дорожки 5 и 6 – исключение отцовства)
На рис. II.36 показаны результаты одного из таких опытов. Интерпретация ДНК-фингерпринтов, полученных при анализе множественных локусов, основана на трех постулатах. Прежде всего, предполагается, что фрагменты ДНК, видимые на фингерпринтах, являются аллельными продуктами отдельных генетических локусов человека и передаются потомству независимо друг от друга. Во-вторых, считается, что для каждого генетического локуса частоты встречаемости в популяции отдельных аллелей следуют нормальному распределению Пуассона. И, наконец, принимается, что фрагменты ДНК, электрофоретическая подвижность которых совпадает, представляют один и тот же аллель конкретного локуса. Накопленный опыт работы с ДНК-фингерпринтами показывает, что первое допущение соблюдается достаточно хорошо: аллелизм (парность гомологичных генов, определяющих разные фенотипические признаки у диплоидных организмов) и генетическое сцепление между исследуемыми локусами наблюдаются редко. Невыполнение второго предположения не сказывается серьезно на результатах тестирования, поскольку выводы делаются без учета частоты встречаемости отдельного аллеля на основе совпадения структуры (фрагментов ДНК) многих локусов. Третий постулат является более спорным, однако его применение придает значениям индекса отцовства стабильность.
С этими исходными условиями статистическая оценка ДНК-фингерпринтов множественных локусов основывается только на одном параметре: средней доле фрагментов ДНК (x), которые совпадают у людей без родственных связей. Такой параметр в большей степени зависит от техники лабораторных исследований, чем от свойств обследуемой популяции. Это прежде всего способность используемой системы к электрофоретическому разделению индивидуальных фрагментов ДНК (т.е. разрешающая способность используемого метода), принципы выбора конкретных фрагментов ДНК для анализа, а также критерии принятия решения об идентичности сравниваемых фрагментов ДНК. Следовательно, параметр x может варьировать при сравнении результатов, получаемых в разных лабораториях, но эти различия будут постоянно сохраняться для различных популяций и субпопуляций. Действительно, при использовании, например зондов 33.6 и 33.15, оказалось, что x один и тот же у неродственных индивидуумов, в парах муж–жена и в различных этнических группах.
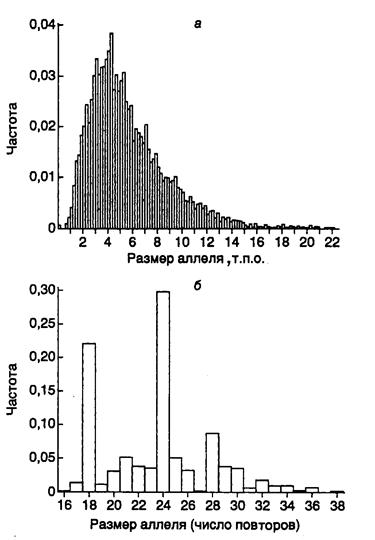
Рис. II.37. Сравнение информативности двух минисателлитных зондов при идентификации личности
Частоты встречаемости минисателлитных локусов D1S7 (а) и D1S80 (б) определенного размера в популяции оценивали гибридизацией по Саузерну после расщепления ДНК рестриктазой HaeIII (а) или ПЦР (б). Для локуса D1S7 характерно квази-непрерывное унимодальное распределение, тогда как локус D1S80 характеризуется меньшей гетерозиготностью (84%) с небольшим числом дискретных аллелей, для которых характерно мультимодальное распределение
Определение отцовства с использованием ДНК-зондов, специфичных в отношении только одного локуса. ДНК-фингерпринты, получаемые при одновременном исследовании многих локусов, отражают скорее фенотип индивидуума, чем его генотип. Действительно, получаемая в итоге картина заключает в себе множество полос ДНК, в том числе и неразделившиеся, а также слабо разделившиеся фракции. Такая электрофореграмма напоминает сложный фенотипический признак, например форму лица человека, которая является результатом экспрессии громадного числа генов. В отличие от этого с помощью ДНК-зондов, представляющих собой клонированные последовательности минисателлитов и взаимодействующих только с одним локусом, можно получать истинную информацию о генотипе изучаемого организма. Таким образом, имея дело с отдельными полиморфными локусами человека, исследователи получают в свои руки систему кодоминантных аллелей (т.е. аллелей, совместно участвующих в формировании фенотипических признаков), наследуемых по законам Менделя. Именно понимание наследования таких минисателлитных локусов и привело к широкому распространению однолокусного метода определения отцовства.
В настоящее время получены сотни клонов минисателлитной ДНК и на их основе разработаны комбинации зондов, пригодные для определения отцовства. При выборе зондов для таких минисателлитных локусов обычно руководствуются следующими критериями: зонды должны обладать строгой локус-специфичностью, а тестируемые локусы быть несцепленными (передаваться потомству независимо друг от друга) и обладать достаточной, но не чрезмерной генетической стабильностью. В частности, среди наиболее широко используемых зондов MS1 (D1S7) соответствует генетическому локусу, гетерозиготному в 99% случаев, однако он мутирует с очень высокой частотой (0,05 на гамету) и поэтому, несмотря на высокую информативность, не используется при определении отцовства (рис. II.37,а). В то же время для локуса D1S80 со значительно меньшей вариабельностью (84% гетерозигот) характерно образование кластеров в частотах распределения фрагмента ДНК по длине (см. рис. II.37,б). Поэтому небольшие ошибки в определении длины аллелей могут привести к значительным ошибкам в оценке частоты их встречаемости. Такие локусы достаточно легко изменяются в результате генетического дрейфа и инбридинга.
В настоящее время разработана теория, указывающая на то, сколько локусов должно быть типировано для получения правильного ответа об отцовстве при известных значениях гетерозиготности этих локусов в популяции. Например, если используются локусы, гетерозиготность которых составляет 90%, для установления отцовства необходимо проанализировать шесть таких локусов. В США в настоящее время для этих целей обычно используется набор из трех–пяти однолокусных зондов. Однолокусные зонды обладают низкой разрешающей способностью относительно братьев и сестер (сибсов). В частности, с помощью одного такого зонда можно лишь с вероятностью 75% обнаружить генетические различия между сибсами, и эта вероятность увеличивается до 99,6% при использовании четырех зондов. Данный факт приобретает особую важность, когда при определении отцовства необходимо сделать выбор между братьями.
Особенности определения отцовства по отдельным локусам с использованием ПЦР. В качестве альтернативы однолокусным зондам в последнее время для определения отцовства часто используют ПЦР. Отдельные мини- и микросателлитные локусы могут быть амплифицированы с помощью праймеров, комплементарных уникальным последовательностям ДНК, фланкирующим эти повторяющиеся последовательности. При идентификации личности метод ПЦР, который по своей сути является одной из разновидностей однолокусной методики, поскольку имеет дело с отдельными локусами, обладает, по крайней мере, двумя преимуществами перед однолокусными зондами. Во-первых, популяционный полиморфизм длин ДНК аллелей, исследуемых с использованием этого метода, носит более дискретный характер, чем у аллелей, изучаемых с помощью однолокусных зондов (см. рис. II.37,а,б). Это обстоятельство облегчает последующее вычисление индекса отцовства. Во-вторых, метод ПЦР обладает гораздо большей чувствительностью и может быть использован при анализе образцов, содержащих <1 нг геномной ДНК и полученных из разных источников (см. раздел 11.1.1).
К недостаткам ПЦР в применении к определению отцовства следует отнести низкую информативность полиморфных микросателлитов и коротких минисателлитов. Это связано с тем, что они обладают <90% гетерозиготности, небольшим числом аллелей и имеют тенденцию к образованию кластеров по размерам (см. рис. II.37,б). Кроме того, на распределение таких последовательностей в геноме оказывают влияние инбридинг и принадлежность индивидуумов к определенным этническим группам. Количество локусов минисателлитов, которое необходимо исследовать методом ПЦР для определения отцовства, приближается к 11, а микросателлитов – к 18.
Для типирования с помощью ПЦР наиболее часто используются три минисателлитных локуса человека: в гене аполипопротеина B (APOB), D17S5 (известный также как локус D17S30) и D1S80. Все три локуса легко амплифицируются (максимальный размер их аллельных вариантов не превышает 1 т.п.о.) и легко обнаруживаются с помощью электрофореза. Однако для них характерны низкий уровень гетерозиготности и малая изменчивость (что выражается в небольшом числе известных аллелей). Мутации в этих микросателлитах возникают очень редко.
Одним из путей повышения информативности полиморфизмов микросателлитов при ДНК-типировании является одновременная амплификация двух тесно сцепленных микросателлитных локусов, сочетания которых формируют множество гаплотипов. Например, одновременная амплификация двух GATA-повторов, локализованных в интроне 40 гена фактора фон Виллебранда, которые разделены последовательностью длиной в 212 п.о., обнаружила суммарный уровень гетерозиготности объединенного локуса ~93%. При этом уровни гетерозиготности индивидуальных локусов составляли лишь 72 и 78% соответственно.
В заключение необходимо еще раз отметить, что по своей логике современные методы определения отцовства, основанные на ДНК-типировании, несколько противоречивы. Если отрицательное заключение об отцовстве, основанное на несовпадении аллелей анализируемых мини- или микросателлитных локусов, абсолютно и не подлежит сомнению, то положительный вывод может быть сделан лишь с некоторой долей вероятности, которая основана на частоте встречаемости конкретных аллелей анализируемых локусов в популяции. С другой стороны, в результате методических ошибок легко могут быть сделаны ложноотрицательные выводы, однако положительное заключение об отцовстве в результате лабораторной методической ошибки практически исключено.
Высокая информативность многолокусных ДНК-фингерпринтов подтверждена большим числом генетических и популяционных исследований. Эмпирические данные, полученные при обследовании тысяч семей, показали, что с помощью многолокусных зондов можно разрешать все спорные случаи отцовства. Использование однолокусных зондов затруднено невозможностью создания полной классификации соответствующих аллелей в популяции из-за кажущегося непрерывного распределения их по размерам. Однако и в этом случае на практике проблема полностью решается с помощью набора из пяти–шести однолокусных зондов. Применение ПЦР ограничивается большой эволюционной консервативностью амплифицируемых мини- и микросателлитных локусов и, как следствие, малым суммарным числом аллелей. Однако ПЦР бывает очень полезна на первых этапах исследования из-за методической простоты постановки опытов, особенно в условиях малой доступности исходного биологического материала. Все три группы методов хорошо дополняют друг друга и в разных сочетаниях в спорных случаях позволяют однозначно идентифицировать личность человека.
Микроматрицы и микрочипы ДНК
Методы создания микроматриц ДНК

Рис. II.38. Комбинаторный синтез олигонуклеотидов, иммобилизованных на твердой подложке
Последовательно предотвращая снятие защитных групп на определенных участках микроматриц (заливка серым цветом) удается соединять четыре нуклеотида во всех возможных комбинациях. В данном примере за 12 (4 х 3) стадий синтеза синтезированы все возможные (34 = 81) тримеры олигонуклеотидов
Для нанесения нуклеиновых кислот на поверхность подложки в основном используют три подхода: короткие олигонуклеотиды синтезируют прямо на ее поверхности, а также прикрепляют к ней предварительно полученные фрагменты ДНК ковалентными или нековалентными связями.
Во время синтеза олигонуклеотидов непосредственно на поверхности стекла применяют те же реагенты и проходят те же стадии, что и при обычном твердофазном синтезе в современных автоматических синтезаторах. В наиболее распространенном варианте при создании микроматрицы используют фотолитографическую маску, которая избирательно закрывает от света и оставляет открытыми участки микроматрицы с синтезируемыми олигонуклеотидами, содержащими чувствительные к облучению светом защитные химические группы. На каждом этапе синтеза маску, которая на схеме обозначена серыми прямоугольниками, помещают над большей частью микроматрицы, а остающиеся открытыми химические группы активируют светом. Затем происходит соединение 5’-гидроксильных групп фосфорамидитных производных добавляемого нуклеотида с активированным сегментом микроматрицы.
Защищая поверхность микроматрицы от света дискретными участками в различных простых комбинациях, удается синтезировать, как это показано на схеме (рис. II.38), за 4·3 = 12 отдельных этапов все теоретически возможные последовательности тринуклеотидов в количестве 34 = 81. В общем случае для синтеза всех возможных последовательностей длиной в N нуклеотидов требуется 4N синтетических стадии. Длина цепи олигонуклеотида, который может быть синтезирован на микроматрице, лимитируется выходом готового продукта на каждой стадии, который составляет ~95%. Так, суммарный выход 25-звенного олигонуклеотида будет составлять всего ~(0,95)25 = 28%. В этой связи рассмотренный метод обычно используют для синтеза олигонуклеотидов, длина которых не превышает 20–25 оснований.
При альтернативном подходе микроматрицы олигонуклеотидов синтезируют на подложке с использованием технологии струйных принтеров. В этом случае головка принтера движется вдоль подложки и, в соответствии с заложенной программой, наносит на необходимые участки небольшие количества раствора с фосфорамидитными производными нуклеотидов из индивидуальных резервуаров. Этапы снятия защитных групп и промывания производятся так же, как и при обычном твердофазном синтезе олигонуклеотидов. Эффективность каждого этапа синтеза в этом случае может превышать 99%, что позволяет синтезировать олигонуклеотиды длиной до 40 оснований с суммарным выходом ~67% (40 этапов с выходом 99% на этап).
Еще одной разновидностью методов создания микроматриц является синтез индивидуальных олигонуклеотидов, их очистка и нанесение с помощью микроробота на поверхность подложки с адгезивным покрытием. Однако создание этим способом микроматриц, содержащих тысячи индивидуальных элементов, – очень трудоемкий процесс.
При конструировании микроматриц, элементы которых содержат индивидуальные кДНК, для нанесения на подложку микропятен чаще всего используют микророботы. В этом случае применяют растворы рекомбинантных кДНК длиной 0,5–1,0 т.п.о., очищенных из бактериальных клеток, которые перед применением как правило, амплифицируют с помощью ПЦР. Поверхность стеклянной подложки покрывают тонким слоем полилизина или обрабатывают аминосиланом с целью создания на ней положительного заряда, что обеспечивает возможность электростатического взаимодействия подложки с отрицательно заряженными молекулами кДНК. Недостатком этого способа является неспецифичность электростатических взаимодействий, в которые вовлечены многие участки кДНК, что уменьшает эффективность взаимодействия кДНК с последовательностями анализируемых образцов. Для преодоления этих затруднений с помощью асимметричной ПЦР синтезируют производные кДНК, которые далее ковалентно соединяют с сиалированным стеклом с помощью боргидрида.
Разрабатываются и альтернативные конфигурации микроматриц, в которых на поверхности стекла фиксируют сами фрагменты ДНК, анализируемой с помощью олигонуклеотидных зондов. Такой подход был использован, в частности для поиска мутаций в гене белка p53. Дальнейшим расширением этого подхода является нанесение на поверхность стекла кусочков тканей с последующим анализом содержащихся в них ДНК или РНК гибридизацией in situ.
Ограничения в использовании микроматриц ДНК
Кинетика гибридизации. Гибридизация в гетерогенных смесях нуклеиновых кислот происходит медленно. При использовании олигонуклеотидов в качестве… Поскольку концентрация зондов в гибридизационных смесях ограничена их… Чувствительность метода. Чувствительность метода специфического обнаружения последовательностей ДНК с использованием…Использование микроматриц ДНК в фундаментальных и прикладных исследованиях
Исследование генетического полиморфизма ДНК. Более информативными оказываются результаты использования микроматриц ДНК для оценки генетического… Такого рода результаты дали возможность разработки на основе микроматриц ДНК… Исследование экспрессии генов с использованием микроматриц ДНК. Технология микрочипов ДНК позволяет осуществлять…Глава 12. КАРТИРОВАНИЕ И ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ГЕНОМА ЧЕЛОВЕКА
После краткого рассмотрения основных методов, наиболее часто используемых в молекулярной генетике для исследования структуры и механизмов функционирования генов, представляется целесообразным на примере генома человека подробнее познакомиться с практическим применением этих методов и их модификаций для изучения больших геномов. В целях всестороннего исследования генома человека, этого колоссального по объему хранилища его генетической информации, недавно была разработана и воплощается в жизнь специальная международная программа "Геном человека" ("Human Genome Project"). Основной задачей программы является построение исчерпывающих генетических карт большого разрешения каждой из 24 хромосом человека, которое, в конечном счете, должно завершиться определением полной первичной структуры ДНК этих хромосом. В настоящее время работы по проекту идут полным ходом. В случае успешного его завершения (а это по планам должно произойти в 2003 г.) у человечества появятся перспективы досконального изучения функциональной значимости и механизмов функционирования каждого из его генов, а также генетических механизмов, управляющих биологией человека, и установления причин большинства патологических состояний его организма.
Основные подходы к картированию генома человека
Генетические карты сцепления
При образовании половых клеток (гамет) у животных и растений на стадии мейоза, как правило, происходит синапсис (конъюгация) гомологичных хромосом.… Генетические карты сцепления правильно отражают порядок расположения… Таблица II.4Современные методы построения генетических карт сцепления
Гибридизация in situ. Метод гибридизации in situ также широко используется для картирования последовательностей нуклеотидов на хромосомах. С этой… Семейный генетический анализ сцепления. Эта группа методов часто используется… Определение эффекта дозы гена и использование хромосомных аберраций. Этими методами обнаруживают корреляции между…ПЦР в исследованиях генома человека
Концепция STS. Одной из ключевых концепций, лежащих в основе картирования генов человека в рамках обсуждаемой программы, является концепция сайтов,… Alu-ПЦР. Диспергированные повторяющиеся Alu-последовательности характерны… ПЦР активно используется для выявления полиморфных молекулярных маркеров при построении генетических карт сцепления,…Физические карты низкого разрешения
Рис. II.39. Четыре типа генетических карт геномной ДНК и их взаимоотношения
1 – генетическая карта сцепления, 2 – физическая рестрикционная карта, пробелы обозначают места расщепления ДНК рестриктазами, 3 – физическая карта контигов, показаны перекрывающиеся клоны ДНК, полученные с помощью YAC-векторов, 4 – исчерпывающая физическая карта в виде последовательности нуклеотидов ДНК. На всех картах представлен один и тот же участок хромосомы
Хромосомные карты. Хромосомные карты генома человека получают локализацией генетических маркеров на индивидуальных хромосомах с использованием цитогенетических методов, включая авторадиографию и FISH. В последних двух случаях радиоактивная или флуоресцентная метки, ассоциированные с исследуемыми генетическими локусами интактных хромосом, выявляются с помощью световой микроскопии. Еще совсем недавно хромосомные карты позволяли локализовать исследуемый фрагмент ДНК на участке хромосомы протяженностью ~10 м.п.о. Современные методы гибридизации in situ с использованием метафазных хромосом, главным образом, метод FISH, локализуют полинуклеотидные маркеры в пределах 2–5 м.п.о. Более того, при гибридизации in situ с интерфазными хромосомами, в которых генетический материал находится в менее компактной форме, разрешающая способность хромосомных карт приближается к 100 т.п.о.
Точность хромосомных карт повышается и с использованием современных генетических методов. Например, способность ПЦР амплифицировать сегменты ДНК единичного сперматозоида позволяет исследовать большое число мейозов, как бы законсервированных в отдельных образцах спермы. В результате появляется возможность проверки взаимного расположения генетических маркеров, локализованных на хромосомных картах более грубыми методами.
Карты кДНК. Карты кДНК отражают положение экспрессирующихся участков ДНК (экзонов) относительно известных цитогенетических маркеров (бэндов) на метафазных хромосомах. Поскольку такие карты дают представление о локализации транскрибирующихся участков генома, в том числе и генов с неизвестными функциями, они могут быть использованы для поиска новых генов. Этот подход особенно полезен при поиске генов, повреждения которых вызывают заболевания человека, в том случае если приблизительная локализация таких участков хромосом уже предварительно проведена на генетических картах сцепления в результате семейного генетического анализа.
Физические карты высокого разрешения
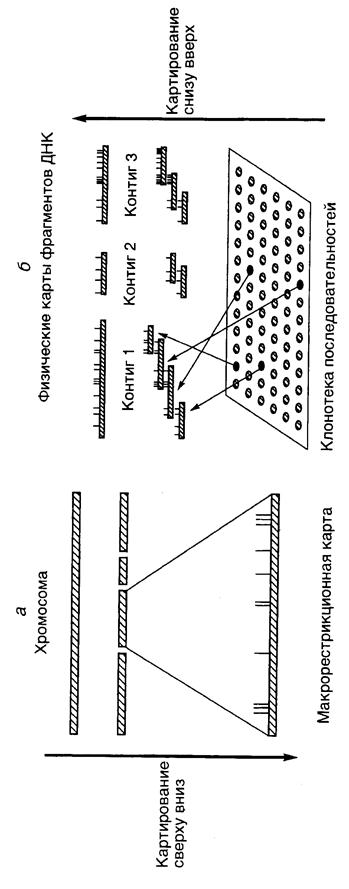
Рис. II.40. Две стратегии построения физических карт ДНК
а – стратегия "сверху вниз": ДНК целой хромосомы расщепляется крупнощепящими рестриктазами, для каждого из индивидуальных фрагментов ДНК строится рестрикционная карта; б – стратегия "снизу вверх", индивидуальные YAC-клоны после идентификации объединяются в контиги
В попытках построения карт генома человека высокого разрешения экспериментально реализуются два альтернативных подхода, получивших названия картирования сверху вниз (top-down mapping) и картирования снизу вверх (bottom-up mapping). При картировании сверху вниз (рис. II.40,а) исходным в анализе является препарат ДНК индивидуальной хромосомы человека. ДНК разрезается крупнощепящими рестриктазами (например NotI) на длинные фрагменты, которые после разделения электрофорезом в импульсном электрическом поле подвергаются дальнейшему рестрикционному анализу с другими рестриктазами. В результате получают макрорестрикционную карту, на которой достаточно полно представлены все последовательности исследуемой хромосомы или ее части, однако ее разрешение невысоко. На такой карте очень трудно локализовать индивидуальные гены. К тому же каждая индивидуальная карта редко охватывает протяженные сегменты ДНК (как правило, не более 1–10 м.п.о.).
При картировании генома человека снизу вверх (см. рис. II.40,б) на основе препарата суммарной ДНК генома или индивидуальной хромосомы получают серию случайных клонов протяженных последовательностей ДНК (10–1000 т.п.о), часть из которых перекрывается друг с другом. В качестве вектора для клонирования в этом случае часто используют искусственные минихромосомы бактерий (BAC) или дрожжей (YAC), подробно описанные в разделе 7.2.4. Серия частично перекрывающихся и дополняющих друг друга клонов образует непрерывную состыкованную (contiguous) последовательность нуклеотидов ДНК, получившую название контига (contig). Правильность полученных контигов подтверждают гибридизацией in situ (FISH) с одновременной их привязкой к определенным участкам исследуемых хромосом. Карты, основанные на контигах, представляют полную информацию о структуре отдельных сегментов хромосом и позволяют локализовать отдельные гены. Однако такие карты трудно применять для реконструкции целых хромосом или протяженных их участков из-за отсутствия соответствующих клонов в имеющихся клонотеках генов.
Основная проблема, которую приходится решать при использовании обоих подходов к построению физических карт высокого разрешения, – объединение разрозненных фрагментов ДНК в непрерывные последовательности нуклеотидов. Чаще всего для этого применяют специальные клонированные фрагменты ДНК, получившие название связующих (linking) клонов. Фрагменты ДНК из связующих клонов содержат в своих внутренних частях последовательности нуклеотидов крупнощепящих рестриктаз и, следовательно, представляют собой места стыковки фрагментов ДНК, используемых на первых этапах физического картирования. Гибридизацией по Саузерну, при проведении которой в качестве зондов используют фрагменты ДНК связующих клонов, определяют фрагменты ДНК физических карт, содержащие последовательности нуклеотидов окрестностей сайтов рестрикции крупнощепящих рестриктаз. Если два таких фрагмента найдены, то соответствующий связующий клон перекрывает оба этих фрагмента и является их частью. Связующие клоны, в свою очередь, отбирают из клонотек генов с помощью зондов, которые представляют собой последовательности нуклеотидов сайтов рестрикции крупнощепящих рестриктаз.
Определение полной первичной структуры ДНК генома человека
Опубликованные одновременно в 1977 г. методы секвенирования ДНК А. Максама и У. Гилберта, а также Ф. Сенгера сделали процесс определения первичной…Базы данных получаемой информации
По мере накопления информации о последовательностях нуклеотидов различных частей генома человека на первое место будут выходить задачи по… Крупнейшей базой данных по структуре генома человека в настоящее время… Четыре другие базы данных хранят все известные последовательности нуклеотидов, включая последовательности нуклеотидов…ЗАКЛЮЧЕНИЕ
Геномика. Конец 1990-х годов отмечен определением полной первичной структуры геномов нескольких организмов. В настоящее время уже имеются полные… Базы данных последовательностей нуклеотидов целых геномов дают возможность… Экспрессией генов управляют большие надмолекулярные комплексы. Определение функций продуктов новых генов на основе их…Случайность и необходимость генетических изменений.
Случайность и необходимость в экспрессии генов.
Конечный результат экспрессии генов предопределен.
Большинство физиологических моделей, в которых делается попытка описания регуляторных воздействий на промежуточные или…РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
К введению
Barbieri M. The organic codes. The basic mechanism of macroevolution. // Biology Forum. 1998. Vol. 91. P. 481–514.
К главе 1
Георгиев Г.П. Гены высших организмов и их экспрессия. М.: Наука, 1989. 254 с. Георгиев Г.П., Бакаев В.В. Три уровня структурной организации хромосом… Глазков М.В. Петельно-доменная организация генов в эукариотических хромосомах // Там же. 1995. Т.29. С. 965–982.К главе 2
Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С. Спирина. М.: Высш. шк. 1990. 352 с. Спирин А.С. Молекулярная биология. Структура рибосомы и биосинтез белка. М.:… Chakraburtty K. Functional interaction of yeast elongation factor 3 with yeast ribosomes // Intern. J. Biochem. Cell…К главе 3
Жимулев И.Ф. Гетерохроматин и эффект положения гена. Новосибирск: Наука, 1993. 491 с. Льюин Б. Гены. М.: Мир, 1987. 544 с. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С. Спирина. М. Высш. шк., 1990. 352 с. …К главе 4
Bell S.P. Eukaryotic replicators and associated protein complexes // Curr. Opinion Genet. Develop. 1995. Vol. 5. P. 162–167. Cesareni G., Heimer-Citterich M., Сastagnoli L. Control of ColE1 plasmid… Chen C.W. Complications and implications of linear bacterial chromosomes // Trends Genet. 1996. Vol. 12. P. 192–196. …К главе 5
Ауэрбах Ш. Проблемы мутагенеза. М.: Мир, 1978. 463 с. DNA repair. A special issue. // Trends Biochem. Sci. 1995. Vol. 20. P.… Friedberg E.C., Gerlach V.L. Novel DNA polymerases offer clues to the molecular basis of mutagenesis // Cell. 1999.…К главе 6
Хесин Р.Б. Непостоянство генома. М.: Наука, 1984. 472 с.
Chun J., Schatz D.G. Developmental neurobiology: Alternative ends for a familiar story? // Curr. Biol. 1999. Vol. 9. R251–R253.
К главе 7
Рыбчин В.Н. Основы генетической инженерии. СПб.: СПбГТУ, 1999. 521 с. Шабарова З.А., Богданов А.А., Золотухин А.С. Химические основы генетической… Bohl D., Heard J.-M. Transcriptional modulation of foreign gene expression in engineering somatic tissues // Cell.…К главе 8
Chang T.K., Jackson D.Y., Burnier J.P. et al. Subtiligase: a tool for semisynthesis of proteins // Proc. Nat. Acad. Sci. US. 1994. Vol. 91. P.… Houghten R.A. Peptide libraries: Criteria and trends // Trends Genet. 1993.… Jackson D.Y., Burnier J., Quan C. et al. A designed peptide ligase for total synthesis of ribonuclease A with…К главе 9
Crooke S.T. Progress in antisense therapeutics // Med. Res. Rev. 1996. Vol. 16. P. 319–344. Dolnick B.J. Naturally occurring antisense RNA // Pharmacol. Ther. 1997. Vol.… Famulok M. Oligonucleotide aptamers that recognize small molecules // Curr. Opinion Struct. Biol. 1999. Vol. 9. P.…К главе 10
Свердлов Е.Д. Очерки современной молекулярной генетики по курсу лекций для студентов биологического факультета МГУ. Очерк 5. Трансгеноз и новая… Свердлов Е.Д. Очерки современной молекулярной генетики по курсу лекций для… Altaner C. Gene therapy for cancer (present status) // Neoplasma. 1995. Vol. 42. P. 209–213.К главе 11
Graber J.H., O'Donnell M.J., Smith C.L., Cantor C.R. Advances in DNA diagnostics // Curr. Opinion Biotechnol. 1998. Vol. 9. 14–18. Jeffreys A.J., MacLeod A., Tamaki K. et al. Minisatellite repeat coding as… Nuwaysir E.F., Bittner M., Trent J., Barret C., Afshary C.A. Microarrays and toxicology: The advent of toxicogenomics…К главе 12
Billings P.R., Smith C.L., Cantor C.L. New techniques for physical mapping of the human genome // FASEB J. 1991. Vol. 5. P. 28–34. Burge C.B., Karlin S. Finding the genes in genomic DNA // Curr. Opinion… Clark M.S. Comparative genomics: The key to understanding the Human Genome Project // BioEssays. 1999. Vol. 21. P.…– Конец работы –
Используемые теги: экспрессия, генов0.028
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Экспрессия генов
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов