Гальванические элементы
1. Гальванические элементы
В окислительно-восстановительных реакциях происходит переход электронов от одних атомов или ионов к другим, при этом химическая энергия превращается в тепловую.
Гальваническим элементом называется прибор, в котором происходит превращение химической энергии в электрическую за счет окислительно-восстановительной реакции, при отсутствии непосредственного контакта между веществами и переход электронов осуществляется с помощью металлического проводника.
Механизм гальванического элемента связан со структурой металла, в узлах кристаллической решетки которой находятся ионы. При погружении металла в воду, ионы, имеющиеся на поверхности, гидратируются полярными молекулами воды и переходят из пластинки в раствор, оставляя на пластинке электроны, которые заряжают ее отрицательно. Вследствие электростатического притяжения, ионы цинка из раствора притягиваются к цинковой пластинке, что препятствует дальнейшему переходу ионов цинка в раствор, устанавливается подвижное равновесие и образуется двойной электрический слой (ДЭС). Скачок потенциала, возникающий на границе между металлом и раствором, называется электродным потенциалом.Чем активнее металл, тем больше ионов переходит в раствор и тем больше величина отрицательного заряда. Так как цинковая пластинка заряжается отрицательно, то такой электродный потенциал считается отрицательным.
На медном электроде происходит иное явление: энергия электронно-ионной связи в медной пластинке больше, чем в цинке, поэтому катионы меди переходят из раствора на пластинку в большем количестве, чем с поверхности металла в раствор, и медная пластинка заражается менее отрицательно, чем цинковая, а прилегающий к ней слой жидкости отрицательно. Такой электродный потенциал считается положительным.
Электродом гальванического элемента называется система, состоящая из металла, погруженного в раствор ионов этого же металла.
адсорбируются на пластинке и электроны, имеющиеся в избытке на цинковой пластинке пойдут от цинковой пластинки к медной, в результате чего возникнет… Электрод, на котором идет процесс окисления (отдача электронов),… Гальванические элементы изображаются в виде схем:Ряд металлов, расположенный в порядке возрастания электродных потенциалов, называется рядом напряжения.
1. Чем меньше значение электродного потенциала, тем активнее металл, больше восстановительная способность атомов и меньше окислительная способность… - Каждый предыдущий металл вытесняет все следующие за ним из водных растворов…При 250С: е = е0 + 0.059/n. lq C.
2. Электролиз
Электролизомназывается окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита. Этот процесс сопровождается превращением электрической энергии в химическую, то есть за счет электрической энергии осуществляется химическая реакция восстановления на катоде и окисления на аноде; при этом катод отдает электроны катионам, а анод принимает электроны от анионов.
Для проведения электролиза используется электролизер: электроды погружают в раствор электролита и соединяют с источником постоянного тока.
2.1 Электролиз расплава
Если в расплав хлорида калия погрузить угольные электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы калия K+ - к отрицательно-заряженному катоду, анионы Cl - к положительно-заряженному аноду:

2.2 Электролиз раствора
Электролиз раствора более сложен, т.к. в нем принимают участие молекулы воды.
КАТОДНЫЙ ПРОЦЕСС. Возможны три случая.
1. Катионы металлов, расположенные в ряду напряжений от лития до алюминия (Li+ - Al3+), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды:
2 H2O + 2 e => H2 + 2 OH-1.
2. Катионы металлов, расположенные в ряду напряжений от алюминия до водорода (Al3+ - 2H+), восстанавливаются на катоде совместно с молекулами воды:
Мn+ + n e => M
H2O + 2 e => H2 + 2 OH-1.
3. Катионы металлов, расположенные в ряду напряжений после
водорода (Сu2+ - Au3+) полностью восстанавливаются на катоде: Мn+ + n e => M.
АНОДНЫЙ ПРОЦЕСС.Характер реакций зависит от присутствия молекул воды и от вещества, из которого сделан анод.
Нерастворимый анод (уголь, графит, платина и др.).
1. Анионы бескислородных кислот (Cl - , Br - , I - , S2-) легко окисляются: 2Cl - 2 e => Cl2
S2 - 2 e => S0.
- Анионы кислородсодержащих кислот (SO42-, NO3-, PO43-, CO32-) на аноде не окисляются, вместо них окисляются молекулы воды:
H2O - 4 e => O2 + 4 H+.элемент
Растворимый анод (изготовляют из металлов: меди, серебра, цинка, кадмия, никеля и других) при электролизе разрушается, то есть переходит в раствор в виде ионов: М0 - n е => Мn+.
Электролиз с растворимым анодом находит широкое применение:
· получение металлов высокой чистоты;
· покрытие одних металлов слоем других металлов (гальваностегия);
· получение рельефных изображений, точных металлических копий с различных предметов (гальванопластика).
ПРИМЕР 2.1Электролиз расплава хлорида меди.
СuCl2 => Cu2+ + 2 Cl -
(-) Катод (С) Cu2+ + 2 e => Cu
(+) Анод (С) 2 Cl - 2 e => Cl2

ПРИМЕР 2.2Электролиз раствора хлорида меди с угольными электродами.
СuCl2 => Cu2+ + 2 Cl -
H2O
(-) Катод (С) Cu2+ + 2 e => Cu
(+) Анод (С) 2 Cl - 2 e => Cl2

ПРИМЕР 2.3Электролиз раствора хлорида меди с медным анодом.
СuCl2 => Cu2+ + 2 Cl -
H2O
(-) Катод (Cu) Cu2+ + 2 e => Cu
(+) Анод (Cu) Сu0 - 2 е => Cu2+.
ПРИМЕР 2.4Электролиз раствора сульфата цинка с платиновыми электродами. ZnSO4 => Zn2+ + SO42-
H2O
(-) Катод (Pt) Zn2+ + 2 e => Zn
H2O + 2 e => H2 + 2 OH-1
(+) Анод (Pt) 2 H2O - 4 e => O2 + 4 H+
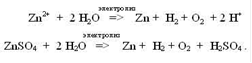
ПРИМЕР 2.5Электролиз сульфата цинка с цинковым анодом.
ZnSO4 => Zn2+ + SO42-2O
(-) Катод (Zn) Zn2+ + 2 e => Zn
(+) Анод (Zn) Zn - 2 e => Zn2+.
ПРИМЕР 2.6Электролиз сульфата калия с угольными электродами.
К2 SO4 => 2 К + + SO42-
H2O
(-) Катод (С) 2 H2O + 2 e => H2 + 2 OH-1.
(+) Анод (С) 2 H2O - 4 e => O2 + 4 H+

ПРИМЕР 2.7Электролиз сульфата калия с цинковыми электродами.

2.3 Законы электролиза (законы Фарадея)
Количество вещества (m), восстановленного на катоде и окисленного на аноде, пропорционально количеству прошедшего электричества(Q)и химическому эквиваленту (Э):

где F=96500 кулон (постоянная Фарадея).
Зная, что Q = I. t, где I - сила тока, t -время прохождения тока, можно записать:

ПРИМЕР 2.8Ток силой 10 ампер пропускали через раствор сульфата меди 2 часа. Определить массу выделившегося металла.

3. Химические источники тока
В принципе для получения электрической энергии можно использовать любую окислительно-восстановительную реакцию. Для этого надо разделить процессы окисления и восстановления и провести их отдельно на электродах.
Устройства, вырабатывающие электрический ток за счет энергии окислительно-восстановительной реакции, называются химическими источниками тока.
Простейшим примером химического источника тока может служить медно-цинковый гальванический элемент Даниэля-Якоби. В других широко применяемых гальванических элементах используются не два электролита, как в медно-цинковом, а один, что удобнее в эксплуатации. Эти элементы относятся к первичным источникам тока, так как они предназначены для одноразового использования (или в несколько приемов). После разряда такие элементы к дальнейшей работе непригодны.
Вторичные химические источники тока допускают многократное их использование - аккумуляторы.Они характеризуются обратимостью: после разрядки их работоспособность может быть восстановлена пропусканием тока от внешнего источника в обратном направлении (электролиз).
Аккумуляторы -приборы, которые служат для накопления химической энергии, превращающейся по мере необходимости в электрическую.
Превратив с помощью электролиза электрическую энергию в химическую, можно получить эту энергию обратно, если использовать элемент в качестве гальванического. Анод аккумулятора при разряде служит катодом при зарядке. Аккумуляторы бывают кислотные и щелочные.
3.1 Свинцовый (кислотный) аккумулятор
Свинцовый (кислотный) аккумулятор состоит из свинцовых пластин в виде решеток или рам с ребристой поверхностью. Отверстие в пластинах заполнено пастой из оксида свинца PbO и воды. Эти электроды опускаются в раствор 30-35 % серной кислоты H2SO4 c плотностью 1.25 - 1.30 г/мл. Концентрация кислоты может изменятся в зависимости от условий работы, Например, у аккумуляторов, применяемых в автомобилях эта концентрация зимой больше, чем летом. При этом происходит реакция:
PbO + H2SO4 => PbSO4 ↓ + H2O
Образующийся сульфат свинца PbSO4 нерастворим и остается на поверхности электрода.
К (-) PbSO4 + 2 е => Pb0 + SO42 - на катоде образуется губчатый свинец Pb и концентрация кислоты увеличивается. А (+) PbSO4 + SO42 - 2 е => Pb (SO42-) 2. Образующаяся на аноде соль Pb… Pb (SO42-) 2 + 4 H2O => Pb (OH) 4 + H2SO4Водородно-кислородный топливный элемент
(-) H2 | KOH | O2 (+) АНОД (-) H2 + 2 OH - 2 e => 2 H2O КАТОД (+) ½ O2 + H2O + 2 e => 2 OH-По механизму протекания коррозионных процессов различают два типа коррозии: химическую и электрохимическую.
Химическая коррозия - это окисление металла в результате непосредственного химического взаимодействия с окружающей средой (которая называется… 1) Газовая - окисление металла кислородом воздуха, сернистым газом,… 2) Жидкостная - коррозия металлов в жидкой среде, не проводящей электрический ток (нефть, бензин, керосин, смазочные…Коррозия с водородной деполяризацией протекает в кислой среде (рН < 7): 2 H+ + 2 e => H20.
2) Коррозия с кислородной деполяризацией протекает в нейтральной (рН = 7) или щелочной среде (рН > 7):
O2 + 2 H2O + 4 e => 4 OH (-).
ПРИМЕР 4.1Коррозия сплава железа и меди в кислой среде.
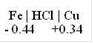
Стандартный электродный потенциал железа ( - 0.44 вольта) меньше стандартного электродного потенциала меди (+ 0.34 вольта), следовательно в данной гальванопаре железо является анодом, а медь - катодом, а т.к. среда кислая (HCl, pH < 7) идет коррозия с водородной деполяризаций: 2 H+ + 2 e => H20.

ПРИМЕР 4.2Коррозия железа во влажном воздухе (атмосферная коррозия).

ПРИМЕР 4.3Коррозия сплава железа и меди в морской воде.
А (-) Fe | NaCl | Сu (+) К(-) Fe - 2 e => Fe2+
K (+) O2 + 2 H2O + 4 e => 4 OH (-)
ПРИМЕР 4.Коррозия сплава железа и меди в щелочной среде.
А (-) Fe | NaОН | Сu (+) К(-) Fe - 2 e => Fe2+
K (+) O2 + 2 H2O + 4 e => 4 OH (-)
4.3 Защита от коррозии
1) Изменение состава среды: удаление вредных примесей (например, удаление кислорода из воды увеличивает срок службы паровых котлов); применение замедлителей кислотной коррозии (ингибиторов).
2) Защитные покрытия: неметаллические (применение эмалей, лаков, красок, полимеров и др.) и металлические (анодное и катодное покрытие). Металлические покрытия часто наносят гальваническим путем. Если потенциал покрытия более отрицателен, чем потенциал защищаемого металла, то покрытие называется анодным, оно защищает металл и в том случае, когда покрытие нарушено. Например, железо покрыто цинком (оцинкованное железо): при нарушении защитного покрытия слой цинка предохраняет железо от коррозии, т. к цинк покрыт снаружи защитной пленкой и при повреждении цинкового защитного слоя в присутствии влаги возникает гальваническая пара железо - цинк, где катодом служит железо, а анодом - цинк; электроны переходят от цинка к железу и связываются молекулами кислорода в присутствии молекул вода (кислородная деполяризация), цинк растворяется, но железо остается защищенным до тех пор, пока не будет разрешен весь слой цинка.

Если потенциал покрытия более положителен, чем потенциал защищаемого металла, то покрытие называется катодным.Например, железо покрыто никелем (никелированное железо): при нарушении катодного покрытия коррозия железа ускоряется (однако покрытие железных изделий никелем, хромом помимо защиты придает им красивый внешний вид):

Т.к. электродный потенциал железа более отрицательный, чем никеля, то железо является анодом, а никель - катодом.

3) Электрохимическая защита: катодная и протекторная.При катодной защите защищаемое сооружение присоединяют к катоду внешнего источника постоянного тока, а в качестве анода используется металлический лом, который и корродирует. Протекторная защита применяется в тех случаях, когда защищаемая конструкция (подземный трубопровод, корпус судна), находящаяся в среде электролита (морская вода, подземные, почвенные воды и т.д.). Сущность ее заключается в том, что конструкцию соединяют с протектором - более активным металлом, чем металл защищаемой конструкции. В качестве протектора при защите стальных изделий обычно используется магний, алюминий, цинк. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя конструкцию от разрушения. По мере разрушения протекторов их заменяют новыми. Например, схема протекторной защиты подземного трубопровода, протектор - цинк:
4)
