рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Что такое константа диссоциации и степень диссоциации.
Реферат Курсовая Конспект
Что такое константа диссоциации и степень диссоциации.
Что такое константа диссоциации и степень диссоциации. - раздел Образование, Основные понятия Константа Диссоциации — Вид Константы Равновесия, Которая Ха...
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когдакомплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.

Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":

числа распавшихся на ионы молекул к общему числу растворенных молекул.
Степень диссоциации 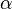 равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул  к сумме
к сумме  , где
, где 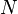 — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто 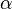 выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
10)как зависит степень диссоциации слабого электролита от константы диссоциации и концентрации его в в водном растворе. Запишем константу равновесия для реакции гидролиза аниона слабой кислоты:


Так как концентрация воды при гидролизе изменяется очень мало, то, принимая ее постоянной и умножая на константу равновесия, получим константу гидролиза Кг:

Умножая числитель и знаменатель на равновесную концентрацию ионов водорода, получаем

Произведение [OH‾][H+] = Kв, а отношение 

является константой диссоциации Кк слабой кислоты НAn.Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Кг = Кв/Кк
Это уравнение показывает, что Кг тем больше, чем меньше константа диссоциации кислоты. Иными словами, чем слабее кислота, тем в большей степени подвергается гидролизу ее соль.
11. Как влияет введение одно- и разноименных ионов на степень диссоциации слабого электролита?
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье.
Прибавление одноименных ионов уменьшает степень диссоциации. Это положение также находится в соответствии с принципом Ле-Шателье.
Добавлением одноименных ионов часто пользуются для более полного выделения малорастворимого вещества.
Прибавление одноименных ионов оказывает влияние на растворимость малорастворимых соединений и способствует более полному осаждению твердой фазы.
12) Ионное произведение воды. Вода является слабым электролитом и диссоциирует по схеме:
2Н2О ↔ Н3О+ + ОН-
Ионы Н+ в воде и водных растворах практически отсутствуют, т.к. равновесие реакции
Н2О + Н+ ↔ Н3О+
полностью смещено влево, обычно реакцию диссоциации воды записывают упрощенно
Н2О ↔ Н+ + ОН-
Константу диссоциации воды можно записать:

В чистой воде концентрации ионов водорода и гидроксида очень малы и вместо активностей можно использовать аналитические концентрации. Диссоциация практически не влияет на концентрацию воды, поэтому

Эта величина носит название ионное произведение воды. При 295 К (22оС) ионное произведение равно точно 10-14.
Диссоциация воды протекает с поглощением тепла, поэтому при повышении температуры КW возрастает Из ур-ния (7.31) следует, что в чистой воде концентрации ионов водорода и гидроксила равны и составляют при 295 К

Такой раствор называют нейтральным. Если  то раствор будет кислым, а если
то раствор будет кислым, а если  то раствор щелочной.
то раствор щелочной.
Для характеристики кислотности среды обычно используют вместо концентрации водородный показатель (рН) – отрицательный десятичный логарифм активности (концентрации) ионов водород:
 (7.32)
(7.32)
При 295 К в нейтральной среде рН=7, в кислой – рН<7, в щелочной - pH>7.
Несколько реже используют гидроксидный покадатель (рОН) отрицательный десятичный логарифм активности (концентрации) ионов гидроксила:
 (7.32а)
(7.32а)
При 295 К в нейтральной среде рОН=7, в кислой – pОH>7, в щелочной - рОН<7.
рН+рОН=14.
Величина рН может контролироваться с помощью приборов (рН-метров) или посредством специальных реактивов, называемых индикаторами. Окраска индикаторов изменяется в зависимости от концентрации ионов водорода. Кислотно-основные индикаторы представляют собой слабые органические кислоты (HInd) или основания (IndOH), диссоциирующие по схемам:
HInd↔H+ + Ind-
IndOH↔Ind+ + OH-
Молекулярная и ионная формы индикаторов имеют разные окраски. При избытке ионов водорода HInd находится преимущественно в молекулярной форме, а IndOH – в ионной, а при избытке ионов гидроксила, наоборот - HInd находится преимущественно в ионной форме, а IndOH –в молекулярной.
Изменение окраски индикатора происходит в некотором интервале рН, называемом интервал перехода индикатора, определяемом величиной рКHind.
13. По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Такой подход известен как бренстедовская кислотность и основность органических соединений или протонная теория кислот и оснований (протолитическая теория): кислота протон + основание.
14) Поведение электролитов в различных по характеру средах. Многосторонние исследования показали, что некоторые вещества, которые ведут себя как кислоты в среде одного растворителя, в другом проявляют себя как основания. Соединения, проявляющие себя как основания в одних средах, ведут себя как кислоты в других; нередко в неводных растворах кислые или основные свойства проявляют также вещества, которые, казалось бы, ничего общего не имеют с кислотами и основаниями в обычном их представлении.
При переходе от амфотерных, или амфипротных. растворителей (каким является вода) к основным или протофильным (какими являются аммиак, этилендиамин и др.), отличающимся склонностью к присоединению протонов, ионизация по типу кислот усиливается, а ионизация по типу оснований уменьшается.
При переходе от амфотерных, или амфипротных, растворителей к кислым или протогенным (какими являются безводная уксусная кислота, жидкий фтористый водород и др.), отличающимся склонностью отдавать свои протоны, усиливается ионизация по типу оснований, а ионизация по типу кислот уменьшается.
Одно и то же вещество может вести себя различно в зависимости от растворителя, в котором оно растворено. Таково, например, поведение мочевины, являющейся кислотой в растворе жидкого аммиака, сильным основанием в среде безводной уксусной кислоты и слабым основанием в водном растворе.
Кислотная сила растворенного вещества значительно увеличивается в сильноосновном растворителе. Чем сильнее основные свойства растворителя, тем сильнее его влияние на слабые кислоты. Все кислоты становятся одинаково сильными в основных растворителях. Например, в среде жидкого аммиака слабая синильная кислота становится столь же сильной, как азотная кислота в водном растворе. Благодаря этому слабые кислоты можно титровать в неводных растворителях.
Равным образом в кислых растворителях наблюдается сильное влияние растворителя на основания. Чем сильнее кислотные свойства растворителя, тем сильнее его влияние на слабые основания. В сильнокислом растворителе основные свойства растворенного вещества значительно увеличиваются. Все основания становятся одинаково сильными в кислых растворителях. Этиловый спирт в среде жидкого фтористого водорода является ясно выраженным основанием и отличается сильноосновными свойствами, а уксусная и муравьиная кислоты, характеризующиеся кислыми свойствами в врдных растворах, проявляют основные свойства в среде жидкого
19. Гидро́лиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Константа гидролиза − константа равновесия обратимой реакции. Зависит от температуры, но не зависит от концентрации раствора
20. Степень гидролиза соли зависит от природы соли, её концентрации и температуры. Усилить или подавить гидролиз можно тремя способами:
1) прибавлением к раствору соли другого гидролизующегося электролита, кислоты или щелочи;
2) изменением концентрации раствора соли;
3) повышением или понижением температуры раствора соли.
21. БУФЕРНЫЙ РАСТВОР, поддерживает при изменении состава среды постоянство значения к.-л. характеристики, напр. рН (кислотно-основной буферный раствор) или окислит.-восстановит. потенциала (окислит.-восстановит. буферный раствор).
Значение рН кислотно-основного буферного раствора зависит от концентраций компонентов буферной смеси, находящихся в хим. равновесии, и мало меняется при концентрировании и разбавлении р-ра, введении относительно небольших кол-в в-в, взаимодействующих с одним из компонентов буферного раствора.
Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы.
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия
Качественный химический анализ Основные понятия Предмет и средства Чувствительность специфичность селективность... Качественный анализ имеет своей целью обнаружение определенных веществ или их... В настоящее время к а выполняют инструментальными методами спектральными хроматографическими электрохимическими и...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Что такое константа диссоциации и степень диссоциации.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов