рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Легкі конструкційні метали
Реферат Курсовая Конспект
Легкі конструкційні метали
Легкі конструкційні метали - раздел Образование, Легкі конструкційні метали Велике Значення Для Машинобудування Належить Легким Конструкційним Металам, Я...
Велике значення для машинобудування належить легким конструкційним металам, які мають достатньо питому міцність. Питома міцність – це відношення міцності матеріалу до щільності. З огляду на питому міцність і хімічну активність до легких конструкційних матеріалів відносять магній, берилій, алюміній, титан і сплави на їх основі.
Алюміній – сріблясто-білий метал, легкоплавкий (т.пл. 660,40С), легкий (густина 2,7 г/см3), механічно міцний, має добру електричну провідність і теплопровідність, легко утворює сплави і піддається обробці. Він має високу корозійну стійкість в окиснювальних середовищах внаслідок утворення непроникливої захисної плівки алюміній оксиду, завдяки цьому за звичайної температури алюміній практично не взаємодіє з концентрованою й сильно розведеною нітратною кислотою, дуже повільно розчиняється в нітратній кислоті середніх концентрацій, тому нітратну кислоту зберігають і перевозять в алюмінієвій тарі. Алюміній розчинний у хлоридній і сульфатній кислотах:
2Al + 6H+ = 2Al³+ + 3H2↑.
Зовсім не стійкий у лугах та лужних розчинах із рН = 9. Алюміній легко з’єднується з киснем на повітрі, покриваючись оксидною плівкою Al2O3, що захищає метал від подальшої корозії. Алюміній – метал, але нетиповий. З водою алюміній реагує, якщо плівка гідроксиду, що утвориться, буде розчинятися, що може бути досягнуте при додаванні до води лугу:
2Al + 2NaOH + 10H2O = 2Na[Al(OH)4(H2O)2] + 3H2↑.
У йонній формі: 2Al + 2OHˉ + 10H2O = 2[Al(OH)4(H2O)2]ˉ + 3H2↑.
Алюміній, у якого зруйнована оксидна плівка, хімічно активний:
2Al + 6H2O + 6H3O+ = 3H2↑ + 2[Al(H2O)6]3+.
За звичайних умов алюміній реагує з галогенами:
2Al + 3Cl2 = 2AlCl3.
При нагріванні алюміній взаємодіє з багатьма неметалами:
2Al + N2 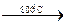 2AlN;
2AlN;
2Al + 3S 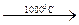 Al2S3;
Al2S3;
4Al + 3C 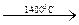 Al4C3.
Al4C3.
Алюміній є хорошим відновником багатьох оксидів металів, що використовується в металургії для одержання тугоплавких металів – ванадію, хрому, марганцю тощо. Наприклад:
2Al + Cr2O3 = Al2O3 + 2Cr.
Метод відновлення оксидів металів алюмінієм одержав назву алюмінотермії. На цьому методі ґрунтується один зі способів зварювання стальних виробів. Для цього суміш порошкоподібних алюміній оксиду й магнітного залізняку (Fe3O4 ), що має назву терміт, підпалюють за допомогою запалу. При цьому відбувається реакція:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe.
У результаті цієї екзотермічної реакції розвивається температура порядку 30000С. Залізо, що виділяється, у розплавленому вигляді тече на місце стику металевих деталей, зварюючи їх.
Алюміній оксид і алюміній гідроксид є амфотерними сполуками. Основні властивості цих сполук виявляються у реакціях з кислотами:
Al2O3+ 6HCl = 2AlCl3 + 3H2O;
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O.
Кислотні властивості алюміній оксид і алюміній гідроксид виявляють у реакціях з лугами в розчинах:
Al2O3 + 6KOH + 3H2O = 2K3[Al(OH)6];
Al(OH)3 + 3KOH = K3[Al(OH)6].
За поширеністю в земній корі алюміній посідає перше місце серед металів, його вміст у земній корі становить 8,8 %. Внаслідок високої хімічної активності алюміній зустрічається в природі тільки у вигляді сполук. Основним промисловим методом добування металічного алюмінію є електроліз розплаву, що містить алюміній оксид Al2O3 (глинозем) і кріоліт Na3AlF6. Електроліз відбувається при температурі 9500С. Добутий технічний алюміній (до 99,7 % Al) піддають очистці шляхом електрорафінування.
Магній відноситься до найбільш електропозитивних елементів. Від свого сусіда по періоду – алюмінію – магній відрізняється меншим числом валентних електронів і відносно більшим розміром атому, тому його здатність утворювати ковалентний зв’язок у порівнянні з алюмінієм знижена. Для магнію характерне утворення йонного зв’язку. Магній у вигляді простої речовини – білий метал, легко окиснюється повітрям, приймає матовий відтінок. Магній – активний метал, легко вступає у взаємодію з галогенами, при нагріванні згорає на повітрі, окиснюється сіркою та азотом. У електрохімічному ряді напруг магній розташований перед воднем. Він майже не взаємодіє з холодною водою, тому що магній гідроксид, який утворюється при цьому, погано розчинний у воді. При нагріванні реакція між магнієм і водою прискорюється за рахунок розчинення Mg(OH)2. У кислотах магній розчиняється дуже енергійно, за винятком HF i H3PO4, які утворюють із ним малорозчинні сполуки. Розбавлену нітратну кислоту (з масовою часткою кислоти 10-15 %) метал відновлює до амоній нітрату:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O.
З лугами магній практично не взаємодіє. За хімічною природою сполуки Mg (II) – переважно основні. Більшість його солей розчинні у воді. Малорозчинні солі слабких кислот – Mg3(PO4)2 ; MgCO3, MgF2. Магній карбонат розчиняється у воді в присутності CO2, перетворюючись у розчинний магній гідрогенкарбонат:
MgCO3 + CO2 + H2O = Mg(НCO3)2.
Магній може відновлювати багато металів з їхніх оксидів і солей:
TiCl4 + 2Mg = Ti + 2MgCl2.
Магній оксид і магній гідроксид виявляють основні властивості.
При змішуванні магній хлориду з водою й магній оксидом утворюється магній гідроксидхлорид:
MgCl2 + MgO + H2O = 2MgOHCl,
який при змішуванні з водою утворює масу, яка швидко твердіє, що дозволяє використовувати його як цемент. Магній входить до складу мінералів магнезиту, доломіту, карналіту (додаток 1).
Титан–сріблясто-білий метал. При звичайних температурах хімічна активність титану надзвичайно мала. Це пояснюється тим, що на свіжій поверхні чистого титану дуже швидко з’являється інертна плівка діоксиду титану, яка добре „зростається” з металом і захищає його від подальшого окиснення.
Титан із галогенами може утворювати тетрагаліди:
Ti + 2Cl2 = TiCl4.
Флуор і хлор реагують з титаном на холоду, а бром і йод – при температурі вище 2500С. Титан при високій температурі утворює також сполуки з азотом – нітрид (TiN), який використовується для полірування коштовного каміння; з вуглецем – карбід (TiC), що використовується для виготовлення абразивних інструментів.
Титан не може протистояти дії гідроген пероксиду, сухим хлору й брому, спиртам та ортофосфатної кислоти, навіть слабкої концентрації.
Титан стійкий у багатьох агресивних середовищах, особливо в слабких розчинах нітратної кислоти, де він пасивується, хлорорганічних сполуках. Однак титан розчиняється у кислотах, які здатні руйнувати захисну плівку, наприклад, розведені хлоридна, сульфатна та флуоридна кислоти:
2Ti + 6HCl 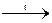 2TiCl3 + 3H2.
2TiCl3 + 3H2.
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2.
2Ті + 6НF = 2TiF3 + 3H2.
Сполуки, де титан виявляє ступінь окиснення +3, мають червоно-фіолетове забарвлення різних відтінків: Ті(ОН)3 – вишнево-червоний, TiF3 – пурпурово-червоний, TiCl3 – фіолетовий, TiBr3 – червоно-фіолетовий.
На повітрі при звичайній температурі титан досить стійкий. При високій температурі (1200-13000C) він бурхливо реагує з киснем повітря, утворюючи оксид TiO2, причому реакція супроводжується яскравим світінням. Титан (ІV) оксид TiO2 – хімічно малоактивна речовина. Цей оксид є амфотерною сполукою, проте він реагує з кислотами тільки при нагріванні, а з лугами – при сплавлянні з утворенням титанатів:
TiO2 + H2SO4 = TiO(SO4) + H2O;
TiO2 + 2KOH = K2TiO3+ H2O.
Сульфатна кислота, так само як і хлоридна, руйнує захисну плівку діоксиду титану й підвищує розчинність металу. Її можна різко знизити, якщо до розчинів цих кислот додати певну кількість нітратної, хромової кислот, сполук хлору чи інших окисників, що швидко пасивують поверхню титану захисною плівкою, і припиняють його подальше розчинення.
Титан – хімічно активний, і в той же час титан є одним із деяких металів, що мають винятково високу корозійну стійкість. Титан практично вічний в атмосфері повітря, у холодній і киплячій воді, дуже стійкий у розчинах багатьох солей, неорганічних і органічних кислотах. За своєю корозійною стійкістю в морській воді він перевершує всі метали, за винятком благородних металів – золота, платини, більшість видів нержавіючої сталі, нікелеві, мідні й інші сплави. Протистоїть титан і ерозійній корозії, що відбувається в результаті сполучення хімічного й механічного впливу на метал. У цьому відношенні він не поступається кращим маркам нержавіючих сталей, сплавам на основі міді й інших конструкційних матеріалів.
У хімічній промисловості використовують, в основному, технічно чистий титан, який має найбільшу корозійну стійкість. Для особливо агресивних середовищ застосовують сплави титану з молібденом, паладієм, нікелем та цирконієм, що підвищують його стійкість у десятки й сотні разів. Найбільший ефект досягається завдяки добавкам у титан чотирьох металів платинової групи: платини, паладію, родію й рутенію.
– Конец работы –
Эта тема принадлежит разделу:
Легкі конструкційні метали
Розділ Неметалеві конструкційні матеріали Полімерні матеріали За походженням полімери... Розділ Металеві конструкційні... Металічні сплави...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Легкі конструкційні метали
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов