Число подуровней на данном уровне равно номеру уровня
 | |||||
 | |||||
 |
Дистанционное обучение: dot.mpei.ru/do/


Электрическую, тепловую, механическую энергии в настоящее время в основном получают преобразованием химической энергии природных веществ.
 | |||||
 | |||||
 |
 |
 | |||||
 | |||||
 | |||||
 |
 | |||
 |
К В А Н Т О В Ы Е Ч И С Л А

L = 0 : s-орбитали , имеют сферическую форму.
S-электроны.
L =1 : р-орбитали , имеют гантелеобразную форму.
р-электроны.
l= 2 : d-орбитали , имеют более сложную форму.
D-электроны.
L= 3 : f- орбитали , их форма еще сложнее.
F- электроны.
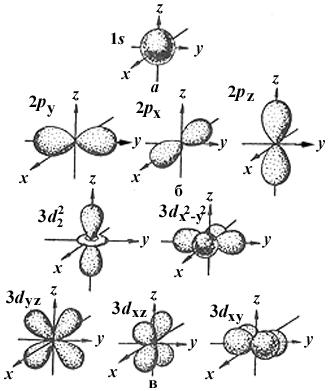
Формы электронных облаков различных атомных орбиталей и их ориентация в пространстве.
Каждый энергетический уровень расщепляется на на определенное количество подуровней:
Число подуровней на данном уровне равно номеру уровня.
Оболочка Энергетич. уровень Значение n Подоболочки Значения ml Число…Распределение электронов в многоэлектронных атомах. Электронные конфигурации.
ОСНОВНЫЕ ПРИНЦИПЫ И ПРАВИЛАПример
 |  |
S1 n = 3 3s2 n = 3
L = 0 l = 0
Ml = 0 ml = 0
ms = + 1/2 (условно) ms = -1/2, +1/2(условно)
 |
p3


p4
Два способа составления схем распределения электронов
в атомах
 |
Е S p
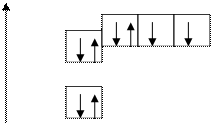 8О 1s22s22p4
8О 1s22s22p4
n = 2
О
n = 1


Пример: для атома кислорода 8О
формирующим является 2р4 электрон,
Для атома калия 19К - формирующий - 4s1 электрон.
Основное состояние – наиболее устойчивое состояние атома.
Возбужденное состояние – состояние с повышенной энергией.
При переходе атома в возбужденное состояние электроны поглощают кванты энергии и переходят на орбитали с более высокой энергией.
Пример: бор B 1s22s22p1 - основное состояние
B* 1s22s12p2 - возбужденное состояние
для ряда d и f –элементов – «проскок» или «провал» электрона с подуровня ns в (n-1)d (Cu, Ag, Au, Pt, Pd, Rh, Ru, Cr, Mo, Nb) Например, атом меди Cu существует с конфигурацией …3d104s1 , а не …3d94s2 Причина - Повышенная энергетическая устойчивость 3d10 состояния.Способность атома образовывать определенное число химических связей.
Валентность по обменному механизму равна числу внешних неспаренных электронов в атоме. Различают валентность в основном (В) и возбужденном (В*) состоянии атома.
Примеры.
 |
Магний Mg ... 3s2
 |
Кислород O…2s22p4 и Фтор F…2s22p5
Возбужденного состояния нет.
Хлор Cl … 3s23p5– аналог фтора – валентности: В=1, В*= 3, 5, 7 - вследствие наличия свободных d-орбиталей на…Валентная конфигурация или
Сокращенная электронная формула
Содержит только валентные электроны (наиболее активные, которые могут участвовать в образовании химических связей). Это – все внешние электроны и электроны формирующихся подуровней.
Примеры:

 Литий Li … 2s 1 ,
Литий Li … 2s 1 ,
квантовые числа для формирующего электрона 2s:
n = 2, l = 0, ml = 0, ms =+1/2 или –1/2;
Валентность: В =1.

 Стронций Sr … 5s 2 ,
Стронций Sr … 5s 2 ,
квантовые числа для формирующего электрона 5s:
n = 5, l = 0, ml = 0, ms =+1/2 или –1/2;
Валентность: В = 0, В* = 2.





 Азот N … 2s 22p 3 ,
Азот N … 2s 22p 3 ,
квантовые числа для формирующего электрона 2р:
n = 2, l = 1, ml = -1,0,+1(одно из), ms =+1/2 или –1/2;
Валентность: В = 3.







 Хлор Cl … 3s 23p 5 ,
Хлор Cl … 3s 23p 5 ,
квантовые числа для формирующего электрона 3р:
n = 3, l = 1, ml = -1, 0, +1 (одно из), ms =+1/2 или –1/2;
Валентность: В = 1, В* = 3,5,7.






 Марганец Мn … 3d 54s 2 ,
Марганец Мn … 3d 54s 2 ,
квантовые числа для формирующего электрона 3d:
n = 3, l = 2, ml = -2, -1, 0 ,+1 ,+2 (одно из),
ms =+1/2 или –1/2;
Валентность: В = 0, В* = 2,3,4,5,6,7.








 Серебро Ag … 4d 105s 1 ,
Серебро Ag … 4d 105s 1 ,
квантовые числа для формирующего электрона 4d:
n = 4, l = 2, ml = -2, -1, 0 ,+1 ,+2 (одно из),
ms =+1/2 или –1/2;
Валентность: В = 1.
Уран U … 5f 36d 17s 2,
 |  |  | |||
квантовые числа для формирующего электрона 5f:
n = 5, l = 3, ml = -3, -2, -1, 0 ,+1 ,+2, +3 (одно из),
ms =+1/2 или –1/2;
Валентность: В = 0, В* = 1,2,3.
Полная электронная конфигурация урана:
U 92 : 1s 22s 22p 63s 23p 63d 104s 24p 64d 104f 14
5s 25p 65d 105f 36s 26p 66d 17s 2