рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Представления о природе химической связи
Реферат Курсовая Конспект
Представления о природе химической связи
Представления о природе химической связи - раздел Химия, ХИМИЯ XX ВЕКА На Протяжении Всего Xix Века Химия, Основанная На Атомно-Молекулярной Теории,...
На протяжении всего XIX века химия, основанная на атомно-молекулярной теории, не могла дать никаких объяснений природе связи между атомами. Понятие валентности, при всей плодотворности его применения, оставалось сугубо эмпирическим. Лишь после открытия делимости атома и установления природы электрона как составной части атома возникли реальные предпосылки для разработки первых теорий химической связи.
Немецкие учёные Рихард Вильгельм Генрих Абегг и Гвидо Бодлендер в 1899 г. высказали идею о сродстве атомов к электрону – способности атомов присоединять электрон: "Вследствие того, что для существования неорганических соединений сродство атомов или отдельных групп к электрическому заряду оказывается гораздо более важным, нежели сродство их друг к другу, кажется вполне целесообразным принять за основу систематики неорганических веществ именно это сродство элементов и радикалов к электричеству...".
На основе этих представлений Абегг в 1904 г. разработал теорию электровалентности. Валентностью, по мнению Абегга, обладают ионы, и величина валентности равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями – положительной и отрицательной, сумма которых равна восьми. Одна из них, производящая более сильное действие, нормальная, другая – контрвалентность. Для семи групп периодической системы Абегг приводил следующие значения нормальных и контрвалентностей:
| Группа Нормальная валентность Контрвалентность | I +1 -7 | II +2 -6 | III +3 -5 | IV +4 -4 | V -3 +5 | VI -2 +6 | VI -1 +7 |
Следует отметить, что формулы высших оксидов и водородных соединений, приводимые Менделеевым в своей таблице, аналогичны построениям Абегга.
Все дальнейшие попытки объяснения природы валентных сил находились в тесной связи с представлениями о строении атома. Дж. Дж. Томсон в своей модели строения атома указывал на участие электронов в образовании связи между атомами. В 1908 г. Уильям Рамзай высказал идею о связи атомов посредством общего электрона. Нильс Бор в 1913 г. предложил динамическую модель молекулы, в которой химическая связь возникает за счёт электронов, находящихся на общей для двух атомов орбите; плоскость этой орбиты перпендикулярна линии, соединяющей ядра. Иоганнес Штарк в 1915 г. ввёл в теорию понятие о валентных электронах: согласно Штарку, валентность атома не связана с общим числом электронов в атоме, а определяется только числом поверхностных электронов. Представления Штарка о валентных электронах и модель атома Резерфорда-Бора легли в основу новых теорий химической связи.
Представления об электровалентности или полярной валентности получили развитие в работах немецкого физика Вальтера Косселя. В 1916 г. он разработал теорию, основанную на модели атома Бора и представлении об особой стабильности двух- или восьмиэлектронных оболочек инертных газов. Реакционная способность атома, по Косселю, определяется его стремлением приобрести такую электронную конфигурацию. Учитывая тот факт, что большинство неорганических соединений полярно и способно диссоциировать на ионы, он предположил, что природа валентных сил заключается в электростатическом притяжении ионов, образующихся за счёт отдачи одним атомов одного или нескольких электронов другому. Ниже приведена схема образования молекулы фторида натрия по Косселю:
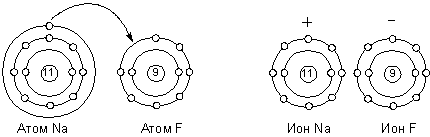
В 1916 американский химик Джилберт Ньютон Льюис предложил теорию кубического атома, основанную на сходных предпосылках. Согласно Льюису, химическая инертность элементов нулевой группы периодической системы объясняется тем, что группы из двух или восьми электронов являются очень устойчивыми. По мнению Льюиса, атом гелия имеет два электрона; атом неона – два электрона, расположенных внутри куба, образованного восемью электронами. В аргоне ещё восемь электронов расположены в вершинах куба, внешнего по отношению к кубу неона. Атомы других элементам стремятся к приобретению или отдаче электронов, чтобы приобрести электронную конфигурацию инертного газа. Образование связи между одинаковыми атомами Льюис объяснил возможностью обобществления валентных электронов. Льюис предложил также способ изображения связей, в котором каждый валентный электрон обозначается точкой (формулы Льюиса).
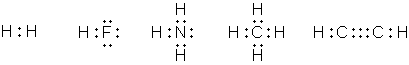
Аналогичные взгляды высказал Ирвинг Ленгмюр, который, однако, отбросил идею о стационарном кубическом расположении внешних электронов в атоме. Ленгмюр предположил существование трёх типов валентности: положительной, отрицательной и ковалентности. Положительная и отрицательная валентности определяются числом электронов, которые атом способен соответственно отдать или принять. Ковалентность определяется числом электронных пар, которыми атом может владеть совместно с другими атомами. В начале 20-х гг. английский химик Невилл Винсент Седжвик распространил понятие ковалентности на неорганические и координационные соединения, постулировав существование похожего типа связи, в котором оба электрона связывающей электронной пары изначально принадлежали одному из соединяющихся атомов (семиполярная или донорно-акцепторная связь).
В целом можно отметить, что теории Косселя и Льюиса-Ленгмюра позволили весьма удачно объяснить, как образуются химические связи между атомами в неорганических и органических соединениях. Основанные на "полуклассической" модели атома Бора-Зоммерфельда, теории ионной и ковалентной связи удачно сочетали простоту и наглядность с новейшими современными представлениями о строении атома.
Опираясь на теории Косселя и Льюиса-Ленгмюра, в 1923 г. датский химик Йоханнес Николаус Брёнстед и англичанин Томас Мартин Лаури разработали протонную теории кислот и оснований, а Джилберт Льюис расширил представления о кислотах и основаниях, предложив электронную теорию, согласно которой кислота кислота является акцептором, а основание – донором электронных пар.
Однако многие вопросы по-прежнему оставались без ответов. Теория Льюиса-Ленгмюра не могла объяснить причины связующего действия электронной пары; помимо этого, имелось множество отклонений от правила октета. Окончательное установление природы связи между атомами оказалось возможным лишь на основании принципиально новых – квантовомеханических – представлений.
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЯ XX ВЕКА
На сайте allrefs.net читайте: "ХИМИЯ XX ВЕКА"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Представления о природе химической связи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов