рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- З а д а н и е 1
Реферат Курсовая Конспект
З а д а н и е 1
З а д а н и е 1 - раздел Химия, Программа и контрольные задания по «Физической химии» Для Химической Реакции С Участием Газообразных Веществ, Приве...
Для химической реакции с участием газообразных веществ, приведенной в табл.1, произвести следующие термодинамические расчеты:
1. Рассчитать тепловой эффект реакции при стандартной температуре при постоянном давлении ΔН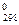 и постоянном объеме ΔU
и постоянном объеме ΔU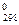 .
.
2. Вычислить тепловой эффект реакции при температурах Т1, Т2, Т3 по температурным зависимостям теплоемкостей. Построить график зависимости теплового эффекта реакции от температуры.
3. Определить температурный коэффициент теплового эффекта ΔСр при температуре Т2 графическим и аналитическим методами. Провести анализ результатов расчета на основании уравнения Кирхгофа.
4. Определить изменение энтропии и нормального сродства реакции при стандартной температуре. Провести анализ полученных результатов.
5. Рассчитать термодинамическую константу равновесия реакции К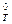 по методу Темкина – Шварцмана при температурах Т1, Т2, Т3 . Провести анализ полученных результатов на основании изобары химической реакции.
по методу Темкина – Шварцмана при температурах Т1, Т2, Т3 . Провести анализ полученных результатов на основании изобары химической реакции.
6. Рассчитать значения рациональных констант равновесия Кр, Кс, КN для заданной реакции при температуре Т2.
7. На основании данных расчета в п.5 построить график зависимости термодинамической константы равновесия от температуры в координатах lnK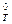 = f(1/T). Определить тепловой эффект реакции при температуре Т2 графическим методом и сравнить полученное значение с результатами расчетов п.2.
= f(1/T). Определить тепловой эффект реакции при температуре Т2 графическим методом и сравнить полученное значение с результатами расчетов п.2.
8. Вычислить равновесную степень превращения α и мольные доли компонентов равновесной смеси Ni при температуре Т2 и общем давлении в системе Робщ, если исходные вещества были смешаны в стехиометрических отношениях, а продукты реакции в исходной смеси отсутствуют.
9. Объяснить влияние общего давления в системе и парциальных давлений на стандартную константу равновесия К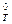 , константу равновесия КN и равновесную степень превращения.
, константу равновесия КN и равновесную степень превращения.
Таблица 1
| № | Уравнения реакции | Т1, К | Т2, К | Т3, К | Роб.105 , Па |
| СО2+3Н2↔СН3ОН+Н2О | |||||
| С2Н4+ Н2О↔С2Н5ОН | |||||
| С2Н4+ С2Н5ОН ↔ С2Н5ОС2Н5 диэтиловый эфир | 1,5 | ||||
| С2Н6+NH3 ↔ С2Н5 NH2 | 2,5 | ||||
| С2Н4+H2S ↔ С2Н5HS | |||||
| 2С2Н4+ С4Н10 ↔ С8Н18, октан | |||||
| 3С2Н2 ↔ С6Н6 | |||||
| С4Н8 + Н2О ↔ С4Н9ОН | 1,5 | ||||
| СН3СНО+Н2 ↔ С2Н5ОН ацетальдегид | 2,5 | ||||
| СН3ОН+НСl ↔ СН3Сl+Н2О | 2,5 | ||||
| СО+Н2↔НСНО, формальдегид | 0,5 | ||||
| С2Н2+С2Н4+С2Н6↔С6Н6+3Н2 | |||||
| СН3СНО+ Н2О ↔НОСН2СН2ОН | |||||
| НСНО+ СН4 ↔ СН3СНО+Н2 Формальдегид ацетальдегид | |||||
| 2СН4+СО ↔ СН3СОСН3+Н2 | |||||
| 2СО2+5Н2 ↔ СН3СНО+3Н2О ацетальдегид | 0,5 | ||||
| 4NО2+О2+ Н2О ↔4 HNО3 | |||||
| 6NО2 + Н2О ↔4 HNО3+2NО | 0,5 | ||||
| 2СН3ОСН3↔СН3СОСН3+СО+3Н2 | 0,5 | ||||
| СН4+СО↔СН3СНО | |||||
| С2Н4+СО↔СН3СНО | |||||
| С6Н5NO2+3H2↔С6Н5NH2+Н2О | 2,5 | ||||
| С2Н5ОН+H2↔СН3ОН+CH4 | |||||
| CO+3H2↔С2Н4+Н2О | 2,5 | ||||
| N2+3H2↔2NH3 |
З а д а н и е 2
1. Рассчитать мольную энтропию оксида углерода при 200° С и 50,67.105 Н/м2, если энтропия при 25°С и 1,013.105 Н/м2 равна 197,9 Дж/моль.К, а зависимость мольной теплоемкости от температуры выражается уравнением
СР = 28,41+4,10.10-3Т –0,46.105 Т-2 , Дж/(моль. К).
2. Найти изменение энтропии при нагревании 2 моль кадмия от 25 до 727°С, если температура плавления 321°С и теплота плавления равна 6109 Дж/моль. СР(Cdтв) = 22,22+12,30.10-3Т ; СР(Cdж) = 29,83 Дж/(моль.К).
3. Определить изменение энтропии, если 0,0112 м3 азота нагреваются от 0°С до 50°С. Одновременно давление уменьшается от 1,013.105 Н/м2 до 1,013·103 Н/м2. Теплоемкость равна 29,29 Дж/(моль.К).
4. Найти изменение энтропии при изотермическом сжатии 1 моль паров бензола при 80 °С от 0,4053.105 до 1,013.105 Н/м2 с последующей конденсацией и охлаждением жидкого бензола до 60 °С. Нормальная температура кипения бензола 80 °С; мольная теплота испарения бензола 30,88 кДж/моль; удельная теплоемкость жидкого бензола 1,799 Дж/(К·г).
5. В сосуд, содержащий 0,001 м3 воды при 20 °С, погружена железная пластинка массой 10 г, нагретая до 200 °С. Чему равно изменение энтропии, если СР(Feтв) = 25,52 Дж/(моль.К); СР(Н2Ож) = 77,82 Дж/(моль.К).
6. Определить изменение энтропии в процессе сжижения 1 моль метана, если начальная температура равна 25 °С, а конечная 111,8 К. Мольная теплота испарения метана при 111,8 К равна 8234 Дж/моль и мольная теплоемкость СР,г = 35,79 Дж/(моль.К). Вычислить работу сжижения метана, приняв к.п.д. равным 10 %.
7. Рассчитать изменение энтропии 1 моль бензола при переходе из жидкого состояния при 25 °С в пар при 100 °С, если теплота испарения бензола 393,3 Дж/г, температура кипения бензола 80,2 °С, мольная теплоемкость жидкого бензола равна СР,ж = 136,1 Дж/(моль.К), а мольная теплоемкость паров бензола СР,г = -33,90 + 471,87.10-3Т Дж/(моль.К).
8. Найти изменение энтропии при нагревании 1 моль ацетона от 25 °С до 100 °С, если удельная теплота испарения ацетона равна 514,6 Дж/г, температура кипения равна 56 °С, мольные теплоемкости жидкого ацетона СР,ж = 125 Дж/(моль.К), паров ацетона СР,г = 22,47 + 201,8.10-3Т - 63,5.10-6Т2 Дж/(моль.К).
9. Рассчитать изменение энтропии при нагревании 2 моль метанола от 25 °С до 100 °С, если удельная теплота испарения СН3ОН 1100,4 Дж/г, температура кипения 64,7 °С, мольные теплоемкости жидкого и газообразного метанола: СР,ж = 81,56; СР,г = 15,28 +105,2.10-3Т - 31,04.10-6Т2 Дж/(моль.К).
10. Вычислить изменение энтропии при нагревании 1 моль твердого брома от температуры плавления –7,32 до 100°С, если удельная теплота плавления равна 67,78 Дж/г, скрытая удельная теплота испарения равна 188,5 Дж/г, температура кипения равна 59 °С; СР,ж = 75,71 Дж/(моль.К); мольная теплоемкость паров брома СР,г = 37,20 + 0,71.10-3Т - 1,19.10-5Т2 Дж/(моль.К).
11. Определить изменение энтропии при нагревании 1 моль этанола от 25 °С до 100 °С, если удельная теплота испарения С2Н5ОН 863,6 Дж/г, температура кипения 78,3 °С, мольные теплоемкости жидкого этанола СР,ж = 111,4 и газообразного СР,г = 19,07+212,7.10-3Т-108,6.10-6Т2 ,
Дж/(моль.К).
12. В термически изолированный сосуд, содержащий 5 кг воды при 30°С, вносят 1 кг снега, температура которого –10°С. Как возрастает энтропия в происходящем процессе, если теплота плавления снега 333,3 Дж/г, удельная теплоемкость снега 2,008 Дж/(г.К), а удельная теплоемкость воды 4,184 Дж/(г.К).
13. Каково изменение энтропии в системе, если 0,002 м2 аргона при 100оС и 20 000 кг/м2 нагреваются, при этом объем увеличивается до 0,008 м2, а давление до 12,16.10 н/м2.
14. Вычислите DS при нагревании 589 г кобальта от 298 К до 1600 °С, если при 464 °С a-Со переходит в b-Со, а при 1120 °С b-Со переходит в g-Со. Теплоты модификационных превращений a-Со ® b-Со и b-Со ® g-Со соответственно равны 251 Дж/моль и 0,40 кДж/моль. Температура плавления кобальта равна 1768 К, а lплавления = 15,7 кДж/моль. Теплоемкости кобальта в различных состояниях равны, Дж/(моль·К):
СР(a-Со) = 21,38 + 14,31×10-3×Т; СР(b-Со) = 11,97 + 21,04×10-3×Т;
СР(g-Со) = 41,21; СР(Сожид) = 35,14.
15. В 1 кг воды при 273 К положили кусок железа весом 500 г, нагретый до 100 °С. Вычислите изменение энтропии каждого тела и DS системы в целом после достижения телами температурного равновесия. СР(Н2Ожид) = 4,2 Дж/(г·К); СР(Feтв) = 26,87 Дж/(моль·К). Систему считать изолированной.
16. Вычислите молярную энтропию монооксида углерода при 200 °С и давлении 50 атм., если его энтропия при 298 К и давлении 1 атм. равна 197,98 Дж/(моль·К), а зависимость теплоемкости от температуры выражается уравнением СР = 6,79 + 0,98×10-3×Т кал/(моль·К).
17. Вычислите DS при переходе 1 моль ZrBr4 из твердого состояния при 298 К в парообразное при температуре сублимации 357 °С, если lсубл при Тсубл равна 107,95 кДж/моль.
18. Вычислите DS при нагревании 10 моль железа от 20 °С до 1600 °С, если Тпл = 1539 °С, а lпл = 3,65 ккал/моль. При 760 °С a-Fe переходит в b-Fe, при 908 °С b-Fe переходит в g-Fe, а при 1401 °С g-Fe переходит в d-Fe. Теплоты соответствующих фазовых переходов равны: la®b = 2,76 кДж/моль; lb®g = 920 Дж/моль; lg®d = 1,17 кДж/моль. Теплоемкости железа в различных состояниях равны, Дж/(моль·К):
СР(a-Fe) = 16,32 + 28,45×10-3×Т; СР(b-Fe) = СР(d-Fe) = 41,21;
СР(g-Fe) = 31,59 + 4,77×10-3×Т;; СР(Feжид) = 34,10.
19. Вычислите DS при нагревании 585 г NaCl от 273 К до 1973 К, если Тпл = 800 °С, Ткип = 1465 °С, lпл = 30,96 кДж/моль, а lисп = 30,96 кДж/моль. Теплоемкости твердого, жидкого и газообразного NaCl равны, Дж/(моль·К):
СР,тв = 45,94 + 16,32×10-3×Т; СР,жид = 66,53; СР,газ = 37,57 - 1,72×105×Т-2.
20. Вычислите DS при переходе 1 моль HgJ2 из твердого состояния при 293 К в газ при Ткип = 354 °С. При 130 °С a- HgJ2 переходит в b- HgJ2. Теплота перехода a®b равна 2,72 кДж/моль, Тпл(b- HgJ2) = 258 °С, lпл = 4,6 ккал/моль, а lисп при Ткип равна 59,83 кДж/моль. Теплоемкости HgJ2 равны (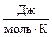 ): СР(a- HgJ2) = 77,4; СР((b- HgJ2) = 84,51; СР(HgJ2,жид) = 104,6.
): СР(a- HgJ2) = 77,4; СР((b- HgJ2) = 84,51; СР(HgJ2,жид) = 104,6.
21. Вычислите DS при переходе 1 г твердого циркония, взятого при 298 К, в жидкий Zr при Тпл = 1860 °С, если при 852 °С a-Zr переходит в b-Zr. Теплота модификационного перехода a®b равна 0,92 ккал/моль, lпл = 220 Дж/г, а теплоемкости модификаций циркония равны:
СР(a-Zr) = 6,83 + 1,12×10-3×Т 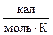 ; СР(b-Zr) = 30,41
; СР(b-Zr) = 30,41 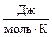 .
.
– Конец работы –
Эта тема принадлежит разделу:
Программа и контрольные задания по «Физической химии»
На сайте allrefs.net читайте: "Программа и контрольные задания по «Физической химии»"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: З а д а н и е 1
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов