рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Закон Гесса
Реферат Курсовая Конспект
Закон Гесса
Закон Гесса - раздел Химия, Физическая химия Закон Гесса Лежит В Основе Термохимии. Термохимия Занимается ...
Закон Гесса лежит в основе термохимии. Термохимия занимается изучением тепловых эффектов химических реакций. Тепловым эффектом химической реакции называется количество энергии, которое система выделяет или поглощает в виде теплоты при полном необратимом протекании реакции при постоянстве температуры и давления или температуры и объема. Условия знаков в термохимии иные, чем в термодинамике, те есть теплота, которая выделяется в ходе реакции, считается положительной (экзотермическая реакция), и наоборот, теплота, которая поглощается в ходе реакции (подводится), считается отрицательной (эндотермическая реакция). Поэтому в термохимии тепловые эффекты обозначаются Q и учитывается, что Q = -q.
Закон Гесса вытекает непосредственно из первого закона термодинамики. Он читается:
Тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода при условии, если объем и температура или давление и температура в ходе реакции остаются постоянными.
Действительно, при P=const: qp=∆H=-Qp ; при V=const: qv=∆U=-Qv . Связь между Qp и Qv выражается уравнением:
Qp = Qv - ∆nRT
Где ∆n – изменение числа моль газообразных участников реакции.
Для практических расчетов широко используется следствия из закона Гесса. Их пять.
Первое следствие. Теплота образования соединения из исходных веществ не зависит от способа, каким это соединение получено.
Второе следствие. Тепловой эффект разложения какого-либо соединения равен по абсолютной величине и противоположен по знаку тепловому эффекту его образования.
Третье следствие. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое; если совершаются две реакции, приводящие из одинаковых начальных к различным конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое.
Четвертое следствие. Тепловой эффект реакции равен разности между суммой теплот образования конечных продуктов и суммой теплот образования исходных веществ с учетом соответствующих стехиометрических коэффициентов:

Для расчета теплот образования выбрано стандартное состояние и приняты условия нормировки энтальпии. В соответствии с международным соглашением за стандартное состояние принято состояние при давлении 1 атм. (1,013.105 н/м2) и температуре 298К. Условия нормировки: для каждого элемента в модификации, наиболее устойчивой в стандартном состоянии, абсолютное значение стандартной энтальпии равно нулю: 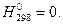 Тогда энтальпия сложного вещества определится тепловым эффектом с обратным знаком реакции его образования из элементов в стандартном состоянии.
Тогда энтальпия сложного вещества определится тепловым эффектом с обратным знаком реакции его образования из элементов в стандартном состоянии.
Пятое следствие. Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания конечных продуктов с учетом соответствующих стехиометрических коэффициентов.
Теплотой сгорания называется тепловой эффект реакции полного сгорания одного моль данного соединения до образования высших окислов.
Пример 3:
Пользуясь стандартными теплотами образования соединений при 298К и 1,013*105 н/м2 , вычислить тепловой эффект реакции при Р=const и V=const:
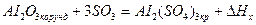
Стандартные теплоты образования веществ следующие:

Решение:
В соответствии с четвертым следствием из закона Гесса:

Для расчета ∆Ux воспользуемся уравнением:
∆Ux= ∆Hx-∆nRT
∆Ux= - 573,4 + 3.8,314 .10-3 .298 = -566,0кДж
Пример 4:
Пользуясь стандартными теплотами сгорания, вычислить тепловой эффект реакции:
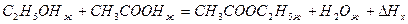
если теплоты сгорания веществ следующие:


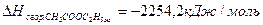
Решение:
Согласно пятому следствию из закона Гесса, тепловой эффект реакции равен:

1.4. Зависимость теплового эффекта химической реакции от температуры:
Зависимость теплового эффекта от температуры определяется уравнением Кирхгофа, дифференциальная форма:
 и
и 
Здесь: 
В интегральной форме уравнение Кирхгофа имеет вид:
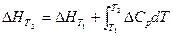
При Т1= 298К и Т2=Т: 
Учитывая зависимость теплоемкости от температуры:
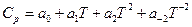 и
и 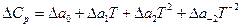
где:  и т.д.
и т.д.
Подставляем значение ∆Ср в уравнение Кирхгофа и интегрируем:

здесь: 
Полученное уравнение дает возможность вычислять тепловые эффекты реакций при любых температурах, если известны теплоты образования и зависимости теплоемкостей от температуры всех участников реакции.
Пример 5:
Вычислить тепловой эффект химической реакции:
2Н2+СО=СН3ОНг при 500К и постоянном давлении, если стандартные теплоты образования равны:

 , а зависимости мольных теплоемкостей реагентов (Дж/моль*К) от температуры выражаются уравнениями:
, а зависимости мольных теплоемкостей реагентов (Дж/моль*К) от температуры выражаются уравнениями:
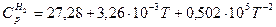


Решение:
Определяем ∆СР :

Отсюда:
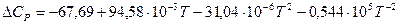
Определяем:  :
:

Определяем  :
:

– Конец работы –
Эта тема принадлежит разделу:
Физическая химия
На сайте allrefs.net читайте: ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Закон Гесса
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов