рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Вычисление изменения энтропии в различных процессах
Реферат Курсовая Конспект
Вычисление изменения энтропии в различных процессах
Вычисление изменения энтропии в различных процессах - раздел Химия, Физическая химия Математическое Выражение Второго Закона Термодинамики Записыв...
Математическое выражение второго закона термодинамики записывается:
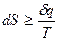
Здесь знак > относится к необратимым процессам, а знак = к обратимым. Так как энтропия является функцией состояния, ее изменение при протекании как обратимого, так и необратимого процессов одинаково. Поэтому при расчете изменения энтропии необходимо пользоваться формулами для обратимых процессов.
Энтропия обладает свойствами аддитивности, поэтому изменение энтропии в сложном процессе равно сумме изменений энтропий в отдельных его стадиях. Абсолютное значение энтропии какого-либо вещества при любой температуре можно рассчитать, если известна абсолютная энтропия при какой-то одной температуре, например, при 298К и температурные коэффициенты теплоемкости:
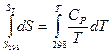 ,
, 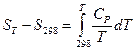
Изменение энтропии в различных процессах вычисляют по следующим уравнениям:
При нагревании n – моль вещества от Т1 до Т2 при P = const:
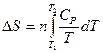 где
где 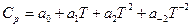
Интегрирование дает:
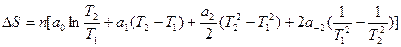
При фазовом превращении:
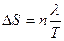 где λ – молярная теплота фазового перехода (плавления, испарения, сублимации, модификационного превращения); Т – температура фазового перехода.
где λ – молярная теплота фазового перехода (плавления, испарения, сублимации, модификационного превращения); Т – температура фазового перехода.
При переходе n – моль идеального газа из состояния 1 в состояние 2 при Т=const:
при 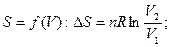 при
при 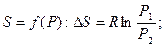
При смешении идеальных газов (Т,Р=const):
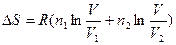 , где n1 и n2 – числа моль первого и второго газа: V1 и V2 – их начальные объемы:
, где n1 и n2 – числа моль первого и второго газа: V1 и V2 – их начальные объемы:
V= V1 + V2 - конечный объем.
Пример 6:
Определить изменение энтропии при превращении 2г льда, взятого при температуре 253К и давлении 1,013*105 н/м2 в пар при температуре 423К, если теплота плавления льда при 273К равна 0,335 кДж/г, удельная теплоемкость льда равна 2,02 Дж/г*К воды – 4,2 Дж/г.К, скрытая теплота парообразования воды равна 2,255 кДж/г, мольная теплоемкость пара при постоянном давлении:
Ср = 30,13+11,3*10-3Т, Дж/моль.К
Решение:
Данный процесс состоит из пяти стадий:
1) нагревание льда от 253 до 273 К – ∆S1;
2) плавление льда при 273 К – ∆S2;
3) нагревание жидкой воды от 273 до 373 К – ∆S3;
4) переход жидкой воды в пар при 373К – ∆S4;
5) нагревание водяного пара от 373 до 473 К – ∆S5 .
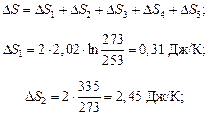
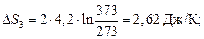
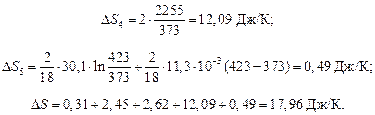
Пример 7
В одном из сосудов вместимостью 0,1 м3 находится кислород, в другом, вместимостью 0,4 м3 – азот. В обоих сосудах температура 290 К и давление 1,013 · 105 Н/м2 . Найти изменение энтропии при смешении газов, считая их идеальными.
Решение
Находим числа моль газов по уравнению Менделеева – Клапейрона:
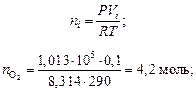
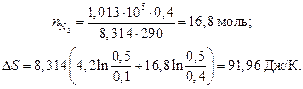
Пример 8
Вычислить стандартное изменение энтропии 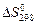 для реакции: Cd+2AgCl = 2Ag+CdCl2 , если
для реакции: Cd+2AgCl = 2Ag+CdCl2 , если 
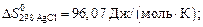
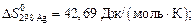
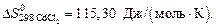
Решение
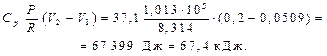
2.2. Вычисление изменения изобарного и изохорного
потенциалов в различных процессах
В изобарно-изотермическом процессе (Р, Т = const) критерием направления процесса и равновесия является изобарно-изотермический потенциал или свободная энергия Гиббса: ∆G ≤ 0. При равновесии G минимальна. В изохорно-изотермическом процессе (V, T = const) критерием направления процесса и равновесия служит изохорно-изотермический потенциал или свободная энергия Гельмгольца: ∆F ≤ 0. При равновесии F минимальна.
Изменения ∆G и ∆F при постоянной температуре рассчитываются по формулам: ∆G = ∆H – T ∆S и ∆F = ∆U – T ∆S.
Из этих уравнений видно, что свободная энергия G или F являются частью полного запаса энергии системы Н или U за вычетом связанной энергии T S. Свободная энергия может быть извлечена из системы и превращена в работу: -∆G = Aр макс и -∆F = = AV макс , где Aр макс – максимальная полная работа; AV макс – максимальная полезная работа.
При расширении или сжатии идеального газа при постоянной температуре
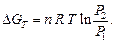
Зависимость ∆G и ∆F от температуры выражается уравнением Гиббса – Гельмгольца. Для ∆G в интегральной форме оно записывается так:
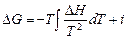
или в пределах от 298 до Т:
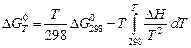 ,
,
здесь ∆Н = f(T).
Для химической реакции
∆G = ∆F + ∆nRT,
где ∆n – изменение числа моль газообразных участников реакции.
Пример 9
Вычислить изменение свободной энергии Гиббса при изотермическом сжатии 10 м3 кислорода от 1,013 · 105 до 10,13 · 105 Н/м2 при 298 К. Газ считать идеальным.
Решение
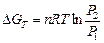 ,
, 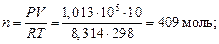
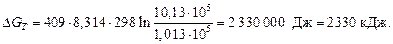
Пример 10
Определить стандартное изменение свободной энергии Гиббса 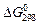 и свободной энергии Гельмгольца
и свободной энергии Гельмгольца 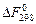 для реакции
для реакции
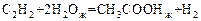 ,
,
пользуясь данными следующей таблицы:
| Вещество | 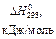
| 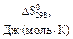
|
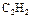
| 226,75 | 200,30 |
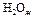
| -285,84 | 69,96 |
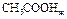
| -484,90 | 159,80 |
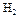
| 130,60 |
Решение
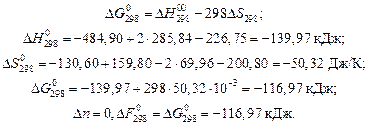
– Конец работы –
Эта тема принадлежит разделу:
Физическая химия
На сайте allrefs.net читайте: ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Вычисление изменения энтропии в различных процессах
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов