рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Гидратная (сольватная) теория растворов)- взаимодействие растворенного вещества и растворителя
Реферат Курсовая Конспект
Гидратная (сольватная) теория растворов)- взаимодействие растворенного вещества и растворителя
Гидратная (сольватная) теория растворов)- взаимодействие растворенного вещества и растворителя - раздел Химия, В зависимости от размера частиц растворенного вещества Растворение Nacl (К) В Н2О: &...
Растворение NaCl (к) в Н2О:
 |  | ||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
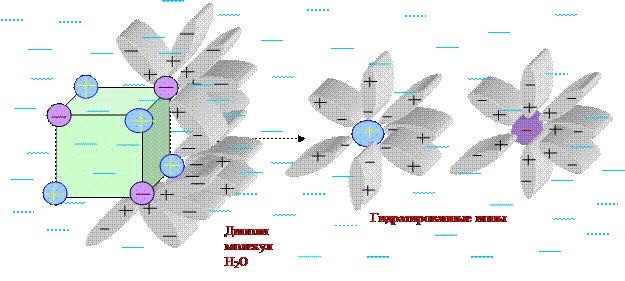 |
Три стадии процесса растворения:
1) процесс ионизации - разрушение связей:
 NaClк Na+(г) + Cl-(г) ; DНион > 0; DSион > 0
NaClк Na+(г) + Cl-(г) ; DНион > 0; DSион > 0
2) процесс сольватации (гидратации) - взаимодействие растворителя с растворяющимся веществом с образованием сольватов (гидратов):
 Na+(г) + aq Na+ ×aq (р-р)
Na+(г) + aq Na+ ×aq (р-р)
 Cl-(г) + aq Cl- ×aq (р-р)
Cl-(г) + aq Cl- ×aq (р-р)
– Конец работы –
Эта тема принадлежит разделу:
В зависимости от размера частиц растворенного вещества
В зависимости от размера частиц растворенного вещества...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Гидратная (сольватная) теория растворов)- взаимодействие растворенного вещества и растворителя
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов