рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- В зависимости от размера частиц растворенного вещества
Реферат Курсовая Конспект
В зависимости от размера частиц растворенного вещества
В зависимости от размера частиц растворенного вещества - раздел Химия, ...


►В зависимости от размера частиц растворенного вещества:
 гомо- микрогетеро- гетеро-
гомо- микрогетеро- гетеро-
 генные генные генные
генные генные генные

10-10 10-9 10-8 10-7 ,м(размер)

 истинные коллоидные суспензии, эмульсии
истинные коллоидные суспензии, эмульсии
Растворы механические смеси
…РАСТВОР: растворитель + растворенные вещества
ß
- концентрация выше, чем у других;
Не меняет своего фазового
Состояния при образовании раствора
► В зависимости от природы растворителяРастворы Растворы
Электролитов неэлектролитов
Проводят эл. ток не проводят эл.ток
СПОСОБЫ ВЫРАЖЕНИЯ
КОНЦЕНТРАЦИИ РАСТВОРОВ:
 |
Моль/л] СМ Û С
Где М - молярная масса вещества, г/моль.

2.
Моль/л ] СН Û Н

:: ► 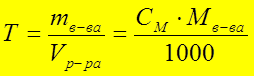 [г/мл, г/см3]
[г/мл, г/см3]

Доли
или ´ 100%)
r- плотность раствора [г /мл, г/см3]

:: ► 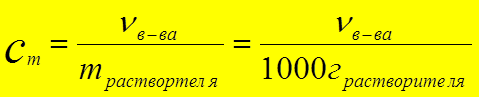
[моль/кг растворителя]
Пример. Имеется раствор Н2SО4 с массовой долей w= 5% . Рассчитать молярную С , нормальную Н , моляльную Сm концентрации и титр Т раствора.
Решение.
Молярная масса М Н2SO4 = 98г/моль,
Молярная масса эквив. Мэ, Н2SO4 = 98/2=49 г/моль, плотность раствора r =1 г/мл.
Масса Н2SО4 в 100 г раствора:
m Н2SO4 = mр-ра . 0,05 = 5г (5%)
Масса Н2SО4 в 1 л раствора: m Н2SO4 = 50г.
T = m /V = 50/1000 = 0,05 г/мл
C = m /(M .V) = 50/(98 .1) = 0,51 моль/л
H = m /(MЭ .V) = 50/(49 .1) = 2 .С = 1,02 моль/л
Масса растворителя для 1л раствора:
Mрастворителя = m р-ра - m Н2SO4 = 1000 – 50 = 950 г = 0,95 кг.
Сm = m /(M . mрастворителя)= 50/(98 . 0,95)= 0,54 моль/кг Н2О
Все свойства растворов зависят от концентрации
Температура кипения
Т кип > Т кип
Раствора растворителя
Температура замерзания
Т зам < Т зам
Раствора растворителя
Повышение DТкип ü
Понижение DТзам þ = ¦ (Сm )
DТкип = Кэ .сm… ююDТзам = Кк .сm…
Кэ - эбуллиоскопическая постоянная ü = ¦ (природы
Кк - криоскопическая постоянная þ растворителя)
Пример. Для Н2О: Кэ = 0,52, Кк = 1,85 (табл.)
Для 5 % раствора Н2SО4 :
DТкип = 0,52 . 0,54 = 0,4 0С Þ Ткип = 100,4 0С
DТзам = 1,85 . 0,54 = 1 0С Þ Тзам = – 1 0С

Растворение - самопроизвольный, обратимый физико-химический процесс.
Þ DG растворения < 0
Растворение

 А(к)
А(к)  А(р-р)
А(р-р)
Кристаллизация
Ненасыщенный раствор - самопроизвольное растворение вещества еще возможно: DGрастворения < 0, Jрастворения > Jкрист. Насыщенный раствор - в данных условиях дальнейшее самопроизвольное растворение невозможно: DGрастворения = 0,…Гидратная (сольватная) теория растворов)- взаимодействие растворенного вещества и растворителя
…DНсольв < 0; DSсольв < 0
DНдифф > 0 , DSдифф > 0 – (величины существенно меньше 1 и 2 ст.) DНраств = DНион + DНсольв +DНдиффИДЕАЛЬНЫЙ РАСТВОР – гипотетический..
Раствор, в котором нет химического..
Взаимодействия между компонентами, а силы
Межмолекулярного взаимодействия одинаковы.
THORN; DНраств = 0 каждый компонент ведет себя в растворе независимо от других компонентов.
И идеальный раствор Þ его свойства зависят только от концентрации и
Пример: разбавленные растворы неэлектролитов – сахар в воде
Процесс образования раствора неэлектролита:
АnВm , ( к) + х Н2О ® (АnВm ) . хН2О

Процесс образования раствора электролита:
АnВm , ( к) + хН2О ® (АnВm ) . хН2О
 2) (АnВm ) . хН2О ® nAm+ . хН2О + mBn – . хН2О
2) (АnВm ) . хН2О ® nAm+ . хН2О + mBn – . хН2О
Гидратированные ионы
Со - исходная концентрация электролита
a - зависит от :
► природы растворенного вещества
► природы растворителя
► температуры: Т Þ a
► концентрации раствора: с Þ ¯ a
. по величине a :
ß ß
A < 1 a = 1
Слабые электролиты сильные электролиты
Плохо распадаются ●практически полностью
На ионы распадаются на ионы
Диссоциация обратима ●диссоциация необратима
↔ →
● a = ¦ ( с 0) ● a ¹ ¦ ( с 0)
● относятся: - H2O ● относятся:
Органика - все неорганич. соли
Основания p, d, f – элем. - основания S– элем.
Часть кислот: H2SiO3 , - часть кислот: H2SO4 , H2CO3 , HNO2 , CH3COOH HNO3 , HCl , HI , HBr

Процесс диссоциации - обратим,
Диссоциация слабой кислоты: НА « Н+ + А-
Константа диссоциации: :: ►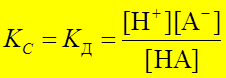
Диссоциация слабого основания: RОН « R+ + ОН-
:: ► 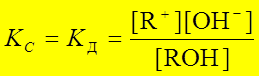
СРАВН ≡ [ С ] – равновесные концентрации, моль/л
►КД - зависит от :
► природы растворенного вещества
► природы растворителя
► температуры: Т Þ КД
►! КД - не зависит от концентрации раствора.
Кд - таблицы
Диссоциация слабого электролита:
АВ « А+ + В -
Со - исходная концентрация , моль/л
A - степень диссоциации
Закон разведения Оствальда
 Если a << 1 Þ
Если a << 1 Þ
Упрощенная формула
Примеры Диссоциации слабых электролитов: НСООН « НСОО - + Н+ КД = 1,77×10-4Раствор имеет сложный ионно-молекулярный состав.
Всегда: КД1 >> КД2 Þ расчет a
в оценочных расчетах ведется по 1 ступени диссоциации: :: ►: КД1 » a2 со :
Концентрация ионов: :: ►.. сi = a . со .. , моль/л.
► Концентрация ионов сi мала Þ
энергия взаимодействия слабая Þ
все свойства слабых электролитов = ¦ ( сi )

Процесс диссоциации - необратим,
Сильные электролиты диссоциированы полностью :
AnBm ® nAm+ + mBn-
Концентрации: c n . c m . c
заряд ионов z : m+ n- Примеры диссоциации: кислота HCl ® H+ + Cl -G - коэффициент активности, учитывает все виды взаимодействия частиц в растворе.
G - по экспериментальным данным, б/размерн.
g - зависит от :
► природы растворенного вещества
► природы растворителя
► температуры
► концентрации раствора
Аi - активность ионов, учитывает концентрацию
И все виды взаимодействия частиц в растворе, [моль/л].
Теория Дебая и Хюккеля (1923г.)
Расчет энергии взаимодействия ионов - по энергии в шаровом конденсаторе: - ион окружен противоположно заряженными ионами –
ионная атмосфера:
 С электролита
С электролита
THORN; ¯ среднее
Расстояние между
Ионами Þ образование
ионных пар:



Взаимодействия ионов – до 1020 соударений в сек.
Ионная сила раствора I… –
количественная характеристика меж ионного взаимодействия:
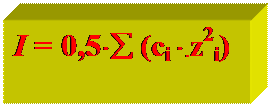
Б/размерн.
Ci – концентрация i -иона
Zi - заряд i -иона
► Для электролита AnBm ® nAm+ + mBn- Средний коэффициент активности электролита g± - среднее геометрическое…По правилу ионной силы - по табл.
Задача. Определить активность ионов в 0,01 М растворе СаСl2.
СаCl2 ® Ca 2+ + 2Cl-
С, моль/л: 0,01 0,01 2×0,01
Решение: = 0,5(0,01×4+0,02×1) = 0,03 коэффициент активности ионов gi ÞДиссоциация

 Н2О Н+ + ОН-
Н2О Н+ + ОН-
Молизация
Ионное
константа диссоциации произведение воды:


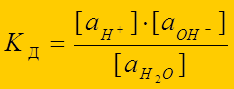 КW = КД . aH2O
КW = КД . aH2O
Активность
а Н2О = 55,56 моль/л КW = ¦( Т )
= const
 ионное произведение
ионное произведение
воды KW :
DG0дис = DН0дис - Т DS0дис = - RT lnKдис
при 298 К:
DH0 298 дис = 55,9 кДж, DS0298 дис = - 80,48 Дж/К
LnKдис = -55900/8,31×298 - 80,48/8,31×298
Þ K298 дис = 1,8×10-16 Þ KW = Kдис .а Н2О = 10-14

KW, 298 = 10-14
Ионы Н+ - носители кислотных свойств
Ионы ОН- - носители основных свойств
Прологарифмируем ионное произведение Н2О: lgKW = lgaH+ + lgaOH- = - 14При 298 К
THORN; рН = 14 - рОН
Примеры решения задач:
Задача
Рассчитать рН 0,05 М раствора НСN.
Решение.
НСN - слабая кислота , со = 0,05 моль/л
Уравнение диссоциации:
НСN « Н+ + СN-
КД = 7,9×10-10 (по таблице)
a = =
= 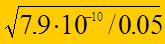 = 1,26×10-4
= 1,26×10-4
СH+ = a со = 1,26×10-4×0,05 = 6,3×10-6 моль/л
РН = ‑ lg сH+ = - lg 6,3×10-6 = 5,18 < 7 – кислая среда.
Задача
Рассчитать рН 0,01 М раствора Zn(OН)2.
Решение.
Zn(OН)2 - слабое основание, со = 0,01 моль/л
Уравнения диссоциации по ступеням:
1 ст.: Zn(ОH)2 « OН - + ZnOH+ КД1 = 4,4×10-5
2 ст.: ZnOH+ « OH - + Zn 2+ КД2 = 1,5×10-9
a = т.к. КД1 >> КД2
т.к. КД1 >> КД2
__________ _________________
Þ a = Ö КД 1 / со =Ö 4,4×10-5 /0,01 = 6,6 ×10-2
СОН- = a со = 6,6×10-2×0,01 = 6,6×10-4 моль/л
РОН = ‑ lg сОН- = - lg 6,6×10-4 = 3,2
РН = 14 – 3,2 = 10,8 > 7 - щелочная среда.
Задача
Рассчитать рН 0,05 М раствора NаОН.
Решение
NаОН - сильное основание, со = 0,05 моль/л
Уравнение диссоциации:
NаОН ® Nа+ + ОН-
С: 0,05 0,05 0,05 моль/л
zi 1+ 1–
I = 1/2(0,05 ×12 + 0,05 ×12) = 0,05
gОН- = 0,85 (по таблице)
АОН- = gОН-× сOH- = 0,85 ×0,05 = 0,043 моль/л
РОН = ‑ lg аОН- = - lg 4,3 ×10-2 = 1,37
РН = 14 – 1,37 = 12,63 > 7 - щелочная среда.
Задача
Рассчитать рН 0,01 М раствора H2SO4.
Решение
H2SO4 - сильная кислота , со = 0,01 моль/л
Уравнение диссоциации:
H2SO4 ® 2Н+ + SO4-2-
С: 0,01 0,02 0,01 моль/л
zi 1+ 2–
I = 1/2(0,02 ×12 + 0,01 ×22) = 0,03
gН+ = 0,9 (по таблице)
АН+ = gН+× сH+ = 0,9 ×0,02 = 0,018 моль/л
РН = ‑ lg аН+ = - lg 1,8×10-2 = 1,74 < 7 – кислая среда.
– Конец работы –
Используемые теги: зависимости, размера, частиц, растворенного, вещества0.084
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: В зависимости от размера частиц растворенного вещества
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов