КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[А+(m-n) ( В )n]±mDm K[Ag(CN)2] [Fe(H2O)6]Cl2 [Cu(NH3)4]SO4 комплексные ионы [А+(m-n)(В )n]±m – устойчивы и существуют самостоятельно как в растворах,Так и в узлах кристаллической решетки.
æ анионы – [Ag(CN)2]-
комплексные ионы: í
è катионы – [Fe(H2O)6]2+
[Cu(NH3)4]2+
СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
 |  | ||
Внутренняя внешняя
Сфера сфера
[А+(m-n) ( В )n]±m Dm±
Комплексные ионы противоионы
ВНУТРЕННЯЯ СФЕРА (комплекс)Комплексообразователь лиганды
n - Координационное число: количество лигандов, располагающихся (координирующихся) вокруг…Координационные числа: 2 4
Заряд заряду с
Комплексн. иона = противоиона противоположным
А+(m-n) ( В )n]±m Dm± знаком ±m
равен алгебраической сумме заряда комплексообразователя и зарядов всех лигандов ПРИМЕР: [Zn(CN)4]ZЗаряд заряд å заряд
Комплексо- = комплексного - всех
Образователя иона лигандов
M-n) ±m ån
ПРИМЕР: [Ag(CN)2]- Þ Ag X
Х = Z[Ag(CN)2]- -2Z(CN - ) = -1 - 2(-1)= +1 Þ x = +1
Комплексообразователь: ион Ag+
Химическая связь в комплексных соединениях.
Внешняя внутренняя сфера --------- сфера ÝКоординационному числу = количеству лигандов
Для комплексов, у которых в качестве комплексообразователя выступают s- , p- или d10 – элементы :
Все вакантные орбитали комплексообразователя, принимающие участие в образовании связи, - внешние, одинаковы по энергии и по форме, т.е. гибридизованы.
ПРИМЕР:Комплекс [Zn(NH3)4]2+
Атом Zn …3d104s2
Комплексообразователь - ион Zn2+: …3d104s04p0
| 4s04p0 |
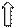
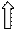
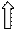
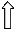
 :NH3 :NH3 :NH3 :NH3
:NH3 :NH3 :NH3 :NH3
неподеленные пары электронов лигандов
sp3-гибридизация орбиталей комплексообразователя.
Структура комплексного иона - тетраэдр
Если комплексообразователь – d1-9-элемент:I-< Br -< Cl- < ОН- < F- < H2O < NCS- < NH3 < NO2- < CN- < CO
Для 4d- , 5d - элементов– все лиганды являются сильными.
Но границы между сильным и слабым полями лигандов провести сложно.
ПРИМЕР: [MnF6]2- лиганд F- - слабое поле,
[NiF6]2- лиганд F- - сильное поле.
Возможные типы гибридизации
При образовании комплексов
ПРИМЕР: Комплекс [Fe(CN)6]4-Комплексообразователь Fe2+: 3d64s0.
:CN-:CN-:CN-:CN-:CN-:CN-D2sp3-гибридизация орбиталей
Структура комплекса - октаэдр.
ПРИМЕР: Комплекс [Fe(Н2О)6]2+
Комплексообразователь Fe2+: 3d64s0.
:Н2О:Н2О:Н2О:Н2О:Н2О:Н2ОСтруктура комплекса - октаэдр.
ПРИМЕР: Комплекс [Ni(Cl)4]2 -
Комплексообразователь Ni2+: 3d84s0.
:Cl- :Cl- :Cl- :Cl-Структура комплекса - тетраэдр.
ПРИМЕР: Комплекс [Ni(NO2)4]2 -
Комплексообразователь Ni2+: 3d84s0.
:NO2 :NO2 :NO2 :NO2Структура комплекса - плоский квадрат.
Комплекс, при образовании которого происходит спаривание d-электронов Þ низкоспиновый комплекс. В противном случае Þ высокоспиновый комплекс.Магнитные свойства комплекса
Определяются наличием неспаренных электронов
На d - орбиталях.
Если на d - орбиталях имеются неспаренные электроны Þ комплекс обладает парамагнитными свойствами (втягивается в магнитное…Zn(NH3)4]2+ þ - диамагнетики
Szlig;………убрать после новых рисунков……..
1.Лиганды располагаются вокруг комплексообразователя так, чтобы силы… 2. Лиганды влияют на энергетическое состояние d-электронов комплексообразователя.Sp3d2-гибридизация
Структура комплекса [Fe(Н2О)6]2+ -октаэдр
Комплекс [Fe(CN)6]4-- низкоспиновый, внутриорбитальный. Высокоспиновые комплексы менее прочные, чем низкоспиновые Þ комплекс…Sp3-гибридизация АО Þ структура - тетраэдр
комплекс - высокоспиновый, внешнеорбитальный,парамагнетик,т.к. есть неспаренные электроны на 3d – орбиталях; менее прочный, чем [Ni(CN)4]2-.
Окраска комплексов.
Реакционная способность.Реакционная способность комплексных соединений определяется скоростью обмена лигандов на другие ионы или молекулы в… Условия, благоприятствующие обмену лигандов : - гибридизация внешних АО;Убрать после новых рисунков Ý..