Лекция № 5. Фазовые равновесия. Растворы неэлектролитов
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов.
На прошлой лекции мы рассмотрели химическое равновесие, константу равновесия, ее связь с т.д. величинами и факторы, влияющие на сдвиг равновесия. … Хим. равновесие является динамическим, т.е. сбалансированы два противоположных… Динамическое равновесия реализуется, когда сбалансированы два противоположных процесса. Динамическое равновесие м.б.…Двухкомпонентные системы.
Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми… Одной из важнейших характеристик раствора является его состав, описываемый с… Молярная концентрация С – число молей nВ растворенного вещества в одном литре раствора.Образование раствора
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между… Растворение – физико-химический процесс, он включает в себя переход из одной… DH = DHф.п.+ DHсольв.Растворимость
При избытке растворяемого вещества одновременно с переходом частиц тв. вещ-ва в раствор происходит обратный процесс – кристаллизация. С течением… Можно получить и пересыщенный раствор, т. е. такой, концентрация вещества в… Растворимость – концентрация в насыщенном растворе.Растворимость газов в газах
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях. Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
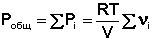
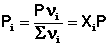
Растворимость газов в жидкостях
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017… Поскольку растворимость характеризует истинное равновесие для определения… Р-рение газов всегда сопровождается выделением теплоты (из-за сольватации молекул), поэтому при повышении температуры…Растворы неэлектролитов.
Понижение давления пара вызвано тем, что поверхность раствора, в отличие от поверхности растворителя частично занято частицами нелетучего… Рассмотрим двухкомпонентный идеальный раствор. Пусть давление насыщенного пара растворителя и растворенного вещества:…Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества.
Т зам – Т, при которой давление пара вода = давлении е пара льда = 613 Па.Температура кипения раствора.
Р-р, содержащий нелетучее вещество обладает меньшей летучестью, чем чистый растворитель. Поэтому его кипение начинается при более высокой Т, чем кипение чистого растворителя.
DТ=Тр-р–Тр-ль=Есm, сm–моляльность растворенного вещества, Е –эбулиоскопическая постоянная р-ля.
Дать диаграмму.