рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Относительные электроотрицательности атомов в виде полусуммы сродства к электрону и потенциала ионизации
Реферат Курсовая Конспект
Относительные электроотрицательности атомов в виде полусуммы сродства к электрону и потенциала ионизации
Относительные электроотрицательности атомов в виде полусуммы сродства к электрону и потенциала ионизации - раздел Химия, Классификация химических связей Период Группы Элементов I...
| Период | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 2,1 | He | |||||||
| Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,50 | F 4,10 | Ne | |
| Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,47 | P 2,1 | S 2,6 | Cl 2,83 | Ar | |
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 Co 1,70 Ni 1,75 | |
| Cu 1,75 Rb 0,89 | Zn 1,66 Sr 0,99 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr |
Существуют и другие подходы к определению электроотрицательности. Так, первой и наиболее известной является шкала Л.Полинга, полученная из термохимических данных и предложенная в 1932 г. За начало отсчета в этой шкале произвольно принята величина электроотрицательности наиболее электроотрицательного элемента фтора, 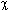 (F) = 4,0 (табл. 3.2).
(F) = 4,0 (табл. 3.2).
Таблица 3.2
– Конец работы –
Эта тема принадлежит разделу:
Классификация химических связей
Классификация химических связей... Одним из наиболее важных вопросов химии является вопрос химической связи... Электроотрицательность элементов...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Относительные электроотрицательности атомов в виде полусуммы сродства к электрону и потенциала ионизации
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов