рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Электроотрицательности атомов в стабильных степенях окисления по Полингу
Реферат Курсовая Конспект
Электроотрицательности атомов в стабильных степенях окисления по Полингу
Электроотрицательности атомов в стабильных степенях окисления по Полингу - раздел Химия, Классификация химических связей Период Группы Элементов I...
| Период | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 2,1 | He | |||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne | |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | Ar | |
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 Co 1,8 Ni 1,8 | |
| Cu 1,9 Rb 0,8 | Zn 1,6 Sr 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | Kr |
Электроотрицательность элементов периодической системы, как правило, последовательно возрастает слева направо в каждом периоде. В пределах каждой группы, за несколькими исключениями, электроотрицательность последовательно убывает сверху вниз. С помощью электроотрицательностей можно охарактеризовать химическую связь. Чем больше разница электроотрицательностей атомов, образующих химическую связь, тем больше степень ионности этой связи. Связи при разности электроотрицательностей атомов больше 2,1 могут считаться чисто ионными (по данным других научных источников, 50%-й ионности связи соответствует разность электроотрицательностей атомов, равная 1,7).
Связи с меньшей разностью электроотрицательностей атомов относят к полярным ковалентным связям. Чем меньше разность электроотрицательностей атомов, образующих химическую связь, тем меньше степень ионности этой связи. Нулевая разность электроотрицательностей атомов указывает на отсутствие ионного характера у образованной ими связи, т. е. на ее сугубую ковалентность.
Электроотрицательность атома, по-видимому, зависит и от степени его окисления. Так, для трех оксидов хрома: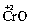 ,
,  ,
,  – наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
– наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
При составлении химических формул соединений следует учитывать, что более электроотрицательные элементы помещаются правее, например, H2S, OF2, SCl2O, Br3N, SiBr2F2.
– Конец работы –
Эта тема принадлежит разделу:
Классификация химических связей
Классификация химических связей... Одним из наиболее важных вопросов химии является вопрос химической связи... Электроотрицательность элементов...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Электроотрицательности атомов в стабильных степенях окисления по Полингу
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов